慢性阻塞性肺疾病致肺动脉高压右心衰竭病人血清IL-6和TNF-α水平表达及临床意义
2024-04-29马秋晓,李灵生,张新宇,崔力心,张琼
马秋晓,李灵生,张新宇,崔力心,张琼
摘要 目的:探讨慢性阻塞性肺疾病(COPD)致肺动脉高压右心衰竭病人白细胞介素6(IL-6)和肿瘤坏死因子α(TNF-α)水平表达及意义。方法:选取2017年7月—2020年3月于中国中医科学院西苑医院就诊的COPD病人442例作为研究对象,中医辨证为气虚血瘀,毒瘀阻肺证。根据病人是否合并肺动脉高压及右心衰竭分为单纯COPD组(226例)、COPD合并肺动脉高压组(151例)和COPD合并肺动脉高压右心衰竭组(65例)。对比分析3组病人的IL-6、TNF-α、B型脑钠肽(BNP)、纤维蛋白(FIB)和D-二聚体水平,肺功能,美国纽约心脏病学会(NYHA)心功能分级;分析IL-6、TNF-α与COPD致肺动脉高压右心衰竭病人FIB、D-二聚体、BNP水平、肺功能及心功能的关系。结果:与单纯COPD组比较,COPD合并肺动脉高压右心衰竭组IL-6水平升高,COPD合并肺动脉高压右心衰竭组、COPD合并肺动脉高压组TNF-α水平升高(P<0.05)。与COPD合并肺动脉高压组比较,COPD合并肺动脉高压右心衰竭组血清IL-6、TNF-α水平升高(P<0.05)。与单纯COPD组比较,COPD合并肺动脉高压右心衰竭组、COPD合并肺动脉高压组FIB、D-二聚体、BNP水平升高,第1秒用力呼气容积(FEV1)、第1秒用力呼气容积占用力肺活量百分比(FEV1/FVC)降低(P<0.05)。与COPD合并肺动脉高压组比较,COPD合并肺动脉高压右心衰竭组FIB、D-二聚体、BNP水平升高,FEV1/FVC降低(P<0.05)。COPD合并肺动脉高压右心衰竭病人心功能Ⅰ级11例、Ⅱ级17例、Ⅲ级21例、Ⅳ级16例。心功能Ⅲ级病人IL-6水平高于心功能Ⅰ级病人(P<0.05);心功能Ⅳ级病人IL-6、TNF-α水平高于心功能Ⅰ级、Ⅱ级病人(P<0.05)。心功能Ⅳ级病人FIB、D-二聚体水平高于心功能Ⅰ级病人(P<0.05);心功能Ⅳ级病人BNP水平高于心功能Ⅰ级、Ⅱ级、Ⅲ级病人(P<0.05)。心功能Ⅱ级、Ⅲ级、Ⅳ级病人FEV1低于心功能Ⅰ级病人,心功能Ⅳ级病人FEV1低于心功能Ⅱ级病人(P<0.05);心功能Ⅲ级、Ⅳ级病人FEV1/FVC低于心功能Ⅰ级病人(P<0.05)。Spearman相关分析显示,COPD合并肺动脉高压右心衰竭病人IL-6、TNF-α水平与病人心功能分级、D-二聚体、FIB呈相关性不明显,与FEV1%和FEV1/FVC呈负相关性,与BNP水平相关性不明显。结论:IL-6和TNF-α与COPD合并肺动脉高压右心衰竭病人心功能分级、D-二聚体、FIB呈正相关,与FEV1%、FEV1/FVC呈负相关,炎症反应参与了COPD致肺动脉高压右心衰竭的病理过程,影响病人的凝血功能、心功能和肺功能。
关键词慢性阻塞性肺疾病;肺动脉高压;右心衰竭;白细胞介素6;肿瘤坏死因子α
doi:10.12102/j.issn.1672-1349.2024.04.023
合并症可影响慢性阻塞性肺疾病(chronic obstructive pulmonary disease,COPD)病人的急性加重次数,是加重病人死亡风险的独立危险因素[1]。肺动脉高压(pulmonary hypertension,PH)是COPD发生发展过程中常见的病理改变和严重的合并症,与COPD病人急性加重风险和死亡率密切相关,随着疾 病的进展,此类病人预后差,其导致的慢性肺源性心脏病和右心衰竭是病人高病残率的主要原因[2]。COPD是最常见的慢性气道疾病,是全球五大死亡病因之一,以咳嗽、咳痰、喘息等相应的呼吸道症状和持续存在的气流受限为特征,多与吸烟和(或)暴露于有害颗粒中有关,异常的炎症反应等众多因素参与其发病过程,合并症可影响疾病的发展和病人的病死率、病残率[3]。慢性缺氧、炎症、内皮功能障碍等原因共同参与了COPD相关肺动脉高压的发生发展[4]。白细胞介素6(interleukin-6,IL-6)和肿瘤坏死因子α(tumor necrosis factor-alpha,TNF-α)等炎性因子参与COPD疾病的进展[5]。炎症和凝血之间存在广泛的相互作用,炎症反应会导致组织因子介导的凝血酶产生和正常生理抗凝机制的不平衡或功能障碍,进而影响病人急性加重次数和加大心血管疾病的患病风险[6-9]。因此,研究IL-6和TNF-α在COPD合并肺动脉高压右心衰竭病人中的作用具有重要的临床意义。
1资料与方法
1.1一般资料
本研究采用横断面研究方法,选取2017年7月—2020年3月于中国中医科学院西苑医院就诊的COPD病人442例作为研究对象,中医辨证为气虚血瘀、毒瘀阻肺证。根据病人是否合并肺动脉高压及右心衰竭分为单纯COPD组(226例)、COPD合并肺动脉高压组(151例)和COPD合并肺动脉高压右心衰竭组(65例)。单纯COPD组,男153例,女73例;年龄(71.16±9.09)岁;有吸烟史者131例。COPD合并肺动脉高压组,男96例,女55例;年龄(71.94±6.47)岁;有吸烟史者77例。COPD合并肺动脉高压右心衰竭组,男43例,女22例;年龄(73.35±4.27)岁;有吸烟史者34例。65例COPD合并肺动脉高压右心衰竭病人中心功能Ⅰ级11例、Ⅱ级17例、Ⅲ级21例、Ⅳ级16例。3例一般资料比较,差异均无统计学意义(P>0.05)。
1.2纳入与排除标准
纳入标准:COPD诊断符合《慢性阻塞性肺疾病诊治指南(2013年修订版)》中COPD稳定期的诊断标准[7]。肺动脉高压诊断符合《肺动脉高压筛查诊断与治疗专家共识》[8]中的相关诊断标准。右心衰竭诊断参考中华医学会心血管病学分会制定的《右心衰竭诊断和治疗中国专家共识》[9]中的相关诊断标准。中医辨证分型为气虚血瘀,毒瘀阻肺,其中,主证为胸闷、气短、喘息,疲倦乏力活动后加重,咳嗽,舌有瘀斑、斑点,舌质紫黯,苔薄白,脉细涩或沉弱;次证为咯痰,面色淡白或暗滞,或胸中隐痛,眩晕,面色紫黯,唇甲发绀。
排除标准:其他病因所导致的肺动脉高压或右心衰竭;合并严重原发性疾病如心脑血管、肾、肺、肝、造血系统等及精神性病者;呼吸系统严重感染者;肺栓塞、下肢深静脉血栓等血栓类疾病者。
1.3研究方法
1.3.1肺动脉收缩压检测
采用超声多普勒估测肺动脉收缩压(pulmonary arterial systolic pressure,PASP),根据国际推荐超声心动图拟诊肺动脉高压的标准为肺动脉收缩压≥40 mmHg[10-11]。静息状态下超声心动图测量的三尖瓣反流峰值流速(VTR)估测右心室收缩压(right ventricular systolic pressure,RVSP),在右心室流出道梗阻且无心内分流时,右心室收缩压近似于PASP,RVSP=PASP=4VTR2+右心房压力(RAP)。
1.3.2肺功能检测
所有病人行常规肺功能检查,包括第1秒用力呼气容积(FEV1,实际值/预测值)、第1秒用力呼气容积占用力肺活量百分比(FEV1/FVC)。
1.3.3心功能评估
根据美国纽约心脏病学会(NYHA)心功能分级分别对COPD合并肺动脉高压右心衰竭病人进行心功能评价,其中,Ⅰ级为病人体力活动不限制,平时一般的体力活动不引起疲劳、心悸、呼吸困难等症状;Ⅱ级为体力活动轻度受限制,休息时无症状,一般体力活动会引起疲劳、心悸、呼吸困难或心绞痛,休息后很快缓解;Ⅲ级为体力活动明显受限,休息时尚无症状,但一般的轻体力活动就会引起疲劳、心悸、呼吸困难或心绞痛,休息较长时间方可缓解;Ⅳ级为体力活动能力完全丧失,休息时仍可存在心功能不全或心绞痛症状,进行任何体力活动都会使症状加重。
1.3.4血液指标检测
采用酶联免疫吸附法检测病人血清IL-6、TNF-α、B型脑钠肽(BNP)、D-二聚体水平;全自动凝血分析仪检测纤维蛋白(fibrinogen,FIB)水平。
1.4统计学处理
采用SPSS 23.0软件进行数据分析。符合正态分布的定量资料以均数±标准差(x±s)表示,多组间比较采用单因素方差分析,两组间比较采用Wilcoxon-Mann-Whitney检验。定性资料以例数或百分比(%)表示,采用χ2检验。采用Spearman相关性分析COPD合并肺动脉高压右心衰竭病人各项指标与血清IL-6、TNF-α水平的关系。以P<0.05为差异有统计学意义。
2结果
2.13组IL-6、TNF-α水平比较
与单纯COPD组比较,COPD合并肺动脉高压右心衰竭组IL-6水平升高,COPD合并肺动脉高压右心衰竭组、COPD合并肺动脉高压组TNF-α水平升高,差异均有统计学意义(P<0.05)。与COPD合并肺动脉高压组比较,COPD合并肺动脉高压右心衰竭组血清IL-6、TNF-α水平升高,差异均有统计学意义(P<0.05)。详见表1。
2.23组FIB、D-二聚体、BNP水平比较
与单纯COPD组比较,COPD合并肺动脉高压右心衰竭组、COPD合并肺动脉高压组FIB、D-二聚体、BNP水平升高,差异均有统计学意义(P<0.05)。与COPD合并肺动脉高压组比较,COPD合并肺动脉高压右心衰竭组FIB、D-二聚体、BNP水平升高,差异均有统计学意义(P<0.05)。详见表2。
2.33组病人肺功能指标比较
与单纯COPD组比较,COPD合并肺动脉高压右心衰竭组、COPD合并肺动脉高压组FEV1、FEV1/FVC降低,差异均有统计学意义(P<0.05)。与COPD合并肺动脉高压组比较,COPD合并肺动脉高压右心衰竭组FEV1/FVC降低,差异均有统计学意义(P<0.05)。详见表3。
2.4不同心功能分级COPD合并肺动脉高压右心衰竭病人IL-6、TNF-α比较
心功能Ⅲ级病人IL-6水平高于心功能Ⅰ级病人,差异有统计学意义(P<0.05);心功能Ⅳ级病人IL-6、TNF-α水平高于心功能Ⅰ级、Ⅱ级病人,差异均有统计学意义(P<0.05)。详见表4。
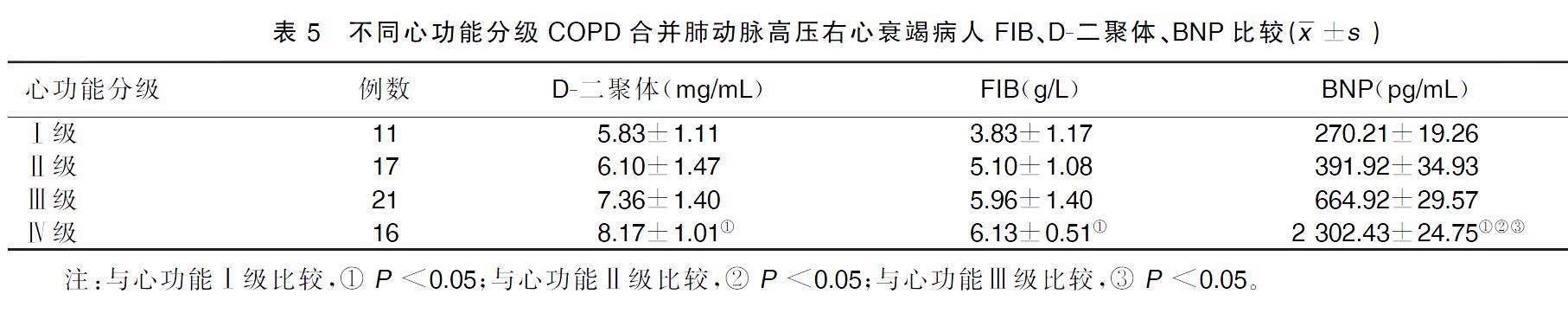
2.5不同心功能分级COPD合并肺动脉高压右心衰竭病人FIB、D-二聚体、BNP比较
心功能Ⅳ级病人FIB、D-二聚体水平高于心功能Ⅰ级病人,差异均有统计学意义(P<0.05);心功能Ⅳ级病人BNP水平高于心功能Ⅰ级、Ⅱ级、Ⅲ级病人,差异均有统计学意义(P<0.05)。详见表5。
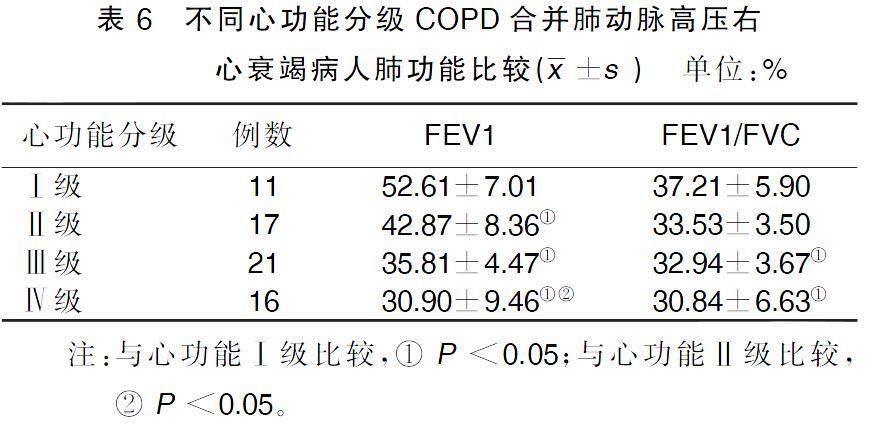
2.6不同心功能分级COPD合并肺动脉高压右心衰竭病人肺功能比较
心功能Ⅱ级、Ⅲ级、Ⅳ级病人FEV1低于心功能Ⅰ级病人,心功能Ⅳ级病人FEV1低于心功能Ⅱ级病人,差异均有统计学意义(P<0.05);心功能Ⅲ级、Ⅳ级病人FEV1/FVC低于心功能Ⅰ级病人,差异均有统计学意义(P<0.05)。详见表6。
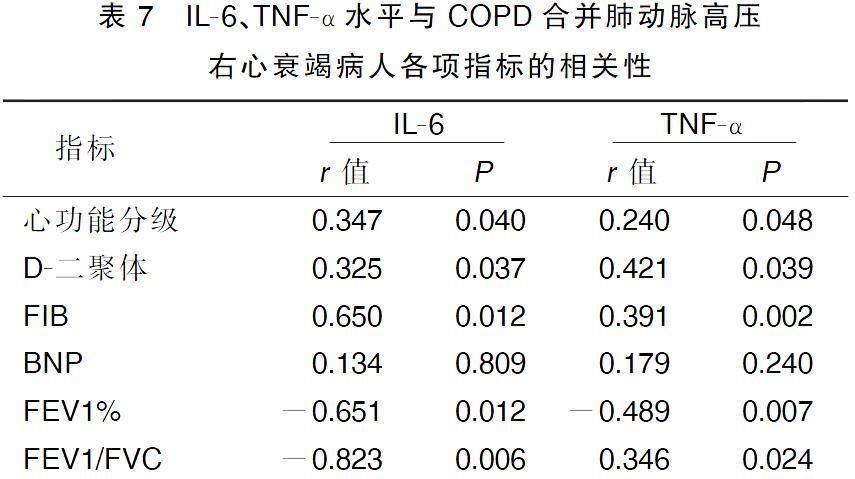
2.7IL-6、TNF-α水平与COPD合并肺动脉高压右心衰竭病人各项指标的相关性
Spearman相关分析显示,COPD合并肺动脉高压右心衰竭病人IL-6、TNF-α水平与病人心功能分级、D-二聚体、FIB呈正相关,与FEV1%和FEV1/FVC呈负相关,与BNP水平相关性不明显。详见表7。
3讨论
合并症可影响COPD病人的病死率、病残率,在COPD病人病情评估中应引起足够重视。气道炎症与COPD的发病机制和进展密切相关,炎症可促进COPD病人的肺血管重塑和内皮功能障碍[12-13]。缺氧会引起肺小动脉缺氧性收缩,进而增加肺血管阻力,慢性缺氧会导致肺小动脉内膜增厚和肌肉化,内皮功能障碍可引起肺血管结构的改变,进而导致肺动脉高压风险增加,其导致的右心衰竭是COPD病人死亡的主要原因[14]。炎性因子水平与心力衰竭具有相关性,凝血活性增加会影响心脏应激[15-16]。因此,了解炎性因子水平对COPD肺动脉高压右心衰竭病人的影响,有助于明确炎症在COPD致肺动脉高压右心衰竭的发病机制,从而更有针对性地治疗疾病,提高COPD病人的生活质量和生存期。
IL-6和TNF-α为炎症反应中重要的促炎因子,参与COPD病人的炎症反应,且与肺动脉高压的发生呈正相关,而肺动脉高压是COPD致肺动脉高压右心衰竭重要的病理过程[17-18]。本研究结果显示,COPD病人随着疾病进展,血清IL-6、TNF-α、D-二聚体、FIB水平逐渐升高,FEV1%、FEV1/FVC水平逐渐下降,在COPD慢性炎症情况下,多种细胞介导的IL-6和TNF-α释放,可能与氧化应激信号通路的激活相关,炎症反应增加可加重病人的气流受限和疾病进展[19-20]。
在COPD合并肺动脉高压右心衰竭病人中,COPD合并肺动脉高压右心衰竭病人的IL-6、TNF-α与病人心功能分级、D-二聚体、FIB呈正相关,与FEV1%和FEV1/FVC呈负相关,与BNP水平相关性不明显。炎症会导致凝血激活,促炎细胞因子能够激活凝血系统并下调重要的生理抗凝途径,炎性细胞因子,如TNF-α或白细胞介素可强烈诱导组织因子在内皮细胞和血细胞中的表达,并通过蛋白酶激活的受体与其他凝血因子促进炎症反应[21-22]。研究显示,D-二聚体等凝血标志物是晚期COPD病人病情加重和死亡潜在的预测因子,而COPD病人缺氧会导致凝血系统激活,同时增加炎症反应[7,23]。由此可见,炎症反应对COPD合并肺动脉高压右心衰竭病人具有重要的影响,可导致病人处于高凝状态,且会影响病人的肺功能和心功能。
COPD合并肺动脉高压右心衰竭在中医认识中属于喘证、肺胀范畴,随着疾病的进展,多本虚标实,辨证以虚、痰、瘀为主,本研究主要针对气虚血瘀,毒瘀阻肺证。目前,中医药治疗COPD相关肺动脉高压右心衰竭多从益气活血、解毒祛瘀入手,可改善病人的气道黏液高分泌状态、炎症水平、凝血功能等[24-27]。本研究主要纳入辨证分型为气虚血瘀、毒瘀阻肺证,胸闷气短,喘息憋气是本病主要的临床症状,在COPD合并肺动脉高压发生发展的过程中,“毒-瘀”贯穿疾病始终,毒瘀犯肺,煎熬津液,内生瘀血,内瘀生毒,互为因果,炎症与毒瘀阻肺密切相关[28-29]。痰、毒、瘀相互交结瘀滞于心肺,病人处于高凝状态,加重炎症反应,因此治疗应注重益气活血,解毒祛瘀类中药可祛邪扶正。
综上所述,本研究结果显示,IL-6和TNF-α与COPD合并肺动脉高压右心衰竭病人心功能分级、D-二聚体、FIB呈正相关,与FEV1%、FEV1/FVC呈负相关,炎症反应参与了COPD致肺动脉高压右心衰竭的病理过程,可影响病人的凝血功能、心功能和肺功能,其中IL-6和TNF-α对病人病情评估和管理具有重要的临床价值,在此基础上针对性抗感染治疗是防治COPD合并肺动脉高压右心衰竭的重要靶点,可减轻合并症对COPD病人病情的影响,提高病人的生活和生存质量。
参考文献:
[1]Global initiative for chronic obstructive lung disease.Global strategy for the diagnosis,management,and prevention of chronic obstructive pulmonary disease(2020 REPORT)[EB/OL].[2019-12-20].https://goldcopd.org/goldreports/.
[2]GREDIC M,BLANCO I,KOVACS G,et al.Pulmonary hypertension in chronic obstructive pulmonary disease[J].Br J Pharmacol,2021,178(1):132-151.
[3]中华医学会呼吸病学分会慢性阻塞性肺疾病学组,中国医师协会呼吸医师分会慢性阻塞性肺疾病工作委员会.慢性阻塞性肺疾病诊治指南(2021年修订版)[J].中华结核和呼吸杂志,2021,44(3):170-205.
[4]中华医学会呼吸病学分会肺栓塞与肺血管病学组,中国医师协会呼吸医师分会肺栓塞与肺血管病工作委员会,全国肺栓塞与肺血管病防治协作组,等.中国肺动脉高压诊断与治疗指南(2021版)[J].中华医学杂志,2021,101(1):11-51.
[5]ZHENG J,SHI Y,XIONG L,et al.The expression of IL-6,TNF-α,and MCP-1 in respiratory viral infection in acute exacerbations of chronic obstructive pulmonary disease[J].J Immunol Res,2017,2017:8539294.
[6]LIU M,HU R,JIANG X,et al.Coagulation dysfunction in patients with AECOPD and its relation to infection and hypercapnia[J].J Clin Lab Anal,2021,35(4):e23733.
[7]中华医学会呼吸病学分会慢性阻塞性肺疾病学组.慢性阻塞性肺疾病诊治指南(2013年修订版)[J].中国医学前沿杂志(电子版),2014,6(2):67-79.
[8]中华医学会心血管病学分会,中华心血管病杂志编辑委员会.肺动脉高压筛查诊断与治疗专家共识[J].中华心血管病杂志,2007,35(11):979-987.
[9]中华医学会心血管病学分会,中华心血管病杂志编辑委员会.右心衰竭诊断和治疗中国专家共识[J].中华心血管病杂志,2012,40(6):449-461.
[10]RUDSKI L G,LAI W W,AFILALO J,et al.Guidelines for the echocardiographic assessment of the right heart in adults:a report from the American Society of Echocardiography endorsed by the European Association of Echocardiography,a registered branch of the European Society of Cardiology,and the Canadian Society of Echocardiography[J].J Am Soc Echocardiogr,2010,23(7):685-713.
[11]GALI N,HUMBERT M,VACHIERY J L,et al.2015 ESC/ERS guidelines for the diagnosis and treatment of pulmonary hypertension:the Joint Task Force for the Diagnosis and Treatment of Pulmonary Hypertension of the European Society of Cardiology(ESC) and the European Respiratory Society(ERS):endorsed by:association for European Paediatric and Congenital Cardiology(AEPC),International Society for Heart and Lung Transplantation(ISHLT)[J].European Heart Journal,2016,37(1):67-119.
[12]BRIGHTLING C,GREENING N.Airway inflammation in COPD:progress to precision medicine[J].Eur Respir J,2019,54(2):1900651.
[13]SZUCS B,SZUCS C,PETREKANITS M,et al.Molecular characteristics and treatment of endothelial dysfunction in patients with COPD:a review article[J].Int J Mol Sci,2019,20(18):E4329.
[14]WROBEL J P,THOMPSON B R,WILLIAMS T J.Mechanisms of pulmonary hypertension in chronic obstructive pulmonary disease:a pathophysiologic review[J].J Heart Lung Transplant,2012,31(6):557-564.
[15]CUGNO M,MARI D,MERONI P L,et al.Haemostatic and inflammatory biomarkers in advanced chronic heart failure:role of oral anticoagulants and successful heart transplantation[J].Br J Haematol,2004,126(1):85-92.
[16]WANNAMETHEE S G,WHINCUP P H,PAPACOSTA O,et al.Associations between blood coagulation markers,NT-proBNP and risk of incident heart failure in older men:the British regional heart study[J].Int J Cardiol,2017,230:567-571.
[17]冯磊.慢性阻塞性肺疾病急性加重期患者IL-6、TNF-α表达变化及意义[J].现代诊断与治疗,2018,29(7):1124-1125.
[18]曹秀丽.慢性阻塞性肺疾病患者肺动脉高压的发生与其机体炎症反应严重程度的相关性[J].当代医药论丛,2020,18(7):51-52.
[19]LEELARUNGRAYUB J,PUNTUMETAKUL R,SRIBOONREUNG T,et al.Preliminary study:comparative effects of lung volume therapy between slow and fast deep-breathing techniques on pulmonary function,respiratory muscle strength,oxidative stress,cytokines,6-minute walking distance,and quality of life in persons with COPD[J].Int J Chron Obstruct Pulmon Dis,2018,13:3909-3921.
[20]LUO Y,ZHENG S G.Hall of fame among pro-inflammatory cytokines:interleukin-6 gene and its transcriptional regulation mechanisms[J].Front Immunol,2016,7:604.
[21]LEVI M,VAN DER POLL T.Inflammation and coagulation[J].Crit Care Med,2010,38(2 suppl):S26-S34.
[22]WITKOWSKI M,LANDMESSER U,RAUCH U.Tissue factor as a link between inflammation and coagulation[J].Trends Cardiovasc Med,2016,26(4):297-303.
[23]SABIT R,THOMAS P,SHALE D J,et al.The effects of hypoxia on markers of coagulation and systemic inflammation in patients with COPD[J].Chest,2010,138(1):47-51.
[24]方志坚,熊旭东.中医辨证施治肺心病肺动脉高压初探[J].中国中医急症,2002,11(1):50-51;54.
[25]朱亚琴,戚徐斌.补肺温肾活血方治疗慢性阻塞性肺疾病稳定期合并肺动脉高压的临床研究[J].中医药临床杂志,2020,32(11):2150-2152.
[26]王彬,吴蔚,汪伟,等.补肺化痰活血中药治疗慢性阻塞性肺疾病合并肺动脉高压临床观察[C].北京:北京中西医结合学会呼吸专业委员会学术研讨会,2013.
[27]郝维佳,黄燕.慢性阻塞性肺疾病并右心衰竭中医研究进展[J].内蒙古医学杂志,2022,54(1):63-65.
[28]丛晓东,张洁,李灵生,等.从毒瘀理论探讨慢性阻塞性肺疾病合并肺动脉高压[J].新中医,2019,51(1):230-232.
[29]樊长征,马秋晓,李灵生,等.住院慢性阻塞性肺疾病合并肺动脉高压患者证型分布及主要检验指标分析[J].实用医学杂志,2018,34(21):3503-3507.
(收稿日期:2022-05-25)
(本文编辑邹丽)
