头颈部CTA联合血清CTRP3、ANGPTL8对短暂性脑缺血发作后继发脑梗死的预测价值
2024-04-29吴磊,胡岗,王浩
吴磊,胡岗,王浩
摘要 目的:探讨头颈部CT血管成像(CTA)联合血清补体C1q/肿瘤坏死因子相关蛋白3(CTRP3)、血管生成素样蛋白8(ANGPTL8)对短暂性脑缺血发作(TIA)后继发脑梗死的预测价值。方法:选取2020年6月—2022年6月于本院治疗的205例TIA病人作为研究对象。按发生后循环TIA后30 d内是否继发脑梗死将病人分为未继发脑梗死组(141例)和继发脑梗死组(64例)。采用酶联免疫吸附法(ELISA)检测血清CTRP3、ANGPTL8水平。Pearson法分析CTRP3、ANGPTL8表达与CTA评分的相关性;采用受试者工作特征(ROC)曲线评价头颈部CTA联合血清CTRP3、ANGPTL8对TIA后继发脑梗死的预测价值。结果:继发脑梗死组病人血清ANGPTL8水平及CTA评分均高于未继发脑梗死组,血清CTRP3水平低于未继发脑梗死组,差异均有统计学意义(P<0.05)。Pearson法分析结果显示,继发脑梗死病人血清CTRP3水平与CTA评分呈负相关(r=-0.405,P<0.05);继发脑梗死病人血清ANGPTL8水平与CTA评分呈正相关(r=0.428,P<0.05)。头颈部CTA联合CTRP3、ANGPTL8预测TIA后继发脑梗死的ROC曲线下面积(AUC)为0.904,高于单项指标检测(P<0.05)。结论:血清CTRP3、ANGPTL8水平联合头颈部CTA检测可显著提高预测TIA继发脑梗死的价值。
关键词短暂性脑缺血发作;继发脑梗死;CT血管成像;补体C1q/肿瘤坏死因子相关蛋白3;血管生成素样蛋白8
doi:10.12102/j.issn.1672-1349.2024.04.034
短暂性脑缺血发作(transient ischemic attack,TIA)作为临床常见脑血管疾病,具有发病急、发病率高、发病时间短等特点[1]。TIA的临床症状可完全恢复,但部分病人在TIA发病初期会发生脑梗死。因此,对于TIA病人,应尽早预测TIA后早期脑梗死的风险,以便采取措施预防脑梗死的发生[2]。头颈部CT血管成像(computed tomography angiography,CTA)是一种无创检查方法,可清晰显示动脉血管及头颈部动脉病变情况,处理功能强,因此,在头颈部血管疾病的辅助诊断中应用广泛[3-4]。补体C1q/肿瘤坏死因子相关蛋白3(complement-C1q/tumor necrosis factor-related protein 3,CTRP3)在抑制炎症反应、调节脂代谢及维持内皮功能中具有重要作用[5]。血管生成素样蛋白8(angiopoietin-like protein 8,ANGPTL8)是一种促代谢因子,能抑制细胞内外脂蛋白脂肪酶,调节脂质代谢[6]。研究发现,ANGPTL8与多种心脑血管病如冠心病、脑梗死等密切相关[7]。但CTRP3、ANGPTL8联合头颈部CTA是否能更为有效地预测TIA病人继发脑梗死尚不明确。故本研究旨在分析血清CTRP3、ANGPTL8水平联合头颈部CTA检测对TIA病人继发脑梗死的预测价值,为提高继发脑梗死的预测率和改善病人预后提供参考依据。
1对象与方法
1.1研究对象
选取2020年6月—2022年6月于本院治疗的205例TIA病人作为研究对象。按发生后循环TIA后30 d内是否继发脑梗死将病人分为未继发脑梗死组(141例)和继发脑梗死组(64例)。本研究获得医院伦理委员会批准,所有病人均签署知情同意书。
1.2纳入与排除标准
纳入标准:继发脑梗死符合相关诊断标准[8],并接受头颈部CTA检查;发病24 h内就诊。排除标准:有冠状动脉疾病、心脏瓣膜病、脑卒中、肺栓塞和血栓栓塞循环相关疾病病史;发病前1个月有手术或外伤史;严重肝肾功能障碍、癌症、慢性炎症疾病;妊娠者;临床资料不完整者。
1.3方法
1.3.1血清CTRP3、ANGPTL8水平检测
所有TIA病人于就诊当天清晨采集空腹静脉血5 mL,在4 ℃下3 000×g离心15 min。收集上层血清,血清样本于-80 ℃冷冻保存。酶联免疫吸附试验(ELISA)检测血清CTRP3(上海富雨生物科技有限公司,货号:FY-04008H1)、ANGPTL8(上海富雨生物科技有限公司,货号:FY-04043H2)水平,检测步骤严格按照产品说明书进行。
1.3.2CTA检查
病人于48 h内采用Philips 256排扫描仪进行CTA检查。取仰卧位,经肘静脉穿刺后连接高压注射器,以5 mL/s的速度注射非离子型造影剂50 mL,智能触发软件进行触发扫描。扫描参数为:管电压120 kV,层间距0.45 mm,层厚0.90 mm,螺距0.99 mm,探测器宽度128 mm×0.625 mm,视窗220.0 mm。扫描范围:主动脉弓至颅底,颅底至颅顶。观察和计算基底动脉、大脑中动脉、大脑前动脉、椎动脉、大脑后动脉、颈内动脉和颈总动脉狭窄情况。
采用北美症状性颈动脉内膜切除术试验(north american symptomatic carotid endarterectomy,NASCET)标准[9]评定血管狭窄程度,狭窄率(%)=(1-最狭窄处动脉直径/狭窄远端动脉直径)×100%,分为无狭窄(血管狭窄率为0)、轻度狭窄(血管狭窄率为<50%)、中度狭窄(血管狭窄率为50%~<70%)、重度狭窄(血管狭窄率为70%~<100%)、完全闭塞(血管狭窄率为100%)。参照文献[10]对CTA进行赋值,无狭窄或轻度狭窄为0分,中度狭窄为1分,重度狭窄或完全闭塞为2分;0分评定为低风险,≥1分评定为高风险。
1.4统计学处理
采用SPSS 22.0软件进行数据分析。采用Kolmogorov-Smirnov检验进行正态性检验。符合正态分布的定量资料以均数±标准差(x±s)表示,组间比较采用独立样本t检验。定性资料以例数或百分比(%)表示,采用χ2检验。Pearson法分析CTRP3、ANGPTL8表达与CTA评分的相关性;采用受试者工作特征(receiver operating characteristic curve,ROC)曲线分析头颈部CTA联合血清CTRP3、ANGPTL8对TIA后继发脑梗死的预测价值。以P<0.05为差异有统计学意义。
2结果
2.1两组一般资料比较
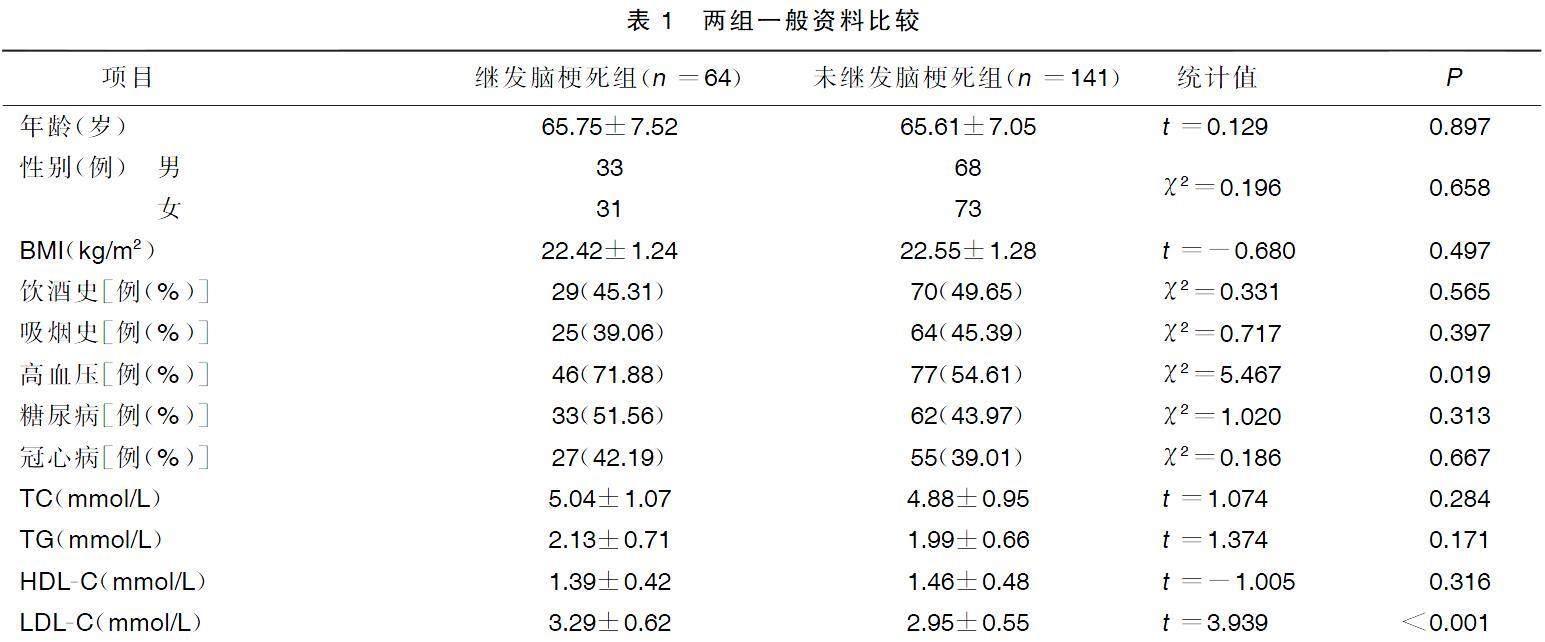
两组年龄、性别、体质指数(BMI)、饮酒史、吸烟史、糖尿病、冠心病、总胆固醇(TC)、三酰甘油(TG)、高密度脂蛋白胆固醇(HDL-C)等一般资料比较,差异均无统计学意义(P>0.05),继发脑梗死组病人高血压、低密度脂蛋白胆固醇(LDL-C)水平均高于未继发脑梗死组,差异有统计学意义(P<0.05)。详见表1。
2.2两组血清CTRP3、ANGPTL8水平及CTA评分比较
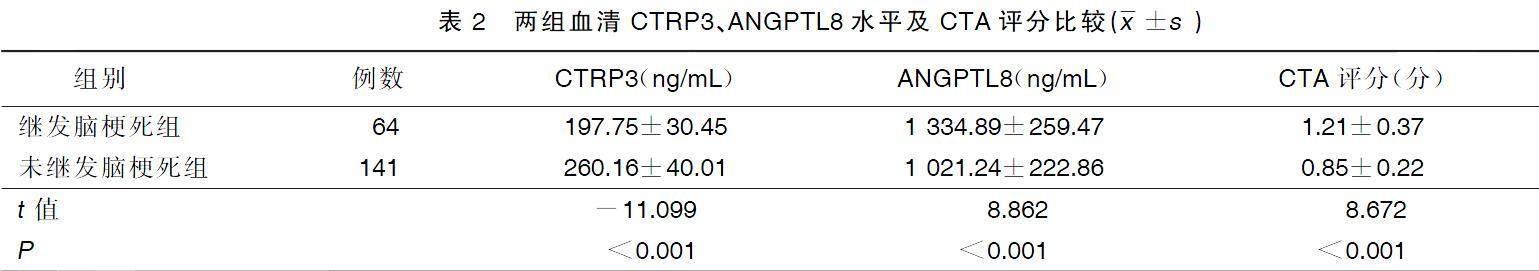
继发脑梗死组病人血清ANGPTL8水平及CTA评分均高于未继发脑梗死组,血清CTRP3水平低于未继发脑梗死组,差异均有统计学意义(P<0.05)。详见表2。
2.3继发脑梗死病人血清CTRP3、ANGPTL8水平与CTA评分的相关性
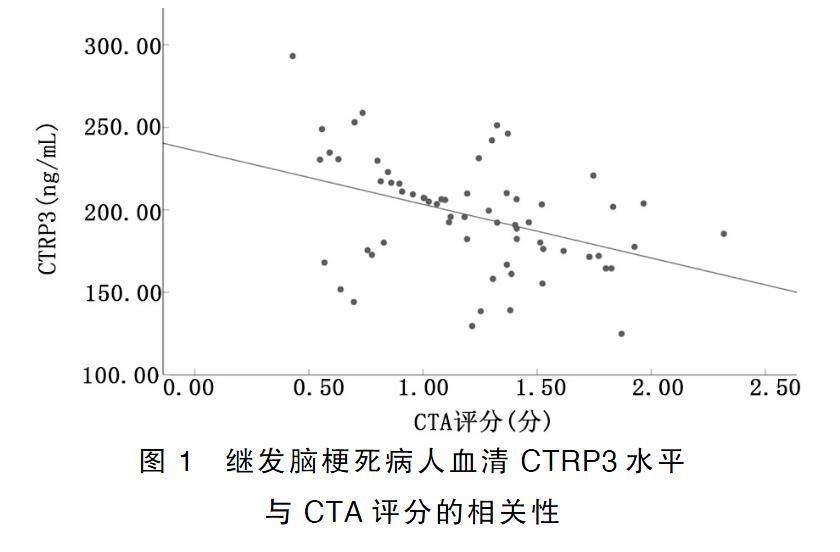
Pearson法分析结果显示,继发脑梗死病人血清CTRP3水平与CTA评分呈负相关(r=-0.405,P<0.05);继发脑梗死病人血清ANGPTL8水平与CTA评分呈正相关(r=0.428,P<0.05)。详见图1、图2。
2.4CTRP3、ANGPTL8、CTA评分单一预测及联合预测继发脑梗死的效能
结果显示,CTA评分联合CTRP3、ANGPTL8预测继发脑梗死的曲线下面积(AUC)为0.904,敏感度为73.44%,特异度为94.33%,均高于单项指标检测,差异有统计学意义(P<0.05)。详见表3、图3。
3讨论
TIA是由于局灶性脑或视网膜缺血而引起的短暂的、可逆的神经功能障碍[11]。大部分临床症状会在1~2 h内恢复,不会留下神经功能缺损的症状和体征,但约有三分之一的病人会发展为脑梗死[12]。因此,早期对TIA病人进行客观风险评估,对预防脑梗死的发生具有重要的临床意义。CTA检查因准确性较高、操作简便等优势逐渐应用于头颈部病变血管筛查,为进一步提高临床预测准确性,往往会采用联合检测方法。如李尚坤等[13]头颈部CTA检查联合ABCD2评分法可进一步提高对继发脑梗死预测的准确性。在本研究中,ROC曲线结果显示,CTA评分预测继发脑梗死的ROC曲线下面积为0.746。表明临床影像学技术检查对TIA发作后继发脑梗死均具有一定预测效能,然而TIA由多种病因及危险因素所致,故目前临床采用单个评估方法在敏感度、特异度方面存在一定误差,无法很好地预测TIA后继发脑梗死。血管生成素样蛋白属于一类与血管生成素具有相似结构的蛋白质,但缺乏与经典的血管生成素受体结合所需的结构域,其在血脂异常、胰岛素抵抗和伤口愈合等多种生物和病理过程中发挥重要的代谢作用[14]。ANGPTL8主要在人体肝脏和脂肪组织中产生和分泌,参与调节糖脂代谢,与代谢参数、氧化应激和炎性疾病有关[15]。研究发现,冠心病、胸主动脉夹层或原发性高血压病人血清ANGPTL8水平明显升高[16]。此外,啜红斐[17]研究表明,血清ANGPTL8是老年TIA病人近期发生脑梗死的危险因素,可用于临床预测TIA病人近期脑梗死的发生风险。在本研究中,ANGPTL8在继发脑梗死病人血清中表达显著升高,且与CIA评分呈正相关,表明ANGPTL8与继发脑梗死发展及病情严重程度密切相关,推测TIA病人血清中ANGPTL8水平越高,继发脑梗死的风险也越大。推测由于血清ANGPTL8水平越高,代表病人体内发生脂质代谢异常,而脂质代谢异常已被证明是影响动脉斑块稳定性的重要原因之一,当动脉斑块破裂,极易形成急性血栓,导致脑组织局部缺血缺氧,从而引发脑梗死。
CTRP3是脂肪因子家族的新成员,主要作用是抑制高糖诱导的氧化应激、抑制细胞凋亡、抗炎症、促进血管生成、抑制纤维化和抑制糖异生[18]。CTRP3异常表达与重症急性胰腺炎[19]、糖尿病视网膜病变[20]、抑郁症[21]等多种疾病的发病有关。越来越多的证据表明,CTRP3在许多心血管疾病中发挥重要作用[22]。李楠等[23]研究表明,CTRP3与急性脑梗死密切相关,对疾病具有较高的诊断价值。因此,推测CTRP3也可能介导TIA后继发脑梗死的发生机制。本研究发现,在继发脑梗死病人血清中CTRP3水平明显降低,并与CTA评分呈负相关,表明CTRP3参与TIA病人继发脑梗死发展进程及疾病严重程度密切相关。其在疾病中的具体作用机制尚需进一步深入研究。ROC曲线结果显示,血清CTRP3、ANGPTL8水平预测TIA后继发脑梗死的ROC曲线下面积分别为0.865,0.815,表明临床血清学指标检测对TIA发作后继发脑梗死均具有一定预测效能,而头颈部CTA联合血清CTRP3、ANGPTL8预测继发脑梗死的ROC曲线下面积为0.904,预测效能得到了显著提高,并有效提高继发脑梗死预测特异度及敏感度,表明3者联合检测对TIA后继发脑梗死预测敏感度高、特异度高,有利于对TIA后继发脑梗死的预测。
综上所述,TIA后继发脑梗死病人血清中ANGPTL8水平升高,CTRP3水平降低,采用头颈部CTA联合血清CTRP3、ANGPTL8检测可显著提高临床TIA后继发脑梗死病人的预测效能。但本研究尚存在不足,如样本量较少,试验设计简单,有待进一步完善实验方案,为临床预测TIA病人继发脑梗死的发生提供更可靠的依据。
参考文献:
[1]许涛,郭静,由秀.短暂性脑缺血患者发作的MRI影像学特点及高危因素分析[J].中国CT和MRI杂志,2022,20(11):26-27;39.
[2]ZHANG C H,ZANG Y J,HU L,et al.Study on the risk prediction for cerebral infarction after transient ischemic attack:a STROBE compliant study[J].Medicine,2020,99(11):e19460.
[3]田文飞,成艳平.头颈部CTA诊断脑血管性病变的价值[J].影像研究与医学应用,2021,5(14):36-37.
[4]杜捷.头颈部CTA在诊断头颈部血管疾病中的临床应用[J].影像研究与医学应用,2022,6(19):125-127.
[5]张翔,陈薪旭,冯晓丽.急性脑梗死患者血清CTRP3,CTRP9水平与颈总动脉内膜中层厚度的相关性分析[J].卒中与神经疾病,2021,28(2):162-166.
[6]安然,杨璐,艾志兵.血清血管生成素样蛋白8、白细胞介素-23水平与缺血性卒中患者颈动脉斑块易损风险的关系[J].中国医药导报,2022,19(26):58-61;74.
[7]申晓平,窦志杰,白磊鹏,等.老年脑梗死患者血清血管生成素样蛋白8水平与颈动脉不稳定斑块的相关性研究[J].中华老年心脑血管病杂志,2020,22(4):397-401.
[8]中华医学会神经病学分会脑血管病学组.中国脑血管病一级预防指南2019(摘要)[J].健康指南,2019(12):8-10.
[9]NORTH AMERICAN SYMPTOMATIC CAROTID ENDARTERECTOMY TRIAL COLLABORATORS,BARNETT H J M,TAYLOR D W,et al.Beneficial effect of carotid endarterectomy in symptomatic patients with high-grade carotid stenosis[J].The New England Journal of Medicine,1991,325(7):445-453.
[10]佟晓燕,白玉海,贾红娟,等.Essen卒中风险评分量表联合CTA评分对短暂性脑缺血发作患者脑梗死的预测价值[J].临床神经病学杂志,2016,29(1):27-29.
[11]周科,王力.磁共振灌注加权成像联合ABCD2评分对短暂性脑缺血后继发性脑梗死风险的预测价值[J].实用医学影像杂志,2022,23(4):345-348.
[12]蓝玉,钟良,韦馨娴,等.短暂性脑缺血发作早期继发脑梗死的CT血管造影及血清CRP、D-D水平的研究[J].微创医学,2019,14(6):746-748.
[13]李尚坤,余恒旺,崔美莲,等.ABCD2评分法结合头颈部CTA对短暂性脑缺血发作后脑梗死的预测价值[J].中西医结合心脑血管病杂志,2019,17(10):1573-1575.
[14]ABU-FARHA M,GHOSH A,AL-KHAIRI I,et al.The multi-faces of Angptl8 in health and disease:novel functions beyond lipoprotein lipase modulation[J].Progress in Lipid Research,2020,80:101067.
[15]HU L,WEI J R,ZHANG Y,et al.ANGPTL8 is a negative regulator in pathological cardiac hypertrophy[J].Cell Death & Disease,2022,13(7):621.
[16]YANG Y Y,JIAO X L,LI L Y,et al.Increased circulating angiopoietin-like protein 8 levels are associated with thoracic aortic dissection and higher inflammatory conditions[J].Cardiovascular Drugs and Therapy,2020,34(1):65-77.
[17]啜红斐.血管生成素样蛋白8联合ABCD-3Ⅰ评分预测老年短暂性脑缺血病人近期脑梗死的应用价值[J].实用老年医学,2022,36(2):188-191.
[18]ARAFAT Y,HILMI E S,HASAN K,et al.Complement C1q/tumor necrosis factor-related protein-3(CTRP3) is significantly decreased in patients with heart failure and closely related with ventricular tachycardia[J].Acta Cardiologica Sinica,2021,37(3):278-285.
[19]LV C Y,HE Y A,WEI M L,et al.CTRP3 ameliorates cerulein-induced severe acute pancreatitis in mice via SIRT1/NF-κB/p53 axis[J].Bioscience Reports,2020,40(10):BSR20200092.
[20]ZHANG J A,HE J.CTRP3 inhibits high glucose-induced oxidative stress and apoptosis in retinal pigment epithelial cells[J].Artificial Cells,Nanomedicine,and Biotechnology,2019,47(1):3758-3764.
[21]MENG J,WANG D M,LUO L L.CTRP3 acts as a novel regulator in depressive-like behavior associated inflammation and apoptosis by meditating p38 and JNK MAPK signaling[J].Biomedicine & Pharmacotherapy,2019,120:109489.
[22]SONG Y B,ZHANG Y Q,WAN Z F,et al.CTRP3 alleviates cardiac ischemia/reperfusion injury via LAMP1/JIP2/JNK signaling pathway[J].Aging,2022,14(3):1321-1335.
[23]李楠,张续,张江宽.血清CaM和CTRP3在急性脑梗死患者中表达意义的研究[J].中国实用神经疾病杂志,2021,24(15):1299-1305.
(收稿日期:2023-02-17)
(本文编辑邹丽)
