miR-145-5p调控Survivin通过凋亡通路对食管癌生物学行为的影响
2024-04-07郑竞雄孙光蕊赵宝山侯继申梁宗英
郑竞雄, 杨 阳, 孙光蕊, 赵宝山, 侯继申, 梁宗英, 王 敏
(1.承德医学院附属医院, 河北 承 德 067000 2.河北省胸科医院临床实验室, 河北 石家庄 050000)
食管癌是世界上最致命的恶性肿瘤之一,数十年以来,其发病率激增[1]。虽然食管癌的诊疗技术有所突破,但令人扼腕的是其预后仍然很差。靶向治疗是食管癌治疗的一种新方式,为患者提供了新的希望。因此,深入研究食管癌的发病机制,并不断探索新的治疗靶点,这对于提高食管癌的治疗水平具有至关重要的临床意义[2]。MicroRNA( microRNA,miR)作为一种非编码RNA,可以通过调控靶基因的翻译或转录,并可以与基因结合并发挥其功能。众所周知,miRNA在多种肿瘤中表达异常,不仅参与癌症的形成,更加促进了癌症的滋生和发展。据证实,miR-145-5p被证实具有抑癌作用,可以通调控靶基因的表达,参与调节肝癌等肿瘤的侵袭和转移过程[3]。Survivin是一种真核蛋白,它能有效抑制细胞的凋亡。在诸多恶性肿瘤中,Survivin展现出惊人的抗凋亡能力,可以通过精准调控细胞周期和凋亡通路,促进肿瘤细胞的不断繁衍生息[4]。研究发现,Survivin在食管癌组织和转移淋巴结组织中呈高表达趋势,且与食管癌的发生和发展密切相关[5]。因此,进一步探究miR-145-5p对食管癌细胞恶性生物学行为是否具有促进作用及其能否靶向调控Survivin的表达来发挥作用,值得深入研究。本研究旨在揭示miR-145-5p对Survivin的靶向调控对食管癌生物学行为的影响,并且阐述食管癌可能的发生机制,期望能为食管癌的治疗和预防提供更深层次的理论支持。
1 资料与方法
1.1一般资料:承德医学院附属医院胸外科2020年1月至2022年1月共15例食管鳞状细胞癌患者,男性13例,女性2例,年龄47~71岁,平均(61.33±6.46)岁。以癌组织为实验组,采用同一患者癌旁组织为对照组(距癌组织边缘大于8cm的正常食管上皮黏膜)。纳入标准:术前或术后经病理科明确诊断食管鳞状细胞癌患者。排除标准:合并其他部位恶性肿瘤病史和或术前经过放疗、化疗及其他抗肿瘤药物治疗的患者。本研究经医院伦理委员会批准,并获得研究患者的知情同意。
1.2试剂:广州索友百生物科技有限公司提供试剂,包括食管癌TE-1细胞和正常食管黏膜上皮HEEC细胞系;miR-145-5p模拟物购自由上海雅吉生物科技有限公司;LipofectamineTM3000 Transfection Reagent(sjzwd-007)购自石家庄旺迪生物科技有限公司;Survivin、BCL2、MDM2和Caspase-3抗体购自广州泰勒生物科技有限公司,PCR试剂盒和双荧光素酶检测试剂盒够自杭州百替生物技术有限公司。
1.3方 法
1.3.1细胞培养、转染和分组:F12K培养基中,按照常规方法接种细胞,并将其放置在5% CO2、37℃孵育箱中,生长至对数生长期。将TE-1细胞以3×105个/孔接种于6孔板中,使用LipofectamineTM3000试剂盒将miR-145-5p的模拟物和阴性对照物分别转染TE-1细胞中,继续孵育48h,进行后续实验。
1.3.2双荧光素酶报告基因实验分析miR-145-5p与Survivin的靶向关系:利用生物信息学TargetScan预测miR-145-5p与Survivin结合位点。在分子生物学和基因突变技术辅助下,构建荧光报告基因载体,包括野生型和突变型miR-145-5p。将不同细胞组接种于24个小孔板内,然后用荧光报告载体、miR-145-5p表达质粒以及阴性对照质粒对TE-1细胞株进行转染。经过24h培养,进行细胞检测,包括萤火虫和海肾荧光素酶值。通过二者数值比例,计算出细胞相对荧光素酶活性。
1.3.3RT-qPCR:提取组织或细胞总RNA,进行反转录。荧光定量试剂盒检测mRNA的表达;(U6作为miR-145-5p内参,GAPDH作为Survivin内参),相对表达量以2-△△Ct计算;引物见表1。

表1 各基因的实时荧光定量聚合酶链反应引物
1.3.4Western blot实验:提取蛋白并测定蛋白浓度。制备电泳蛋白样液,行凝胶电泳。将分离的蛋白转到 PVDF膜上。封闭2h后加入一抗,摇床温育过夜。次日加入二抗,洗膜后,凝胶系统曝光显影。
1.3.5MTT实验:选取对数生长期的细胞悬液,并进行计数。将l000个/孔密度接种于96孔板,进行后续实验步骤。细胞密度达到80%时转染;于2、12、24、36、48h观察细胞状态,在每个时间点拿出孔板,每孔加入5mg/mL MTT液体30μL室温孵育。4h后添加二甲基亚砜(每孔150μL),80r/min摇匀。在结晶消失之后,需要利用酶标仪来检测在570nm 处的细胞吸光度(OD值)。用时间作为横坐标,吸光度作为纵坐标,绘制细胞生长曲线。
1.3.6流式细胞术:使用对数生长期的细胞,并将其制作成单细胞悬液。在计算细胞数后,将每个孔接种8×103个细胞,将其置于96孔板中,并加入每孔100μL。正常培养,每孔细胞密度达到80%进行转染;48h后,取出细胞并用不含EDTA的胰蛋白酶消化,使其变成为单细胞液,将细胞悬液离心,去除上方液体。加入500μL的Binding Buffer悬浮细胞,分别加入5μL的Annexin V-APC和5μL的7-AAD染液,混匀;室温、避光反应20min。使用流式细胞仪检测细胞凋亡。
1.3.7划痕修复实验:选取对数生长期的细胞悬液,并进行计数后接种于24孔板。细胞培养至铺满孔底。应用无菌移液枪头留下划痕,使用PBS洗去脱落细胞并拍照。48h后观察细胞,在倒置显微镜下拍照并测量划痕的宽度。
1.3.8Transwell小室侵袭实验:使用制好的基质胶包被上室24h,于上室接种各组细胞混悬液(细胞数:2×104个/孔),下室添加DMEM 500μL。经培养48h后,弃培养基;使用无菌棉签去除上室未穿膜细胞。对下层细胞进行多聚甲醛溶液固定处理,并用结晶紫染色。通过倒置显微镜,在随机选取的5个视野下观察细胞,并计数穿膜细胞数。
1.4统计学分析:SPSS20.0统计软件分析数据。正态分布的计量资料以均数±标准差表示,两组间均数比较采用t检验,析因设计资料采用方差分析。以P<0.05为差异有统计学意义。
2 结 果
2.1食管癌组织和细胞中miR-145-5p的表达:与癌旁组织相比,miR-145-5p在食管癌组织中的表达下降(19.01±1.85 vs 9.46±1.57)(t=4.623,P<0.05),见图1A;与正常食管黏膜上皮HEEC细胞相比,TE-1细胞中miR-145-5p表达显著降低(1.13±0.07 vs 0.44±0.08)(t=2.674,P<0.05),见图1B。
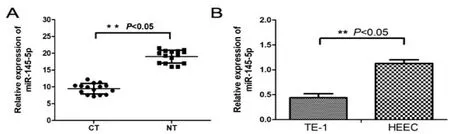
图1 miR-145-5p在食管癌组织和细胞系中的表达
2.2食管癌组织和细胞中:Survivin的表达 与癌旁组织相比,食管癌组织中Survivin 的相对表达量显著升高(13.91±1.74 vs 4.51±1.08)((t=3.531,P<0.05),见图2A;与正常食管黏膜上皮HEEC细胞相比,食管癌TE-1细胞中Survivin相对表达量明显上升(1.28±0.07 vs 0.36±0.06)(t=2.013,P<0.05),见图2B。
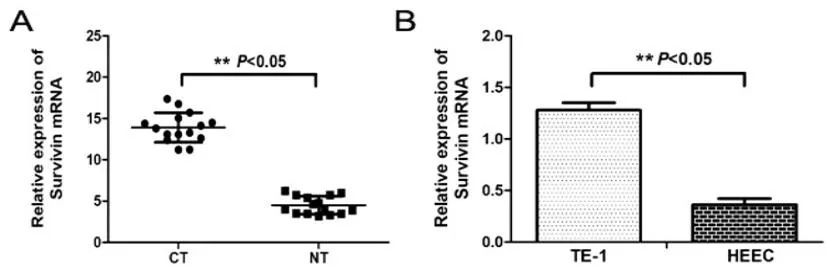
图2 Survivin在食管癌组织和细胞系中的表达
2.3验证miR-145-5p与Survivin靶向关系:使用TargetScan生物信息学网预测miR-145-5p与Survivin互补结合位点,详见图3;双荧光素酶报告基因结果显示,转染miR-145-5p表达质粒的TE-1细胞中,共转染野生型荧光报告基因载体的TE-1细胞荧光素酶活性显著降低(P<0.05);而荧光报告基因载体的TE-1细胞荧光素酶活性无变化(P>0.05)。在转染miR-145-5p阴性表达对照质粒的TE-1细胞中两组荧光素酶活性均未见明显改变(P>0.05)。见图4。

图3 TargetScan预测miR-145-5p与靶基因Survivin的结合位点
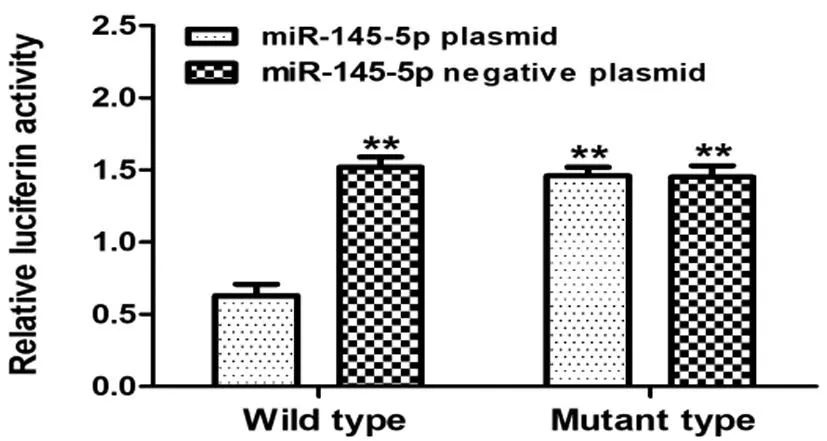
图4 荧光素酶报告基因实验验证miR-145-5p与Survivin的靶向关系
2.4miR-145-5p表达变化对Survivin mRNA表达的影响:RT-qPCR检测结果显示,TE-1细胞中转染miR-145-5p模拟物增加miR-145-5p的表达,并降低Survivin 的相对表达量(P<0.05);转染miR-145-5p阴性对照物组与未转染组相比,miR-145-5p和Survivin 的表达量差异无统计学意义(P>0.05)。见图5。
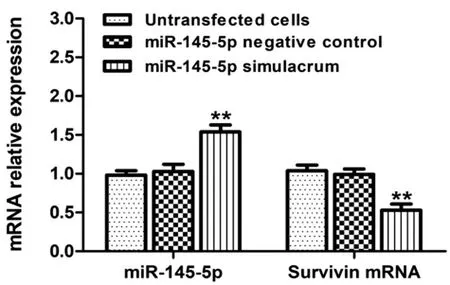
图5 miR-145-5p表达变化对Survivin mRNA表达的影响
2.5上调miR-145-5p对食管癌细胞存活能力的影响:MTT实验结果显示,在12h、24h、36h和72h时间点,转染miR-145-5p模拟物组570nm吸光度值细胞吸光度值(OD值)均小于阴性对照组和未转染组,细胞存活能力降低(P<0.05);而阴性对照组和未转染组相比无统计学差异。见图6。
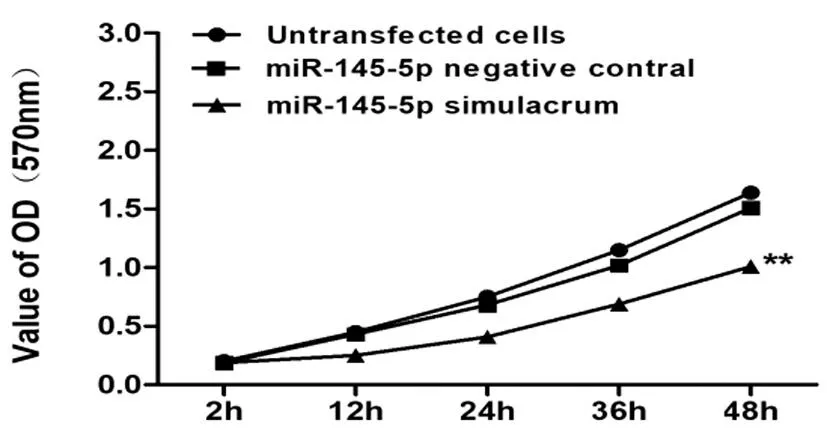
图6 上调miR-145-5p对TE-1细胞存活能力的影响
2.6上调miR-145-5p对食管癌细胞迁移能力的影响:划痕愈合结果显示,转染miR-145-5p模拟物组的细胞迁移距离明显短于未转染组和转染阴性对照物组,两者之间差异具有统计学意义(P<0.05);转染阴性对照物组和未转染组之间的细胞迁移距离无差异。见图7。

图7 上调miR-145-5p表达对TE-1细胞迁移能力的影响
2.7上调miR-145-5p对食管癌细胞侵袭能力的影响:与miR-145-5p阴性对照物组和未转染细胞组相比,转染miR-145-5p模拟物组侵袭细胞数减少(P<0.05);转染miR-145-5p阴性对照物组和未转染细胞组比较,差异无统计学意义 (P>0.05),见图8。
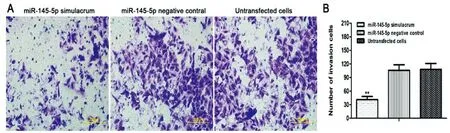
图8 上调miR-145-5p表达对TE-1细胞侵袭能力的影响
2.8miR-145-5p上调对食管癌细胞凋亡的影响:流式细胞术显示,转染TE-1细胞48h后,miR-145-5p模拟物组细胞凋亡率明显增高,与转染miR-145-5p阴性对照物组和未转染细胞组相比,差异有统计学意义(P<0.05)。见图9。

图9 上调miR-145-5p表达对TE-1细胞凋亡的影响
2.9上调miR-145-5p对Survivin、BCL2、MDM2和Caspase-3蛋白表达的影响:与未转染细胞组相比,转染miR-145-5p模拟物组TE-1细胞Survivin、BCL2和MDM2蛋白水平显著下降,但Caspase-3表达水平上升(P<0.05);转染miR-145-5p阴性对照物组和未转染细胞组相比,各种蛋白表达水平差异无统计学意义(P>0.05),见图10。
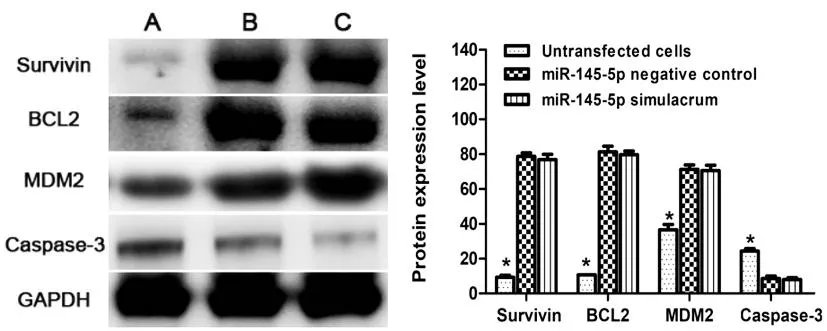
图10 上调miR-145-5p表达对凋亡通路相关蛋白的影响
3 讨 论
因缺乏早期临床症状,导致食管癌往往在中晚期时才被确诊,错过了治疗的最佳时机。尽管现代医学在手术、放化疗和免疫治疗方面有了长足的进步,可以在一定程度上延长食管癌患者的生存期,但总体来看,患者的预后仍让人感到无奈。因此,发现能够提高食管癌早期诊断率和预后评估的新指标对食管癌治疗至关重要,具有重要意义和作用。食管癌是一种不可小觑的疾病,其发生和发展过程中,细胞成分的水平常常会发生变化。这些变化既可以被用于食管癌的检测,也可用于恶性状态预后的监测。更让人振奋的是这些变化也为食管癌的基因靶向治疗提供了新的思路,帮我们攻克食管癌的难关。
Survivin是一种凋亡抑制基因,在人体肿瘤中多呈高表达,可调控癌细胞的增殖和凋亡[6]。根据研究发现,Survivin的高表达程度与食管癌分期、细胞分化程度和淋巴结转移有一定相关性,这些关联得到了相关研究文献的支持[7]。以前的研究发现,miRNA能够与靶基因结合,调控其表达,进而对肿瘤的形成和发展产生调节作用[8]。国内研究人员发现,Survivin在食管癌组织中具有高度表达性,与miR-143、miR-145的表达具有相关性[9]。然而,miR-145能否作为上游分子,以Survivin为靶点加速食管癌的进展?其中具体机制尚存未知。
在miR-145的RNA双链结构中存在着一条前导链,即miR-145-5p,其在各种肿瘤组织中的表达情况各不相同,具有对不同靶基因产生不同的调节作用[10]。近几年,已有不少研究表明miR-145-5p在膀胱癌及胃癌等多种癌症的发生和发展中起到重要的作用[11-12]。然而,miR-145-5p在食管癌中的研究却相对较少,并且该RNA在该疾病中的的确切作用尚不清楚。经实验验证,结果发现miR-145-5p在食管癌组织中的表达水平较低,而Survivin则呈现高水平,这与封敏等[9]学者的研究结果相一致。在细胞系中进一步证实,miR-145-5p在食管癌TE-1细胞中的表达率较低,而Survivin表达率较高。这表明miR-145-5p和Survivin的差异可能与食管癌的发生和发展密切相关。生物信息学数据库的预测结果显示,Survivin基因存在一个与miR-145-5p互补的位点,可能是调控Survivin的上游分子。本研究通过双荧光素酶报告基因证实,共转染野生型Survivin-3’ UTR载体能够明显降低食管癌TE-1细胞的荧光素酶活性,而共转染突变型载体的细胞荧光素酶活性无变化。这说明Survivin是miR-145-5p的靶基因。此研究还发现,过表达miR-145-5p可以有效地抑制了Survivin的表达,迫使细胞走向凋亡。同时,过表达miR-145-5p不仅有效地抑制了食管癌细胞的存活能力,也抑制了细胞的迁移和侵袭能力;这说明miR-145-5p的高表达降低了Survivin的表达,从而有效地抑制食管癌细胞的恶性生物学行为,表明了其在治疗食管癌方面具有显著的潜力。
恶性肿瘤的形成和发展是一个复杂的过程,而细胞凋亡则在其中发挥着重要作用。将肿瘤细胞诱导到凋亡过程中是治疗肿瘤的重要途径之一,因为这种方式能够遏制恶性肿瘤的进展[13]。肿瘤细胞的凋亡是通过一系列的凋亡通路来实现的。在这个过程中,有一些分子发挥着至关重要的作用,例如BCL2、MDM2和Caspase-3等。正是这些重要的凋亡分子,为我们预测肿瘤细胞的凋亡提供了重要的分子标志。本研究发现,过表达miR-145-5p可降低Survivin的表达,BCL2和MDM2蛋白的表达明显降低,但Caspase-3蛋白表达增加。这个结果提示,miR-145-5p的高表达会抑制Survivn进而激活凋亡通路,从而引发食管癌的凋亡。
综上所述,miR-145-5p的过表达能够调节Survivn的表达,进而启动细胞凋亡通路,有效地遏制食管癌细胞存活、侵袭及转移,从而充分展现了miR-145-5p作为治疗食管癌的新靶点的巨大潜力。本研究深入探究miR-145-5p和Survivin在食管癌中的相互作用机制,为寻找食管癌靶向治疗的新靶点提供了重要参考。然而,今后工作中需要更加深入的研究来验证miR-145-5p和Survivn在体内的功能,以期解开二者调控食管癌机制的奥秘。
