miR-365靶向调控USP22促进大肠癌细胞组蛋白修饰和EMT
2023-03-22孙梓程陈海军范德标尹中波关红伟南通市第六人民医院普外科南通60南通市第六人民医院病理科南通市第六人民医院信息科
孙梓程,陈海军,刘 岩,范德标,尹中波,关红伟(南通市第六人民医院普外科,南通 60;南通市第六人民医院病理科;南通市第六人民医院信息科)
大肠癌是消化系统常见恶性肿瘤,发病率逐年递增,严重威胁着国民健康安全[1]。大肠癌起病隐匿,多数患者确诊时已步入晚期。流行病学研究证实[2],大肠癌病发隐匿特征使得约30%患者确诊时已发生转移。因此,探讨大肠癌病发及转移的分子机制并为靶向治疗提供新思路至关重要。上皮间质转化(epithelial-mesenchymal transition,EMT)是指上皮细胞在特定病理和生理情况下向间质细胞转化,EMT已被证实与多种恶性肿瘤的转移迁移密切相关。特异性泛素肽酶22(ubiquitin-specific peptidase 22,USP22)是一种新型的去泛素化水解酶[3]。研究证实[4],USP22信号通路的表达可促使大肠癌细胞获得干细胞样表型,进而促进肿瘤细胞转移,但其具体调控分子机制仍尚未明确。miRNAs是大约有22个核苷酸长度的非编码RNA,已被证实在诸多癌症的恶性分化、增殖、迁移过程中扮演重要角色[5]。miR-365是一种新发现的miRNA,已被证实在胃癌、肺癌和肝癌等恶性肿瘤细胞的恶性转移中发挥生物学功能[6]。本课题组前期发现,miR-365与USP22的表达呈负相关。但miR-365能否通过靶向调控USP22的表达,进而通过影响组蛋白泛素化修饰并促进EMT过程,最终使大肠癌发生恶性转移仍缺乏系统报道。基于此背景,本研究拟从miR-365对USP22的靶向调控机制角度探讨大肠癌转移的分子机制,为靶基因的筛选奠定基础,为临床上实现对大肠癌转移的有效干预提供新的思路。
1 资料与方法
1.1 材料、试剂及仪器
大肠癌高转移细胞系HCT-116、LoVo和中低转移细胞系SW480细胞均购自中国科学院上海细胞库。miR-365模拟物和miR-365抑制物购自广州市锐博生物科技有限公司;Transfection Kit和miRNA NC购自上海美轩生物科技有限公司。miRNA Isolation Kit购自上海恒斐生物科技有限公司;miRNA检测试剂盒、反转录试剂盒反转录引物购自青旗(上海)生物技术发展有限公司;DEME培养基、RPMI1640和胎牛血清购自北京华研世佳质检科技有限公司。抗组蛋白H2B抗体、泛素化组蛋白H2A抗体(Lys119)、抗组蛋白H2A抗体、泛素化组蛋白H2B抗体(Lys120)均购自上海江莱生物科技有限公司。
1.2 细胞培养及转染
采用含10%胎牛血清的RPMI1640培养基(高糖)培养HCT-116、LoVo和SW480细胞。HCT-116、LoVo和SW480细胞,在5%CO2和37 ℃的培养箱培养,待细胞生长至对数期传代。将SW480细胞接种到6孔板并严格按照试剂盒说明进行miR-365抑制物、模拟物和miR-NC的转染操作,分别分为miR-365抑制物组、miR-365模拟物组和NC组,连续转染48 h。每组设置5个复孔。
1.3 采用RT-PCR检测miR-365和USP22 mRNA水平
采用Trizol提取大肠癌细胞中总RNA,并严格按照试剂盒说明进行逆转录操作,逆转录为cDNA后进行后续操作。PCR反应条件为:70 ℃ 35 s、58 ℃ 35 s、95 ℃ 30 s、95 ℃ 5 min,共35个循环,所有实验均重复4次,最后取平均值。引物序列见表1。以GAPDH管家基因作为对照检测USP22mRNA,以U6作为miR-365的内部对照。USP22和miR-365 mRNA的表达采用2-ΔΔCt方法进行计算。

表1 RT-PCR引物序列Table 1 Primer sequences for RT-PCR
1.4 采用双荧光素酶报告基因检测miR-365与USP22的相互作用
将SW480细胞接种于6孔板,细胞汇合度达60%后严格按照试剂盒说明进行转染,分组如下:miR-365+USP22-mut组、miR-NC+USP22-mut组、miR-365+USP22-wt组和miR-NC+USP22-wt组。48 h后收集细胞并检测荧光素酶活性,检测采用双荧光素酶报告基因检测试剂盒。
1.5 采用Western blot法检测USP22信号通路下游EMT相关蛋白表达
采用Western blot法检测miR-365抑制物组、miR-365模拟物组和NC组SW480细胞中Vimentin、N-cadherin、E-cadherin蛋白表达情况,具体方法为:收集大肠癌SW480细胞后,采用细胞裂解液提取细胞中总蛋白约30 μg,随后进行凝胶电泳分离和转移,并在5%脱脂牛奶中封闭1 h,并在4 ℃条件下过夜孵育。次日进行二抗孵育,在室温下进行缓冲液清洗。孵育1 h后再次冲洗,进行显影液曝光显影,试剂采用增强化学发光试剂。蛋白表达实验重复进行4次,最后计算平均值。
1.6 采用斑点杂交法检测H2A和H2B蛋白泛素化修饰
采用斑点杂交法[7]检测miR-365抑制物组、miR-365模拟物组和NC组SW480细胞中H2BKl20ub(组蛋白H2B作为内参)和H2AK119ub(组蛋白H2A作为内参)水平,即取50 μl SW480细胞加到硝酸纤维素膜上,经丽春红S染膜液出现红色斑点证实蛋白结合到硝酸纤维素膜上。避光洗膜后,使用Odyssey近红外成像系统检测蛋白表达,并对每个斑点的荧光强度进行准确的定量分析,最终结果由目的蛋白/内参蛋白获得。
1.7 细胞划痕实验检测细胞转移能力
收集miR-365抑制物组、miR-365模拟物组和NC组转染后细胞,将细胞放置于5%CO2孵箱37 ℃培养24 h,待细胞融合率达到90%左右时,在垂直方向,用1 ml微量移液器枪头在6孔板底部做横线划痕,划下的细胞经PBS冲洗去除,之后细胞继续置于恒温培养箱中培养,培养后24 h,于倒置光学显微镜下拍照观察,并计算划痕愈合率:划痕愈合率=(划痕后即刻的划痕面积-划痕后48 h的划痕面积)/划痕后即刻的划痕面积×100%。实验重复3次,取平均值。
1.8 Transwell实验检测细胞迁移能力
Transwell实验分为miR-365抑制物组、miR-365模拟物组和NC组。将细胞浓度调整至2.0×105个/ml,调整方案采用无血清培养基制备细胞悬液;随后在Transwell小室下层加入含10%胎牛血清的培养基600 μl,并将调整好的细胞接种至Transwell小室上层,培养48 h。随后采用95%乙醇固定30 min,染色后读取细胞数。最后细胞数确定方案:随机选取5个视野,取视野中平均值。
1.9 统计学方法
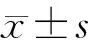
2 结果
2.1 不同大肠癌细胞株中miR-365 mRNA的表达
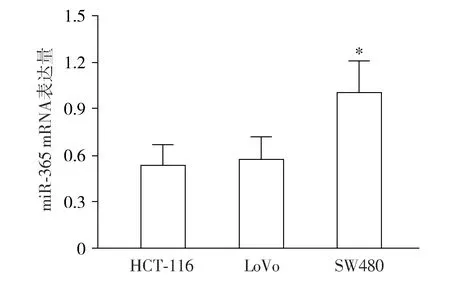
HCT-116和LoVo细胞系中miR-365 mRNA表达量显著低于SW480细胞系(P<0.05,见图1)。转染后,与NC组比较,miR-365抑制物组miR-365 mRNA的表达显著降低,而miR-365模拟物组则升高(P<0.05,见图2)。
与HCT-116和LoVo细胞系相比较,*P<0.05图1 RT-PCR法检测不同大肠癌细胞株中miR-365 mRNA的表达Figure 1 Expression of miR-365 mRNA in different colorectal cancer cell lines by RT-PCR
与NC组相比较,*P<0.05图2 RT-PCR法检测miR-365在转染后大肠癌细胞系SW480的表达Figure 2 Expression of miR-365 in colorectal cancer cell line SW480 after different transfection by RT-PCR
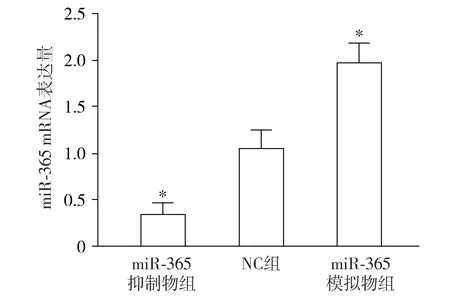
2.2 miR-365和USP22的靶向关系
双荧光素酶报告基因检测结果显示,转染后miR-NC+USP22-wt荧光素酶活性明显高于miR-365+USP22-wt(P<0.05),而miR-365+USP22-mut组和miR-NC+USP22-mut组间比较差异无统计学意义(P>0.05,见图3)。
与miR-365+USP22-wt相比较,*P<0.05图3 双荧光素酶报告基因检测miR-365和USP22的靶向关系Figure 3 Targeting relationship between miR-365 and USP22 verified by double luciferase reporter gene
2.3 miR-365对SW480细胞中USP22 mRNA表达的影响
RT-PCR法检测结果显示,与NC组比较,miR-365抑制物组SW480细胞中USP22 mRNA的表达量显著升高,而miR-365模拟物组则降低(P<0.05,见图4)。
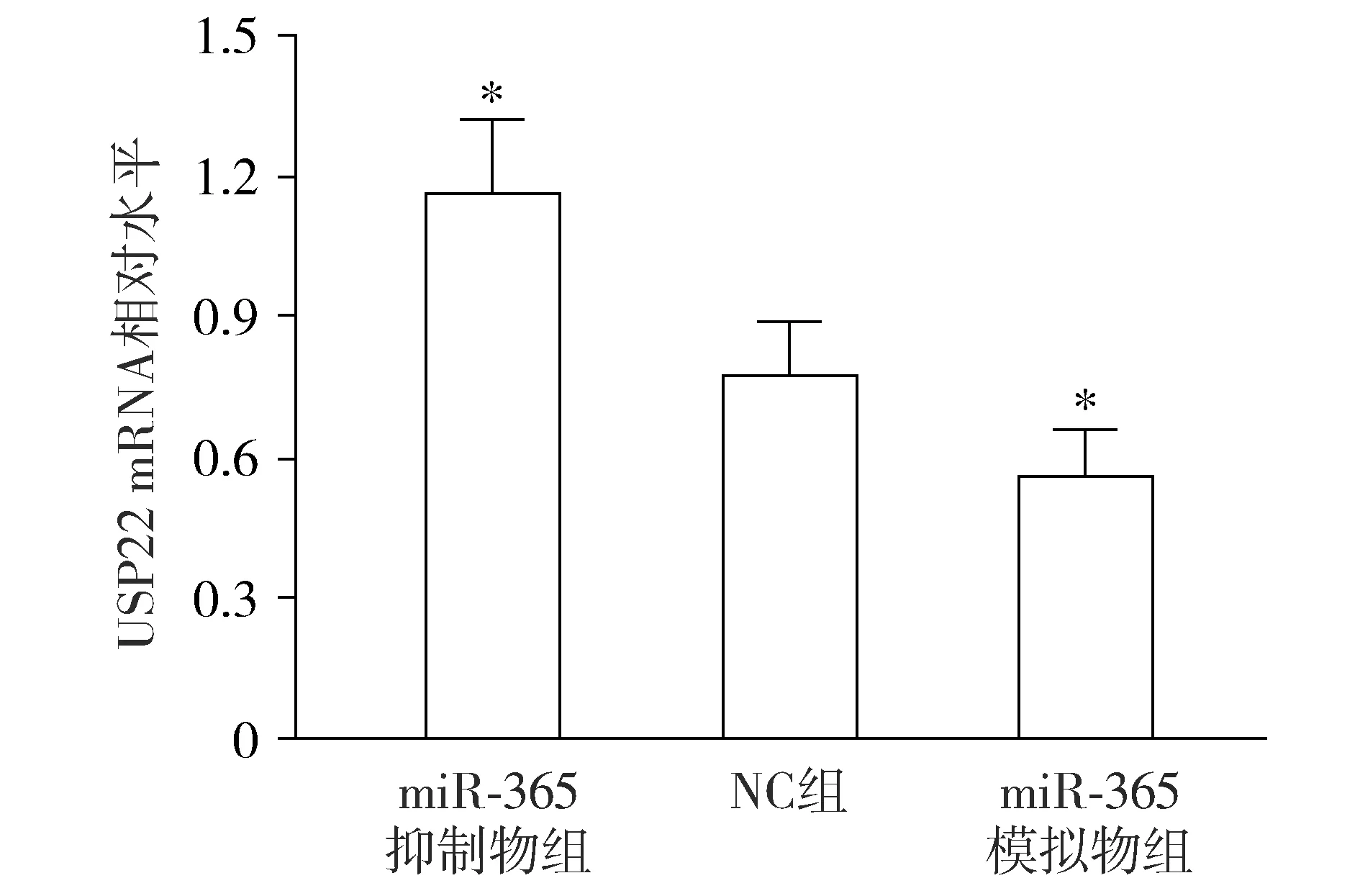
与NC组相比较,*P<0.05图4 RT-PCR法检测miR-365对SW480细胞中USP22 mRNA表达的影响Figure 4 Effect of miR-365 on the expression of USP22 mRNA in SW480 cells detected by RT-PCR
2.4 miR-365对H2A和H2B蛋白泛素化修饰水平的影响
与NC组比较,miR-365抑制物组H2AK119ub表达量显著升高,而miR-365模拟物组则降低(P<0.05,见图5);与NC组比较,miR-365抑制物组H2BK120ub表达量显著升高,而miR-365模拟物组则降低(P<0.05,见图5)。
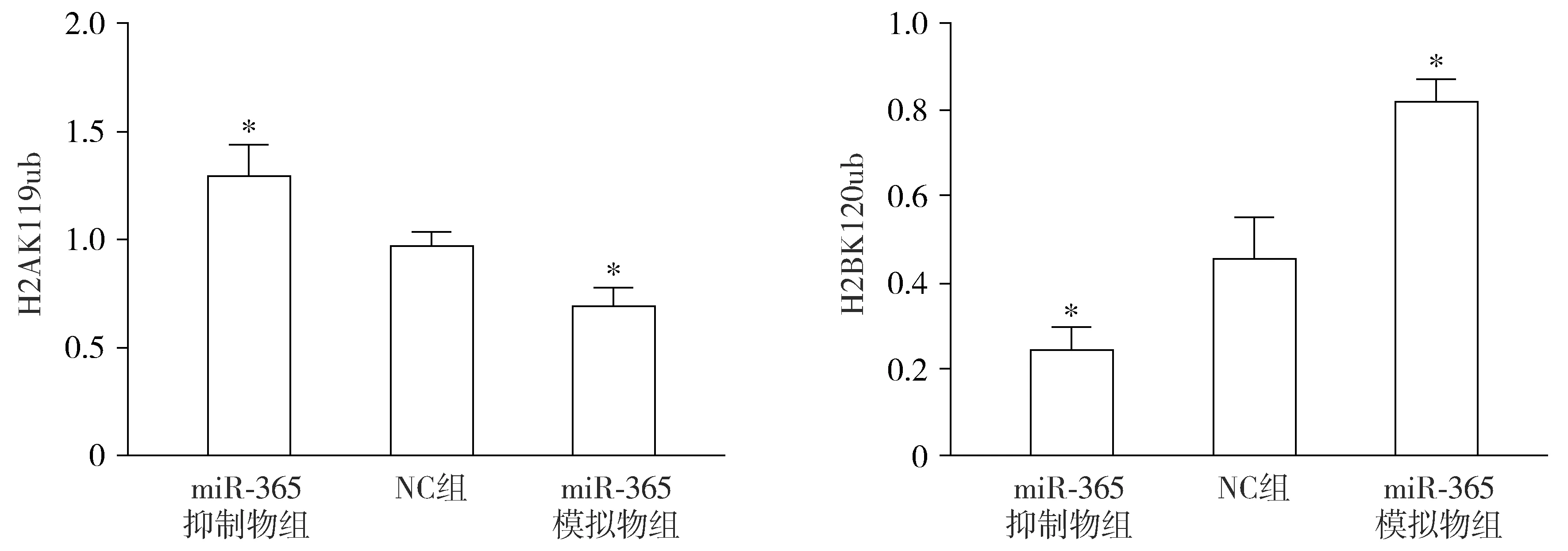
与NC组相比较,*P<0.05图5 斑点杂交法检测H2A和H2B蛋白泛素化修饰水平Figure 5 H2A and H2B protein modification level detected by dot blot hybridization
2.5 miR-365对EMT相关蛋白表达水平的影响
与NC组比较,miR-365抑制物组SW480细胞中N-cadherin蛋白表达量显著降低,而miR-365模拟物组则升高(P<0.05);与NC组比较,miR-365抑制物组SW480细胞中Vimentin、E-cadherin蛋白表达量显著升高,而miR-365模拟物组则降低(P<0.05,见图6)。
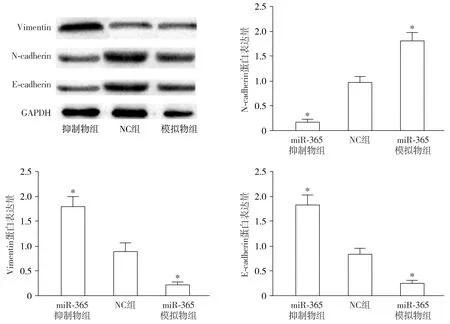
与NC组相比较,*P<0.05图6 Western blot法检测不同转染后SW480细胞中EMT相关蛋白表达水平Figure 6 EMT-related protein expression in SW480 cells after different transfection detected by Western blot
2.6 miR-365对细胞转移的影响
与NC组比较,miR-365抑制物组愈合率明显升高(P<0.05),而miR-365模拟物组明显降低(P<0.05,见图7),提示SW480细胞的转移能力被明显增强。
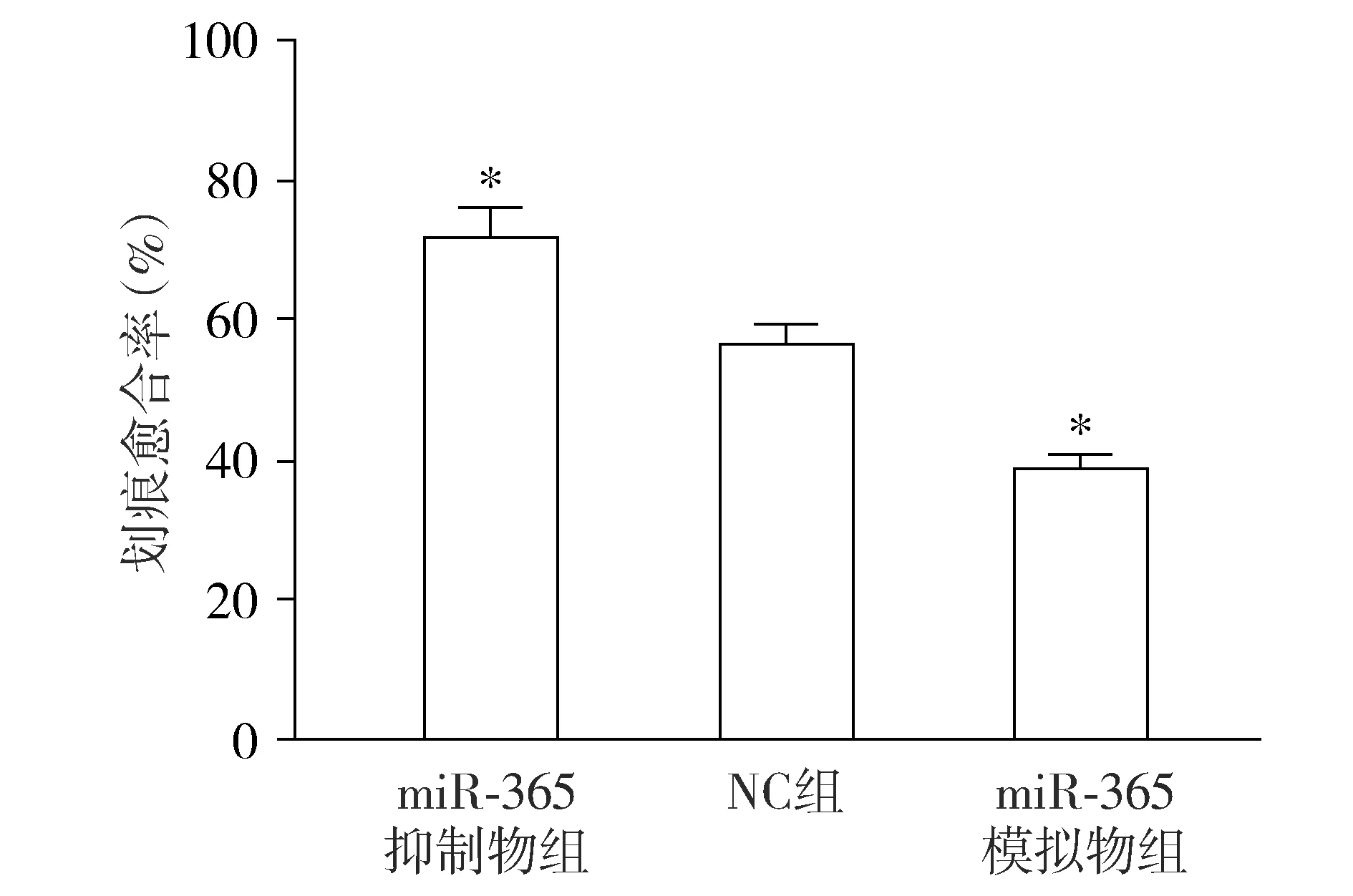
与NC组相比较,*P<0.05图7 细胞划痕实验检测不同转染后SW480细胞转移能力Figure 7 Cell metastasis of SW480 cells after different transfection by cell scratch test
2.7 Transwell检测miR-365对SW480细胞迁移的影响
与NC组比较,视野下miR-365抑制物组SW480细胞穿模数量明显升高,miR-365模拟物组明显降低(P<0.05,见图8,9),表明miR-365的表达降低有利于SW480细胞的迁移。

图8 Transwell实验检测miR-365对SW480细胞迁移能力的影响Figure 8 Cell migration of SW480 cells after different transfection by Transwell test
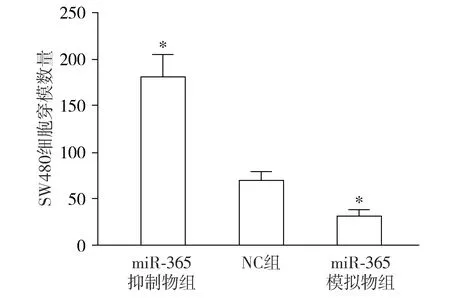
与NC组相比较,*P<0.05图9 Transwell实验检测不同转染后SW480细胞穿模数量Figure 9 The number of SW480 cells penetrating the mold after different transfection by Transwell test
3 讨论
近来随着辅助治疗手段的更新、靶向分子药物的研发和外科技术的进步大肠癌的死亡率得到改善,但仍处于较高水平。远处转移是大肠癌患者死亡的重要因素[8]。上皮-间质转变(epithelial-mesenchymal transition,EMT)是肿瘤转移的重要病理过程,上皮细胞发生EMT使细胞间连接解体,导致细胞形态改变使间质标志物表达上升,而上皮标志物表达逐渐降低,引起细胞外基质重构及基底膜降解,使得肿瘤细胞失去细胞间的上皮极性和黏附作用,从而获得侵袭和迁移的能力[9-11]。大肠癌作为起源于上皮的恶性肿瘤,研究证实,其迁移前沿的病理组织中存在EMT样的肿瘤细胞[12]。USP22是最新发现的肿瘤相关基因,与肿瘤的增殖、迁移等过程密切相关[13]。Zhang等[14]证实,USP22的表达上调与EMT相关蛋白表达被激活十分相关。鲍洁等[15]证实,miR-101可靶向调控USP22水平影响肝癌MHCC97H细胞的EMT病理过程,进而影响肿瘤细胞的转移能力。Liu等[16]发现,USP22的异常表达与结直肠癌的肝转移密切相关。然而大肠癌患者USP22表达的调控机制仍尚未明确。miRNA作为小的非编码RNA,是大肠癌转移发生、发展的重要调节因子[17]。Hong等[18]证实,结直肠癌患者中miR-31-5可通过靶向调节NUMB抑制HT29细胞的增殖、迁移和侵袭。Jian等[19]发现,大肠癌患者循环miR-15b的高丰度与肿瘤转移十分相关。miR-365是miRNA家族一员,被证实与肝癌、非小细胞肺癌和神经胶质瘤等疾病的肿瘤细胞转移有关,但在大肠癌中仍未见报道,尤其USP22信号通路是否为miR-365的靶基因亦未见系统报道。
本研究发现,在大肠癌高转移细细胞株miR-365 mRNA的表达明显低于中低转移的细胞株。选取中低转移的SW480的细胞进行miR-365过表达和敲低模型构建,并采用Transwell实验证实,与miRNA-NC组比较,miR-365抑制物组SW480的细胞侵袭能力显著升高,模拟物组明显降低,同时细胞划痕实验结果显示与NC组比较,miR-365抑制物组愈合率明显升高,miR-365模拟物组显著降低,表明在大肠癌的基础病理发展中,miR-365扮演着抑癌基因的作用,与文献报道的结论基本一致[20,21]。本课题前期实验发现USP22的3’UTR区有miR-365的特异性调控位点,且大肠癌组织中miR-365的表达与USP22的表达呈负相关。为深入明确miR-365的作用机制,本次课题采用双荧光素酶报告基因实验发现,miR-NC+USP22-wt荧光素酶活性明显高于miR-365+USP22-wt,而miR-365+USP22-mut组和miR-NC+USP22-mut组比较无显著差异,提示大肠癌细胞中miR-365和USP22基因的表达存在靶向调节关系。同时本课题组前期实验发现,USP22与组蛋白的泛素化修饰存在相关性,推测USP22的表达改变后可通过调控组蛋白的泛素化修饰,进而影响肿瘤细胞EMT过程,最终促进肿瘤细胞侵袭过程发生。为验证上述科学假说和深入分析miR-365调控大肠癌细胞迁移的机制,本次课题采用斑点杂交法检测H2B和H2A的泛素化修饰水平,结果显示与NC组比较,miR-365抑制物组H2AK119ub表达量显著升高,而miR-365模拟物组则降低(P<0.05);与NC组比较,miR-365抑制物组H2BK120ub表达量显著升高,而miR-365模拟物组则降低(P<0.05);同时与NC组比较,miR-365抑制物组SW480细胞中N-cadherin蛋白表达量显著降低,而miR-365模拟物组则升高(P<0.05);与NC组比较,miR-365抑制物组SW480细胞中Vimentin、E-cadherin蛋白表达量显著升高,而miR-365模拟物组则降低(P<0.05),证实miR-365在大肠癌病理发展过程中扮演抑癌基因角色。
综上所述,miR-365在大肠癌细胞转移中发挥着重要调节作用,为后续研究大肠癌的发病机制及分析靶向药物的研究奠定了基础。然而本次实验仍存在不足,如本次课题仅从细胞水平开展了立体实验,故今后仍需进一步从动物水平设置在体实验予以论证。
