发酵豆乳乳酸菌的筛选及其对豆乳抗氧化性能的改善作用
2024-02-28王敬丽孟珺朱萌茜章绍兵
王敬丽,孟珺,朱萌茜,章绍兵
(河南工业大学粮油食品学院,河南郑州 450001)
益生性乳酸菌在维护和调控人体肠道健康方面有很多作用:为宿主提供营养物质,赋予其平衡的胃肠道微生态体系,防止血压、血脂升高,调节免疫系统等,在发酵食品工业中,乳酸菌是一种广泛使用的发酵剂,在发酵过程中可代谢产生大量有机酸、氨基酸、维生素、胞外多糖和各种酶,能改善食品风味和产品质构,提高产品的贮藏性能[1]。
泡菜、浆水、酸笋等是历史悠久的传统发酵食品,含有丰富的乳酸菌资源,同时人体肠道也是乳酸菌的重要资源库,其具有很高的营养价值和益生功效。冯金晓等[2]通过分离纯化、生理生化及定性试验后,对从6 个泡菜样品中筛选出的乳酸菌进行模拟胃酸测定,得到了2 株耐胃酸(pH 值2.5)性强的短乳杆菌和干酪乳杆菌。Rehmat 等[3]对从浆水中分离出的4 株乳酸菌进行耐酸、耐胆盐、耐药性以及抑菌性研究,得到两株具有良好胃肠液耐受能力的菌株。肖石高等[4]对老人肠道中的乳酸菌进行分离、纯化、驯化、培养后,得到优势乳酸菌来发酵豆乳。发酵食品和人体肠道中还有很多未知菌株有待开发。
大豆乳、花生乳、鹰嘴豆乳中含有大量蛋白、脂肪、维生素、碳水化合物等营养物质,所含有的多酚和异黄酮是很好的抗氧化和抗癌物质,对人体具有独特的保健功能。但其含有的抗营养因子如低聚糖会导致部分人群产生胃胀气,抑制人体对矿物质的吸收。发酵可以增加产品营养成分的消化率和生物利用度,消除抗营养因子的不良效应,提高产品的储藏和安全性,减少由于变质而造成的食物资源流失和浪费,是处理营养不足等问题的一种简单、经济、以食物为基础的高效方式。利用乳酸菌发酵豆乳制品,能够产生独特的风味物质,减少有害微生物菌群及毒素的产生,还具有抗突变、提高机体免疫、增强肠道营养吸收等功效[5]。Hu等[6]用L.fermentumHFY02 发酵大豆乳,能显著改善豆乳中的活性物质含量。Chawafambira 等[7]用L.rhamnosus发酵豇豆-花生乳可减少其抗营养素含量。Tangyu 等[8]使用L.paracasei对鹰嘴豆乳进行发酵,减轻了豆腥味。但目前关于乳酸菌发酵豆乳多集中于大豆乳,而对花生乳和鹰嘴豆乳的报道较少。所以开发适于发酵不同豆乳的乳酸菌菌株具有重大的意义。
本研究旨在对传统自然发酵食品及健康人体肠道中的乳酸菌进行分离鉴定,筛选出性能优良的菌株发酵大豆乳、花生乳和鹰嘴豆乳,并对发酵豆乳的抗氧化性进行评价,最终得到适于发酵不同豆乳并能显著提高豆乳抗氧化性能的乳酸菌菌株,为开发功能性发酵豆乳提供理论依据。
1 材料与方法
1.1 材料与试剂
浆水、泡菜、糖蒜、酸笋、奶嚼口、雪莲菌、牦牛制品等均来自市售,粪便采自健康85 岁老人。MRS 培养基按文献进行配制[2],细菌基因组DNA提取试剂盒:天根生化科技有限公司。
1.2 仪器与设备
立式压力蒸汽灭菌锅(TG16-WS):上海博讯实业有限公司;电热恒温培养箱(DPH-360):北京市永光明医疗仪器有限公司;超净工作台(SWGCZ-2F):上海笃特科学仪器厂;pH 计(PHS-3C):上海仪电科学仪器股份有限公司;图像颗粒分析仪(BT-1600):丹东百特仪器有限公司;紫外可见分光光度仪(TV-1901):上海精密科学仪器有限公司。
1.3 实验方法
1.3.1 乳酸菌的分离纯化
将采集的样品用无菌生理盐水充分混合后进行梯度稀释,并涂布于MRS 固体培养基中,37 ℃培养48 h 后,选取不同大小和形态的单个菌落采用平板划线法分离菌株,重复上述步骤至得到纯的菌株后通过革兰氏染色进行形态学观察。
1.3.2 16S rDNA鉴定
采用试剂盒对分离的菌株进行DNA 提取。PCR 扩增引物为:27F(5'-AACTGAGTTTGATCCTGGCTC-3')、1492R(5'-TACGGTTACCTTGTTACGACTT-3')。扩增体系(50 μL)为:模板DNA 2 μL,2×Taq PCR MasterMixⅡ 25 μL,引物(F+R)2.5 μL,双蒸水(ddH2O)20.5 μL。扩增条件为:94 ℃预变性5 min;30 个循环(95 ℃,30 s变性;55 ℃,30 s退火;72 ℃,90 s延伸);72 ℃末端延伸10 min。将PCR 扩增产物送至华大基因科技服务有限公司进行测序,并使用NCBI 中的BLAST(Basic Local Alignment Search Tool)程序进行同源性比对分析[2]。
1.3.3 模拟胃肠液耐受性的测定
已鉴定菌株在恒温培养箱中(37 ℃)孵育18 h 后,用无菌生理盐水洗涤离心(4 000 r/min,10 min)后的菌体,并使其重悬制成菌悬液。将其与人工胃液(8.5 g/L NaCl、4 g/L 胃蛋白酶,用1 mol/L 的HCl 调节pH 值至2.50)按1:9(V/V)比例混合,37 ℃培养3 h 后,利用菌落平板计数法分别于0 h 和3 h 进行活菌计数,计算菌株在pH 值2.50 人工胃液中的存活率。同样的方法模拟人工肠液(8.5 g/L NaCl、1 g/L 胰蛋白酶、1.5 g/L 猪胆盐,用1 mol/L 的NaHCO3调节pH 值至8.0)对乳酸菌的影响 [3]。
1.3.4 产酸能力测定
将筛选出的胃肠液耐受性较强的菌株活化传代,并以2%(体积分数)的接种量在pH 值6.20的MRS 液体培养基中接种菌株,使其振荡培养18 h(37 ℃,180 r/min)后测定其pH 值及滴定酸度[9]。
1.3.5 菌株生长特性的测定
按1.3.4 方法培养菌株24 h,选取原MRS 液体培养基作为空白对照,每2 h 测定菌液的pH 值及OD600值[10]。
1.3.6 发酵豆乳的制备及基本特性的测定
分别取浸泡过夜的大豆、花生、鹰嘴豆与蒸馏水1:12(m/V)于料理机中100 ℃混合粉碎,灭菌(121 ℃,15 min),冷却,以2%(体积分数)的比例接种菌株种子液,使用摇床发酵24 h(37 ℃,180 r/min),每隔4 h 取样进行测定。
1.3.6.1 pH值的测定
每隔4 h 使用pH 计测定不同发酵豆乳的pH 值。
1.3.6.2 活菌数的测定
使用无菌生理盐水将发酵乳样品进行梯度稀释后,使其涂布于MRS 固体培养基中,37 ℃培养24 h,计算菌落总数。
1.3.7 发酵豆乳的抗氧化能力测定
1.3.7.1 DPPH·清除能力测定
10 mL 发酵豆乳离心(10 000 r/min,4 ℃,10 min)后,将1 mL 豆乳上清液与1 mL 0.2 mmol/L DPPH· 标准液混合,于室温避光反应30 min 后再离心(5 000 r/min,10 min),并于517 nm 测定上清液的吸光度[11],按式(1)计算DPPH· 清除率:
式中:
AC——DPPH· 清除率,%;
Ai——1 mL 样品+1 mL DPPH· 的吸光值;
Aj——1 mL 样品+1 mL 无水乙醇的吸光值;
A0——1 mL 蒸馏水+l mL DPPH· 的吸光值。
1.3.7.2 OH·清除能力测定
10 mL 发酵豆乳离心(10 000 r/min,4 ℃,10 min)后,将0.5 mL 豆乳上清液与0.5 mL 9 mmol/L FeSO4、0.5 mL 8.8 mmol/L H2O2溶液充分混合后静止10 min,再加入0.5 mL 6 mmol/L 水杨酸溶液混匀,37 ℃水浴30 min,离心(5 000 r/min,10 min),于510 nm 测定上清液的吸光度 [12],按式(2)计算OH·清除率:
式中:
AD——OH· 清除率,%;
Ai——样品组吸光值;
Aj——不加显色剂H2O2吸光值;
A0——空白对照吸光值。
1.4 数据处理
所有数据均3 次或以上平行实验计算得出平均值,使用 SPSS 25 和Origin 2018 进行数据分析处理以及绘图,使用Duncan 法进行显著性分析,P<0.05时认为具有显著性差异。
2 结果与分析
2.1 乳酸菌的分离与鉴定
在MRS 固体培养基中进行分离纯化后,部分乳酸菌分离菌落形态如图1 所示。菌株主要呈边缘整齐、中央有突起或扁平的乳白色圆形菌落,大小不一。从样品中分离出的菌株通过显微镜观察时发现细胞形态呈多样性,有长形、细长形、弯曲形和短粗状等,与Zhang 等[13]在浆水中观察到的可培养乳酸菌的菌体形态相似。
通过16S rDNA 鉴定及BLAST 同源性对比,23 份样品中分离出的乳酸菌菌群组成情况如图2 所示,共计74 株菌。其中包括乳杆菌属、乳球菌属、魏斯氏菌属、肠球菌属,且共含有10 种乳杆菌属,共66 株。泡菜样品中含有多种乳酸菌,其中鼠李糖乳杆菌数量最多,副干酪乳杆菌在浆水样品中占最大比例,而腌制品(酸笋、糖蒜等)中只分离出2 种乳酸菌,分别为短乳杆菌和植物乳杆菌,另外从泡菜、浆水及酸笋中也分离出植物乳杆菌。奶嚼口中含有独特的韩泡菜乳杆菌,牦牛制品中筛选出干酪乳杆菌和乳酸乳球菌,雪莲菌中也有乳酸乳球菌,酸汤中仅分离出副干酪乳杆菌,而从健康老人粪便中主要筛选出唾液乳杆菌和发酵乳杆菌。
2.2 菌株在模拟胃肠道环境中的耐受能力
乳酸菌在胃肠道环境中具有较高存活率是其作为益生菌能够在人体内发挥作用的前提 [3],因此本实验测定了74 株已鉴定乳酸菌在模拟胃肠道环境中的存活情况,结果如图3 所示。菌株经pH 值2.5 的模拟胃液处理3 h,存活率高于80%的只有8 株,另外有40 株存活率低于40%。郭志华等[14]从泡菜中筛选出的两株植物乳杆菌JYF2、JYF3 在pH 值 2.5 的胃液中的存活率也介于40%~60%之间。熊涛等[15]认为L.plantarumNCU116 在该胃液条件下保持较高的存活率,达到了45.76%。之后将胃液存活率高于40%的34 株菌进行pH 值 8.0 模拟肠液处理4 h,存活率高于40%的只有13 株,说明这13 株乳酸菌对胃肠液具有较强的耐受性,但存在明显的菌株差异性(表1)。植物乳杆菌 NCU116 在肠液中存活率达到49.63%[15]。

表1 部分乳酸菌在模拟胃肠液中的存活率Table 1 Survival of some lactic acid bacteria in simulated gastrointestinal fluid
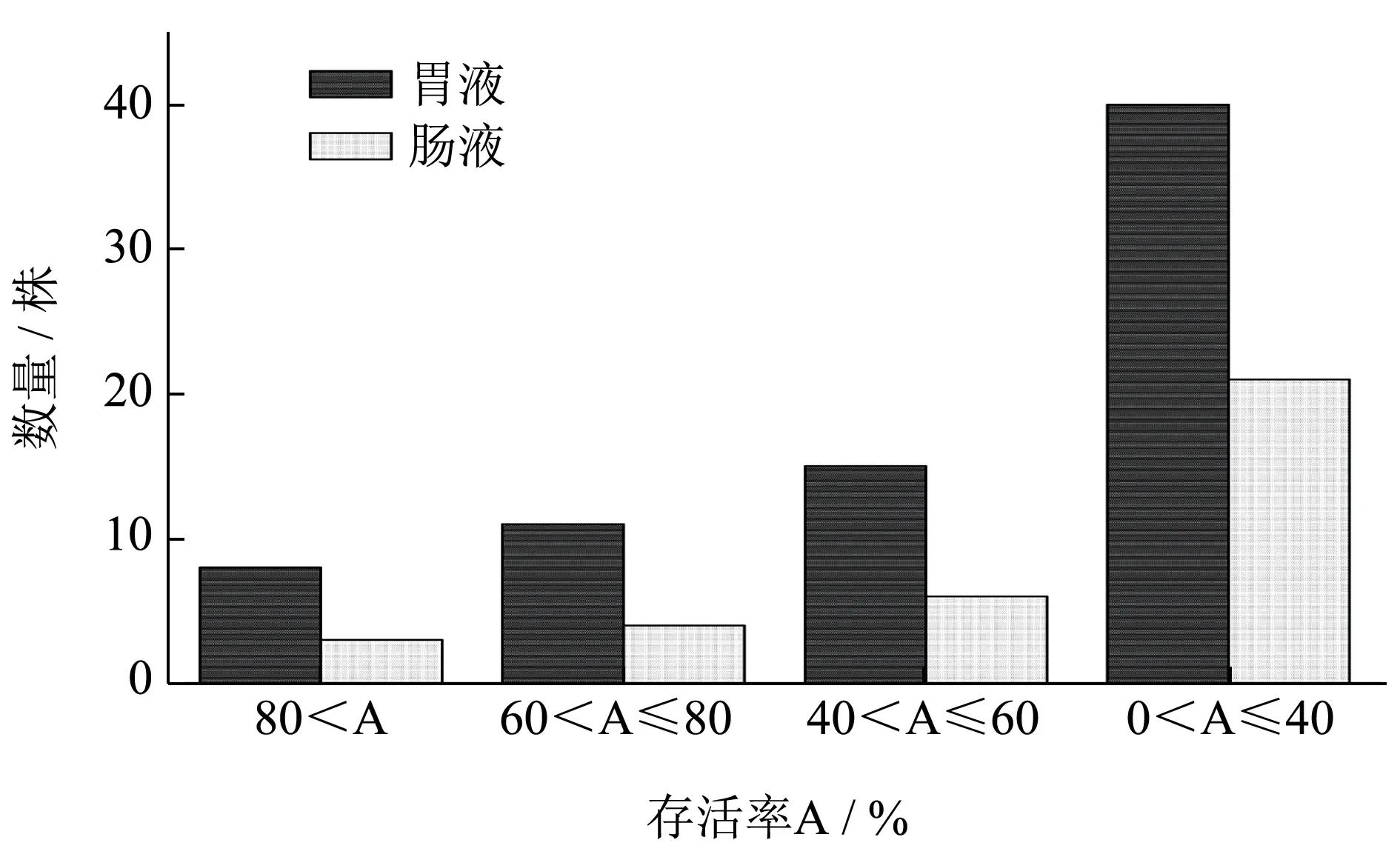
图3 74株乳酸菌在模拟胃肠液中的存活率分布情况Fig.3 Survival rate distribution of 74 strains of lactic acid bacteria in simulated gastrointestinal fluid
如表1 所示,L.paracaseiM1.5 在胃液中的存活率高达185.65%,L.plantarumG1.3 在肠液中的存活率高达109.36%,表明这两株菌分别在模拟胃、肠液环境中继续生长繁殖,使得其活菌数增加,出现其存活率大于100%的情况,可见L.paracaseiM1.5 具有很强的耐酸性,L.plantarumG1.3 具有很强的胆盐耐受性。
2.3 高产酸能力菌株的筛选
产酸能力是乳酸菌活力良好的重要特征之一,高产酸菌株不仅可以缩短发酵周期,降低成本,同时能在发酵初期抑制杂菌的生长繁殖。研究发现,多数乳酸菌在发酵18 h 时产酸能力已进入平稳期[16],因此选取具有较强胃肠耐受性的13 株乳酸菌进行初步产酸能力评价,测定其发酵18 h 时发酵液的pH 值和滴定酸度,结果如图4 所示。只有7 株 菌(L.plantarumG1.3、L.plantarumG1.4、L.plantarumQ2.3、L.fermentumLF3.2、L.pentosusQ1.4、L.paracaseiL2.7、L.paracaseiP3.1)的滴定酸度在140 °T 以上。如意等[17]从29 份酸马奶样品中分离出的161 株乳酸菌中,只有11 株乳酸菌到达发酵终点时的滴定酸度达到80 °T 以上。初始发酵液pH 值为6.20,发酵18 h 后,这7 株菌发酵液的pH值均达到4.20 以下。吴燕[18]发现菌株L.fermentumSJ-1、L.plantarumSJ-2、L.fermentumSJ-3 发 酵18 h 时培养液的pH 值在4.25 左右。初步说明这7株菌具有较好的产酸能力。
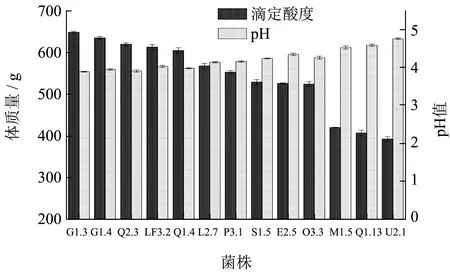
图4 13 株乳酸菌发酵18 h 时产酸情况Fig.4 Acid production of 13 strains of lactic acid bacteria at 18 h of fermentation
2.4 菌株发酵24 h时生长曲线及产酸变化
乳酸菌利用自身生长代谢过程中产生的多种有机酸来抑制有害菌的生长,从而可提高发酵乳的安全性,使其在制作过程中避免受到腐败菌及致病菌的污染[6],且菌株增殖越快,产酸越多,对有害菌的抑制能力越强。由图5a 可知,0~4 h 时,七种乳酸菌的菌体浓度低,生长延滞,随后快速增加,可见菌株适应环境能力强,12 h 后各菌株的生长速率减缓,20 h 时除L.paracaseiL2.7、L.paracaseiP3.1,其余菌株均已进入稳定生长期,此时各菌株的生长速率、生理活性呈下降状态,但其代谢产物在发酵体系中仍大量累积。在相同培养时间内,菌株L.fermentumLF3.2、L.plantarumG1.3 的生长繁殖能力最强,最终菌液浓度最大。

图5 乳酸菌菌株发酵24 h 时生长曲线及pH 值变化Fig.5 Growth curve and pH value change of lactic acid bacteria at 24 h of fermentation
如图5b 所示,7 株乳酸菌培养液pH 值变化也基本经历了延滞期、对数变化期和稳定期。0~4 h时,菌株培养液pH 值基本不变,4~12 h 内其随着菌体数目的增加而快速降低,培养时间的延长,导致代谢产物积累和营养物质消耗,使待测菌株的增殖速度受到明显抑制,pH 值的下降速率减缓[19],24h 时 除L.paracaseiL2.7、L.paracaseiP3.1,其余菌株培养液pH 均下降至4.0 以下。比较发现,L.plantarumG1.3 的产酸能力最强,pH达到3.78,L.plantarumQ2.3、L.plantarumG1.4 次之。金成武等[20]从市售泡菜中筛选到1 株高产酸植物乳杆菌Q12,其24 h 发酵液pH 值达到3.79。
2.5 乳酸菌发酵豆乳过程中pH值的变化
乳酸菌可利用自身代谢产生的酶降解豆乳中的糖类和脂肪,导致有机酸和脂肪酸的产生,使体系的pH 值降低[19]。根据前期实验结果(3.3、3.4),淘汰产酸能力差、生长缓慢的菌株L.paracaseiL2.7、L.paracaseiP3.1,应用其余5 种菌株(L.plantarumQ2.3、L.fermentumLF3.2、L.pentosusQ1.4、L.plantarumG1.4、L.plantarumG1.3)分别发酵大豆乳、花生乳和鹰嘴豆乳,三种发酵豆乳的pH 值变化测定结果如图6 所示。不同菌株在三种豆乳中的pH 值变化趋势相似,但产酸能力有所不同。发酵24 h 时,L.fermentumLF3.2 在三种豆乳中的产酸效果最好,此时发酵大豆乳和花生乳的pH 值达到4.5 以下,L.plantarumG1.3 在三种豆乳中也具有较好的产酸能力。这可能与微生物在发酵体系中对发酵底物的吸收利用情况有关[18]。黄玉军等[21]发现12 株乳酸菌在发酵大豆乳24 h 内pH值均降至4.5 以下。菌株TL-P3、TL-B13、TL-St发酵花生乳24 h 时,pH 值可从6.5 降至5.0[22]。利用保加利亚乳杆菌、嗜热链球菌发酵鹰嘴豆乳与牛乳混合乳,其pH 值随豆水比、牛乳与豆乳比、接种量、发酵温度与时间的变化在4.70~4.90内浮动[23]。pH 值的变化,能够改善豆乳发酵制品的风味[24]。
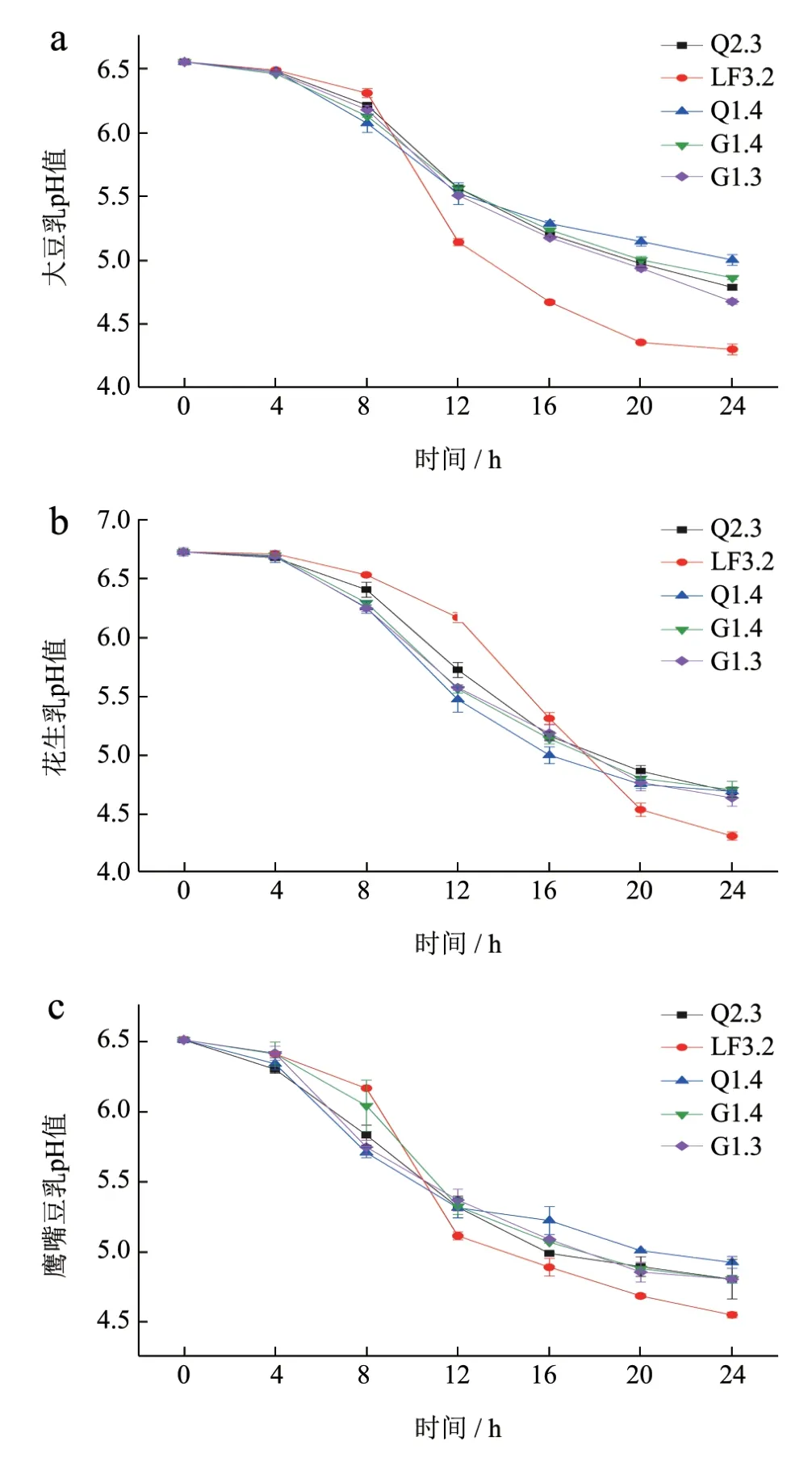
图6 5 株乳酸菌发酵不同豆乳过程中的pH 值变化Fig.6 pH value changes during the fermentation of different bean milk by 5 strains of lactic acid bacteria
2.6 乳酸菌发酵豆乳过程中活菌数的变化
为了筛选适于在不同豆乳中生长代谢的乳酸菌,本实验监测了5 种乳酸菌发酵三种豆乳过程中的活菌数变化。如图7 所示,在发酵的0~12 h,各组乳酸菌数快速增长;12~16 h 时乳酸菌数略有下降趋势,之后略有增加,这可能因为乳酸菌受到酸胁迫时,会抑制其生长,增殖速度低于死亡速度,在受到抑制后乳酸菌体内的一些蛋白质会被诱导表达,这些蛋白可以使乳酸菌恢复正常的细胞活动,活菌数继续增加[25]。发酵24 h 时,三种发酵豆乳中的活菌数都达到了8 log CFU/mL 以上,且菌株L.fermentumLF3.2、L.plantarumG1.3 在大豆乳和花生乳中生长情况更好,而鹰嘴豆乳中的营养成分更适合菌株L.fermentumLF3.2、L.plantarumG1.4 生长。L.fermentumLA-5 在发酵大豆乳中培养24 h 时的活菌数达到了8.56 log CFU/mL,充分发挥其益生功效[26],但关于乳酸菌发酵花生乳和鹰嘴豆乳的研究较少,且多集中于豆乳凝乳状态和混合乳发酵优化探究。

图7 5 株乳酸菌发酵不同豆乳过程中的活菌数变化Fig.7 Changes in viable bacteria count during fermentation of different bean milk by 5 strains of lactic acid bacteria
2.7 发酵豆乳的抗氧化能力测定
根据乳酸菌发酵豆乳过程中pH 值和活菌数变化的结果,选择L.fermentumLF3.2、L.plantarumG1.3 应用于发酵三种豆乳,并测定不同发酵豆乳对DPPH· 和OH· 的清除率。如图8 所示,未发酵豆乳(UF)本身也有一定的抗氧化能力,大豆乳对DPPH·清除率为61.47%,显著高于花生乳和鹰嘴豆乳(P<0.05)。花生乳对OH·清除率为39.26%,显著高于大豆乳和鹰嘴豆乳(P<0.05)。发酵24 h 后,三种发酵豆乳对DPPH· 和OH· 的清除率与未发酵比均显著提高(P<0.05),抗氧化性增强,但是所提高的量与菌株、豆乳种类以及抗氧化机制均有一定的关系。

图8 不同发酵豆乳的DPPH ·和OH ·清除率Fig.8 DPPH.and OH.scavenging rates of different fermented bean milk
L.fermentumLF3.2 增加三种发酵豆乳对DPPH· 清除率的效果比L.plantarumG1.3 更好,而L.plantarumG1.3 增加三种发酵豆乳对OH· 清除率的效果比L.fermentumLF3.2 更佳。L.fermentumLF3.2、L.plantarumG1.3 发酵24 h,大豆乳对DPPH· 和OH· 的清除率比未发酵分别高出23.34%、23.64%,增长量最高。Jose 等[27]使用L.rhamnosusCRL981发酵大豆乳24 h 时其DPPH·清除率比未发酵豆乳高出29.5%。经L.plantarum-P1201 发酵后,大豆乳的抗氧化能力提高,对DPPH· 清除率从38.80%升至77.40%,对OH· 清除率从15.60%升至47.00%[28]。在乳酸菌的作用下,众多酶被激活,能够产生并增加大量具有生理功能的生物活性物质,从而使豆乳具有更明显的抗氧化功能,延长其贮藏期。Juan 等[29]认为发酵豆乳具有较强抗氧化性的原因可能是由于发酵过程中总酚和游离型黄酮含量增加所致。
3 结论
本文从传统发酵食品和健康人肠道中中分离鉴定出74 种乳酸菌,经胃肠液耐受性测定、产酸和生长特性测定,筛选得到5 株性能优良的菌株(L.plantarumQ2.3、L.fermentumLF3.2、L.pentosusQ1.4、L.plantarumG1.4、L.plantarumG1.3),并应用于发酵大豆乳、花生豆乳和鹰嘴豆乳。其中菌株L.fermentumLF3.2、L.plantarumG1.3 在三种豆乳中生长与代谢能力最强,而且L.fermentumLF3.2 和L.plantarumG1.3 发酵可显著提高三种豆乳的抗氧化性。
