动物双歧杆菌和罗伊氏乳杆菌对肥胖小鼠体脂分布和血脂的影响
2024-02-28朱梅珍郑晗盈郭东北陈小旋潘莉莉李红卫
朱梅珍,郑晗盈,郭东北,陈小旋,潘莉莉,李红卫
(厦门大学公共卫生学院,福建厦门 361100)
超重或肥胖指体内脂肪过量堆积引起的健康异常状态[1]。肥胖作为诸多非传染性疾病的主要危险因素,与糖尿病、高血压及心血管疾病等的发生密切相关[2,3]。另外,脂肪的分布也与诸多疾病紧密联系。体脂肪的分布不仅影响血脂异常[4],还与胰岛素抵抗[5]、胆囊结石[6]等相关。如今,肥胖率在全球诸多国家均呈现迅速上升状态[7],肥胖的防治已成为亟待解决的重要公共卫生问题。当前采用手术和药物等治疗肥胖的方法均有副作用存在[8,9],节制饮食和运动减脂又难以坚持[10,11],因而迫切需要安全有效的营养解决方案。而益生菌可以通过影响与肥胖症有关的能量调节和慢性炎症状态从而改变宿主的新陈代谢[12,13],使得肠道微生物干预成为治疗肥胖的一种可行策略。但益生菌种类繁多,各自所具的作用也不尽相同,其对体质量的作用具有显著的菌株特异。有研究表明双歧杆菌通过影响肠道微生物的生长繁殖,改善肠道代谢,从而治疗高脂饮食引起的肥胖[14]。而临床随机对照研究表明补充乳双歧杆菌BS01(Bifidobacterium lactisBS01,BS01)和嗜酸乳杆菌LA02(Lactobacillus acidophilusLA02,LA02)对人体体质量、体脂百分比、手臂皮褶脂肪、腰围等测量指标没有影响[15]。用三株不同的罗伊氏乳杆菌干预肥胖小鼠的研究发现,罗伊氏乳杆菌ATCC(Limosilactobacillus reuteriATCC,ATCC)干预显著抑制了小鼠体质量增长,而补充罗伊氏乳杆菌L6798(Limosilactobacillus reuteriL6798,L6798)的小鼠体质量明显增加[16]。可见,不同菌株干预对高脂饮食诱导的小鼠体质量增加产生了不同的作用。毒理实验表明动物双歧杆菌CP-9(Bifidobacterium animalisCP-9,CP-9)可以降低Caco-2 肠上皮细胞中甘油三酯(Triglyceride,TG)的积累[17],而罗伊氏乳杆菌ADR-1(Limosilactobacillus reuteriADR-1,ADR-1)可以改善高果糖喂养大鼠的胰岛素抵抗和肝脂肪变性[18],尚未发现这两种益生菌对宿主体质量和脂肪代谢的影响。因此,本研究选取CP-9、ADR-1 两种益生菌,利用肥胖小鼠模型,探讨其对肥胖小鼠体质量、体脂肪分布、血脂等的影响,并对作用机制进行初步探索。
1 材料与方法
1.1 动物
SPF 级雄性C57/BL6 周龄小鼠,购自北京维通利华,动物许可证号为:SYXK(闽)2018-0010,饲养于某大学实验动物中心,饲养条件:温度22 ℃,湿度40%~60%,12 h 明暗交替照明,自由饮水。适应性喂养1 周后开始实验。动物伦理号:XMULAC20210010。
1.2 造模与分组
全程普通饲料喂养的12 只小鼠为正常饮食组(Normal Diet,ND),其余小鼠高脂饲料(Research Diets Inc.D12492)喂养8 周。选取肥胖造模成功的36 只小鼠(即自身体质量增长大于40%)[19],随机均分为高脂饮食对照组(High-fat Diet,HFD),动物双歧杆菌CP-9 组(Bifidobacterium animalisCP-9,CP-9)和罗伊氏乳杆菌ADR-1 组(Limosilactobacillus reuteriADR-1,ADR-1)。
1.3 受试物与干预
CP-9(1.5×1011CFU/g)购自台湾丰华生物有限公司;ADR-1(5.0×1010CFU/g)购自景岳生物科技股份有限公司。CP-9 组、ADR-1 组每日分别予以CP-9、ADR-1 进行灌胃,灌胃剂量参考人体日摄入量分别为1×109、1×109CFU/g,灌胃质量浓度分别为4.952×10-5、1.486×10-4g/mL。ND、HFD 组灌以生理盐水,灌胃量为0.2 mL/10 g,连续干预10 周。
1.4 指标检测
1.4.1 体质量
每周测量并记录小鼠体质量(g)。
1.4.2 体成分分析
使用体成分分析仪EchoMRI-100H(中国,汇佳生物)测量小鼠总瘦组织量(Lean Weight,LW)和总脂肪量(Fat Weight,FW),并计算瘦组织体质量比(Lean Weight Ratio,LWR)和脂肪体质量比(Fat Weight Ratio,FWR)。
式中:
A——瘦组织体质量比(LWR);
B——脂肪体质量比(FWR);
WL——动物瘦组织质量(LW),g;
WF——动物脂肪质量(FW),g;
W——动物体质量,g。
1.4.3 腹腔脂肪、脏器重量及相关指标
干预结束后禁食12 h,处死、解剖小鼠,分离并称量肾脏(Kidney Weight,KW)、脾脏(Spleen Weight,SW)、肝脏(Liver Weight,LW)和肾周脂肪(Perirenal Fat Weight,PFW)、附睾周围脂肪(Epididymal Fat Weight,EFW)和肠系膜脂肪(Mesenteric Fat Weight,MFW)质重,计算脂肪系数(Fat Ratio,FR)和肝脏系数(Liver Ratio,LR)。
式中:
C——脂肪系数(FR);
WPF——肾周脂肪质量(PFW),g;
WEF——附睾周脂肪质量(EFW),g;
D——肝脏系数(LR);
W肝——肝脏质量(Liver Weight),g;
W——动物体质量,g。
1.4.4 脂肪面积
小鼠采用体积分数2%的异氟烷进行吸入诱导麻醉后,将小鼠俯卧位固定于动物载床上,利用小动物磁共振成像设备9.4TMRI(德国,Bruke)对小鼠进行MRI 成像,观察小鼠皮下和腹腔的脂肪分布。通过圈定T1 加权成像、T2 加权成像中各层小鼠脂肪目标区域,计算小鼠肝脏上边界到肾脏下边界的各层脂肪面积总和。
1.4.5 肝组织切片染色
解剖后取小鼠完整的肝脏用质量分数4%的多聚甲醛固定。一部分样品洗涤、脱水、透明、浸蜡包埋后,使用石蜡切片机(美国,Leica RM2235)切割切片,烤干后按照标准染色程序进行苏木精-伊红(Hematoxylin-erosin Staining,H&E)染色。另一部分样品常规冰冻切片后,进行油红O(Oil Red O Stainning,ORO)染色。最后使用光学显微镜下观察肝组织病理形态。
1.4.6 生化指标
干预结束后,小鼠摘眼球取血,于4 ℃放置1 h 后,2 000 r/min 离心15 min,收集上清,-80 ℃保存,用于测定生化指标。采用全自动生化分析仪(中国厦门宝诚,BS-240vet)检测小鼠血脂和肝功能,即血清总胆固醇(Total Cholesterol,TC)、高密度脂蛋白胆固醇(High-density Lipoprotein Cholesterol,HDL-C)、低密度脂蛋白胆固醇(Low-density Lipoprotein Cholesterol,LDL-C)、总甘油三酯(Total Triglyceride,TG)、谷丙转氨酶(Alanine Aminotransferase,ALT)及谷草转氨酶(Aspartate Transaminase,AST)。
1.4.7 肝组织FAS、PPARγ基因的蛋白表达
解剖后的肝脏组织,生理盐水清洗、吸干后,置于冻存管中,-80 ℃保存。采用Western Blot 法检测肝组织脂肪酸合成酶(Fattty Acid Synthase,FAS)和过氧化物酶体增殖物激活受体γ(Peroxisome Proliferator-activated Receptor-γ,PPARγ)基因的蛋白表达。取100 mg样品,洗涤、裂解、研磨、12 000 r/min 离心5 min 后取上清;利用BCA蛋白浓度测定试剂盒(上海,碧云天生物技术)进行蛋白定量;灌胶后电泳,上样液为20 μg;然后转移到PVDF 膜上,封闭;后分别加入FAS 一抗(英国,Abcam1:1 000)、PPARγ一抗(英国,Jackson1:1 000)4 ℃孵育过夜;洗膜后加入羊抗兔二抗(英国,Jackson1:2 000)、辣根过氧化物酶标记的羊抗小鼠二抗(英国,Jackson1:2 000)孵育2 h;最后用化学发光检测试剂(试剂A:试剂B =1:1)显影。蛋白质条纹的灰度读取使用Tanon 化学发光成像系统(上海,Tanon),结果表示为FAS、PPARγ蛋白条带与内参β-actin 条带的OD 值的比值。
记者一行利用中秋假期体验了一次乘坐西成高铁。从西安北客站出发,一路都是金秋美景。列车翻越秦岭时,90%的时间都在隧道中,列车短暂出隧道时,可以看见高耸入云的山峰,可想西成高铁建设的空前难度。乘坐普通列车需要14小时,而今乘坐高铁只需要3小时左右,真令人难以想象。
1.5 数据分析
采用SPSS 22.0 软件进行统计分析,结果表示为均数±标准差(±S)或中位数(四分位数)[Median(IQR)],组间比较采用方差分析或Kruskal-Wallish检验,两两比较采用LSD或Nemenyi方法,以P<0.05表示差异具有统计学意义。
2 结果与分析
2.1 摄食量与体质量
本研究给予小鼠高脂饮食8 周进行肥胖造模,造模成功的小鼠根据随机数字表法随机分组后,各组间体质量均衡(P>0.05)。表1 结果显示,10 周干预期内各组小鼠饲料摄入量差异无统计学意义,因而可以排除高脂饮食各组因摄食量不同而造成的体质量差异。重复测量方差分析结果表明,各组小鼠体质量增长趋势不同(P<0.01)。ND 组体质量增长缓慢,而高脂饮食组体质量增长迅速,但其中CP-9、ADR-1 组较HFD 组明显减缓。至第6周时,CP-9、ADR-1 组体质量均明显低于HFD组(37.35 g、37.46 g vs 42.35 g,P<0.05),该现象一直持续至干预结束。干预10 周后,CP-9 组、ADR-1 组体质量分别为36.80 g、36.63 g,与HFD组(45.33 g)相比显著降低(P<0.05)。CP-9 组、ADR-1 组体质量增长较HFD 组显著降低(4.25%、3.31% vs 24.87%,P<0.05),表明CP-9 组、ADR-1两种益生菌能有效缓解高脂饮食引起的体质量增长。
Pedret 等[14]发现动物双歧杆菌亚种Ba8145(Bifidobacterium AnimalisBa8145,Ba8145)及 其热失活形式均能够降低腹型肥胖者的体质量指数,改善人体肥胖症的生物标志物。Fåk 等[16]发现罗伊氏乳杆菌ATCC 可使小鼠体质量增长显著抑制,而L6798 具有相反的作用。本研究选取的动物双歧杆菌亚种CP-9 和罗伊氏乳杆菌ADR-1 两种益生菌同样能够显著抑制高脂饮食引起的小鼠体质量增长,可见这两种益生菌治疗肥胖的巨大潜力。
2.2 体成分分析
研究表明身体成分的改变与健康结局具有相关性,与身体质量指数(Body Mass Index,BMI)相比,使用体脂百分比对肌少型肥胖进行分类更能预测疾病的结局[20]。干预后各组的体成分结果如图3 所示。各组瘦组织质量接近(P>0.05),但各组间瘦组织体质量比不同(P<0.05),高脂饮食组瘦组织体质量比明显低于ND 组(0.48 vs 0.85)。高脂饮食组脂肪质量均高于ND 组(P<0.05)。CP-9 组、ADR-1与HFD 组相比,脂肪质量和脂肪体质量比明显降低(9.36 g vs 19.51 g,0.25 vs 0.41),ADR-1 组结果与之相似(8.53 g vs 19.51 g,0.24 vs 0.41)(P<0.05),表明高脂饮食小鼠体质量增长的主要原因是脂肪增长,而这两种益生菌主要作用于脂肪组织,可以有效降低肥胖小鼠的脂肪质量和脂肪体质量比,对小鼠瘦组织含量无明显影响。上述Fåk 等[16]的研究结果也显示益生菌降低脂肪的显著作用。
2.3 脂肪质量
脂肪的分布与诸多疾病(如高血压、肝癌、恶性肿瘤等)相关[21,22],因此对肥胖的防治不应只关注体脂肪量,更应关注体脂肪的分布规律。小鼠腹腔各处脂肪质量如图4所示。HFD组肾周、附睾周围、肠系膜脂肪质量均高于ND 组(P<0.05);CP-9 与HFD 相比,肾周、附睾周围、肠系膜脂肪质量显著降低(-36.78%、-31.39%、-71.52% vs HFD,P<0.05),ADR-1 组也出现相似的结果(-40.23%、-45.74%、-72.15% vs HFD)。脂肪系数更能清楚的表明腹部脂肪的高低。结果显示各组间脂肪系数不同,高脂饲料喂养组高于ND 组(0.07 vs 0.02,P<0.05),ADR-1 组低于HFD 组(0.06 vs 0.07,P<0.05)。该结果表明益生菌干预可有效降低高脂饮食引起的肾周、附睾周围和肠系膜脂肪的堆积,一定程度上降低肥胖小鼠的腹腔脂肪比例。
2.4 腹腔和皮下脂肪面积
本研究进一步通过核磁共振扫描对腹腔和皮下脂肪进行准确定位。腹部脂肪可作为肥胖危险人群的衡量指标[23],其比传统的BMI 更能代表心血管疾病的风险[24],而皮下脂肪分布与肥胖和血压升高有关[25]。图5 小鼠核磁扫描各层的影像结果显示,HFD 组腹腔(十字星所示区域为肾周)和皮下(五角星所示区域)的白色及灰白色的面积明显高于CP-9 和ADR-1 组,说明益生菌干预能够显著降低小鼠腹腔脂肪和皮下脂肪,结合图4 可知,腹部脂肪的降低在肾周、附睾周围及肠系膜周围均有体现,足见益生菌改变脂肪分布的显著作用。如图6 所示,HFD 组腹腔、皮下脂肪堆积明显高于ND组(479.36%,820.38% vs ND,P<0.05)。益 生菌干预后,CP-9 组腹腔、皮下脂肪面积低于HFD组(957.34 mm2vs 1 265.28 mm2,892.56 mm2vs 1 725.98 mm2);ADR-1 组腹腔、皮下脂肪也低于HFD 组(923.35 mm2vs 1 265.28 mm2,943.32 mm2vs 1 725.98 mm2),差异均具有统计学意义(P<0.05),表明益生菌干预可以降低高脂饮食引起的皮下和腹腔的脂肪堆积,减少小鼠腹腔和皮下脂肪的分布。
2.5 脏器质量及肝脏系数
2.6 肝组织病理切片
2.6.1 肝脏H&E染色
如图8 所示,ND 组小鼠肝脏结构完整,肝索以中央静脉为中心呈放射状排列(图8 中黑色框形所示即为某一中央静脉及肝索),肝细胞形态正常,未见脂质空泡。HFD 组小鼠肝脏发生脂肪变性,细胞体积增大且细胞核因脂肪空泡的出现发生位置偏离(图8 中黑色箭头所示为细胞核);肝小叶结构受损,肝窦受压变窄甚至消失,肝索排列紊乱。HFD 组与ND 组间差异显著,可见高脂饮食造成明显的肝内细胞脂肪变性及肝损伤。而CP-9、ADR-1干预对肝脂肪变性及肝损伤有明显的改善作用,肝细胞结构得到一定程度的恢复。
2.6.2 肝脏油红O染色
如图9 所示,ND 组小鼠肝小叶结构相对完整,基本未观察到红色脂肪滴。HFD 组小鼠肝小叶结构紊乱,能观察到大量红色脂肪滴。HFD 组与ND 组间差异显著,可见高脂饮食造成明显肝内细胞脂肪变性及肝损伤。CP-9、ADR-1 组小鼠肝细胞结构得到一定程度的恢复,较HFD 组能观察到红色脂肪滴的数量明显减少。
肝脏是维持机体脂质合成与分解平衡的重要场所,但高脂饮食会打破这种平衡,使肝脏脂质过度积累(即肝脏脂肪变性)和氧化应激[27],脂肪肝又可进一步导致肝脏发生实质性损伤,导致血脂升高。结合肝脏质量和肝脏组织病理切片结果可知,HFD 组肝脏存在大量脂滴,提示高脂饮食引起肝脏质量增加和脂肪变性。而益生菌干预在降低肝脏质量的同时,对肝脂肪变性及肝损伤也有明显的改善作用。有研究显示补充动物双歧杆菌乳酸杆菌亚种LKM512(Bifidobacterium AnimalisSubsp.lactislkm512,LKM512)可改善肝脏脂质蓄积,减轻肝脏和脂肪组织炎症[28],这在本研究中也有所体现。
2.7 肝功能指标结果
如图10 所示,HFD 组血清中ALT(78.70 U/L vs 34.52 U/L)和AST(193.15 U/L vs 147.75 U/L)水平显著高于ND 组(P<0.05),表明高脂饮食对小鼠肝脏功能造成一定程度的损伤。CP-9 干预显著降低了血清ALT 水平(-42.88% vs HFD,P<0.05),ADR-1干预显著降低了血清ALT 和AST 水平(-67.51%,-26.58% vs HFD,P<0.05),说明CP-9、ADR-1 对高脂饮食造成的肝脏功能损伤具有一定的修复作用,能够在一定程度上缓解肝损伤,这与先前的研究结果相同[29]。综合来说,CP-9、ADR-1 益生菌干预可以减少高脂饮食导致的肝内脂肪分布,抑制肝脂肪变性及肝损伤,改善甚至恢复肝功能。

图1 干预期间小鼠体质量变化Fig.1 Body weight during intervention
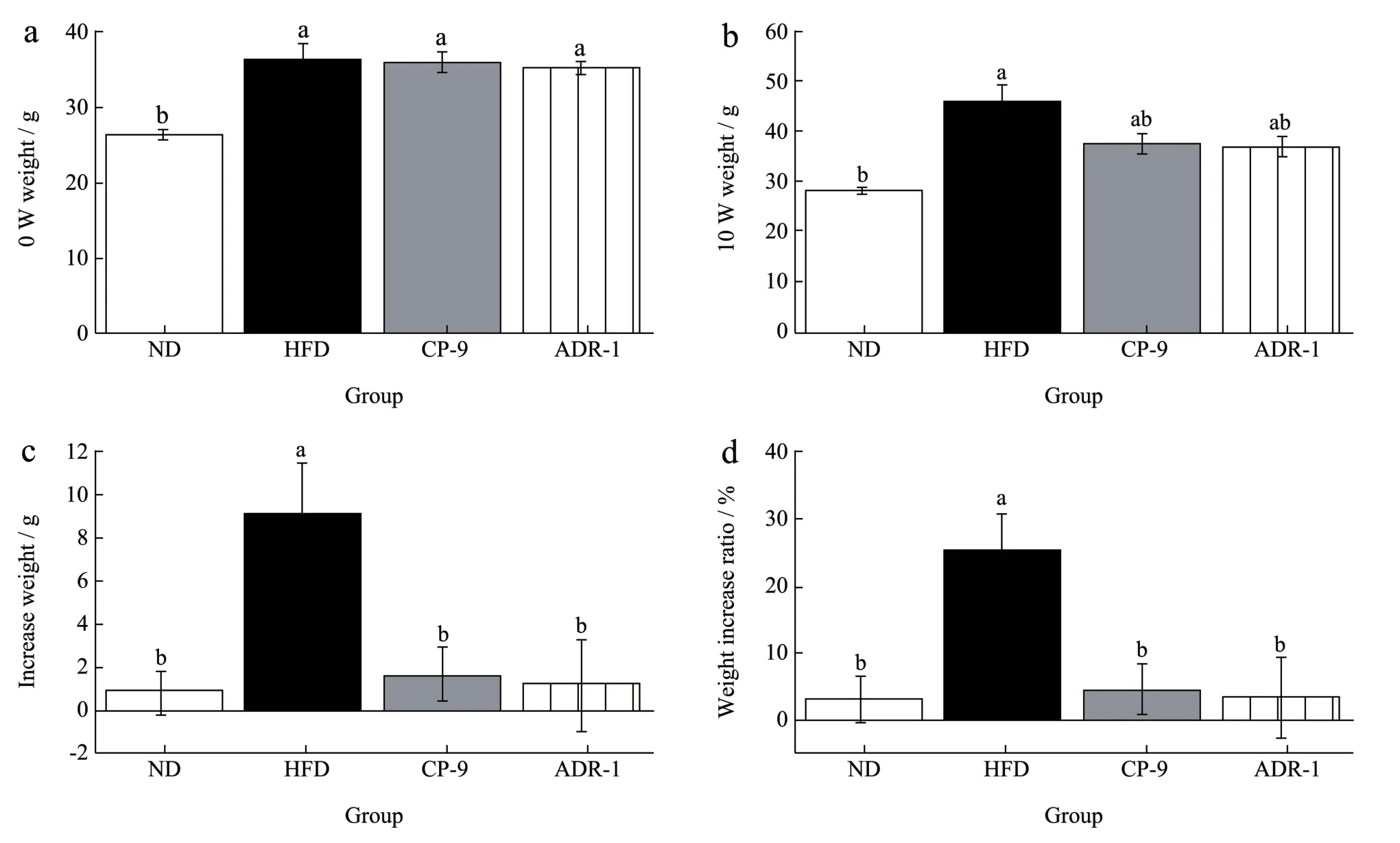
图2 实验动物第0 周、第10 周体质量结果比较Fig.2 Comparison of body weight of mice at week 0 and week 10
2.8 血脂结果
高脂饮食不仅引起小鼠体质量增加,还会造成血脂异常,通常表现为血清TC、TG、LDL-C水平的升高和HDL-L 水平的降低[30]。如图11 所示,HFD 组TC、HDL-C、LDL-C、TG 水平显著高于ND 组(76.15%,40.39%,124.39%,6.36%vs ND,P<0.05)。与HFD 组相比,CP-9 组、ADR-1组LDL-C(-33.70%,-25.00% vs HFD)、TG(-11.11%,-5.98% vs HFD)水平显著降低(P<0.05),TC 水平有降低趋势,HDL-C 水平有升高趋势(P>0.05)。本研究中HFD 组小鼠血清中TC、TG、LDL-C 水平均增高,提示了高脂饮食所致的肥胖小鼠体内存在血脂异常和脂质代谢紊乱。但未见HDL-C 显著降低,这在其它研究中也存在。有学者通过高脂饮食建立代谢综合征小鼠模型,发现HDL-C 水平出现显著增高,认为可能原因是由于处于代谢综合征的早期[31]。CP-9、ADR-1 干预后,血清LDL-C、TG 显著降低,TC 呈现降低趋势,HDL-C 呈增加趋势,这意味着血脂异常和脂质代谢得到一定改善。小鼠体内TC 主要以HDL-C 形式存在,本研究采用的益生菌干预对LDL-C 有明显降低作用,但由于LDL-C 在TC 中占比较低,因此未观察到TC出现明显的降低。Li 等[32]发现长双歧杆菌BORI(Bifidobacterium LongumBORI,BORI)和双歧杆菌BGN4(Bifidobacterium BifidumBGN4,BGN4)能够抑制高脂饮食引起的小鼠体质量增长,同时能够改善脂肪代谢及相关生化指标,这与本研究研究结果相似。
2.9 肝脏FAS、PPARγ基因蛋白表达
FAS对动物长链脂肪酸的合成具有关键作用,其催化丙二酰辅酶A 和乙酰辅酶A 转化为饱和的十六碳脂肪酸棕榈酸[33],该催化途径是内源性合成十六碳以内的饱和脂肪酸的唯一途径。阻断FAS基因的表达或抑制FAS活性可减少体内脂肪酸的合成、阻断脂肪细胞的分化并减少其数量[34]。此外,FAS还可以通过下丘脑途径,调节促进进食作用的神经肽Y 的分泌,从而影响食欲和食物摄入量[35]。因而FAS基因具有调节脂肪代谢,降低体内脂肪的作用。图12 显示,各组间FAS、PPARγ基因的蛋白表达不同(P<0.05)。HFD 组FAS表达高于ND组,结合上述体成分、核磁扫描及解剖各部位的脂肪质量结果(图3~6),可以印证HFD 组小鼠体内脂肪大量沉积[36],进而引起体质量(图1、2)的升高。FAS表达的上调往往随着脂类物质摄入的增加而上调,这是对内源性脂肪酸合成和细胞增殖的一个适应表现,因而HFD 组呈现体质量、体脂和FAS 表达升高的状态。通过上调FAS的转录水平和活性引起脂肪酸合成增多,进而在肝细胞中过量沉积形成脂肪肝[37],肝脏发生实质性变化,在病理上表现为上述图8、9 中HFD 组的肝细胞脂肪变性和结构损伤,同时出现上述图10 所示的肝功能紊乱和图11 中的血脂代谢紊乱表现,即TG、TC 升高。
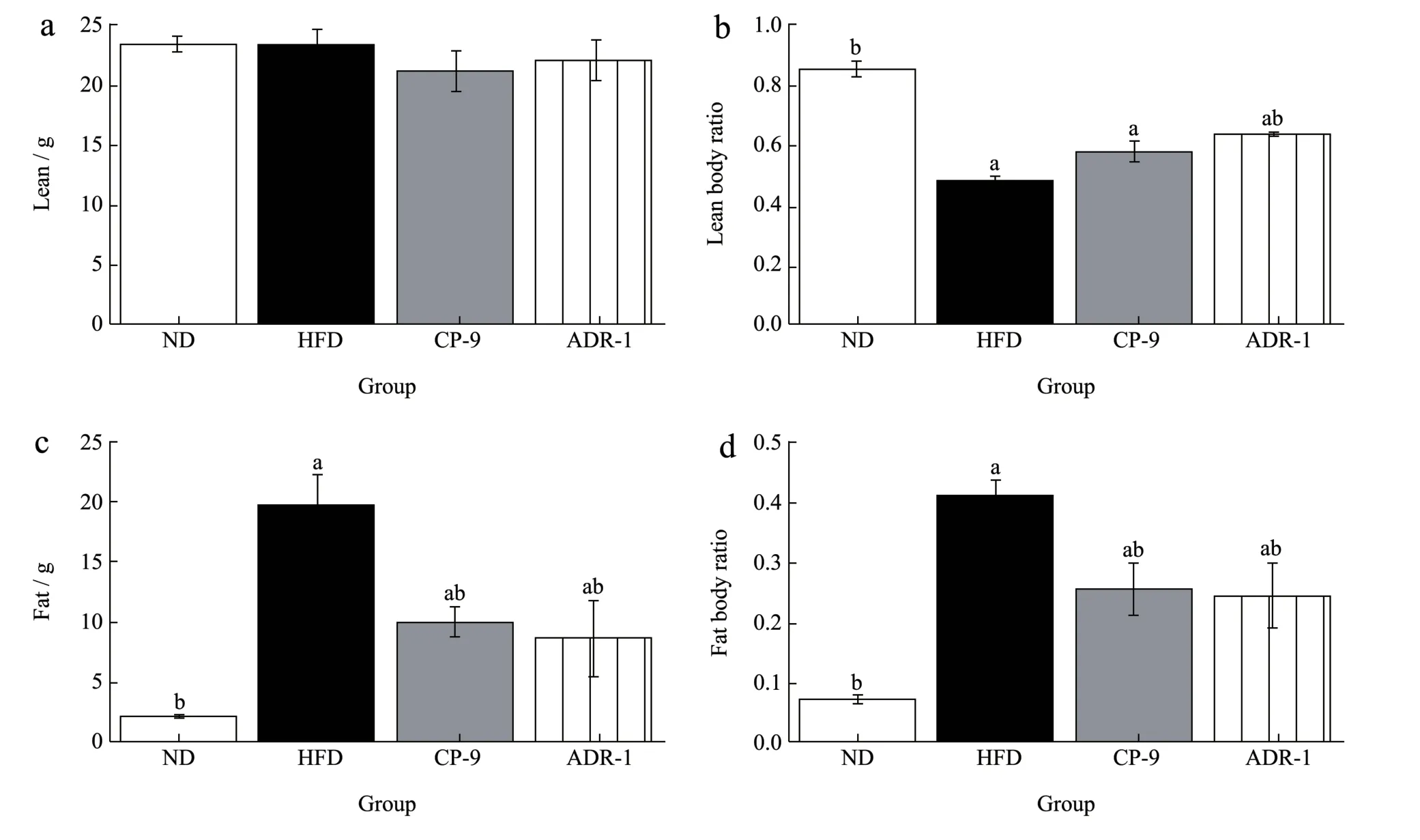
图3 实验动物体成分结果Fig.3 Analysis of body composition

图4 脂肪质量及脂肪系数Fig.4 Fat mass and fat coefficient

图5 实验动物核磁扫描Fig.5 Results of nuclear magnetic resonance scanning in mice (n=3)

图6 实验动物脂肪面积Fig.6 Fat area in mice in mice

图7 脏器质量及肝脏系数Fig.7 Organ mass and liver coefficient

图8 肝脏H&E 染色Fig.8 Representative histopathological findings in the liver of mice (H&E)

图9 肝脏ORO 染色Fig.9 Representative histopathological findings in the liver of mice (ORO)

图10 肝功能指标Fig.10 The serum parameters of liver function

图11 实验动物血脂结果Fig.11 Analysis of blood lipid in mice

图12 FAS、PPARγ 基因蛋白表达结果Fig.12 Expressionof FAS and PPARγ genes

图13 FAS、PPARγ 基因蛋白表达结果Fig.13 Expressionof FAS and PPARγ genes
肝脏FAS除了在脂肪酸从头合成中发挥关键作用外,还参与PPARα、PPARγ激活的信号传导过程[38,39]。PPARγ是调控脂肪代谢的必要转录因子,其信号通路对脂质代谢的调控发挥重要作用[40]。PPARγ广泛分布于肝组织、脂肪组织中,可以控制脂肪氧化,是影响前体脂肪细胞向成熟脂肪细胞分化的重要因素。有研究发现高脂饮食小鼠PPARγ基因的表达可以有效减轻脂质代谢紊乱[41]。皮下脂肪选择性地缺乏PPARγ与肥胖增加有关[42]。PPARγ通过调控与脂肪酸转运有关的酶类,刺激肝细胞摄取脂肪酸并转化为脂酰辅酶A,从而调节小鼠血脂水平,起到调控脂质代谢的作用。同时,PPARγ还参与白色脂肪棕色化,并激活棕色脂肪特异性产热基因的表达[43]。本研究结果显示,HFD 组PPARγ基因的蛋白表达低于ND 组(-91.46% vs ND,P<0.05),高脂饮食显著抑制了PPARγ的表达。而经过两种益生菌干预后,CP-9、ADR-1 组FAS的蛋白表达显著低于HFD 组(-53.22%,-53.22% vs HFD,P<0.05),PPARγ基因蛋白表达显著高于HFD 组(571.43%,714.29% vs HFD,P<0.05),同时血清TG、LDL-C水平降低,肝脂肪变性改善,脂质沉积减少,因而体质量和体脂肪质量表现为降低。故推测CP-9、ADR-1 这两种益生菌是通过调节肝脏FAS、PPARγ基因的蛋白表达降低LDL-C、TG 从而缓解肝功能受损,改善脂肪代谢异常,降低脂质沉积起到降低体质量和体内脂肪的作用。
3 结论
综上,高脂饮食可以引发小鼠肥胖,CP-9、ADR-1 干预能够有效缓解高脂饮食所致的小鼠体质量增加,减少全身脂肪,尤其降低了皮下和腹腔内脏脂肪的分布,而不改变体内瘦组织含量。同时干预改善了肝脏脂肪变性及肝损伤,调节肝功能和血脂代谢紊乱,潜在机制可能是通过调节肝脏FAS和PPARγ基因蛋白的表达降低LDL-C、TG 从而缓解肝功能受损,改善脂肪代谢异常,降低脂质沉积起到降低体质量和体内脂肪的作用。
