黑豆-乳清双蛋白膳食对大鼠体内免疫的调节作用
2024-02-28梁得福孟维洪舒欣庄柯瑾张东杰
梁得福,孟维洪,舒欣,庄柯瑾,2*,张东杰,3*
(1.黑龙江八一农垦大学食品学院,黑龙江大庆 163319)(2.农业农村部农产品及加工品质量监督检验测试中心,黑龙江大庆 163319)(3.黑龙江省农产品加工与质量安全重点实验室,国家杂粮工程研究技术中心,黑龙江大庆 163319)
长期坚持合理的膳食是提高机体免疫力的重要方式,膳食摄入机体后,不同营养成分可调节机体的免疫器官,从而使得机体的免疫力增强[1]。机体必需的营养成分包括蛋白质、脂类、碳水化合物、维生素和矿物质[2],其中蛋白质不仅是构成机体免疫反应的基础物质,还是免疫器官、免疫细胞和免疫因子的主要成分[3]。目前常用于膳食的蛋白主要为植物源蛋白和动物源蛋白,植物源蛋白主要源于粮食作物,如豆类、谷物类、坚果类等,动物源蛋白主要源于畜禽,如肉、蛋、奶[4,5]。
牛奶中的乳清蛋白(Whey Protein,WP)种类丰富,主要含有β-乳球蛋白、α-乳球蛋白、免疫球蛋白、乳铁蛋白和牛血清白蛋白(Albumin,ALB)等多种蛋白质[6]。在饮食中添加乳清蛋白可促进体内胰岛素的释放,从而降低机体在进食后血液中的血糖水平[7]。乳清蛋白可通过增加机体内的谷胱甘肽(GSH)含量,提高机体的免疫应答能力,从而抑制病原的入侵和调节机体免疫功能祛除病原体[8]。研究表明乳清蛋白可巩固小鼠的体液免疫和细胞免疫[9]。但牛乳中含有β-乳球蛋白过敏源,且国内市场对乳清蛋白质需求量过大,而我国乳清蛋白资源相对短缺,只能大量依赖进口。豆科植物中的黑豆(Black Soybeans,BS)蛋白质含量丰富[10],可高达36%~50%,植物源蛋白往往由于某一种必需氨基酸的水平较低,限制了机体对蛋白质的利用率,而动物源蛋白具有更高水平的必需氨基酸。此外,黑豆蛋白可帮助患有急性结肠炎的小鼠更快恢复健康,并降低机体炎性因子的释放[11]。黑豆多肽能显著提高亚急性衰老小鼠机体的免疫能力,延缓小鼠衰老[12]。综上,食用黑豆蛋白和乳清蛋白均可改善机体的免疫特性,虽然两者都有利于机体,但对机体都有着局限性,而双来源的蛋白质能更好解决膳食中单一蛋白源的不足[13]。两种蛋白质的精准互作,对调节控制饮食结构具有重要的支持作用。豆类-乳清双蛋白还可缓解机体对某单一蛋白的不耐受和过敏等生理反应,可以促进人体对Ca 和VD 的吸收,豆类蛋白质还可以减少乳清蛋白乳糖的不耐症,两者相结合可满足必需氨基酸的互补性,改善人体的饮食结构。
乳清蛋白易溶于酸性溶液,在胃部酸性环境下能够快速消化降解,在较短的时间内释放出大量必需氨基酸,尤其是以亮氨酸为代表的支链氨基酸,进而促进肌肉蛋白合成。相较于乳清蛋白,豆类分离蛋白和酪蛋白具有较慢的消化吸收效率,摄入后能够长期保持血液中必需氨基酸的有效供给。牛乳蛋白与大豆分离蛋白协同摄入能保证必需氨基酸的持续性供给[14]。双蛋白混合使用可提高动植物蛋白的利用率,植物源蛋白可避免纯摄取动物源蛋白的缺陷,如胆固醇的升高;动物源蛋白可避免纯摄取植物源蛋白引起的过敏反应等[15]。最新研究发现,大豆与牛乳混合蛋白较单一乳清蛋白能够持续性的激活mTORC1 信号通路,从而促进运动后肌肉蛋白的合成[16,17]。双蛋白预干预可显著提高白血病患者的血清白蛋白、球蛋白和总蛋白含量,明显缓解患者蛋白质营养不良状况,提高肌肉水平,缩短平均植活时间,降低移植后感染发生率。经造血干细胞移植的白血病患者服用双蛋白营养补充剂后,结果表明,双蛋白能够促进患者造血植入,提高患者血清中蛋白含量,具有降低患者感染的趋势[18]。但双蛋白对机体免疫调节作用的研究相对较少。
本研究使用不同蛋白源的饲料,连续饲喂SD大鼠60 d 后,通过测评SD 大鼠的免疫学指标,评估膳食中添加黑豆-乳清蛋白对SD 大鼠免疫状况的调节作用。
1 材料与方法
1.1 试验材料
清洁级雌性Sprague Dawley 大鼠(3 周龄)32 只,体质量50~70 g,购于长春市亿斯实验动物技术有限责任公司。实验大鼠在温度为(22±1)℃、相对湿度50%~60%、光照昼夜12 h 试验环境下循环适应性饲养一周后用于试验,生产许可证编号:SCXK(吉)2020-0002,质量合格证编号:01021670386083521,该动物试验遵守动物保护道德准则和黑龙江八一农垦大学动物饲养使用规则。
试验饲料:试验用标准饲料为AIN-93G 大鼠纯合日粮标准饲料,购于南通特洛菲饲料科技有限公司;WP 饲料、BSP 饲料和黑豆-乳清“双蛋白”(BS-WP)饲料等氮等能,结合蛋白粉的营养水平,参照AIN-93G 标准,委托南通特洛菲饲料科技有限公司制作,生产许可证编号:苏饲证(2019)06092,质量合格证编号:TP20210812002。
大鼠免疫球蛋白M(Immunoglobin M,IgM,编号BPE20033)、免疫球蛋白A(Immunoglobin A,IgA,编号BPE20307)、免疫球蛋白G(Immunoglobin G,IgG,编号BPE20885)检测试剂盒均购自上海朗顿。血清生化指标16 项试剂盒:尿酸(UA,编号C012-1-1)测试盒、葡萄糖(GLU,编号F006-1-1)含量测试盒、总胆固醇(TC,编号A111-2-1)含量测试盒、甘油三酯(TG,编号A110-2-1)含量测试盒、总蛋白(TP,编号A045-2-1)测试盒、高密度脂蛋白(HDL,编号112-2-1)测试盒、低密度脂蛋白(LDL 编,号A113-1-1)测试盒、谷丙转氨酶(ALT,编号C009-3-1)活力测试盒、总胆汁酸(TBA,编号E006-2-1)测试盒、尿素氮(BUN,编号C013-2-1)测试盒、乳酸脱氢酶(LDH,编号A020-1)测试盒、肌酸激酶同工酶(CK-MB,编号E006-1-1)测试盒、谷草转氨酶(AST,编号C010-1-1)测试盒、白蛋白(ALB,编号A028-2-1)测试盒、总胆红素(TBIL,编号C019-1)测试盒、肌酐(CRE,编号C011-2-1)测试盒,均购自南京建成生物工程研究所。
小鼠淋巴瘤YAC-1 细胞,中国科学院细胞库;刀豆蛋白(Concanavalin A,ConA),美国Sigma 公司;台盼蓝,美国Amresco 公司;RPMI-1640 培养液,美国HyClone 公司;胎牛血清(Fetal Bovine Serum,FBS),加拿大Wisent 公司;CCK-8(Cell Counting Kit-8)检测试剂盒,日本Dojindo 公司;胰蛋白酶(比酶活力120 kU/g),北京奥博星生物技术有限公司。
1.2 仪器与设备
HF-90 型CO2细胞培养箱,美国康力公司;Model 680 型酶标仪,美国BIO-RAD 公司;DK-98-1型电热恒温水浴锅,天津市泰斯特仪器有限公司;荧光分光光度计,日本Hitachi 公司;高压灭菌锅,上海申安医疗器械厂;HVD-1320 洁净工作台,北京东联哈尔仪器公司。
1.3 方法
1.3.1 大鼠的分组与饲料的制备
SD 大鼠32 只,进行一周的适应性饲养后随机分为4 组:标准组(CP)、乳清蛋白组(WP)、黑豆蛋白组(BSP)和黑豆-乳清双蛋白组(BS-WP),每组8 只,实验大鼠采取自由摄食的方式,根据每日摄取量与剩余量计算下一天饲料投喂量,控制蛋白摄入水平相同,每组大鼠按照饲喂标准饲喂不同组分的饲料,饲料详细配方及分组见表1,连续饲喂60 d,并监测其体质量变化。

表1 不同蛋白来源饲料的配方组成Table 1 Compositions of the different protein source diet groups (g/kg)
1.3.2 血清生化指标和免疫球蛋白分析
对SD 大鼠饲喂60 d 后称量体质量,麻醉后采取腹主动脉收集血液。血液样品静置30 min 后,于4 000 r/min 离心10 min,按照16 项生化指标及IgM、IgA、IgG 试剂盒说明书分别检测各项指标,本文球蛋白(GLOB)含量为总蛋白(TP)含量减去白蛋白(ALB)含量所得到。
1.3.3 免疫器官指数的测定
各组大鼠收取血液后处死,分别取出脾脏和胸腺,使用滤纸去除剩余血液,将其置于无菌平皿中分别称质量并记录,分别按照公式(1)和(2)计算脾脏和胸腺指数[19]。
式中:
M1——脾脏质量,mg;
M2——胸腺质量,mg;
M3——大鼠体质量,g;
D1——脾脏指数,%;
D2——胸腺指数,%。
1.3.4 脾淋巴细胞增殖实验
无菌条件下将各组SD 大鼠剖腹,取出脾脏置于盛有Hank,s 溶液中无菌培养皿中,使用眼科镊将其剪碎。取无菌注射芯,对置于细胞筛网上的脾脏组织进行碾压研磨,将上述制备的脾脏匀浆使用200 目的细胞筛网进行过滤,加入2 mL 的Hank,s液将细胞筛网中组织吹洗掉,将收集的脾脏组织悬浮液收集于离心管内,4 000 r/min 离心5 min,弃去上清液。加入2 mL Hank,s 液重悬脾细胞,再加3 倍体积的红细胞裂解液混匀细胞,静置3 min,4 000 r/min 离心5 min,弃去上清液。加入5 mL 的RPMI-1640 细胞培养液将沉淀重悬成单细胞悬液,吸取适量的细胞悬液与台盼蓝试剂混合计量细胞浓度,使活细胞比例大于95%,并调整细胞浓度为每毫升2×105个。
将上述调整浓度后的细胞悬液分别按照每孔200 μL 的体积接种于96 孔细胞培养板,然后每孔加入20 μL 的ConA(终质量浓度为5 μg/mL),混匀每孔内的细胞后,将其置于体积分数5% CO2细胞培养箱中培养24 h,再加入21 μL 的CCK-8 溶液,继续放置于细胞培养箱中孵育4 h,然后取出置于酶标仪中,测定450 nm 波长处的光密度值。脾淋巴细胞增殖指数按照公式(3)计算[20]。
式中:
OD空白孔——以不添加脾细胞悬液的RPMI-1640 培养液作为空白孔;
D3——脾淋巴细胞增殖指数,%。
1.3.5 NK细胞活性分析靶细胞制备:将稳定传代的靶细胞(YAC-1 细胞)培养至对数生长期,重悬靶细胞调整浓度为每毫升1×104个。效应细胞制备:将1.3.4 制备的脾细胞悬液调整浓度为每毫升5×105个。将上述的靶细胞和脾细胞悬液分别吸取每孔50 μL 接种于96 孔细胞培养板内,混匀每孔内的细胞,于细胞培养箱孵育24 h,然后每孔添加10 μL 的CCK-8 试剂,继续孵育4 h,取出置于酶标仪中测定450 nm 波长处各孔的光密度值。NK 细胞活力按照公式(4)计算[21]。
式中:
D4——NK 细胞活力,%。
1.3.6 统计分析
每组8 只大鼠测定各数值后,计算各指标的平均值±标准差(±s),应用GraphPad Prism 8.0软件进行统计分析,多组间数据比较采用单因素方差分析(one-way ANOVA)的Tukey,s 进行事后检验,以组间方差分析P<0.05 为显著性差异,P<0.01为极显著性差异。
2 结果与分析
2.1 各组蛋白对大鼠体质量的影响
试验期间,大鼠行为、精神状态正常,粪便正常,无腹泻等异常情况,饲养期间未有大鼠死亡,饲喂期间大鼠照片如图1 所示。适应性喂养一周后,四组大鼠的初始体质量无显著差异(P≥0.05),随后,大鼠体质量变化如图2 所示,可以看出饲养第5 周时大鼠体质量较初始体质量显著增长(P<0.05),增长率较大,5~9 周时大鼠体质量增长率减小,且饲养结束时BSP 组和BS-WP 组大鼠体质量较WP 组低,与CP 组间无显著差异(P≥0.05),其中,与WP组相比,BS-WP 组大鼠体质量显著降低11.78%,WP 组大鼠体质量增长程度与其他蛋白组相比差异显著(P<0.05),可能与蛋白质源的适口性有关。乳清蛋白粉分子较小,质地细腻,口感更好[22]。乳清蛋白属于快速消化蛋白,易溶于酸性溶液,因此乳清蛋白在胃部强酸环境下能够快速溶解和消化,随即进入小肠完成后续消化过程,这可能是导致WP组大鼠体质量增重显著高于其他组的主要原因[23]。试验结果说明BSP 组饲料的加入有效控制了大鼠体质量的增长。

图1 饲喂不同膳食蛋白组饲料的SD 大鼠Fig.1 SD rats fed diets with different dietary protein groups

图2 饲喂不同组别饲料对SD 大鼠体质量的影响Fig.2 Effects of feeding different groups of diets on body weight of SD rats
2.2 血清生化指标的分析
为评估BS-WP 对大鼠机体健康的影响,参照陈艳勤等[24]的方法,测定大鼠血清的17 项生化指标,检测结果如表2 所示。与CP、WP、BSP 组相比,BS-WP 组大鼠血清中的TP 质量浓度分别增长了27.24%、21.00%和30.71%,TP 在维持血管内胶体渗透压、运输养分等功能中具有重要作用,可反映机体本身的营养状况和对蛋白质的消化吸收情况。由于机体对动物蛋白和植物蛋白的吸收程度不同,可能是因为机体对植物蛋白的吸收程度较好,这可能是导致BS-WP 组大鼠血清中的TP 质量浓度增加的原因[25]。
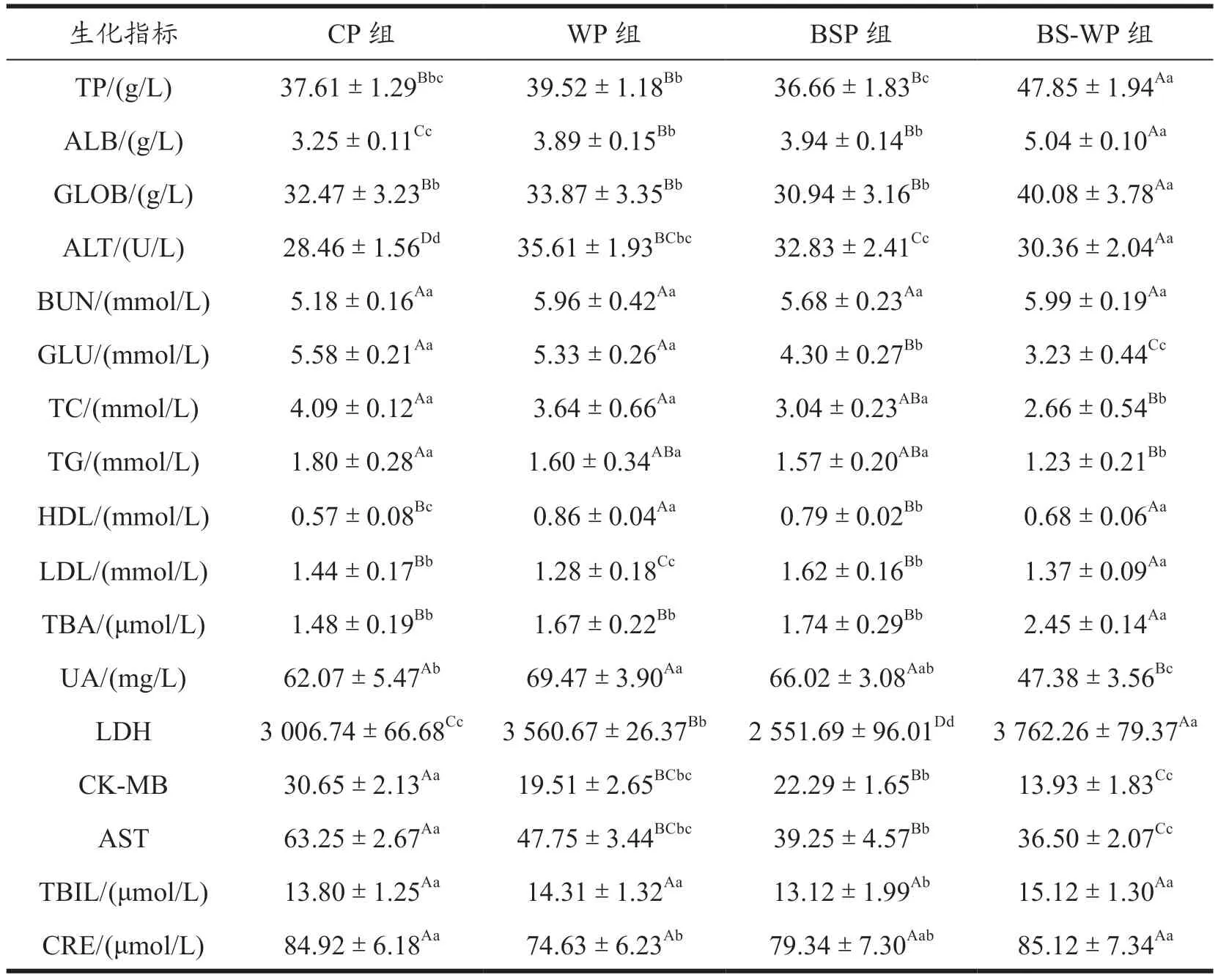
表2 饲喂不同组分饲料对SD大鼠血清生化指标的影响Table 2 Effects of feeding different components of feed on serum biochemical indexes of SD rats
血清TP 主要由血清总球蛋白(GLOB)和血清ALB 构成,TP 含量量越高,表明机体合成蛋白质能力越强,即动物营养状况良好[26]。试验结果表明,BS-WP 组大鼠具有更好的代谢能力。
有研究表明,大鼠进食乳清蛋白后,血清中的ALB提高了14%~16%,TP 质量浓度提高了15%~17%,GLOB 质量浓度分别增长了23.44%、18.33%和29.54%,结果表明乳清蛋白可提高机体的免疫力[27]。本试验中,BS-WP 组与CP、WP、BSP 组相比,ALB 质量浓度分别增长了55.08%、29.56%和27.92%,说明BS-WP 对大鼠免疫有调节作用。膳食中补充赖氨酸可通过影响白蛋白含量调控机体免疫功能,随着赖氨酸的添加量增加,白蛋白含量也有所增加[28]。
ALT 是检测肝功能的重要指标,CP、BSP 各组和BS-WP 各组大鼠血清的ALT 活力显著低于WP组,可能是因为WP 的摄入影响了消化道的正常功能,增加了肝脏的负担。血清BUN 为机体蛋白质和氨基酸等组分的代谢产物,是反映动物体内蛋白质代谢和氨基酸平衡状况的指标。各组大鼠血清的BUN 含量无显著差异,说明各蛋白组的氨基酸组成合理,有利于机体蛋白质的合成代谢。
BS-WP、WP、BSP 与CP 组大鼠相比,血清TC 含量有所降低。张宇等[29]对小鼠补饲乳清蛋白肽水溶液,测定血清生化指标,结果表明乳清蛋白水解得到的活性肽显著降低了小鼠血清总胆固醇水平,降低率达36.3%,具有显著降胆固醇的生理功效。李思锦等[30]通过构建高脂性肝损伤小鼠后在膳食中添加黑豆肽,黑豆肽剂量组小鼠体内AST、ALT、TG、TC、丙二醛(Malondialdehyde,MDA)、LDL水平显著下降。血清TG 含量的降低这种结果可能与机体肝脏脂质合成能力降低有关,也可能与机体血清TG 清除能力增强有关。
综上,本试验的大鼠摄食BS-WP 后,大鼠血清生化指标与WP 组和BSP 组相比均有所改善,因此,摄食BS-WP 更能提高大鼠机体的免疫能力。
2.3 血清中免疫球蛋白分泌的分析
为评估BS-WP 组蛋白对大鼠免疫球蛋白分泌的影响,测定了BS-WP 组免疫球蛋白结果如图3所示,饲喂CP、WP、BSP 的膳食后,三者免疫球蛋白之间无显著性差异,但BS-WP 组大鼠血清中血清的IgG、IgA 和IgM 与其他三组相比差异显著,由图3 可知,饲喂BS-WP 组大鼠相比饲喂单一蛋白组大鼠的血清IgG 含量增加了38.23%~41.23%;同理,血清IgA 含量增加了11.74%~16.48%,血清IgM 含量增加了11.74%~16.48%。由以上结果可知,BS-WP 膳食可促进大鼠血清中免疫球蛋白含量的增加。

图3 饲喂不同组别饲料对SD 大鼠血清Ig 分泌的影响Fig.3 Effects of feeding different groups of feeds on the secretion of serum Ig in SD rats
Ig 是机体免疫系统的主要效应分子,由动物机体的免疫细胞激活后,B 细胞分化成熟为浆细胞后所形成,其含量大小直接反映了机体的免疫应答能力[31]。IgG 含量在动物体中最高,是直接反映机体免疫力的重要指标;IgA 主要参与机体抗感染;IgM 具有激活补体的功能。Moriya 等[32]通过灌胃直接给予小鼠含有乳清蛋白的膳食后测定Ig 的水平,结果表明乳清蛋白可显著性提升Ig 的水平,Bumrungpert 等[33]将乳清蛋白分离物以口服零食的方式用于癌症患者,在口服6 周和12 周时,与未服用的相比,乳清蛋白在口服6 周后无显著性增加,口服12 周后显著增加了患者体内Ig 和ALB 的水平。本实验WP 和BSP 在喂食60 d,与CP 组相比,无显著性差异,可能是由于采用的自由进食的方式,或者喂食时间还较短,但是BS-WP 组大鼠血清中的Ig 水平高于CP、WP、BSP,因此,可知BS-WP促进大鼠血清中Ig 水平的升高。
2.4 免疫器官指数的测定
免疫器官指数的变化可指示机体的免疫能力,脾脏是动物的外周免疫器官,富含T 淋巴细胞、B淋巴细胞和巨噬细胞,是体液和细胞免疫的中心。胸腺是动物的一级免疫器官,对T 细胞成熟和分化起重要作用[34]。各组大鼠解剖后器官如图4 所示,各组器官组织形态均无明显病变。

图4 SD 大鼠解剖过程中状态图Fig.4 State of SD rats during anatomy
从图5a 可知,与CP 组相比,WP 和BSP 组的脾脏指数分别增长了24.98%和24.45%。而BS-WP组大鼠的脾脏指数显著高于其余三组,与其余三组相比,脾脏指数分别增长了69.14%、35.33%和35.91%。由图5b 可知,饲喂WP 和BSP 大鼠的胸腺指数显著高于CP 组,WP 和BSP 的胸腺指数分别增加52.47%和49.35%。而BS-WP 大鼠的胸腺指数均显著高于CP、WP 和BSP,BS-WP 大鼠的胸腺指数对比CP、WP 和BSP 分别增加91.33%、31.51%和34.26%。
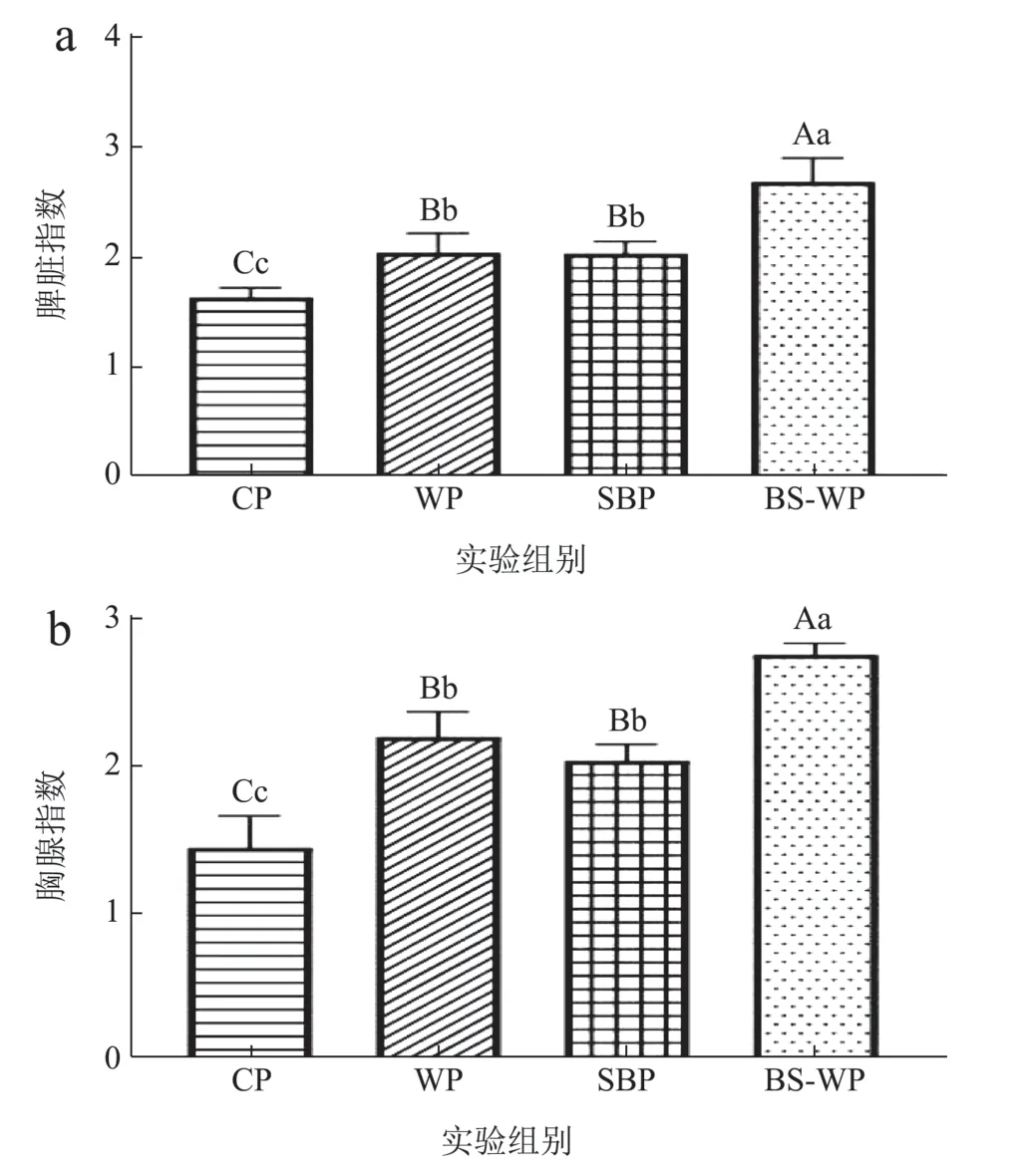
图5 饲喂不同组别饲料对SD 大鼠免疫器官指数的影响Fig.5 Effect of feeding different groups of feeds on immune organ index of SD rats
由以上结果可知,WP 和BSP 可促进大鼠免疫器官指数的增加,但是BS-WP 增加免疫器官指数更为显著。Shiro 等[35]将含有5%的乳清蛋白人工饲喂仔鼠,通过评估仔鼠脾脏和胸腺的重量并对免疫器官进行蛋白质组学分析,结果表明乳清蛋白可增加仔鼠脾脏和胸腺的重量并促进免疫器官的免疫活性。李昱锟等[36]研究表明黑豆肽可增加小鼠脾脏指数和胸腺指数。上述两试验结果均与本实验结果相似,本试验中CP 组和WP 组也可增加免疫器官指数,且BS-WP 组大鼠的免疫器官指数增加更为显著,由此表明BS-WP 更能提高机体的免疫力。
2.5 脾淋巴细胞增殖实验和NK细胞活力的分析
为了更全面的评价BS-WP 对大鼠免疫的影响,对脾脏淋巴细胞和NK 细胞的活力进行测定。结果如图6 所示,脾淋巴细胞增殖指数由图6a 可知,WP 和BSP 组大鼠的脾淋巴细胞增殖指数均高于CP 组,且WP 和BSP 组较于CP 组增加了15.00% 和29.67%,BS-WP 组显著高于CP、WP 和BSP 组,BS-WP 组的脾脏淋巴增殖指数比CP、WP 和BSP 组的多加66.33%、44.64% 和28.28%。NK 细胞活力结果如图6b 所示,CP、WP 和BSP 组大鼠的NK 细胞活力之间无显著性差异,而BS-WP 组大鼠的NK 细胞活力显著高于其他组,与其余三组相比,BS-WP 组的NK 细胞活力分别增长了21.25%、34.72%和25.97%。已有研究表明,采用黑豆蛋白对小鼠进行灌胃后,可增加淋巴细胞增殖指数和NK 细胞活力,该结果与本试验BSP 组脾淋巴细胞增殖指数变化情况一致,但是BSP 组的NK 细胞活力与CP 相比无显著性差异,可能是由于本试验的进食方式与文献不同所导致[37]。冯学轩等[38]采用乳清蛋白与葡聚糖组合对小鼠进行灌胃,测定脾淋巴细胞增殖指数增加了5%~30%,NK 细胞活力增加了7%~20%,结果表明高剂量组的混合物可显著性提高脾淋巴细胞增殖指数和NK 细胞活力,这一结果与本实验WP 和BS-WP 组大鼠的脾淋巴细胞增殖指数和NK 细胞活力是一致的。通过以上结果可知,BS-WP 可提升的SD 大鼠的脾淋巴细胞增殖和NK 细胞活力。

图6 饲喂不同组分饲料对SD 大鼠淋巴细胞增殖和NK 细胞活力的影响Fig.6 Effects of feeding different feed components on lymphocyte proliferation and NK cell activity in SD rats
3 结论
试验使用酪蛋白、黑豆蛋白、乳清蛋白、“黑豆-乳清双蛋白”对SD 大鼠进行60 d 的饲喂,检测血清生化指标、免疫球蛋白、免疫器官指数、脾淋巴细胞增殖指数、NK 细胞活力等免疫学指标,探究“黑豆-乳清双蛋白”膳食对机体免疫性能的影响。试验结果表明,“黑豆-乳清双蛋白”膳食可提高大鼠血液中TP、ALB 等血清生化指标的含量,显著提升大鼠血清中IgA、IgG、IgM 的分泌水平,提高免疫器官(脾脏和胸腺)指数,促进脾脏淋巴细胞增殖并使NK 细胞活力显著提升。因此,BS-WP 组双蛋白膳食可显著提升SD 大鼠的机体免疫性能。
