以FOLFOX方案为核心的肝动脉灌注化疗联合靶向及免疫治疗晚期肝细胞癌的疗效和安全性观察
2024-02-08王晓维戴锋沈建东丁苇蒋逢辰付守忠
[摘"" 要]"" 目的:观察FOLFOX方案为核心的肝动脉灌注化疗(hepatic artery infusion chemotherapy, HAIC)联合靶向和免疫治疗晚期肝细胞癌(hepatocellular carcinoma, HCC)的无进展生存期(progression-free survival, PFS)、总生存率(overall survival, OS)以及安全性。方法:回顾性分析2018年1月—2022年6月在南通市第三人民医院收治的85例晚期HCC患者的病历资料。接受HAIC联合靶向及免疫治疗44例(三联组),接受单纯靶向联合免疫治疗41例(二联组)。随访至2023年12月,比较两组患者治疗后的PFS、OS,应用美国国家癌症研究所制定的不良事件评价标准5.0版评估不良事件来评价治疗的安全性。结果:三联组PFS为6.9(3.3, 13.5)个月,二联组PFS为5(3.4, 7.6)个月,三联组中位PFS明显长于二联组(P=0.013)。三联组OS为17.3(10.5, 23.6)个月,二联组OS为12.8(8, 16.1)个月,三联组中位OS明显优于二联组(P=0.012)。三联组的消化道不良事件发生率较二联组高(P=0.007),1例因消化道出血死亡。余两组不良事件相似,以1~2级为主,3~4级发生率低,且大多可控。结论:HAIC联合靶向及免疫治疗的三联治疗策略可提高晚期HCC患者的生存期,安全性可控,可作为晚期HCC患者的有效治疗方案。
[关键词]"" 肝细胞癌;肝动脉灌注化疗;FOLFOX方案;联合治疗;靶向疗法;免疫治疗
[中图分类号]"" R735.7"""""""""""""" [文献标志码]"" A"""""""""""""" [文章编号]"" 1674-7887(2024)06-0547-05
The efficacy and safety of hepatic artery infusion chemotherapy combined with targeted and immunotherapy with FOLFOX regimen for advanced hepatocellular carcinoma*
WANG Xiaowei**, DAI Feng, SHEN Jiandong, DING Wei, JIANG Fengchen, FU Shouzhong"""""""" (Department of Interventional Vascular, Nantong Third People s Hospital, Affiliated Nantong Hospital 3 of Nantong University, Jiangsu 226006)
[Abstract]"" Objective: To observe the progression-free survival(PFS), overall survival(OS), and safety of hepatic artery infusion chemotherapy(HAIC) with FOLFOX regimen as the core combined with targeted and immunotherapy in the treatment of advanced hepatocellular carcinoma(HCC). Methods: The medical records of 85 patients with advanced HCC admitted to the Nantong Third People s Hospital from January 2018 to June 2022 were retrospectively analyzed. forty-four patients received HAIC combined with targeted and immunotherapy(triplet group), and 41 patients received targeted combined immunotherapy(binomial group). The patients were followed up until December 2023, and the PFS and OS of the two groups were compared after treatment. The adverse events were evaluated using the Adverse Event Evaluation Criteria version 5.0 developed by the National Cancer Institute of the United States to evaluate the safety of the treatment. Results: The PFS of the triplet group was 6.9(3.3, 13.5) months, and the PFS of the binomial group was 5(3.4, 7.6) months. The PFS of the triplet group was significantly better than that of the binomial group(P=0.013). The OS of the triplet group was 17.3(10.5, 23.6) months, and the OS of the binomial group was 12.8(8, 16.1) months. The OS of the triplet group was significantly better than that of the binomial group(P=0.012). The incidence of gastrointestinal adverse events in the triplet group was higher than that in the binomial group(P=0.007), and one patient died of gastrointestinal bleeding. The other adverse events of the two groups were similar, mainly grade 1-2, with a low incidence of grade 3-4, and most of them were controllable. Conclusion: The treatment of HAIC combined with targeted and immunotherapy can improve the survival of patients with advanced HCC, with controllable safety, and can be used as an effective treatment for patients with advanced HCC.
[Key words]"" hepatocellular carcinoma; hepatic artery infusion chemotherapy; FOLFOX regimen; combination therapy; targeted therapy; immunotherapy
肝细胞癌(hepatocellular carcinoma, HCC)是我国常见的肝脏恶性肿瘤,发病率及死亡率均居全球前位。约60%以上的肝癌患者就诊时已属于晚期,失去了根治性治疗的机会。传统的化疗和放疗对晚期HCC的疗效有限,因此急需寻找新的治疗策略来改善患者的生存率和生活质量。肝动脉灌注化疗(hepatic artery infusion chemotherapy, HAIC)作为一种局部治疗方式,可以提高化疗药物在肿瘤组织中的浓度,减少对正常组织的毒副作用[1]。FOLFOX方案是一种包含氟尿嘧啶、亚叶酸和铂类药物的化疗方案,在晚期HCC的治疗中显示出一定的效果[2]。另外,靶向治疗和免疫治疗作为近年来新兴的治疗方式,对晚期HCC也显示出一定的潜力。因此,本研究旨在观察以FOLFOX方案为核心的HAIC联合靶向治疗及免疫治疗对晚期HCC的临床疗效和安全性,为临床提供更有效的治疗策略。
1"" 资料与方法
1.1"" 一般资料"" 回顾性分析2018年1月—2022年6月在南通市第三人民医院接受治疗的85例晚期HCC患者。其中44例接受HAIC联合靶向及免疫治疗(三联组),41例接受单纯靶向联合免疫治疗(二联组)。本研究经南通市第三人民医院伦理委员会审批通过(备案编号:EK2022016)。
1.1.1"" 纳入标准"" (1)符合《原发性肝癌诊疗指南》(2024年版)诊断标准的Ⅲa/Ⅲb期原发性肝癌;(2)肝功能Child A~B级;(3)美国东部肿瘤协作组体能状态评分(Eastern Cooperative Oncology Group, ECOG)评分0~1分;(4)年龄18~80岁。
1.1.2"" 排除标准"" (1)既往接受系统治疗;(2)合并其他恶性肿瘤;(3)严重心肺疾病;(4)严重肾功能不全;(5)严重凝血功能障碍;(6)6个月内重大手术或严重感染者。
1.2"" 治疗方法"" 所有患者入院后完善术前检查,签署知情同意书。加用抗血管分子靶向药物:甲苯磺酸索拉非尼片(多吉美,Bayer AG),0.4 g口服,2次/d。联合免疫检查点抑制剂:注射用卡瑞利珠单抗(艾瑞卡,苏州盛迪),200 mg静脉滴注,每3周1次。HAIC治疗:行Seldinger穿刺法穿刺股动脉,4F RH导管超选至肝总动脉或肝固有动脉造影观察肿瘤形态,留置导管返回病房使用FOLFOX方案进行灌注化疗。化疗药物用量:奥沙利铂130 mg/m2维持2 h、亚叶酸钙200 mg/m2维持2 h、5-氟尿嘧啶(5-fluorouracil, 5-FU) 400 mg/m2维持1 h后续2 400 mg/m2维持46 h。28 d为1个周期,共行4个周期。
1.3"" 随访"" 每2次HAIC治疗后行上腹部MRI及胸部CT检查观察疗效,随后每2个月进行上腹部MRI及胸部CT影像随访,按照mRECIST修订后实体肿瘤临床疗效评价标准(modified response evaluation criteria in solid tumor, mRECIST)标准观察肿瘤情况。应用美国国家癌症研究所制定的不良事件评价标准5.0版评价HAIC治疗过程中及靶向、免疫治疗过程中不良事件发生情况。随访至2023年12月,统计并分析无进展生存期(progression-free survival, PFS)、总生存率(overall survival, OS)及安全性指标。
1.4"" 统计学方法"" 采用SPSS 26.0软件处理数据资料,使用K-S方法检测样本变量是否符合正态分布;正态分布计量资料以x±s表示,配对的资料采用t检验进行比较;非正态分布以中位数(四分位间距)描述,采用非参数检验;计数资料用频数和构成比描述,采用χ2检验;OS、PFS等指标采用K-M法进行分析,并绘制生存率曲线,生存差异分析采用Log-rank检验。P<0.05为差异有统计学意义。
2"" 结""""" 果
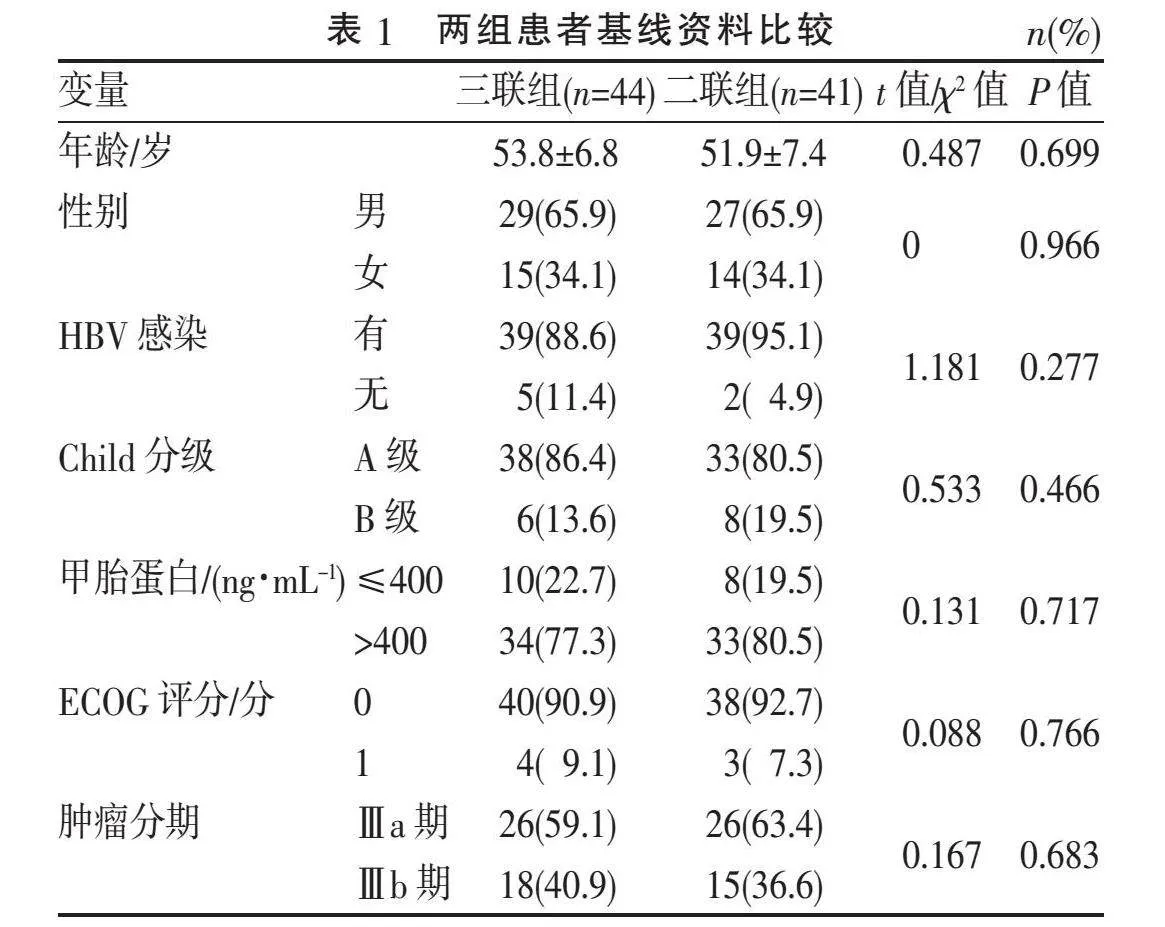
2.1"" 基线资料对比"" 两组患者基线资料比较差异均无统计学意义(均Pgt;0.05),见表1。
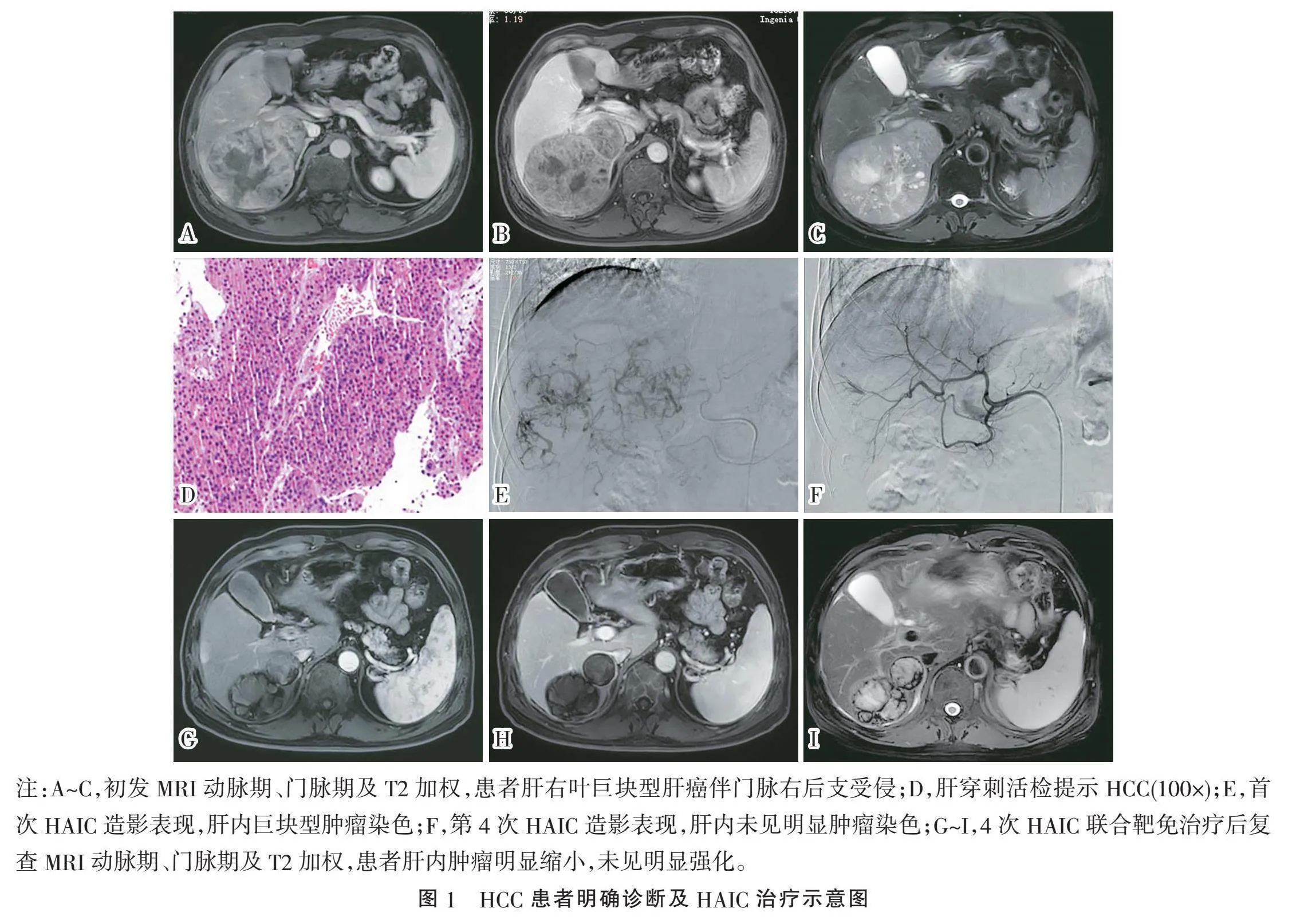
2.2"" 疗效分析"" 由图1三联组典型患者诊断、治疗及影响随访结果可见,HAIC治疗可有效控制肿瘤进展。
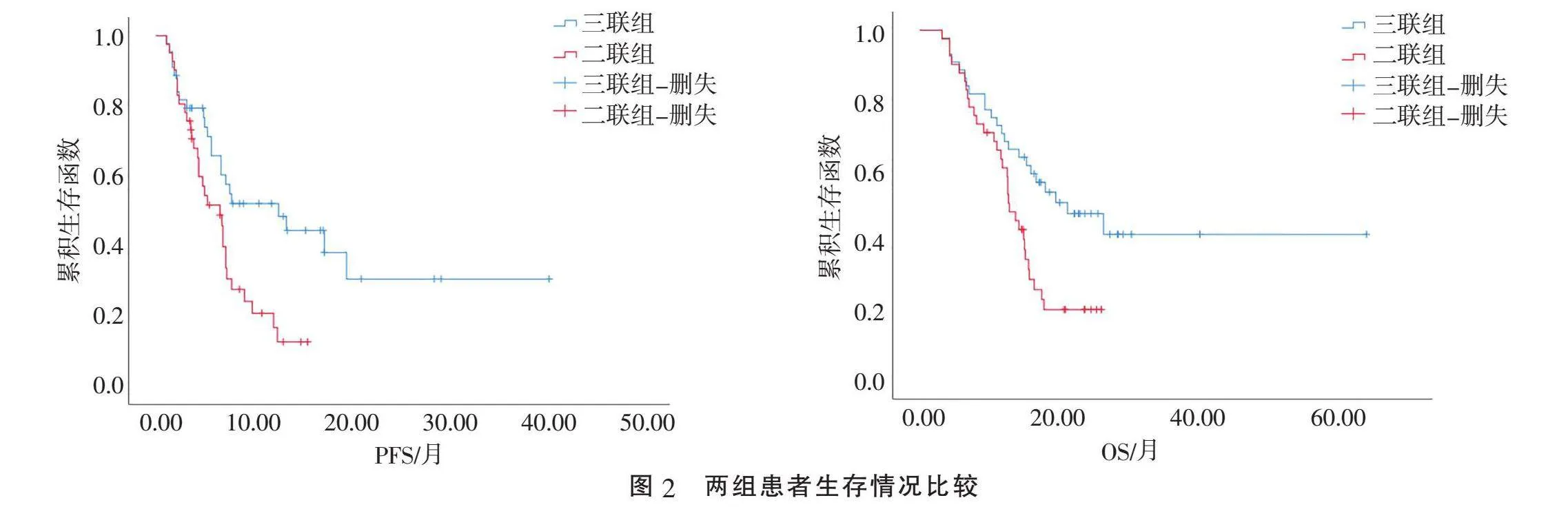
2.3"" 生存分析"" 三联组PFS为6.9(3.3, 13.5)个月;二联组PFS为5(3.4, 7.6)个月,两组比较差异有统计学意义(P=0.013)。三联组OS为17.3(10.5, 23.6)个月;二联组OS为12.8(8.0, 16.1)个月,两组比较差异有统计学意义(P=0.012)。三联组中位PFS及中位OS均明显优于二联组(图2)。
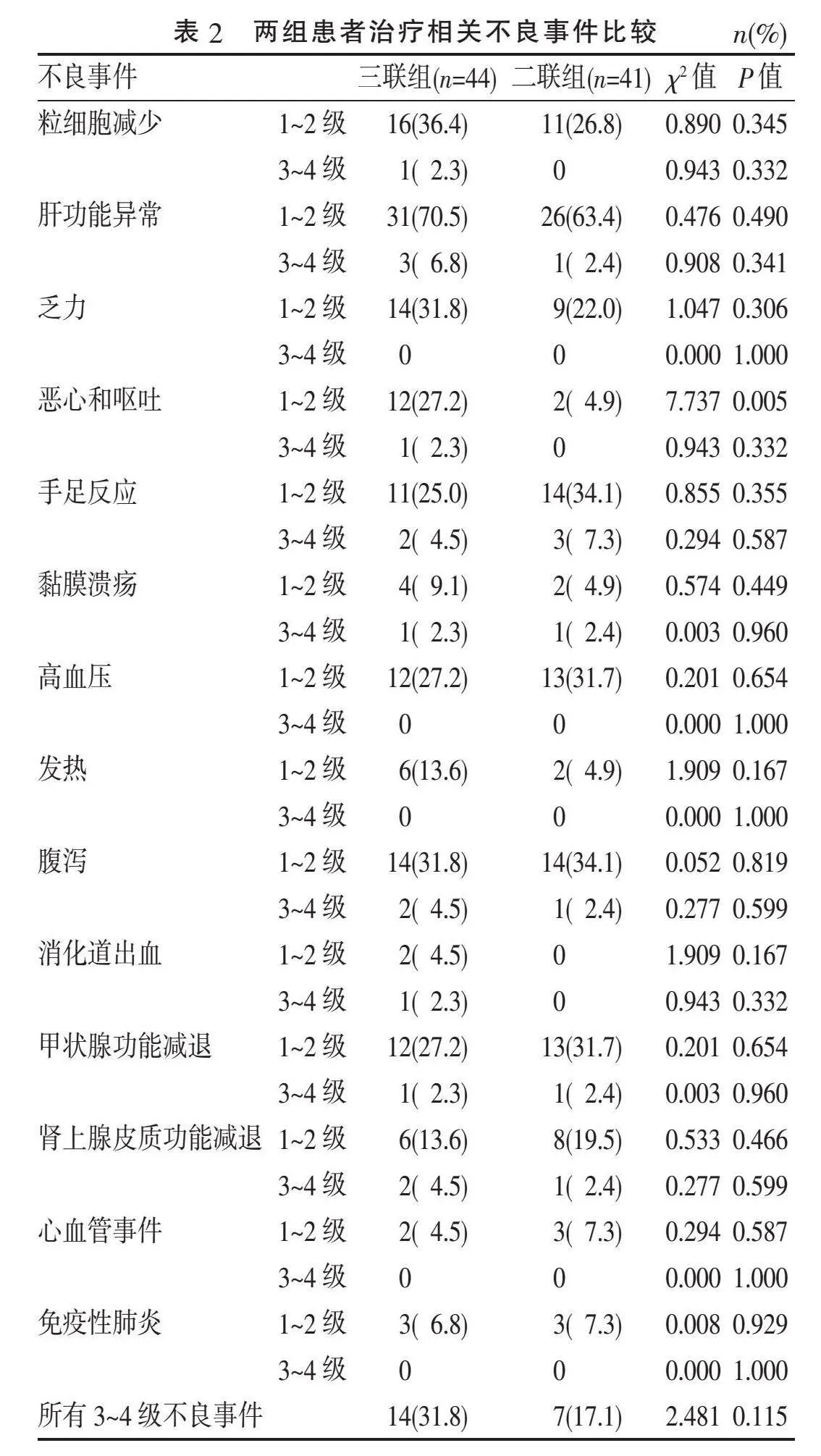
2.4"" 不良事件"" 两组患者不良事件见表2。两组患者均以1~2级不良事件为主。三联组消化道反应较二联组严重(P=0.007),余不良事件比较差异无统计学意义。两组3~4级不良事件总数差异无统计学意义(P=0.137)。除三联组因消化道出血死亡1例外,其余不良事件通过对症处理、激素应用等内科治疗均得到改善,提示总体不良事件可控。
3"" 讨""""" 论
我国是HCC的重灾区,全球癌症数据统计,2020年我国HCC发病率及死亡率约为世界水平的2倍,新发病率及死亡率约占全球总数的50%[3]。大部分HCC患者确诊时已处于中晚期,丧失了根治性手术治疗的机会。这部分患者往往预后很差,如不积极治疗,中位生存期仅4.2~7.9个月[4]。尽管多数指南[5-6]推荐肝动脉栓塞化疗术(transcatheter hepatic arterial chemoembolization, TACE)作为中晚期HCC的标准治疗。但对存在门脉主干癌栓、广泛远处转移的患者,TACE的疗效往往不尽人意。
作为HCC的局部治疗,HAIC治疗越来越受到国内外学者的关注。研究[7]显示,HAIC可显著延长晚期HCC患者的生存期,且不良反应多可耐受。HAIC最早是由日本学者提出,已在日本、韩国等多个亚洲国家开展30余年,常用以FOLFOX方案为核心化疗方案,由5-FU、亚叶酸钙、奥沙利铂组成,是一种针对晚期HCC的有效化疗方案[8]。作为介入的一种治疗方案,具有微创、安全、准确、高效、并发症少以及可重复性高的优点,被日本肝癌指南[9]推荐为伴有门静脉癌栓的中晚期肝癌的标准治疗。在国内,目前HAIC应用日益增多,通过与系统治疗相结合,越来越多的报道[10-11]提示了HAIC治疗的良好效果。HAIC治疗的理论依据主要是肝脏的血供特点:肝脏是具有双重血供的器官,正常肝脏肝动脉供血约占30%、门静脉供血约占70%,而肝癌组织约有90%的血供来源于肝动脉,门静脉供血仅约10%。在理论上,HAIC是通过肝动脉对肿瘤组织进行持续高浓度的化疗药物灌注,发挥最大杀灭肿瘤细胞的作用,并对正常肝组织影响小。另外,由于HAIC治疗首先通过肝脏代谢,因此全身不良反应更少,对于无法手术的晚期HCC患者尤其有效[12],能显著改善生存期和生活质量。研究[13]显示HAIC治疗晚期HCC效果优于TACE治疗,部分应答率及客观缓解率均更高(9.8% vs 52.6%, P<0.001;52.5% vs 83.8%, P=0.004)。同时,在并发症方面,HAIC治疗明显低于TACE治疗。
以索拉非尼及仑伐替尼为代表的酪氨酸激酶抑制剂(tyrosine kinase inhibitors, TKI)药物属于多靶点酪氨酸激酶抑制剂,可以抑制血管内皮生长因子受体(vascular endothelial growth factor receptor, VEGFR)1~3、成纤维细胞生长因子受体(fibroblast growth factor receptor, FGFR)1~4、血小板衍生生长因子受体a(platelet derived growth factor receptor alpha, PDGFRa)、干细胞因子受体(mast/stem cell growth factor receptor, KIT)、转染重排因子(rearranged during transfection, RET)等基因,从而达到抑制肿瘤细胞生长的目的。我国《原发性肝癌诊疗指南(2024年版)》推荐其为中晚期肝癌系统治疗一线方案。免疫检查点抑制剂包括程序性死亡受体1(programmed death-1, PD-1)单抗、细胞程序性死亡-配体1(programmed cell death ligand 1, PD-L1)单抗以及细胞毒性T淋巴细胞相关蛋白4(cytotoxic T-lymphocyte-associated protein 4, CTLA4)。等。作为肝癌二线治疗方案,指南[14]推荐卡瑞利珠单抗、替雷利珠单抗等。一项包含108例晚期肝癌患者的前瞻性随机Ⅱ期研究[15]报道,HAIC联合索拉非尼治疗的总生存期优于单纯索拉非尼治疗(10.6个月vs 8.6个月,P=0.03)。另一项单臂Ⅱ期临床研究[16]表明,HAIC联合索拉非尼是安全有效的。并且,基于此研究的一项前瞻性Ⅲ期临床研究[17]显示,索拉非尼联合HAIC治疗晚期HCC,其客观反应率(40.8% vs 2.5%,P<0.001)、PFS(7.03个月vs 2.60个月,P<0.001)、OS(13.37个月vs 7.13个月,P<0.001)均明显优于索拉非尼治疗。此外,靶向和免疫治疗通过精准作用于癌细胞的特定分子靶点或激活免疫系统攻击癌细胞,为HCC治疗带来了新的希望[18]。HAIC与这些新兴治疗手段结合,更有效地控制肿瘤,增强治疗效果[19]。
尽管HAIC联合靶向和免疫治疗策略在疗效方面展现出了明显的优势,但势必伴随更高的治疗相关不良事件发生[20]。本研究显示,三联组消化道反应较重,考虑与化疗药物有关,其余不良事件多数为轻到中度,通过适当的管理和干预,患者大多能够良好地耐受治疗。因此,可以认为HAIC联合靶向及免疫治疗可以安全应用于晚期HCC患者。
本研究中的疗效和安全性结果仍可能受多种因素的影响,如患者的基线特征(肿瘤分期、肝功能状态以及是否存在其他并发症)。此外,靶向和免疫治疗药物的选择也是影响疗效和安全性的重要因素。因此,探索如何根据患者的具体情况个体化治疗方案,以及如何优化药物组合和治疗计划,将是重要的研究方向。
综上所述,HAIC联合靶向及免疫治疗在晚期HCC治疗中的应用提供了重要的临床依据,这一综合治疗策略在提高患者生存期方面具有潜力,可以作为晚期HCC患者安全、有效的治疗方案。
[参考文献]
[1]"" LAFACE C, LAFORGIA M, MOLINARI P, et al. Hepatic arterial infusion of chemotherapy for advanced hepatobiliary cancers: state of the art[J]. Cancers(Basel), 2021, 13(12):3091.
[2]"" LI Q J, HE M K, CHEN H W, et al. Hepatic arterial infusion of oxaliplatin, fluorouracil, and leucovorin versus transarterial chemoembolization for large hepatocellular carcinoma: a randomized phase III trial[J]. J Clin Oncol, 2022, 40(2):150-160.
[3]"" World Health Organization. Global health estimates 2020: deaths by cause, age, sex, by country and by region, 2000-2019[R/OL]. Geneva: WHO, 2020. [2021-02- 20].
[4]"" Global Burden of Disease Cancer Collaboration, FITZMAURICE C, ALLEN C, et al. Global, regional, and national cancer incidence, mortality, years of life lost, years lived with disability, and disability-adjusted life-years for 32 cancer groups, 1990 to 2015: a systematic analysis for the global burden of disease study[J]. JAMA Oncol, 2017, 3(4):524-548.
[5]"" European Association for the Study of the Liver. EASL clinical practice guidelines: management of hepatocellular carcinoma[J]. J Hepatol, 2018, 69(1):182-236.
[6]"" HASEGAWA K, TAKEMURA N, YAMASHITA T, et al. Clinical practice guidelines for hepatocellular carcinoma: the Japan society of hepatology 2021 version(5th JSH-HCC guidelines)[J]. Hepatol Res, 2023, 53(5):383-390.
[7]"" 肖正芳, 郑游冰, 邓飞燕, 等. 基于TACE联合治疗原发性肝细胞癌的研究进展[J]. 介入放射学杂志, 2024, 33(6):688-692.
[8]"" 陈嵩, 吴志强, 庄文权, 等. 经肝动脉栓塞术联合FOLFOX4方案持续动脉灌注化疗治疗肝细胞癌合并门静脉癌栓15例近期临床疗效评价[J]. 介入放射学杂志, 2019, 28(4):328-333.
[9]"" KUDO M, MATSUI O, IZUMI N, et al. JSH consensus-based clinical practice guidelines for the management of hepatocellular carcinoma: 2014 update by the liver cancer study group of Japan[J]. Liver Cancer, 2014, 3(3/4):458-468.
[10]"" ZHENG K L, ZHU X, FU S J, et al. Sorafenib plus hepatic arterial infusion chemotherapy versus sorafenib for hepatocellular carcinoma with major portal vein tumor thrombosis: a randomized trial[J]. Radiology, 2022, 303(2):455-464.
[11]"" 谢海翔, 韩创业, 彭凯, 等. 肝动脉灌注化疗联合免疫靶向新辅助治疗单发CNLCⅠb期肝细胞癌的安全性与疗效分析[J]. 中华肝胆外科杂志, 2023, 29(1):28-33.
[12]" " 杨振宇, 杜锡林, 贺小军, 等. 胸腺法新联合FOLFOX4治疗进展期肝细胞癌完全缓解一例[J]. 中国临床案例成果数据库, 2020, 2(1):E077-E077.
[13]"" HE M K, LE Y, LI Q J, et al. Hepatic artery infusion chemotherapy using mFOLFOX versus transarterial chemoembolization for massive unresectable hepatocellular carcinoma: a prospective non-randomized study[J]. Chin J Cancer, 2017, 36(1):83.
[14]"" 中华人民共和国国家卫生健康委员会. 原发性肝癌诊疗指南(2024年版)[J]. 临床肝胆病杂志, 2024, 40(5):893-918.
[15]" " IKEDA M, SHIMIZU S, SATO T, et al. Sorafenib plus hepatic arterial infusion chemotherapy with cisplatin versus sorafenib for advanced hepatocellular carcinoma: randomized phase II trial[J]. Ann Oncol, 2016, 27(11):2090-2096.
[16]" " HE M K, ZOU R H, LI Q J, et al. Phase II study of sorafenib combined with concurrent hepatic arterial infusion of oxaliplatin, 5-fluorouracil and leucovorin for unresectable hepatocellular carcinoma with major portal vein thrombosis[J]. Cardiovasc Intervent Radiol, 2018, 41(5):734-743.
[17]" " HE M, LI Q, ZOU R, et al. Sorafenib plus hepatic arterial infusion of oxaliplatin, fluorouracil, and leucovorin vs sorafenib alone for hepatocellular carcinoma with portal vein invasion: a randomized clinical trial[J]. JAMA Oncol, 2019, 5(7):953-960.
[18]" " HE M K, LIANG R B, ZHAO Y, et al. Lenvatinib, toripalimab, plus hepatic arterial infusion chemotherapy versus lenvatinib alone for advanced hepatocellular carcinoma[J]. Ther Adv Med Oncol, 2021, 13:17588359211002720.
[19] " 刘东明, 穆瀚, 刘长富, 等. 免疫及靶向药物联合肝动脉灌注化疗治疗晚期肝癌的回顾性分析[J]. 中国肿瘤临床, 2023, 50(17):888-892.
[20]" " 廖全辉, 卢赓, 王育衡. 肝动脉化疗栓塞加肝动脉灌注化疗对中晚期肝癌的疗效观察[J]. 深圳中西医结合杂志, 2023, 33(23):116-119.
[收稿日期] 2024-08-03
