索磷布韦/维帕他韦对静脉吸毒人群中慢性丙型肝炎初治患者生化指标及肝炎预后的影响分析
2024-02-08陈玲浦文君


[摘"" 要]"" 目的:探讨索磷布韦/维帕他韦(sofosbuvir/velpatasvir, SOF/VEL)对静脉吸毒人群(intravenous drug users, IDUs)中慢性丙型肝炎(chronic hepatitis C, CHC)初治患者生化指标及肝炎预后的影响。方法:选取2023年7月—2024年4月上海市某强制隔离戒毒所确诊为CHC初治患者16例,均有静脉药瘾史,基因型为6a亚型8例(50.00%)、3b亚型7例(43.75%)、6n亚型1例(6.25%),予以SOF/VEL单药治疗12周,治疗结束后继续随访12周。分析SOF/VEL在IDUs中的抗病毒疗效、药物的安全性、服药的依从性以及药物的不良反应。比较患者在治疗基线、治疗4周、治疗结束及治疗结束后12周的丙型肝炎病毒RNA、血常规指标、生化指标、肝脏彩超的变化等。结果:93.75%(15/16)的患者获得治疗结束后12周持续病毒学应答,1例3b亚型肝硬化代偿期患者复发。治疗过程中患者未报告药物相关不良事件,依从性良好,未发生因药物不良反应而停药或死亡事件。与治疗基线相比,治疗后ALT、AST、结合胆红素、γ-谷氨酰转移酶及AST与血小板比值指数显著下降(Plt;0.05),总胆固醇、低密度脂蛋白胆固醇及高密度脂蛋白胆固醇显著上升(Plt;0.05)。治疗过程中肌酐持续升高,治疗结束后可恢复至基线水平。空腹血糖在治疗4周后出现持续性升高(Plt;0.05)。结论:IDUs中不伴有肝硬化的CHC初治患者,接受SOF/VEL治疗可实现高病毒学应答率,安全性和耐受性良好。治疗后肝功能及肝脏纤维化指标显著改善,但伴随血脂、血糖升高等代谢紊乱的出现,肾功能可能受损。
[关键词]nbsp;" 慢性丙型肝炎;静脉药瘾人群;直接抗病毒药物;高脂血症
[中图分类号]"" R512.6+3"""""""""""""" [文献标志码]"" B"""""""""""""" [文章编号]"" 1674-7887(2024)06-0586-05
丙型肝炎病毒(hepatitis C virus, HCV)属于黄病毒科肝炎病毒属,主要通过血源性传播,是导致肝脏炎症感染的嗜肝病毒。HCV进入人体后,通过免疫应答15%~25%的感染可以自发清除,但75%~85%的感染不能彻底清除[1]。HCV免疫逃逸后在肝脏大量复制、长期存活,引起肝细胞炎症、凋亡及坏死,导致肝脏假小叶形成、肝硬化甚至肝细胞癌(hepatocellular carcinoma, HCC)等不良结局。传统的抗病毒方案以干扰素为基础,病毒学应答不佳,不良反应发生率高,未能有效治愈HCV感染。新一代直接抗病毒药物(direct-acting antiviral agents, DAAs)可以清除95%以上的HCV感染,特别是其中的泛基因型药物对基因1~6型感染均有明显效果,临床使用不良反应发生率低、耐受性好,为治愈慢性丙型肝炎(chronic hepatitis C, CHC)带来了曙光。我国普通人群中HCV感染总体呈低水平流行,但静脉吸毒人群(intravenous drug users, IDUs)因其不洁注射等高危行为HCV感染率明显升高[2]。本文就戒毒场所内合并有静脉药瘾史的CHC初治患者接受泛基因型药物索磷布韦/维帕他韦(sofosbuvir/velpatasvir, SOF/VEL)治疗后HCV清除率、肝脏相关指标变化及上报的不良反应,CHC的预后、药物的安全性及不良反应进行简单分析和探讨。
1"" 对象与方法
1.1"" 研究对象"" 收集2023年7月—2024年4月上海市某强制隔离戒毒所确诊为CHC的戒毒人员,所有受试者接受丙肝抗体、HCV RNA和基因型检测。确诊患者均符合《丙型肝炎防治指南(2022年版)》诊断标准[3]。纳入标准:(1)年龄18~65岁;(2)血清抗-HCV抗体阳性,HCV RNA阳性;(3)HCV感染≥6个月,或有6个月前的流行病学史;(4)有静脉药瘾史。排除标准:(1)病程lt;6个月的急性感染;(2)聚乙二醇干扰素α联合利巴韦林或联合索磷布韦经治,直接抗病毒药物经治;(3)肝硬化失代偿期;(4)妊娠期、分娩哺乳期;(5)合并严重疾病危及生命安全。本研究经上海市临床研究伦理委员会审核批准(审批号:SECCR2024-144-01),所有参与者均签署知情同意书。
1.2"" 治疗方法"" 本组CHC初治患者,在启动治疗前邀请上海市青浦区中山医院感染科专家入院会诊,同时咨询青浦区疾病预防控制中心专家治疗意见,在详细评估病情、综合各方专家意见的基础上,制定了抗病毒治疗方案:SOF/VEL(美国吉利德科学公司,每片复合片剂含SOF 400 mg及VEL 100 mg),1次/d,1片/次,治疗12周。在抗病毒治疗满12周时,邀请上海市公共卫生临床中心专家入院评估抗病毒治疗效果,综合评定后,建议抗病毒治疗满12周停药,停药后继续随访12周。
1.3"" 观察指标"" 分别于治疗基线、治疗4周、治疗结束和治疗结束后12周(post-therapy 12 weeks, PT-12W)检测纳入患者的HCV RNA、ALT、AST、白蛋白(albumin, ALB)、结合胆红素(conjugated bilirubin, CB)、非结合胆红素(unconjugated bilirubin, UCB)、碱性磷酸酶(alkaline phosphatase, ALP)、γ-谷氨酰转移酶(γ-glutamyl transferase, GGT)、甲胎蛋白(alpha-fetoprotein, AFP)、空腹血糖(fasting blood glucose, FBG)、总胆固醇(total cholesterol, TC)、低密度脂蛋白胆固醇(low-density lipoprotein cholesterol, LDL-C)、三酰甘油(triglyceride, TG)、高密度脂蛋白胆固醇(high-density lipoprotein cholesterol, HDL-C)、肌酐(serum creatinine, Scr)、中性粒细胞(neutrophils, N)、淋巴细胞(lymphocyte, L)、血红蛋白(hemoglobin, Hb)、PLT、BMI等指标并记录药物不良反应事件。肝纤维化程度采用血清学模型AST与PLT比值指数(aspartate aminotransferase-to-platelet ratio index, APRI)和纤维化指数-4(fibrosis 4 score, FIB-4)评估:APRI评分=(AST/正常值上限)×100/PLT(×109/L),FIB-4指数=(年龄×AST)/(PLT× )。
1.4"" 检测方法"" 高精度HCV RNA核酸定量检测采用PCR-荧光探针法(试剂盒为圣湘生物生产,检测下限为15 IU/mL)。HCV RNA基因分型检测为PCR-荧光探针法(试剂盒为泰普生物生产)。血常规检测采用希森美康XN-1000,生化指标检测采用日立7180全自动生化仪,肝功能采用日本世诺试剂盒。
1.5"" 统计学方法"" 应用SPSS 25.0和Origin2019b软件行统计学分析和作图。小样本的计量资料以M(P25, P75)表示,计量资料多组间比较采用Friedman秩和检验,多重比较采用Bonferroni检验,组间差异采用显著性差异字母标记法标记,计数资料以频数和百分数(%)表示,Plt;0.05为差异有统计学意义。
2"" 结""""" 果
2.1"" 基线指标"" 共纳入CHC初治患者16例,均有静脉药瘾史,其中注射毒品种类主要为甲基苯丙胺10例(62.50%)、吗啡和海洛因各3例(18.75%);病程0.5~gt;20年;男12例(75.00%),女4例(25.00%);年龄44.50(39.50, 50.75)岁;BMI 23.51(21.66, 25.79) kg/m2;基因型为6a亚型8例(50.00%)、3b亚型7例(43.75%)、6n亚型1例(6.25%);平均病毒载量HCV RNA 6.29(6.08, 6.74) log10IU/mL,1例3b亚型处于肝硬化代偿期,4例合并肝脏脂肪变性;合并HBV感染1例、糖尿病2例、高血压6例、慢性肾功能不全3例。
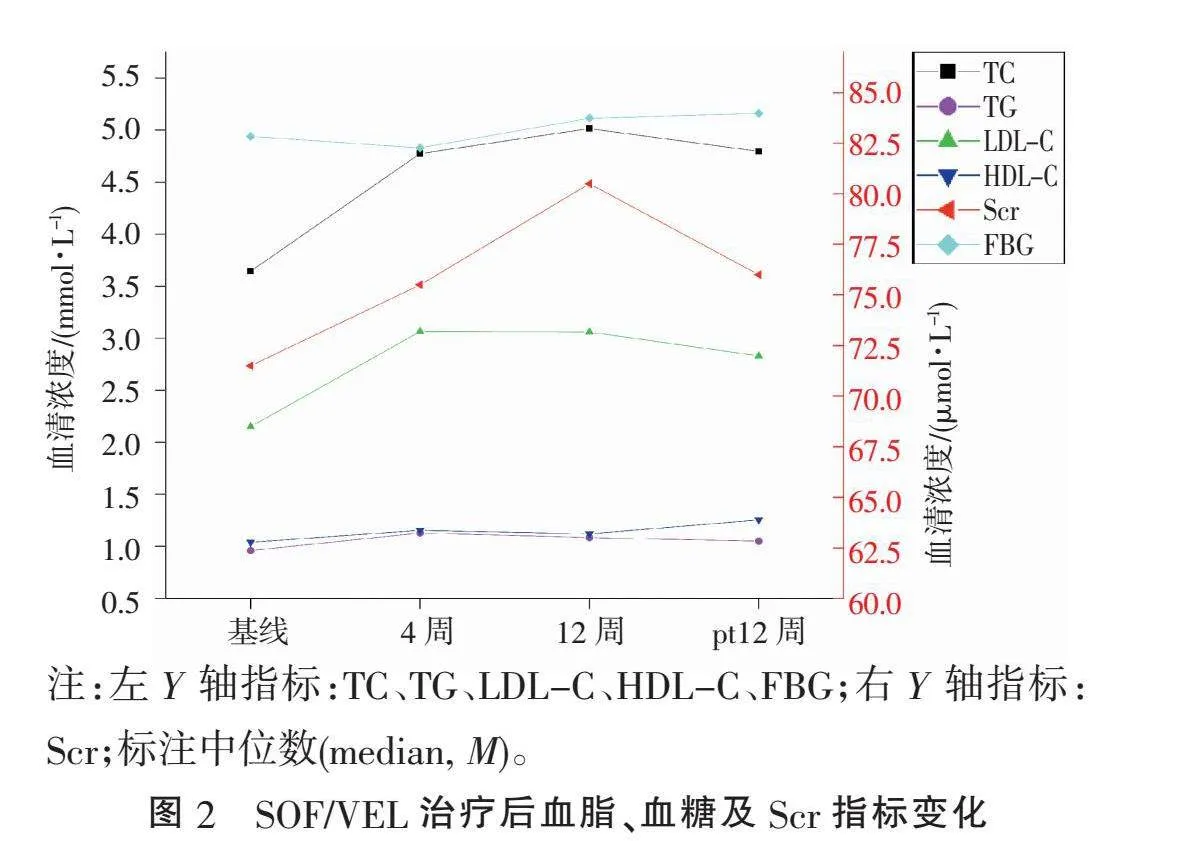
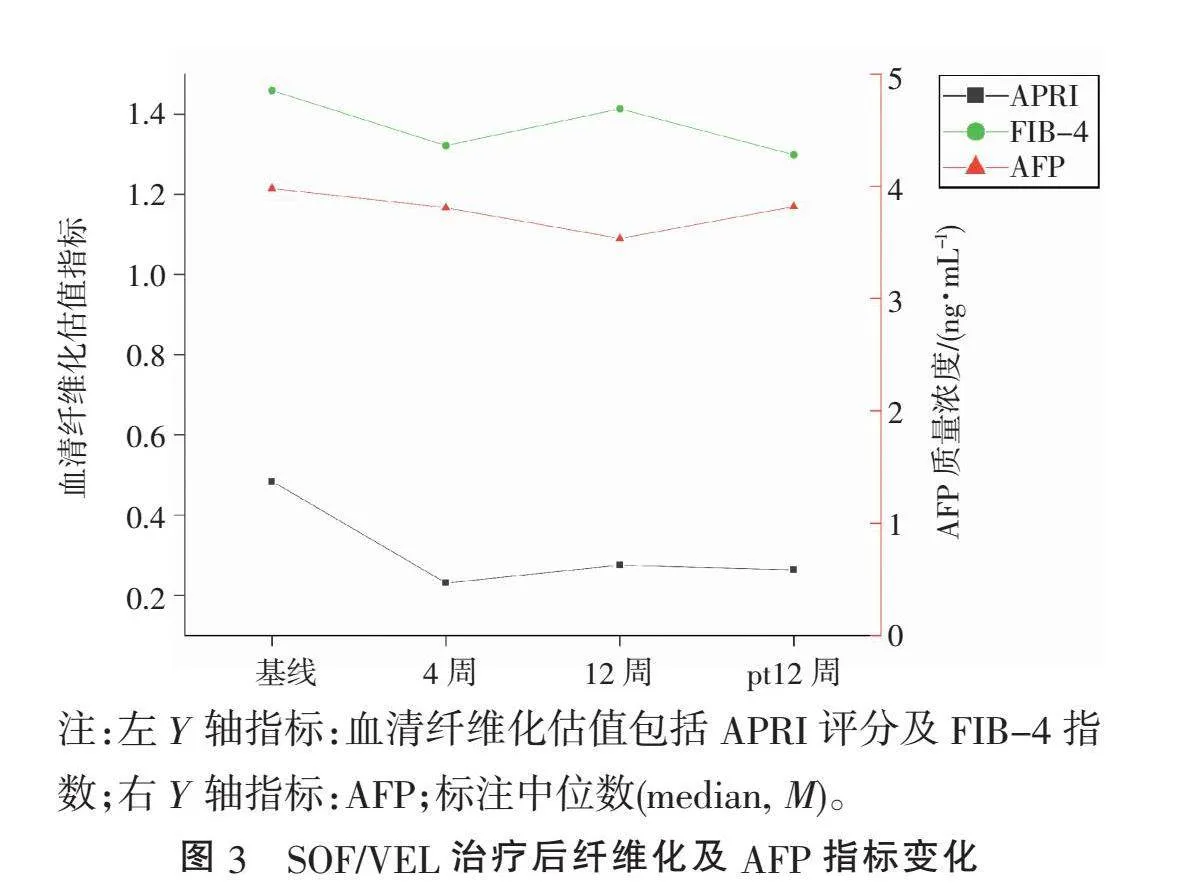
2.2" "SOF/VEL治疗后指标变化"" 接受SOF/VEL治疗后,4周快速病毒学应答(rapid virological response 4, RVR4)及治疗结束病毒学应答(end-treatment virological response, ETVR)均为100%,PT-12W持续病毒学应答(sustained virological response12, SVR12)率为93.75%(15/16)(检测下限≤15 IU/mL)。1例3b亚型肝硬化代偿期患者在PT-12W复发,被发现有病毒低水平复制(1.9 log10IU/mL)。相较于治疗基线,治疗后肝功能指标ALT、AST、CB、GGT及肝纤维化评估指标APRI评分均显著下降(均Plt;0.001),ALP在治疗4周时出现一过性下降(Plt;0.05)。血脂指标TC、LDL-C、HDL-C在治疗过程中持续升高(均Plt;0.05);FBG在第4周出现一过性下降后持续升高(Plt;0.05);Scr在疗程中持续升高,治疗结束后逐步恢复至基线(Plt;0.05)。N、L、Hb、PLT、UCB、ALB、AFP、TG、FIB-4指数差异均无统计学意义(均Pgt;0.05)(表1、图1~3)。达到SVR后,4例合并有脂肪肝的患者中1例6a(1/2)和1例3b(1/1)亚型脂肪肝明显消退。
2.3"" SOF/VEL抗HCV治疗的不良反应"" 本组16例患者治疗过程中未上报药物不良反应,包括头痛、疲劳、失眠和恶心不适等消化道症状。合并HBV的1例患者同时予以恩替卡韦抗HBV治疗,相关时间点复查乙肝DNA定量均低于检测下限。监测生命体征平稳,未发生危及生命或脏器功能衰竭等严重不良事件。
3"" 讨""""" 论
3.1"" SOF/VEL抗病毒疗效"" 本研究中,SOF/VEL单药方案在IUDs无肝硬化的CHC初治患者中可迅速抑制病毒复制获得极高的SVR12(100%)。1例3b亚型的肝硬化代偿期患者复发,但即使治疗失败病毒载量也有大幅下降,揭示治疗即可获益的重要事实。我国西南地区,同样有使用SOF/VEL方案治疗不伴有肝硬化的3型CHC获得极高应答率的成功经验[4]。但肝硬化代偿期或失代偿期的3型CHC患者,SOF/VEL单药治疗SVR并不满意,需要延长疗程或联合利巴韦林才能获得较高应答率[5]。
3.2"" SOF/VEL治疗的安全性"" 在使用SOF/VEL进行CHC抗病毒治疗过程中,监测全部16例患者病情平稳,未出现明显药物不良反应,其中包括1例合并HBV患者,在联合应用恩替卡韦抗病毒治疗过程中,亦未出现药物不良反应。由此可见,SOF/VEL治疗CHC是相对安全的。当然,由于本研究样本量相对较少,仍需要后续积累样本量并积极进行不良反应观察以评估药物安全性。
3.3"" SOF/VEL治疗的依从性"" 本次CHC抗病毒治疗是在国家推行的消除病毒性肝炎公共卫生危害的目标下开展,由戒毒场所及青浦区疾控中心提供资金支持,得到了场所内CHC戒毒人员的积极配合,并在受到充分告知后签署了知情同意书。基于此,本研究入组的16例CHC患者依从性良好,未出现任何不配合、中断治疗的情况或不良事件。
3.4"" SOF/VEL治疗的不良反应"" 血糖是肝脏重要的代谢物质之一。研究[6]发现CHC患者发生糖耐量异常、空腹血糖受损的风险是普通人的4倍。关于CHC患者糖代谢受损的机制,除了被广泛讨论的胰岛素抵抗外[7-8],HCV感染时胰腺内分泌功能同样受损[9],导致胰岛素分泌减少。大量研究[10-11]指出,SVR后糖代谢异常过程得到修复,胰岛素抵抗及FBG、糖化血红蛋白均明显改善。但DAAs诱导的SVR是否对胰岛素抵抗及血糖稳定有益仍不肯定。荟萃分析[12]指出,合并2型糖尿病的CHC患者接受DAAs治疗后有发展为3级高血糖的可能,虽然发生概率不高,但指出了血糖变化的不确定性。本组患者治疗第4周起出现FBG持续性升高,提示HCV清除对糖代谢的长期影响有待进一步研究,需继续随访以了解糖代谢的变化。
血脂是肝脏另一类重要的代谢物质,本研究基线时血脂处于正常偏低水平,病毒清除后TC、LDL-C及HDL-C指标持续升高,与T.T.MEI等[13]的荟萃分析一致。目前血脂变化的机制仍不明确,普遍认为与HCV清除有关[14]。CHC患者肝脏脂肪变性发病率约为50%(30%~70%),是普通成年人的2倍[15],可能与HCV促进肝脏脂肪堆积利于病毒复制有关。肝脏脂肪变性在3型CHC患者中更常见,可能与3型HCV和core蛋白的直接促脂肪变性作用有关[16]。本组达到SVR后3b亚型患者即出现明显脂肪肝消退(100%),而6a亚型中仅1例(50%)出现消退,表明3b亚型与脂肪肝变性的关系可能更加密切。
胆汁淤积是CHC的较常见并发症,也是进展为肝脏纤维化、肝硬化等不良预后的重要诱因,主要与胆管病变及胆道阻塞相关,免疫抑制或病毒高负荷的CHC患者胆汁淤积的发病率也更高[17]。本组患者基线时ALP、GGT、CB均值在正常范围内,但治疗后GGT、CB大幅下降约40%,ALP下降约10%,提示在胆汁排泄指标正常时CHC患者胆管细胞损伤及胆道阻塞可能已经存在,HCV清除后指标明显好转,提示胆管损伤及胆道阻塞得以修复。
本研究中Scr在治疗过程中持续升高,治疗结束时较基线升高6.06 μmol/L,治疗结束后指标逐步下降至基线水平,考虑与SOF代谢产物(GS-331007)主要通过肾脏清除有关。研究[18]发现,早期慢性肾病(chronic kidney disease, CKD 1~2期)患者接受SOF/VEL治疗时可出现短暂肾功能不全,治疗结束后Scr可恢复至基线水平,但后续仍可能出现恶化。一项荟萃分析[19]指出,晚期慢性肾病(CKD 4~5期)患者接受SOF治疗后肾功能恶化风险增加,但总体发生率不高,主要与服用利巴韦林及糖尿病史有关。因此,无糖尿病史的慢性肾病患者采用SOF/VEL治疗是安全、可耐受的,但需密切随访肾功能。
DAAs帮助95%以上的CHC患者实现病毒治愈,但清除病毒仅是本研究的短期目标,逆转肝纤维化、降低肝硬化及HCC的发病率、改善远期预后才是最终目标。研究[20]发现,达到SVR后50%以上的CHC患者肝脏纤维化明显消退,肝纤维化Metavir分期下调,HCC发病率也随之下降。但晚期肝纤维化及肝硬化的患者实现纤维化逆转困难,SVR后每年HCC的发病率仍有1.8%~2.5%[21]。晚期肝纤维化、肝硬化、胆汁淤积及肝脏脂肪变性、糖代谢紊乱可持续性损伤肝脏,最终导致肝硬化失代偿或是HCC不良预后。因此,SVR后随访肝脏纤维化、监测肝硬化、早期诊断HCC及维持血糖、血脂稳定对CHC预后至关重要。本研究采用血清学模型APRI评分及FIB-4指数评估肝脏纤维化。虽然入组患者大部分未进展至肝硬化,血清学评估指标也基本在正常范围内,但治疗后APRI评分显著下降,FIB-4指数在第4周也出现下降,考虑与肝脏炎症的消除及纤维化相关Ⅲ型胶原纤维的减少有关[20]。血清学评估简便易行,数据获取方便,但受ALT、AST等影响大,结果准确性有限,建议联合瞬时弹性超声检查增加评估准确性[22]。
本研究对象均为IUDs,感染途径主要为不洁静脉注射,感染基因型以3型和6型为主,与普通CHC群体有较大区别,对普通CHC群体的代表性不足。
综上,IUDs中不伴有肝硬化的CHC初治患者接受SOF/VEL治疗可实现高病毒学应答率,安全性和耐受性良好。病毒清除后肝细胞损伤得到明显改善,但可能伴随血糖、血脂等代谢紊乱,出现肾功能恶化。病毒清除后肝硬化、HCC的长期发病率仍高于普通人群,因此达到SVR后仍需密切随访评估。
[参考文献]
[1]"" LUNA-CUADROS M A, CHEN H W, HANIF H, et al. Risk of hepatocellular carcinoma after hepatitis C virus cure[J]. World J Gastroenterol, 2022, 28(1):96-107.
[2]"" 庄辉. 中国丙型肝炎感染现状及防治对策研究报告[M]. 北京: 人民卫生出版社, 2017:2-4.
[3]"" 中华医学会肝病学分会, 中华医学会感染病学分会. 丙型肝炎防治指南(2015年版)[J]. 中国肝脏病杂志(电子版), 2015, 7(3):19-35.
[4]"" 徐艳雯, 王鑫, 姜华, 等. 基于索磷布韦的药物治疗3型慢性丙型肝炎患者疗效和安全性观察: 一项单中心真实世界回顾性分析[J]. 昆明医科大学学报, 2022, 43(11):124-129.
[5]"" 黄康, 赵智蓉, 李海雯, 等. 索磷布韦/维帕他韦联合或不联合利巴韦林治疗基因3型慢性丙型肝炎肝硬化患者的疗效和安全性[J]. 昆明医科大学学报, 2023, 44(11):126-134.
[6]"" SPARVOLI J M H, SPARVOLI A C, DE CARVALHO DUMITH S, et al. Impact of hepatitis C virus eradication with direct-acting antivirals on glycidic metabolism[J]. Arch Endocrinol Metab, 2023, 67(3):314-322.
[7]"" DING Y J, LI G D, ZHOU Z G, et al. Molecular mechanisms underlying hepatitis C virus infection-related diabe-tes[J]. Metabolism, 2021, 121:154802.
[8]"" DAS G C, HOLLINGER F B. GSK-3β as a potential coordinator of anabolic and catabolic pathways in hepatitis C virus insulin resistance[J]. Intervirology, 2024, 67(1):6-18.
[9]"" CHEN J Z, WANG F, ZHOU Y, et al. Chronic hepatitis C virus infection impairs insulin secretion by regulation of p38δ MAPK-dependent exocytosis in pancreatic β-cells[J]. Clin Sci(Lond), 2020, 134(5):529-542.
[10]"" ADINOLFI L E, NEVOLA R, GUERRERA B, et al. Hepatitis C virus clearance by direct-acting antiviral treatments and impact on insulin resistance in chronic hepatitis C patients[J]. J Gastroenterol Hepatol, 2018, 33(7):1379-1382.
[11]"" BENETTI F, DE ARA JO A, DE MAMAN J NIOR I, et al. Impact of sustained virologic response on glucose parameters among patients with chronic hepatitis C treated with direct-acting antivirals[J]. Arch Endocrinol Metab, 2024, 68:e220480.
[12]"" ASSELAH T, SHAFRAN S D, BOURGEOIS S, et al. Deferred treatment with a fixed-dose combination of sofosbuvir-velpatasvir for chronic hepatitis C virus genotype 1, 2, 4 and 6 infection[J]. J Viral Hepat, 2019, 26(10):1229-1232.
[13]"" MEI T T, HUANG X J, TANG S, et al. Effects of sustained viral response on lipid in Hepatitis C: a systematic review and meta-analysis[J]. Lipids Health Dis, 2024, 23(1):74.
[14]"" ENDO D, SATOH K, SHIMADA N, et al. Impact of interferon-free antivirus therapy on lipid profiles in patients with chronic hepatitis C genotype 1b[J]. World J Gastroenterol, 2017, 23(13):2355-2364.
[15]"" CHANG M L. Metabolic alterations and hepatitis C: From bench to bedside[J]. World J Gastroenterol, 2016, 22(4):1461-1476.
[16]"" D AVIGDOR W M H, BUDZINSKA M A, LEE M, et al. Virus genotype-dependent transcriptional alterations in lipid metabolism and inflammation pathways in the hepatitis C virus-infected liver[J]. Sci Rep, 2019, 9(1):10596.
[17]"" WIJARNPREECHA K, THONGPRAYOON C, SANGU-ANKEO A, et al. Hepatitis C infection and intrahepatic cholestasis of pregnancy: a systematic review and meta-analysis[J]. Clin Res Hepatol Gastroenterol, 2017, 41(1):39-45.
[18]"" WU C K, CHEN L W, CHANG T S, et al. The novel finding of dynamic change in eGFR up to one year after end of treatment in HCV-infected patients receiving sofosbuvir and velpatasvir[J]. Viruses, 2022, 14(2):362.
[19]"" LI M S, CHEN J, FANG Z X, et al. Sofosbuvir-based regimen is safe and effective for hepatitis C infected patients with stage 4-5 chronic kidney disease: a systematic review and meta-analysis[J]. Virol J, 2019, 16(1):34.
[20]"" CHENG C H, CHU C Y, CHEN H L, et al. Direct-acting antiviral therapy of chronic hepatitis C improves liver fibrosis, assessed by histological examination and laboratory markers[J]. J Formos Med Assoc, 2021, 120(5):1259-1268.
[21]"" SETIAWAN V W, ROSEN H R. Stratification of residual risk of HCC following HCV clearance with direct-acting antivirals in patients with advanced fibrosis and cirrhosis[J]. Hepatology, 2020, 72(6):1897-1899.
[22]"" 中华医学会肝病学分会, 中华医学会消化病学分会, 中华医学会感染病学分会. 肝纤维化诊断及治疗共识(2019年)[J]. 中华肝脏病杂志, 2019, 27(9):657-667.
[收稿日期] 2024-06-25
