大环内酯酶酶解试验在克拉霉素制剂微生物限度检查中的应用
2024-01-11徐晓洁孟晓丽任丽宏丁勃
徐晓洁,孟晓丽,任丽宏,丁勃,2
(1.山东省食品药品检验研究院,山东省食品药品安全检测工程技术研究中心,山东 济南 250101;2.山东大学药学院,山东 济南 250012)
克拉霉素(clarithromycin)是14元环的半合成大环内酯类抗生素,属红霉素的衍生物,通过阻碍核糖体50S亚基的联结,抑制蛋白质的合成而产生抑菌作用。对革兰阳性菌如葡萄球菌、链球菌、肺炎球菌等均有抑制作用,对革兰阴性菌如流感嗜血杆菌、百日咳杆菌、嗜肺军团菌等也有抑制作用[1-3]。克拉霉素在临床上常用于呼吸、泌尿、生殖、皮肤软组织、幽门螺杆菌感染的治疗[4-7]。克拉霉素的最低抑菌浓度(MIC)为红霉素最低抑菌浓度的对数稀释浓度,低于或等于0.25 mg·L-1[8]。克拉霉素难溶于水,在微生物限度检查过程中,其抗菌活性的消除或灭活存在很大的困难,常规的平皿法和薄膜过滤法均不能实现现行标准对试验菌回收率的要求[9-10]。大环内酯酶用于微生物限度检查方法研究时,酶解时间、酶使用量等均没有文献参考。大环内酯酶价格高,从试验成本控制的角度,应考察酶使用量在方法建立时的效果。同时,酶解时间较短,不利于抗菌活性的消除,而酶解时间长,会对产品中污染微生物的活性产生影响。因此,探索最佳的酶解时间和用量对指导大环内酯酶在微生物限度检查试验中的应用具有重要意义。
本文采用高效液相色谱法,以克拉霉素片和克拉霉素颗粒为研究对象,测定经大环内酯酶灭活后的产品中的克拉霉素含量变化,确定开展微生物限度检查方法适用性试验中最佳的酶解条件,以建立更为高效、经济、合理的适用于克拉霉素口服制剂的微生物限度检查方法及微生物质量评价体系。
1 材料
1.1 仪器Waters Acquity ARC高效液相色谱仪(美国沃特世公司);MS105DU电子天平(梅特勒-托利多公司);BP211D电子天平(梅特勒-托利多公司);NU-543-600S生物洁净安全柜(美国Nuaire公司);IF260plus恒温培养箱(德国美墨尔特公司);IPP260低温培养箱(德国美墨尔特公司);Equninox集菌仪(默克公司)。
1.2 菌种大肠埃希菌[CMCC(B)44102]、金黄色葡萄球菌[CMCC(B)26003]、铜绿假单胞菌[CMCC(B)10104]、枯草芽孢杆菌[CMCC(B)63501]、白色念珠菌[CMCC(F)98001]、黑曲霉[CMCC(F)98003],以上菌种均购自中国食品药品检定研究院医学菌种保藏中心,工作菌种为第3代。
1.3 培养基和试剂胰酪大豆胨液体培养基(TSB,批号:230107 )购自北京三药科技有限公司;胰酪大豆胨琼脂培养基(TSA,批号:1105271)、沙氏葡萄糖琼脂培养基(SDA,批号:1113621)、pH 7.0 氯化钠-蛋白胨缓冲液(pH 7.0 SCPB,批号:1104851)、麦康凯琼脂培养基(MAC,批号:1105451)购自广东环凯微生物科技有限公司;沙氏葡萄糖液体培养基(SDB,批号:20210923)、麦康凯液体培养基(MB,批号:20210805)购自青岛高科技工业园海博生物技术有限公司。上述培养基均通过验收和适用性检查。
磷酸二氢钾(批号:20191030)、吐温80 (批号:20210107)购自国药集团化学试剂有限公司;磷酸(批号: 20210303)、三乙胺(批号:20180320) 购自天津科密欧化学试剂有限公司;乙腈(批号:UBYA2H) 购自霍尼韦尔贸易(上海)有限公司。
大环内酯酶(批号:20220121,规格:10 U/支)购自杭州俊丰生物工程技术有限公司。
1.4 样品克拉霉素片(批号:2201037,规格:0.25 g)来自厂家A;克拉霉素颗粒(批号:2107002、2107004、2108019,规格:0.125 g)来自厂家B。
2 方法和结果
2.1 克拉霉素酶解试验克拉霉素不溶于水,其含量测定供试品所用溶剂为磷酸盐缓冲液(取磷酸二氢钾9.11 g,加水溶解并稀释至1 000 mL,加三乙胺2 mL,用磷酸调节pH值至5.5)-乙腈(6∶4)。本文按《中国药典》2020年版收载的方法,分别测定大环内酯酶在药典克拉霉素含量测定浓度下和微生物限度检查相应浓度下作用一定时间后克拉霉素的含量,以比较两种条件下大环内酯酶的酶解作用。
2.1.1 色谱条件色谱柱:MCI GEL CK08EH 色谱柱(8 mm×300 mm,5 μm);流动相:以磷酸盐缓冲液(取磷酸二氢钾9.11 g,加水溶解并稀释至1 000 mL,加三乙胺2 mL,用磷酸调节pH值至5.5)-乙腈(600∶400)为流动相;检测波长:210 nm;柱温:45 ℃;流速:1.0 mL·min-1;进样量:20 μL[11]。
2.1.2 微生物限度检查相应浓度下的酶解试验按克拉霉素片微生物限度检查方法要求,需制备1∶100供试液1 mL转移稀释至500 mL稀释液中进行检查,根据克拉霉素片的规格计算,该稀释液中每1 mL含克拉霉素0.02 mg。根据以上浓度,取克拉霉素对照品适量,精密称定,加流动相溶解并定量稀释制成每1 mL中约含0.02 mg的溶液,过滤后作为供试溶液A;取5 mL供试溶液A,加入10 U大环内酯酶溶解后过滤后作为供试溶液B;另取5 mL供试溶液A,加入20 U大环内酯酶溶解后过滤后作为供试溶液C;另取5 mL供试溶液A,加入30 U大环内酯酶溶解后过滤后作为供试溶液D;精密量取酶解0、10、20、30、60、90、120 min的供试液A、B、C、D注入液相色谱仪,测定含量,结果见图1。

图1 微生物限度检查相应浓度下的酶解试验结果
2.1.3 药典克拉霉素含量测定浓度下的酶解试验按照《中国药典》2020年版克拉霉素含量测定,取克拉霉素对照品适量,精密称定,加流动相溶解并定量稀释制成每1 mL中约含0.35 mg的溶液,过滤后作为供试溶液A;取5 mL供试溶液A,加入10 U大环内酯酶溶解后过滤后作为供试溶液B;另取5 mL供试溶液A,加入20 U大环内酯酶溶解后过滤后作为供试溶液C;精密量取酶解0、10、20、30、60、90、120 min 的供试液A、B、C 注入液相色谱仪,测定含量,结果见图2。
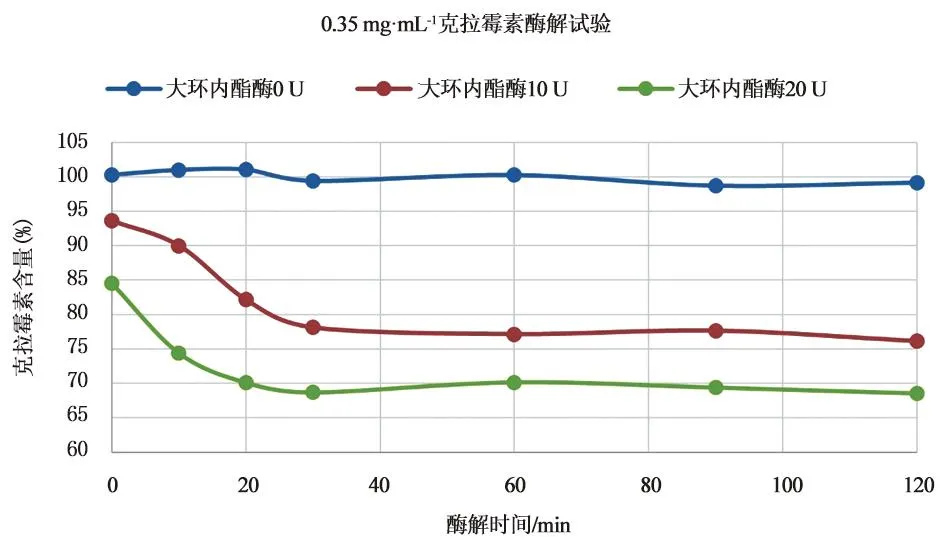
图2 药典含量测定相应浓度下的酶试验结果
由图1和图2可知,10 U和20 U大环内酯酶用于0.02 mg·min-1和0.35 mg·min-1的克拉霉素溶液的酶解试验,克拉霉素含量的变化趋势基本一致。酶解反应的前30 min克拉霉素快速酶解,呈类指数变化,30 min后酶解反应达到平衡。同时观察发现30 U大环内酯酶用于0.02 mg·min-1供试品时,与10 U和20 U浓度大环内酯酶相比无显著差异。使用30 U大环内酯酶酶解供试品溶液时,溶液浑浊,过滤困难。从酶解效果和试验经济性的角度出发,不再比对30 U大环内酯酶用于微生物限度检查的试验。
10 U和20 U大环内酯酶用于克拉霉素酶解试验时,克拉霉素的剩余量在酶解时间30 min 和120 min没有显著差异,但酶解时间为30 min时,大环内酯酶20 U对克拉霉素的酶解率好于大环内酯酶10 U。而在微生物限度检查所对应的0.02 mg·min-1克拉霉素浓度体系下,克拉霉素在10 U和20 U大环内酯酶酶解30 min后,剩余含量没有显著性差异。同时,由于药品微生物限度检查要求从供试品制备到加入培养基培养的过程不能超过60 min,需控制大环内酯酶的酶解时间以满足下游薄膜过滤试验的时间要求。因此,本文分别采用10 U和20 U大环内酯酶,酶解时间20 min的反应条件用于指导微生物限度试验,既保证大环内酯酶达到最佳酶解效果,也满足微生物限度检查对时间的要求和对潜在污染菌的保护。
2.2 微生物限度检查
2.2.1 菌液制备按《中国药典》2020年版(四部),分别制备每1 mL含103~104cfu和不大于100 cfu的大肠埃希菌、金黄色葡萄球菌、铜绿假单胞菌、枯草芽孢杆菌、白色念珠菌菌悬液和黑曲霉孢子悬液,用于方法适用性试验[12]。
2.2.2 供试液制备克拉霉素口服制剂的需氧菌总数标准为103cfu·g-1,当检验量为0.001 g(1∶1 000供试液1 mL),检验结果存在较大的误判风险,因此供试液按下述方法制备:取供试品10 g,加入pH 7.0无菌氯化钠-蛋白胨缓冲液至100 mL,震荡混合均匀,制成1∶10供试液,用同一稀释液10倍梯度稀释制成1∶100和1∶500供试液。
2.2.3 需氧菌总数计数方法适用性试验
2.2.3.1 试验组方法1:取1∶10、1∶100和1∶500供试液10 mL,分别加入金黄色葡萄球菌、铜绿假单胞菌、枯草芽孢杆菌、白色念珠菌和黑曲霉菌悬液0.1 mL,使每1 mL供试液中含菌数不大于100 cfu,按平皿法(倾注法)培养计数。
方法2:取1∶100供试液1 mL,加入500 mL pH 7.0无菌蛋白胨-缓冲液,并以pH 7.0无菌蛋白胨-缓冲液作为冲洗液,冲洗量分别为300、500、1 000 mL,每次100 mL/膜,最后一次冲洗液中加入1 mL金黄色葡萄球菌、铜绿假单胞菌、枯草芽孢杆菌、白色念珠菌和黑曲霉菌悬液,每张滤膜含菌量不大于100 cfu,按薄膜过滤法培养计数。
方法3:取1∶100供试液1 mL,加入500 mL pH 7.0无菌蛋白胨-缓冲液(含大环内酯酶10 U或20 U),并以pH 7.0无菌蛋白胨-缓冲液作为冲洗液,冲洗量为300 mL,每次100 mL/膜,最后一次冲洗液中加入1 mL金黄色葡萄球菌、铜绿假单胞菌、枯草芽孢杆菌、白色念珠菌和黑曲霉菌悬液,每张滤膜含菌量不大于100 cfu,按薄膜过滤法培养计数。
方法4:取1∶100供试液1 mL,加入500 mL pH 7.0无菌蛋白胨-缓冲液中,过滤至无菌滤器,以pH 7.0 SCPB作为冲洗液,冲洗量分别为300 mL,每次100 mL/膜,最后一次冲洗液中加入大环内酯酶(10 U或20 U)作用20 min,然后分别加入金黄色葡萄球菌、铜绿假单胞菌、枯草芽孢杆菌、白色念珠菌和黑曲霉菌悬液或孢子悬液,每张滤膜含菌量不大于100 cfu,按薄膜过滤法培养计数。
2.2.3.2 供试品组取相应稀释级供试液,用缓冲液代替菌液,按试验组进行试验。
2.2.3.3 菌液组用缓冲液代替供试液,按试验组操作加入试验菌液并进行微生物回收试验。
2.2.3.4 中和剂对照组用含大环内酯酶的缓冲液代替供试液,按试验组进行试验。
2.2.4 试验结果取克拉霉素片和克拉霉素颗粒,分别按照上述供试液制备方法和方法1~4开展适用性试验,对各试验菌逐一进行微生物回收试验。平皿法先选择低稀释级的供试液,再选择较高稀释级的供试液。薄膜过滤法先后采用300、500、1 000 mL冲洗量和加入大环内酯酶灭活的方法进行回收试验,结果见表1和表2。

表1 克拉霉素片需氧菌总数回收试验结果

表2 克拉霉素颗粒需氧菌总数回收试验结果
未使用大环内酯酶时,需氧菌总数的检查可选择1∶100供试液,采用薄膜过滤法,分别采用冲洗量为500、800、1 000 mL,经试验冲洗量为1 000 mL时,金黄色葡萄球菌、铜绿假单胞菌、枯草芽孢杆菌、白色念珠菌和黑曲霉的回收比值均在药典规定的0.5~2.0范围内。以大环内酯酶作为中和剂时,需氧菌总数应选择1∶100的供试液,采用薄膜过滤法,冲洗量为300 mL,最后一次冲洗液中加入约10 U和20 U的大环内酯酶作用20 min,金黄色葡萄球菌、铜绿假单胞菌、枯草芽孢杆菌、白色念珠菌和黑曲霉的回收比值均在药典规定的0.5~2.0范围内,中和剂对照组的菌落数与菌液对照组的菌落数的比值均在0.5~2.0范围内。其他方法组合均不能使5种试验菌的回收比值同时在0.5~2.0范围内。
2.3 霉菌和酵母菌总数计数方法适用性试验取克拉霉素片和克拉霉素颗粒的1∶10供试液,按平皿法(倾注法)开展霉菌和酵母菌总数的方法适用性试验,白色念珠菌和黑曲霉的回收比值均在药典规定的0.5~2.0范围内。
2.4 大肠埃希菌检查方法适用性试验克拉霉素片和克拉霉素颗粒为非无菌口服给药制剂,按《中国药典》2020年版通则1107要求,应检查大肠埃希菌[12]。取1∶10供试液10 mL采用薄膜过滤法时,极易造成滤膜堵塞,无法完成过滤和冲洗,本文采用直接接种法和直接接种法联合大环内酯酶的方法开展方法适用性试验。
2.4.1 试验组方法1:取1∶10供试液10 mL,及不大于100 cfu的大肠埃希菌菌悬液1 mL,一并接种至1 000、2 000、4 000 mL胰酪大豆胨液体培养基(TSB)中,按《中国药典》2020年版(四部)1106进行大肠埃希菌检查。
方法2:取1∶10供试液10 mL,及不大于100 cfu的大肠埃希菌菌悬液1 mL,一并接种至500 mL和1 000 mL含大环内酯酶(10 U或20 U)TSB中,按《中国药典》2020年版(四部)1106进行大肠埃希菌检查。
2.4.2 阴性对照组取稀释液10 mL,照试验组同法操作。
2.4.3 试验结果对克拉霉素片和克拉霉素颗粒的大肠埃希菌检查方法进行适用性试验,结果见表3。所有试验组中,仅在1 000 mL含20 U大环内酯酶的TSB培养体系下,检出所加大肠埃希菌相应的反应特征。

表3 大肠埃希菌检查适用性试验结果
3 讨论
3.1 大环内酯酶的应用在磷酸盐-乙腈的流动相体系下,添加10 U和20 U大环内酯酶的克拉霉素酶解试验均在约30min达到酶促反应的动态平衡,20 U的酶解效率略高于10 U浓度下。为验证大环内酯酶在克拉霉素供试液中的酶解作用,本文在开展克拉霉素制品微生物限度检查时将大环内酯酶的使用量设定为10 U和20 U。灭活时间的确定主要从灭活效果和对微生物限度检查总时间的影响两方面考量,灭活时间试验结果表明,超过30 min试验结果相较于20 min结果,酶解并未显著增加,因此设定大环内酯酶在冲洗液中的作用时间为20 min,该条件还可确保微生物限度检查时间符合药典相关要求。大环内酯在磷酸盐-乙腈的流动相体系下对克林霉素的灭活效果虽不能完全反映其在pH 7.0氯化钠-蛋白胨缓冲液的作用效果,但是在一定程度上为微生物限度检查中大环内酯酶的使用量和反应时间,提供了理论依据。
3.2 大环内酯类制品抗菌活性的去除和灭活《中国药典》2020年版通则1105收载的用于供试品中抗菌活性的去除或灭活的方法主要是增加稀释液或培养基体积,加入适宜的中和剂或灭活剂,采用薄膜过滤法,以及几种方法的联合使用[12]。克拉霉素因其广谱的抗菌性、低溶解性和稳定性,在相关制剂微生物限度检查中,消除或者灭活其抗菌活性的方法需借助大量冲洗方法,而口服制剂的需氧菌总数标准规定为103cfu·g-1,通过制备最高稀释级供试液来降低单位体积供试液抗菌活性的平皿法,仍不能达到符合药典要求的试验菌回收比值。薄膜过滤法需控制冲洗液体积达药典规定的上限冲洗量1 000 mL,在最后一次冲洗液中加入试验菌,回收率方可达到要求,而大剂量的冲洗增加了对污染微生物的损伤作用。本文采用薄膜过滤法结合大环内酯酶解作用的方法,可将冲洗量有效控制在300 mL内,不仅提高了克拉霉素相关制剂的微生物限度检验效率,也降低了因长时间操作和大量冲洗引入的污染风险及对微生物的损伤。大环内酯酶在大肠埃希菌检查中也取得了很好的效果,1 000 mL含大环内酯酶20 U的TSB,即可消除供试品中克拉霉素对大肠埃希菌的抑制作用,从试验效果、工作量、经济性等角度考虑,无疑都是最佳方案。
《中国药典》2020年版对供试品中可能存在的干扰物给出了所对应的中和剂或灭火方法,含抗生素类的供试品,如喹诺酮类抗生素可被镁或钙离子络合而失去活性、磺胺类抗生素可被对氨基苯甲酸作用失活,β-内酰胺类抗生素可被青霉素酶或头孢菌素酶灭活等,但大环内酯类抗生素并未给出相适用的灭活剂,含聚山梨酯80和卵磷脂的稀释液和冲洗液也已被证明无法消除大环内酯类抗生素的抗菌活性[12]。低速离心制备供试液的方法,可以减少联合薄膜过滤法时滤膜上截留的供试品,但该方法已在《中国药典》2015年版后删除[13]。牛萌萌等[14]建立了阿奇霉素和罗红霉素干混悬剂的微生物限度检查方法,采用含乙醇的缓冲液作为稀释液和冲洗液来增加两种供试品的溶解,但乙醇在供试液制备过程中是否对潜在污染菌造成损伤尚需验证。传统的酶解中和试验在微生物限度检查中的应用较粗犷,往往以使用大量的酶制剂以获得理想的微生物回收结果为主要目的,而酶使用量、酶作用时间等因素均未考虑。大环内酯酶是最新出现的可以酶解阿奇霉素的酶制剂,还未有其用于大环内酯类抗生素制剂微生物限度检查的相关研究[1,15]。
本文通过HPLC法测定大环内酯酶对克拉霉素的作用过程,掌握了大环内酯酶的最佳作用条件并将其应用于克拉霉素相关制剂的微生物限度检查,建立了以酶解法作为中和方法的克拉霉素相关制剂微生物限度检查方法,同时,也为建立适用于大环内酯类抗生素产品最佳的微生物限度或无菌检查方法提供了新的思路和技术方法。
