选择性剪接在肿瘤化疗耐药中的研究进展
2024-01-11苗春萌吴启鹏江振洲张陆勇
苗春萌,吴启鹏,江振洲,张陆勇,2
(1.中国药科大学新药筛选中心,江苏省药效研究与评价服务中心,江苏 南京 210009;2.广东药科大学新药研发中心,广东 广州 510006)
选择性剪接(alternative splicing,AS)是扩大转录组和构成蛋白质组多样性的关键过程,为高等真核生物提供了进化优势。人类大约95%的基因通过AS机制转录一个以上的转录物,扩大基因组多样性。AS是一个时空过程,对细胞生命活动、细胞分化和器官发育至关重要[1]。其中,受调控基因中的顺式作用元件和反式剪接调节子之间的相互作用是保证AS过程精确执行的关键条件[2]。研究发现致癌相关基因调节元件的突变[3]和剪接因子表达的改变[4],导致AS过程被扰乱,该过程与肿瘤发生发展密切相关。这也表明靶向突变顺式作用元件或受损反式剪接调节子在癌症治疗中具有巨大价值[5]。
恶性肿瘤是危害人类健康的主要疾病之一。放化疗、靶向免疫治疗是治疗肿瘤的常用方法,其中化疗更是发挥着重要作用,但肿瘤细胞对化疗药物耐药严重影响治疗效果和患者预后。尽管近几年癌症化疗取得了重大进展,但是许多对治疗反应良好的患者对化疗药物产生了耐药性,导致治疗失败。药物靶点改变、药物外排和DNA损伤修复等耐药机制的研究一直是肿瘤研究的热点,其中许多化疗耐药机制涉及基因和蛋白质的突变和表达改变。细胞蛋白质组是细胞对药物产生化疗反应的关键因素,受到基因突变、基因转录、mRNA加工、翻译、蛋白质修饰和蛋白质降解等多个环节的影响。AS虽然是一种正常的细胞过程,但可以被癌细胞用于提高化疗时的存活率[6]。对AS的调控是癌症发展的重要机制,虽然已经确定许多化疗药物可以影响AS,但AS在耐药性中的作用尚未阐述明确[7]。本文总结了AS在肿瘤中发挥的作用,以及改变AS事件对不同癌症耐药性的病理影响,并讨论AS如何调节癌细胞获得耐药性,以期为肿瘤化疗耐药性的进一步研究提供参考。
1 选择性剪接与剪接体
1.1 选择性剪接定义及意义选择性剪接指的是mRNA 中外显子进行不同组合产生多样化的成熟mRNA的过程[8],进而可翻译产生多个功能的蛋白质。AS是蛋白质多样性的重要来源,在剪接过程中,前体mRNA(pre-mRNA)前转录本的内含子被移除,外显子按照在基因中出现的顺序结合,进而形成不同的成熟mRNA变体,这些变体在翻译后可以产生功能不同的蛋白质。
与癌症相关的异常剪接包括产生或破坏剪接位点或者剪接增强子或沉默子的突变,剪接因子的异常表达,以及影响剪接过程的信号通路受损[9]。在癌变过程中,许多剪切性因子过表达导致致癌通路的激活,比如MYC通路[10]。AS与许多生理活动息息相关,如细胞分化、组织和器官发育、血管生成等[11]。 mRNA剪接位点内的基因突变、剪接体或剪接调节因子表达水平的改变与肿瘤发生发展密切相关[12],肿瘤的侵袭、转移和血管生成,也受到AS的影响。在mRNA加工过程中,AS可能会导致肿瘤细胞的细胞周期失调、细胞骨架紊乱、迁移和黏附,这些变化除了影响癌症的发生发展过程,还会导致癌细胞对化疗药物的敏感性下降[13]。
近年来,AS在肿瘤发生发展中的作用研究取得了很大进展,尤其是机制方面,但仍需要更多的研究来阐明剪接过程对癌症表型的影响。而阐明AS在异常mRNA加工和修饰产生的癌症特异性mRNA中的作用,将为癌症治疗提供新的策略。
1.2 选择性剪接的过程AS是实现基因表达和蛋白质组多样性的重要过程,调节来自同一基因的多种蛋白质异构体的合成,是维持细胞多样性的重要机制,该过程受到许多剪接体因子的调控[14]。剪接体主要由5个snRNPs (U1、U2、U4、U5和U6)组成,如图1所示[15],依赖许多ATP酶和剪接因子促进snRNPs在剪接过程中不同步骤的结构重塑,调控mRNA剪接反应。snRNPs是剪接体的核心单位。Sm蛋白也是剪接体的组成成分,是维持剪接体正常功能的关键蛋白,7个Sm蛋白共同形成异七聚环结构,分别为SmB/B′、SmE、SmF、SmG、SmD1、SmD2和SmD3。结构高度相似的Sm蛋白在每个snRNA周围形成一个七聚环结构,可能作为其他snRNP蛋白组装的平台。
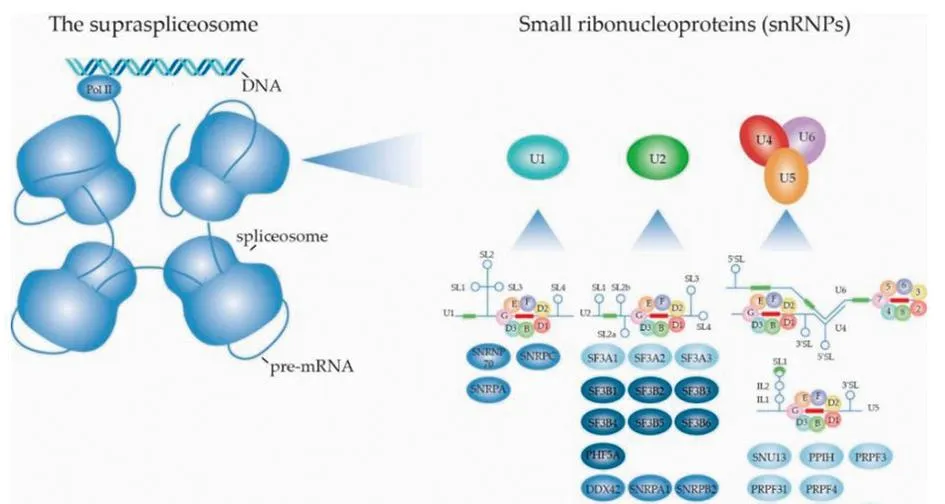
图1 剪接体的结构和组成部分
AS过程由剪接体和剪接因子完成。首先,富含丝氨酸和精氨酸的剪接因子1蛋白(serine and arginine rich splicing factor 1,SRSF1)C端被细胞质中富含丝氨酸/精氨酸的蛋白特异性激酶—SRSF蛋白激酶(SRSF protein kinase,SRPKs)二次磷酸化[16]。然后,磷酸化的SRSF蛋白被CDC2样激酶1 (cyclindependent kinase-like 1-related kinase,CLK1)磷酸化。磷酸化的SRSF蛋白通过一个核糖核酸识别基序结合前核糖核酸[17],招募U1小核核糖核蛋白(U1 snRNP)和U2 snRNP与内含子的剪接位点结合。U1 snRNP与5′剪接位点的保守序列G-U结合,U2 snRNP取代分支位点结合蛋白(BBP),与3′剪接位点的保守序列A-G结合。随后,U4、U6和U5 snRNP在磷酸化的pre-mRNA加工因子激酶31(pre-mRNA processing factor 31,PRPF31)的作用下组装Tri-snRNP(PRP31)和 pre-mRNA加工因子激酶6 (PRP6),两个蛋白均被 pre-mRNA加工因子激酶4k (PRP4k)磷酸化[18]。PRP31通过pre-mRNA加工因子激酶28 (PRP28)与剪接体A相互作用。U2 snRNP取代U4 snRNP与U6和U5 snRNP结合,U6 snRNP取代U1 snRNP与内含子5′剪接位点的保守序列G-U结合,产生剪接体B的构象。最后,pre-mRNA经历两次酯交换,第一次酯交换反应生成复合物 C,在复合物C中发生重排,促进第二次酯交换,产生剪接体后复合物,外显子相互连接形成成熟的mRNA,之后内含子被降解,snRNP被回收[19]。
AS作为一种重要的基因表达调控机制,极大地提高了转录组的复杂性和蛋白质组的多样性。但是当AS发生异常,会导致蛋白质表达障碍和各种疾病,包括癌症、神经退行性疾病、肌肉营养不良以及心血管和免疫疾病等[20]。其中,肿瘤细胞通过异常剪接事件,表达异常蛋白,促进癌症进展,这些异常剪接事件与肿瘤的恶性进展和化疗耐药性相关。
2 选择性剪接在肿瘤化疗耐药中的作用
恶性肿瘤是一种严重危害人类健康的疾病,其发病率仍在不断升高[21]。医疗技术的快速发展使得癌症患者整体生存率有了较大提高,然而长期使用化疗药物的肿瘤患者容易逐渐产生耐药性,进而导致治疗失败。化疗耐药已成为抗肿瘤治疗中的一个重大问题。肿瘤耐药机制复杂,主要包括增加药物外排、DNA损伤修复增强、细胞周期失调、肿瘤微环境改变、肿瘤干细胞转化(cancer stem cells,CSCs)、自噬、上皮间质转化(epithelial-mesenchymal transition,EMT)和细胞凋亡的抵抗等[22]。
肿瘤的固有耐药或获得性耐药导致肿瘤复发是肿瘤化疗的主要障碍。现有的肿瘤耐药机制研究无法完全阐释清楚耐药的产生,仍需更深入的研究耐药机制。近年来,越来越多的证据表明剪接体改变与肿瘤耐药密切相关。异常的AS是改变肿瘤细胞基因表达谱的主要因素,它通过改变药物的靶点和信号转导途径来诱导耐药。以剪接体为治疗药物的靶点,结合传统化疗药物联合用药,可能是克服耐药性肿瘤的有效方法。常见的与化疗耐药相关的剪接体靶点有SRSF蛋白、SRPK蛋白、HNRNP蛋白、Sm蛋白、SPF45和SF3B1。
2.1 SRSF家族SRSF家族成员包含一个或多个RNA识别基序(rms)和一个c端精氨酸-丝氨酸重复序列,称为RS域。SRSF蛋白参与多种转录后调控过程,例如AS。一些SRSF蛋白可以增强交替剪接转录本,在不同的癌症中发挥促癌特性[23],参与多种转录后调控过程[24]。SRSF在胰导管腺癌、卵巢癌和乳腺癌的化疗耐药中发挥重要作用。
研究发现,吉西他滨上调剪接因子SRSF1,诱导MAP激酶相互作用丝氨酸/苏氨酸蛋白激酶2 (MAP kinase signal-integrating kinase 2,MNK2)基因向MNK2b变体转化。MNK2b剪接变异体磷酸化真核起始因子4E(eukaryotic initiation factor 4E,eIF4E),减少吉西他滨诱导的凋亡,促进胰导管腺癌细胞存活、细胞增殖,最终对吉西他滨产生耐药性[25]。在铂类药物治疗耐药性卵巢癌过程中发现剪接因子富含丝氨酸和精氨酸的剪接因子2(serine and arginine rich splicing factor 2,SRSF2)突变,提示AS可能有助于获得性铂耐药性的发生[6]。富含丝氨酸和精氨酸的剪接因子3(serine and arginine rich splicing factor 3,SRSF3)过表达减弱了紫杉醇抑制乳腺癌细胞增殖的效果,SRSF3蛋白表达下调会显著增加癌细胞对紫杉醇治疗的敏感性[26]。以上结果提示剪接因子SRSF家族可能参与了肿瘤对化疗药物的耐药。
2.2 SRPK家族SRPK家族成员是潜在的致癌基因,SRPK家族的3个主要成员为SRPK1、SRPK2和SRPK3,SRPK1和SRPK2在肺癌和肝癌中均可见上调[27]。在前列腺癌细胞中,SRPK1和SRPK2表达的增加与肿瘤的发生发展密切相关,促进肿瘤细胞增殖和抗凋亡过程[28],在胰腺癌、肺癌、乳腺癌、卵巢癌和胶质瘤化疗耐药中起作用。
研究发现,SRPK1基因下调在吉西他滨单用或与顺铂联合使用时都增加胰腺癌细胞的凋亡。在胰腺癌中高表达SRPK1抑制细胞增殖,促进细胞凋亡,增强化疗敏感性[29]。有研究表明顺铂通过涉及Tip60、SRPK1和SRPK2蛋白的机制诱导低乙酰化和磷酸化形式SRSF2的积累,调节SRPK2的表达。在几种人类肺癌细胞系(H358、H1299、H810、H69)中,SRSF2介导的SRSF2磷酸化在顺铂治疗诱导细胞凋亡中起关键作用,提高肺癌细胞对顺铂的敏感性[30]。研究还发现SRPK1乙酰化与化疗敏感性密切相关。在乳腺癌细胞MCF7和231细胞中,顺铂诱导SRPK1乙酰化,但在相应的耐药细胞中,顺铂降低了SRPK1的乙酰化,但增加了SRPK1的磷酸化和激酶活性,促进一些抗凋亡变异的剪接。而且顺铂耐药细胞可以通过增强SRPK1乙酰化或抑制其激酶活性,进而增强对顺铂的敏感性[31]。
研究发现,SRPK1下调可以提高乳腺癌、卵巢癌等对化疗的敏感性,SRPK1下调诱可导雌激素受体阳性乳腺癌细胞对顺铂的敏感性。在雌激素受体阳性的基底细胞样型乳腺癌(basal-like breast cancer,BLBC)中,SRPK下调增强细胞凋亡,增加了MCF10A、MCF7、MDA231和 MDA468细胞对化疗药吉西他滨和顺铂的敏感性,同时抑制细胞迁移和肿瘤转移[32]。在卵巢癌中,靶向SRPK1抑制SKOV3细胞增殖、迁移和侵袭,提高肿瘤细胞对顺铂的敏感性[33]。另外,在胶质瘤细胞系87MG、T98G和U251MG中,SRPK1在mRNA和蛋白水平上的表达显著上调,敲低SRPK1对细胞活力影响不大,但令肿瘤细胞对顺铂的敏感性有一定提高。
2.3 HNRNP家族HNRNP家族与mRNA的合成相关,在转录后调控中发挥多种功能,如促进剪接、多聚腺苷化、mRNA转运和mRNA稳定[34]。HNRNPs含有辅助的脯氨酸、甘氨酸结构域,这些结构域与蛋白质的相互作用有关。HNRNPs的异常表达与癌细胞的增殖、转移息息相关[35]。
研究发现雄激素受体剪接变体 7(androgen receptor splicing variant 7,AR-V7)的剪接由核糖核蛋白L (HNRNPL)和其他两个家族成员HNRNPA1和HNRNPH调节。HNRNPA1在ARAS产生AR-V7中发挥重要作用[36]。它调节AR并诱导产生其变体AR-V7,激活MYC,与转移性前列腺癌的耐药性密切相关。敲低HNRNPH1使PC细胞对比卡鲁胺敏感,抑制体内前列腺肿瘤的生长[37]。另有研究表明在前列腺癌中HNRNPA1可以诱导AR-V7的产生,促进了AR-FL(full-length AR)在缺乏雄激素的情况下的核定位,并减轻了抗雄激素恩杂鲁胺抑制AR-FL核运输的能力。AR剪接变体的表达减弱了雄激素和恩杂鲁胺对LNCaP、22Rv1、COS-7和PC-3细胞的毒性,并降低了恩杂鲁胺的体内抗肿瘤疗效。HNRNPA1过表达提高前列腺癌细胞对恩杂鲁胺的耐药性[38]。槲皮素可以降低HNRNPA1的表达,从而降低AR-V7的表达。槲皮素还与HNRNPA1结合,削弱其在细胞核和细胞质之间穿梭的能力,导致其滞留在细胞质。槲皮素对AR-V7的抑制使恩杂鲁胺耐药前列腺癌细胞恢复对恩杂鲁胺的敏感性。抑制雄激素受体的AS在前列腺肿瘤对抗雄激素治疗中重新获得敏感性具有重要意义[39]。在胃癌中HNRNPA2B1的过表达与患者的不良预后有关,HNRNPA2B1通过增强细胞增殖、抑制细胞凋亡和增加细胞转移来促进胃癌发展。HNRNPA2B1参与抗凋亡因子BIRC5(baculoviral IAP repeat-containing 5)的AS过程。BIRC5亚型202过表达可以部分拮抗因HNRNPA2B1下调导致的顺铂化疗敏感性提高,证明HNRNPA2B1调节BIRC5的剪接过程,有希望成为耐药胃癌细胞的治疗靶点[40]。
2.4 Sm蛋白家族真核生物中有7种Sm蛋白:B/B ′、D1、D2、D3、E、F和G。这些蛋白在剪接体上组装成一个环状的异七聚体,形成相应snRNPs的核心。Sm蛋白是维持snRNAs的稳定性和snRNPs的发挥功能所必需的成分,在pre-mRNA剪接中非常重要[41],在非小细胞肺癌和胶质母细胞瘤化疗耐药中起重要作用。
小核核糖核蛋白多肽B(SNRPB)是剪接体的核心成分,是一种Sm蛋白,在mRNA剪接中起着关键作用。SNRPB在非小细胞肺癌(NSCLC)中高度表达,并作为一种致癌基因发挥作用,SNRPB可负向调节NSCLC细胞的顺铂耐药。敲低SNRPB可以使抑制癌细胞的生长,也会显著降低顺铂诱导的NSCLC细胞生长抑制、细胞周期阻滞和凋亡,SNRPB可能是NSCLC患者对顺铂化疗反应的一个预测指标[42]。替莫唑胺(TMZ)是多形胶质母细胞瘤(GBM)化疗的常用药物,但耐药性限制了其在GBM治疗中的疗效。编码小核核糖核蛋白多肽G的SNRPG基因介导的对胶质瘤细胞的抑制作用可能与MYC和p53有关。且SNRPG在TMZ耐药U87细胞中表达增加,而下调SNRPG可能使耐药细胞对TMZ敏感,这表明敲低SNRPG可以降低GBM细胞对TMZ的化疗耐药[43]。
2.5 SPF45SPF45参与调控pre-mRNA剪接,SPF45不是剪接因子的SR蛋白或HNRNP家族成员,是由一个N端结构域、一个α-螺旋结构域、一个包含40个氨基酸的G-patch域(G-patch domain)和一个C端RRM (RNA-recognition motif)组成,是mRNA剪接所必需的,在卵巢癌化疗耐药中起重要作用。
SPF45在人类导管上皮中表达,在膀胱癌、肺癌、结肠癌、乳腺癌、卵巢癌、胰腺癌和前列腺癌中高表达。在HeLa细胞中过表达SPF45可使其对阿霉素的耐药性增加。在A2780卵巢癌细胞系中,SPF45诱导了多药耐药表型,诱导癌细胞对卡铂、长春瑞滨、阿霉素、依托泊苷、米托蒽醌和长春新碱等多种作用机制的化疗药物耐药,而在A2780细胞中,敲低SPF45则使细胞对依托泊苷敏感。SPF45不只参与选择性mRNA剪接也参与DNA修复,这有助于解释SPF45过表达所表现出对包括DNA损伤剂在内的不同作用机制药物的多药耐药表型[44]。
2.6 SF3B1SF3B1是U2 snRNP的重要组成部分,对剪接位点的选择至关重要,在慢性淋巴细胞白血病(CLL)、急性淋巴细胞白血病(ALL)和Richter综合征伴弥漫性大B细胞淋巴瘤化疗耐药中起重要作用。
在研究氟达拉滨难治性CLL的编码基因组时,发现SF3B1突变患者在氟达拉滨难治性CLL病例中有17%复发,其频率显著高于诊断时采样的连续CLL队列。在氟达拉宾难治性CLL中,SF3B1突变和TP53突变以相互排斥的方式分布。上述结果提示,SF3B1突变相关的剪接调控是CLL一种新的发病机制。在Richter综合征伴弥漫性大B细胞淋巴瘤中检测到SF3B1突变,这表明其在恶性血液肿瘤的发展和进展中具有重要作用,但SF3B1突变后与耐药性之间的关系尚不清楚。研究发现,剪接抑素A (spliceostatin,SSA)或其类似物美亚霉素B (MAMB)能够降低BRAF表达,干扰SF3B1在AS中发挥作用并抑制维莫非尼耐药细胞生长和体内肿瘤生长[45]。SF3B1敲低后,ALL细胞对DNA交联剂丝裂霉素C变得高度敏感[46]。
3 小结
在过去的10年中,癌症治疗取得了很多的进展,包括新的化疗药物、免疫疗法和分子靶向治疗,但是治疗效果仍不够理想,其中最大的难题之一是肿瘤化疗耐药。肿瘤化疗耐药通过多种分子机制发生,其中一种是选择性剪接的调节。癌细胞中基因组不稳定性有助于它们通过获得突变来适应生长环境的变化,这些突变使它们对化疗药物的反应降低。这些突变不仅可以影响pre-mRNA剪接过程,包括剪接位点选择、剪接位点识别核苷酸的突变和剪接机制成分的表达,还可以影响许多其他因素,包括导致蛋白质功能突变获得或丧失的基因突变。肿瘤细胞可以利用这种机制获得耐药性,而无须通过改变基因组获得耐药性。近来使用小分子或反义寡核苷酸调节AS开始用于治疗其他疾病,如脊髓性肌萎缩,为开发此类分子用于癌症治疗带来了希望,因此,需要更深入的研究并发现在促进癌症治疗化疗耐药中起作用的AS事件或剪接因子[7]。
AS的失调在癌症中很常见,肿瘤发生涉及的细胞周期、DNA损伤反应和细胞凋亡在很大程度上都受到AS的调节。癌症相关的剪接模式受损是多条通路共同作用的结果,这包括直接影响剪接位点和SFs的突变以及SFs的差异表达。剪接体已经成为肿瘤新型治疗药物开发的一个极具吸引力的靶点,剪接调节剂目前已经有项目正在临床前和临床研究中进行研究。随着对异常剪接如何在癌细胞中发挥作用的深入了解包括对剪接调节高度敏感的癌症亚型的鉴定,以及剪接调节剂与其他抗肿瘤剂的有效治疗组合等,剪接调节剂有望肿瘤治疗的潜在新型药物,以提高抗肿瘤疗效[46]。此外,剪接转换寡核苷酸是设计用于结合pre-mRNA并防止结合位点利用剪接位点的寡核苷酸。这些分子正被开发为化疗药物,用于靶向特定的AS相关基因。许多基因已经被靶向用于AS重编程,以增强常规化疗药物的功效。此类化合物用于AS定向调控的进一步开发为癌症治疗提供了新的思路。
