夏桑菊浸膏对高渗诱导干眼模型人角膜上皮细胞保护机制研究
2024-01-11李进良胡双飞李沛波吴灏彭维苏薇薇王永刚孙维广
李进良,胡双飞,李沛波,吴灏,彭维,苏薇薇,王永刚,孙维广
(1.中山大学生命科学学院,广东省中药上市后质量与药效再评价工程技术研究中心/广东省热带亚热带植物资源重点实验室,广东 广州 510275;2.广州白云山星群<药业>股份有限公司,广东 广州 510288)
干眼症(dry eye disease,DED)是一种常见的眼部疾病,其发病率逐年上升,严重影响了患者的正常生活和工作[1]。目前,虽然有多种治疗干眼症的方法[2],但病因复杂,如药物依赖、病情反复等问题,治疗效果并不理想[3]。因此,亟须寻找或开发一种更加安全有效的治疗方法。中药用于治疗眼部疾病历史已久,在治疗眼部等疾病中具有独特优势。夏桑菊(Xiasangju)是一种传统的中药复方,常用于治疗目赤肿痛、风热感冒、流感等[4],因其治疗目赤肿痛效果较好,提示其具有治疗干眼症潜力。然而,夏桑菊用于治疗干眼症鲜有报道。现代药理学研究表明,夏桑菊具有抗炎、抗氧化、抗凋亡等多种生物学效应[5]。夏桑菊中的桑叶、野菊花能有效改善睑板腺功能障碍引起的干眼症,且治疗过程简单易行、效果良好,但其作用机制尚未明确[6]。目前,泪液渗透压升高引发的眼表炎症已被认为是干眼症的标志[7-9]。基于此,本研究采用人角膜上皮细胞,通过构建高渗透压模型探究夏桑菊对人角膜上皮细胞的保护作用及机制,以期为干眼症的治疗提供新的思路。
1 材料与方法
1.1 材料
1.1.1 细胞HCE-T人角膜上皮细胞系(富衡生物,FH1239)。
1.1.2 主要试剂夏桑菊浸膏[广州白云山星群(药业)股份有限公司,批号:B220301];HCE-T专用培养基(富衡生物,FH-HCET);N-乙酰-L-半胱氨酸(兰博利德,YXBG01-25G);氯化钠(Sigma-Aldrich,S3014-500g)、白介素-18、白介素-6、白介素-1β检测试剂盒均购于云克隆Cloud-clone;EZ-press RNA Purification Kit(苏州英泽生物医药科技有限公司,B0004D);迷迭香酸(中国食品药品检定研究院,批号:111871-202007)等。
1.1.3 主要仪器设备色谱柱:依利特 Hypersil ODS(4.6 mm×250 mm,5 μm);HERAcell vios 160 CO2培养箱(美国Thermo Fisher Scientific公司);HT840超净工作台(苏州净化安泰技术有限公司);CytoFLEX流式细胞分析仪(CytoFLEX,Beckman);HWS24型电热恒温水浴锅(上海一恒科技有限公司);酶标仪(美国Bio Tek)、LC480实时荧光定量384孔PCR仪(瑞士Roche公司);Virit960梯度PCR仪(美国Applied Biosystems公司);Ultimate 3000高效液相色谱仪(美国Dionex公司)。
1.2 方法
1.2.1 色谱条件色谱柱:C18(4.6 mm×250 mm,5 μm),检测波长329 nm,流速0.9 mL·min-1,柱温30 ℃,进样体积 10 μL,按照《中国药典》夏桑菊颗粒[10]中的流动相条件梯度洗脱。
1.2.2 细胞培养HCE-T细胞每2 d换液1次,细胞生长至近融合状态时,用胰蛋白酶消化细胞并传代。培养条件为HCE-T专用完全培养基,置于37 ℃,5% CO2培养箱中无菌培养。
1.2.3 MTS法检测细胞活力细胞用不同浓度(30、50、70、90、110、130 mmol·L-1)NaCl分别模拟(350、400、450、500、550、600 mOsm·L-1)渗透压及用不同夏桑菊生药量浓度处理人角膜上皮细胞24 h,更换培养基,加入20 μL MTS孵育1~4 h后,采用酶标仪测定波长490 nm处吸光度(optical density,OD)值,按公式计算得各组的细胞活力:细胞活力=实验组OD值/对照组OD值×100%。
1.2.4 研究夏桑菊的保护作用实验分设不同组,采用600 mOsm·L-1(130 mmol·L-1NaCl)渗透压造模并同时给药,MTS检测细胞活力。
1.2.5 夏桑菊的保护作用机制研究
1.2.5.1 抗氧化作用使用2′,7′-二氯荧光黄双乙酸盐(DCFH-DA)探针检测 ROS。将细胞以2×105个细胞/孔的密度接种在6孔板中,按照各自的处理培养24 h。在37 ℃下与10 μmol·L-1DCFH-DA 探针染料孵育30 min后,用PBS洗涤细胞两次,流式细胞分析仪检测。
1.2.5.2 抗炎作用①ELISA法检测各组细胞培养液上清中炎症因子IL-1β、IL-6及IL-18的质量浓度:细胞按实验设计分组并做相应处理。每组处理24 h。检测细胞培养液上清。
②实时荧光定量PCR法检测夏桑菊浸膏对高渗诱导下人角膜上皮细胞相关基因的表达:细胞按实验设计分组并做相应处理,处理24 h。提取总RNA,逆转录成cDNA后于-20 ℃条件下保存。采用实时荧光定量基因扩增仪扩增各组cDNA目的基因。IL-1β上游引物:CACGATGCACCTGTACGAT CA,下游引物:AGACATCACCAAGCTTTTTTGCT;GAPDH上游引物:ATGTTCGTCATGGGTGTGAA,下游引物:GGTGCTAAGCAGTTGGTGGT。以GAPDH为内参,采用2-ΔΔCt法计算目的基因mRNA的相对表达量。
1.2.6 统计学分析采用GraphPad Prism 8.0软件分析实验数据,结果采用单因素方差分析,P<0.05表示差异具有统计学意义。
2 结果
2.1 含量测定按上述色谱条件,将样品进行处理和进样分析,每份样品平行进两针,测定迷迭香酸峰面积,计算夏桑菊浸膏中迷迭香酸的含量,含量测定结果表明,检测得到迷迭香酸含量为6 mg·g-1,高于《中国药典》规定夏桑菊颗粒中迷迭香酸含量。
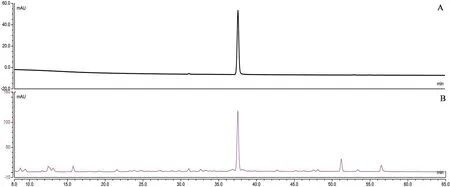
图1 迷迭香酸对照品(A)和夏桑菊浸膏(B)的HPLC色谱图
2.2 不同渗透压对人角膜上皮细胞活力的影响MTS结果如图2所示,不同渗透压处理24 h,350、400、450 mOsm·L-1渗透压对人角膜上皮细胞的活性影响无统计学意义,500~550 mOsm·L-1渗透压降低了人角膜上皮细胞活性,分别降至70%和61%(P<0.01)。600 mOsm·L-1渗透压可明显降低其活性,低于37.6%(P<0.01)。

图2 不同渗透压对人角膜上皮细胞细胞活性的影响(N=3) 注:与正常对照组比较,#P< 0.05,##P < 0.01。
2.3 夏桑菊对人角膜上皮细胞活性的影响采用不同浓度夏桑菊处理24 h对人角膜上皮细胞,实验见图3,与正常对照组相比,夏桑菊浓度≥10 mg·mL-1时,对细胞活性具有显著抑制作用;夏桑菊浓度<10 mg·mL-1,对细胞活性无显著性影响。以10 mg·mL-1为最大浓度,设置多个浓度评价夏桑菊的药效。由“2.2”项下结果可知,600 mOsm·L-1渗透压能够有效降低人角膜上皮细胞活力,因此后续选用600 mOsm·L-1渗透压处理,以探究夏桑菊对细胞的保护作用;低于或等于450 mOsm·L-1渗透压时,对人角膜上皮细胞的活性影响无统计学意义,故选用450 mOsm·L-1渗透压造模探究夏桑菊浸膏对细胞的保护作用机制及迁移能力。

图3 不同浓度夏桑菊浸膏对人角膜上皮细胞活性的影响结果(N=3) 注:与正常对照组比较,#P<0.05,##P<0.01。
2.4 夏桑菊浸膏对高渗诱导的人角膜上皮细胞的保护作用将人角膜上皮细胞在600 mOsm·L-1渗透压培养基中培养24 h后,与正常对照组相比,600 mOsm·L-1组的细胞活力由100%降至43.5%(P<0.01)。与600 mOsm·L-1比较,0.625 mg·mL-1和1.25 mg·mL-1夏桑菊可有效提高人角膜上皮细胞活性,细胞活性由模型组的45%提高到67.3%和64.9%(P<0.01),如图4所示。表明夏桑菊浸膏对高渗透压所致的细胞活性降低具有抑制作用。

图4 夏桑菊浸膏对高渗诱导的人角膜上皮细胞的保护作用的影响(N=3) 注:与正常对照组比较,##P<0.01;与600 mOsm·L-1组比较,*P<0.05,**P<0.01。
2.5 夏桑菊浸膏对高渗诱导下人角膜上皮细胞ROS水平的影响 HCE-T细胞在高渗诱导下,细胞系统中的氧化系统与抗氧化系统之间动态平衡失调,导致氧化损伤。由图5可知,与正常对照组相比,450 mOsm·L-1组 ROS的生成明显增多(P<0.01);与450 mOsm·L-1组相比,450 mOsm·L-1+625 μg·mL-1组和450 mOsm·L-1+1.25 mg·mL-1组细胞ROS的生成明显减少 (P<0.01)。说明夏桑菊能够有效抑制高渗诱导下人角膜上皮细胞 ROS水平升高,在一定程度上缓解高渗所致的氧化应激。

图5 夏桑菊浸膏对高渗诱导的人角膜上皮细胞的ROS水平影响(N=3) 注:与正常对照组比较,##P<0.01;与450 mOsm·L-1组比较,**P<0.01。
2.6 实时荧光定量PCR法检测夏桑菊浸膏对高渗诱导下人角膜上皮细胞IL-1β及Caspase-1基因的表达PCR结果显示,450 mOsm·L-1组IL-1β、Caspase-1 mRNA的相对表达量与对照组相比升高 (P<0.01);与450 mOsm·L-1相比,450 mOsm·L-1+1.25 mg·mL-1组 mRNA的相对表达量降低(P<0.05),如图6所示。研究表明夏桑菊能够有效抑制高渗诱导下人角膜上皮细胞中IL-1β及Caspase-1基因表达。

图6 夏桑菊浸膏对高渗诱导下人角膜上皮细胞IL-1β、Caspase-1基因的表达的影响(N=3) 注:与正常对照组比较,##P<0.01;与450 mOsm·L-1组比较,*P<0.05,**P<0.01。
2.7 夏桑菊浸膏对高渗诱导下人角膜上皮细胞分泌IL-6、IL-18、IL-1β水平的影响高渗诱导的氧化应激中 ROS 的产生,被认为是启动 NLRP3 炎性体激活的关键触发因素[9],随着 NLRP3 炎性体激活,各种炎症因子分泌水平易受影响,根据图7分析,各组IL-6、IL-18、IL-1β的蛋白浓度差具有统计学意义(P<0.05)。与对照组相比,450 mOsm·L-1组中的IL-6、IL-18、IL-1β蛋白浓度明显升高(P<0.01);与450 mOsm·L-1组相比,450 mOsm·L-1+625 μg·mL-1组IL-6、IL-18、IL-1β的蛋白浓度明显降低(P<0.01)。表明夏桑菊浸膏有效抑制了细胞中炎症因子IL-6、IL-18、IL-1β的蛋白分泌。
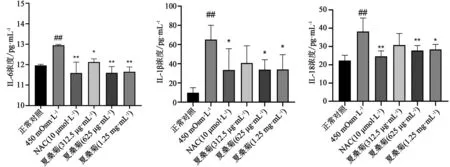
图7 夏桑菊浸膏对高渗诱导下人角膜上皮细胞分泌IL-1β、IL-18、IL-6水平的影响(N=3) 注:与正常对照组比较,##P<0.01;与450 mOsm·L-1比较,*P<0.05,**P<0.01。
3 讨论
在干眼症发生过程中,角膜上皮细胞是最先受到水分流失影响的细胞,同时是眼中唯一暴露在外界环境中的细胞,处于高渗环境下,角膜上皮细胞易凋亡和屏障功能受损[11-15]。研究表明,夏桑菊浸膏中的多种活性成分,例如黄酮类、有机酸类化合物等,通过调节多种炎症和氧化应激相关通路来发挥药效作用[16]。具备眼部疾病保健、预防、医疗潜力[17]。陈安兰等[18]将夏枯草及野菊花开发成雷菊滴眼液治疗结膜炎,发现具有明显的治疗效果。鱼俊杰等[19]采用中药菊花、桑叶等制成清明眼药水,治疗电光性眼炎310例,总有效率99.97%。临床结果表明,清明眼药水是一种疗效好、疗程短的中药滴眼剂。本研究通过构建高渗透压模型,确定合适的夏桑菊的给药浓度,给予高渗环境下人角膜上皮细胞合适夏桑菊浸膏的干预,发现夏桑菊可以抑制高渗诱导的人角膜上皮细胞活性下降,证明了夏桑菊保护人角膜上皮细胞免受高渗诱导的损伤的作用。初步揭示夏桑菊在治疗高渗引起的干眼症中具有药效作用。
高渗引起的眼表炎症已被认为是该病的特征之一[20]。本研究采用NaCl模拟高渗条件体外诱导干眼症模型。在高渗刺激细胞后,其活性氧显著增加,夏桑菊处理细胞后,ROS显著减少,证明夏桑菊可以抑制人角膜上皮细胞中高渗诱导的ROS的增加。此外,高渗诱导细胞炎症因子IL-1β、IL-6、IL-18的分泌水平增加,表明响应高渗应激产生的活性氧不仅会引发眼表氧化应激,将引发涉及炎症级联反应,导致各种促炎细胞因子和趋化因子的产生。而给予夏桑菊干预后显著降低了炎症因子的表达。体内研究显示,在干眼症患者的泪液和眼表中观察到NLRP3炎症小体的上调。高渗应激产生的活性氧可以激活小鼠干眼症模型中的NLRP3炎性体[16]。进一步体外研究表明,活性氧诱导的NLRP3激活通过Caspase-1激活导致IL-1β分泌增加,突出了ROS-NLRP3-IL-1β 信号轴在干眼症进展过程中的重要作用[21]。以上表明,夏桑菊可能通过抑制ROS-NLRP3-IL-1β信号通路来减轻干眼症的炎症反应。
综上所述,夏桑菊浸膏可以保护高渗诱导的人角膜上皮细胞的损伤,这种保护作用可能与其抑制ROS升高及炎症因子的表达有关,后续需对夏桑菊在干眼症治疗中的作用机制进一步深入研究,为其临床应用提供更加可靠的依据。综上,夏桑菊在干眼症的治疗中具有一定的潜力和应用价值。
