替加环素脑室内注射治疗广泛耐药鲍曼不动杆菌颅内感染的PK/PD和神经毒性分析
2024-01-01黄琪杨志玲黄琪蒋宇张兴文贾爱军
黄琪 杨志玲 黄琪 蒋宇 张兴文 贾爱军
摘要:目的 分析替加环素脑室内注射治疗广泛耐药鲍曼不动杆菌颅内感染的药动学/药效学(pharmacokinetics/pharmacodynamics, PK/PD)和神经毒性,预测临床有效性及安全性,为临床治疗方案提供可行的参考。方法 对1例实施脑室内注射替加环素的广泛耐药(extensively drug-resistant, XDR)鲍曼不动杆菌(Acinetobacter baumannii, A. baumannii)颅内感染患者进行药物浓度监测(therapeutic drug monitoring, TDM),研究替加环素在脑脊液(cerebrospinal fluid, CSF)中的PK。浓度测定采用二维高效液相色谱法。结合最小抑菌浓度(minimum inhibitory concentration, MIC)评估替加环素的PD。用细胞计数试剂盒-8(cell counting kit-8,CCK-8)测替加环素对PC12细胞生长抑制、流式细胞术检测细胞凋亡评估替加环素的神经毒性。结果 单次脑室内给药5 mg替加环素后,峰浓度(Cmax)为37.894 mg/L,远高于MIC值2 mg/L。AUC0-12h为200.6 mg·h/L。半衰期为2.73 h,提示每日至少需要给药2次。模拟多剂给予替加环素的稳态Cmax为55 mg/L。替加环素抑制PC12细胞生长并诱导PC12细胞凋亡,IC50值約为51.35 mg/L。替加环素Cmax接近40 mg/L,该浓度对PC12细胞生长抑制率和诱导凋亡率分别为41.33%和4.58%。结论 脑室内注射替加环素是治疗鲍曼不动杆菌颅内感染的一种很有前景的方法。但高浓度替加环素可能存在潜在神经毒性,替加环素单次剂量最好不超过5 mg。脑室内注射替加环素必须谨慎选择,在TDM下进行。
关键词:替加环素;脑室内注射;广泛耐药鲍曼不动杆菌;颅内感染;治疗药物监测
中图分类号:R978.1 文献标志码:A
Analysis of pharmacokinetics/pharmacodynamics and neurotoxicity of tigecycline intraventricular injection for the treatment of extensively drug-resistant Acinetobacter baumannii intracranial infection
Huang Qi1, Yang Zhiling 1, Huang Qi2, Jiang Yu 3, Zhang Xingwen 4, and Jia Aijun 4
(1 Department of Pharmacy, Hunan Provincial Peoples Hospital (The First-Affiliated Hospital of Hunan Normal University), Changsha 410005; 2 Department of Pharmacy, Xiangya Hospital, Central South University, Changsha 410031; 3 Institute of Emergency Medicine, Hunan Provincial People's Hospital (The First-Affiliated Hospital of Hunan Normal University), Changsha 410005; 4 Emergency Intensive Care Unit, Hunan Provincial Peoples Hospital (The First-Affiliated Hospital of Hunan Normal University), Changsha 410005)
Abstract Objective To analyze the pharmacokinetics/pharmacodynamics (PK/PD) characteristics and neurotoxicity of tigecycline intraventricular injection and predict its clinical efficacy and safety to provide a feasible reference for a clinical therapeutic regimen. Methods The PK of tigecycline in cerebrospinal fluid (CSF) was investigated by performing therapeutic drug monitoring (TDM) for an extensively drug-resistant (XDR) Acinetobacter baumannii (A. baumannii) intracranial infection patients with intraventricular injecting tigecycline. The concentration of tigecycline was determined by two-dimensional high performance liquid chromatography (2D-HPLC). The PD of tigecycline was investigated with its minimum inhibitory concentration (MIC) against XDR A. baumannii. The CCK-8 assay was used to evaluate the cytotoxicity of different concentrations of tigecycline effect on PC12 cells, and the apoptosis assay was performed using flow cytometry. Results After a dose of 5 mg tigecycline, Cmax in CSF was 37.894 mg/L which was high above the MIC value of 2 mg/L. The area under the curve of 0 to 12 hours (AUC0-12h) was 200.6 mg·h/L. The t1/2 of tigecycline was estimated to be 2.73 hours, indicating the intraventricular injection frequency at least twice daily. Steady-state Cmax of simulated multi-dose tigecycline was 55 mg/L. Tigecycline significantly decreased cell viability as assessed and induced apoptosis of the PC12 cell. The IC50 value of PC12 cells treated with tigecycline was about 51.35 mg/L. When the concentration of tigecycline was 40 mg/L, close to Cmax, the growth inhibition rate and apoptosis induction rate of PC12 cells were 41.33% and 4.58%, respectively. Conclusion Intraventricular injection of tigecycline is a promising method for treating XDR A. baumannii intracranial infection. Since a high concentration of tigecycline in CSF may have potential neurotoxicity, each dose of tigecycline is better to be less than 5 mg. Intraventricular injection of tigecycline must be selected cautiously and best carried out under TDM.
Key words Tigecycline; Intraventricular injection; XDR A. baumannii; Intracranial infection; TDM
颅内感染是一种严重的、进展迅速、致死率高的难治性疾病。由于存在血脑屏障,大多数抗生素无法进入中枢神经系统(central nervous system, CNS)发挥有效的抗菌作用。近年来,神经外科手术后相关的鲍曼不动杆菌脑膜炎和脑室炎越来越多地被报道[1-3]。其高致残率和致死率,以及可供选择的敏感抗生素很少,为抗感染治疗带来了严峻挑战。根据中国抗菌药物监测网(China antimicrobial surveillance network, CHINET)的数据,约80%的鲍曼不动杆菌菌株对亚胺培南和美罗培南耐药;大多数耐药菌株仅对替加环素和多黏菌素B敏感[4]。然而,静脉注射替加环素和多黏菌素B的腦脊液渗透性差,无法治疗颅内感染。脑室内或鞘内给药是一种绕过血脑屏障和其他限制药物进入大脑的机制的方法[5]。
目前国际共识指南推荐治疗XDR A. baumannii颅内感染仅有的方法为脑室内或鞘内注射黏菌素[6]。 其中甲磺酸黏菌素(colistin methanesulfonate, CMS)药代动力学不稳定,多黏菌素B安全性和有效性循证依据相对较少。另一种敏感抗生素替加环素有可能成为脑室内或鞘内注射替代或联用的选择。静脉注射替加环素在体内分布广泛,尤其在肺部和腹腔中浓度较高,但难以透过血脑屏障。目前已有一些脑室内或鞘内注射替加环素治疗颅内感染成功的案例报道[7-9],在这些案例中未发现严重不良反应。然而,脑室内或鞘内注射替加环素是超说明书用药;给药剂量和使用频率没有公认的指南推荐。由于缺乏大样本研究,其有效性和安全性可能存在偏差。
脑室内或鞘内注射药物必须谨慎,要充分考虑其有效性和安全性[5]。脑室内或鞘内注射抗菌药物的疗效与PK/PD有关,在评价替加环素治疗肺部感染时,国内外文献通常以游离AUC与MIC的比值(fAUC0~24h /MIC)作为PK/PD 参数,其中“f”为替加环素游离血药浓度的系数[10-11]。由于血脑屏障的存在,脑室注射的PK与血药浓度的关系较小,目前尚无公认的脑室注射PK/PD评价标准,故根据CSF中替加环素浓度是否高于MIC值来预测疗效。脑室内或鞘内注射药物的安全性很大程度与药物的神经毒性相关。目前在少数成功的个案中有脑脊液替加环素PK的报道[12-13],但还没有关于替加环素神经毒性的公开数据。因此,本研究为接受脑室内注射替加环素治疗XDR A. baumannii颅内感染患者进行了TDM,根据浓度-时间曲线和MIC值评估脑室内注射替加环素的疗效。同时通过CCK-8法检测PC12细胞在不同浓度替加环素作用下的存活率和流式细胞仪测定凋亡率,评价替加环素的神经毒性。根据上述结果为脑室内注射替加环素治疗颅内感染提出可行性建议。
1 材料与方法
1.1 替加环素在CSF中的PK
1.1.1 替加环素TDM
12岁男童既往体健,因突发颅内巨大动静脉畸形破裂出血破入脑室患者接受双侧脑室钻孔引流术+全脑血管造影脑血管畸形介入栓塞术,术后经痰培养及脑脊液细菌培养先后确诊为肺部及颅内XDR A. baumannii感染,替加环素敏感(MIC值2 mg/L)。经静脉注射替加环素50 mg q12 h治疗3 d感染未控制,遂经脑室引流管注入替加环素5 mg,给药后夹紧引流管1 h后打开,在给药后1、6、8和12 h自引流管抽取脑脊液3 mL测定替加环素浓度。
1.1.2 脑脊液样本处理
将脑脊液置于涡旋混合器(上海青浦西仪器厂XW-80A)离心5 min(3000 r/min),然后提取200 μL上清液,并将其放置在Eppendorf管和200 μL高氯酸(10%)中以沉淀蛋白质。将试管旋转1 min并离心8 min
(14500 r/min),然后将上清液300 μL和醋酸铵(5.0 mol/L)
20 μL添加到注射瓶中,并旋转60 s。最后将200 μL注入岛津LC-20 A二维液相仪系统,使用外标法进行定量分析。
1.2 替加环素对PC12细胞的细胞毒作用
1.2.1 PC12细胞培养
PC12细胞为大鼠肾上腺棕色细胞瘤细胞系,从中国科学院细胞库(中国上海)获得,传代数为10。PC12细胞在添加10%小牛血清、100IU/mL青霉素和100μg/mL链霉素的1640培养基中于37 ℃、含5% CO2的增湿空气中培养。细胞单层接种于96孔板中[14]。
1.2.2 CCK-8测定
PC12细胞在100 μL 1640培养基中以每孔5×103个细胞的速度接种在96孔板中,在37 ℃(5% CO2)孵育24 h至对数生长期。加入适当浓度替加环素(Wyeth,AMSU/12)的新鲜培养基培养24 h。去除细胞上清液,加入100 μL CCK-8:PBS(1:9)稀释液中培养1.5 h。使用微孔板读取器测量450 nm波长处的光吸收率。细胞活力以检测到的吸光度与不含替加环素的对照组比较的百分率表示。用倒置显微镜(日本Olympus)观察细胞并拍照。
1.2.3 细胞凋亡测定
将PC12细胞(按底部面积20%计算)置于6孔板中,于37 ℃(5% CO2)培养过夜。当细胞生长到大约50%到60%时,加入不同浓度的替加环素并培养24 h。用PBS清洗细胞后,以1000 r/min的转速离心5 min,并重复3次。收集细胞并在100 μL磷酸盐缓冲液中重新悬浮,与2.5 μL Annexin V-FITC和5 μL PI(50 μg/mL)孵育5 min,并通过流式细胞术进行分析。
1.3 替加环素多剂给药时的PK和细胞毒性预测
多剂PK预测:基于替加环素单剂量给药数据,建立一房室模型。房室模型参数估算结束后,模拟多剂给予替加环素时的血浆PK。细胞毒性预测:首先根据1.2节数据建立S型Emax模型,描述替加环素浓度与PC12细胞活性之间关系。然后,将替加环素多剂 PK曲线数据代入S型Emax模型,从而获得替加环素静注5 mg q12 h方案下的全程PD曲线(PC12细胞活性-时间曲线)。用Phoenix WinNonlin软件8.3版(美国Cetara公司)执行这些工作。
1.4 统计学方法
相关测量数据以平均差±标准差(x±s)表示,并使用SPSS软件(17.0,美国IBM公司)进行分析。采用t检验对数据进行评估。P<0.05被认为具有统计学意义。
2 结果
2.1 替加环素在CSF中的PK
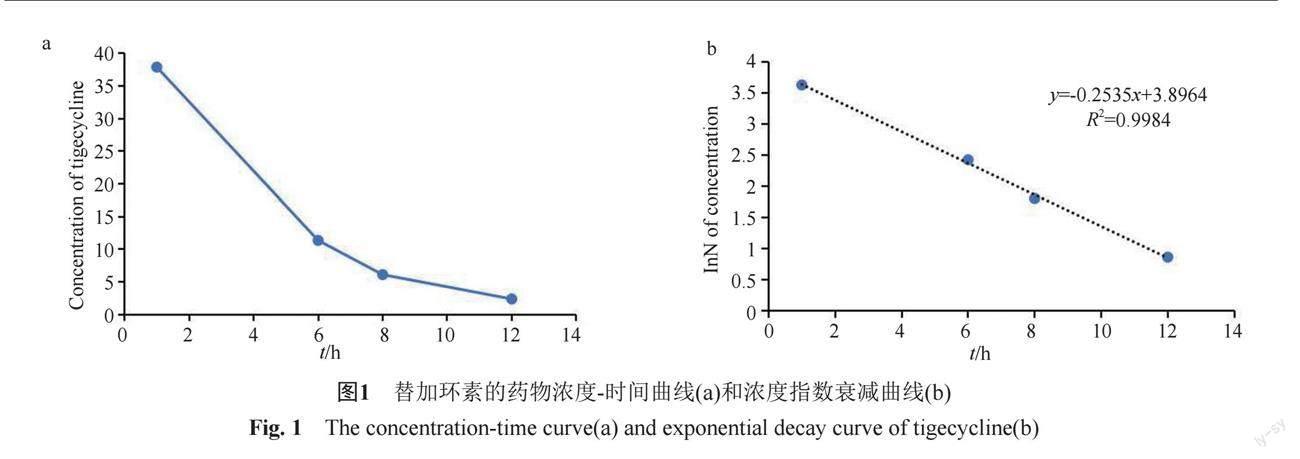
脑室内注射后1、6、8和12 h收集脑脊液中测得替加环素浓度分别为37.89、11.36、6.11和2.38 mg/L(图1a),AUC0-12h为200.6 h·mg/L。根据Cmax计算CSF表观分布体积约为132 mL。替加环素浓度随时间的指数衰减曲线如图1b所示。计算脑脊液中替加环素的t1/2为2.73 h。
2.2 替加环素对PC12细胞的细胞毒作用
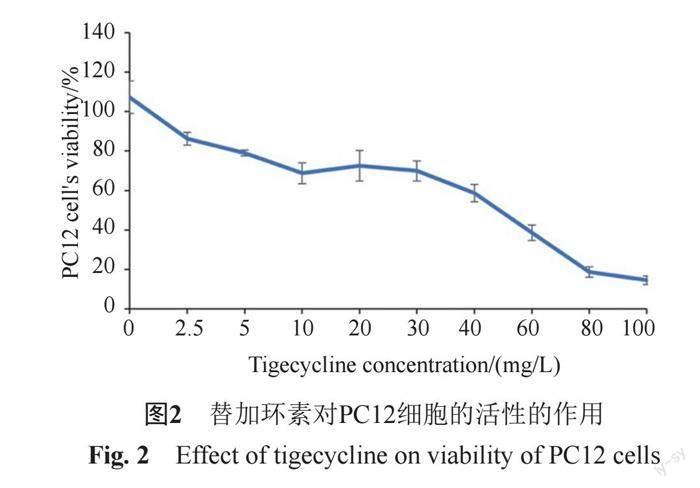
如图2所示,在一定浓度范围内,替加环素以剂量依赖性方式诱导PC12细胞的细胞活力显著降低。在20~100 mg/L之间替加环素之间存在明显的线性关系。经计算IC50值为51.35 mg/L,计算公式见图3。
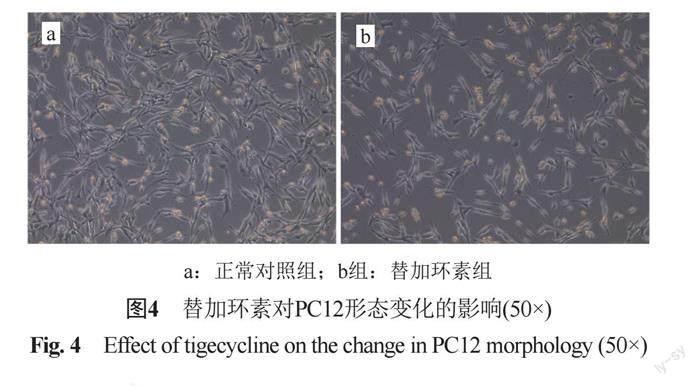
与对照组(图4a)相比,替加环素组(图4b)的细胞数量显著减少。对照组细胞胞体成梭形、锥形或多角形,胞核明显,突起较长,而对照组细胞皱缩,突起变短,可见细胞碎片。
如图5所示,对照组PC12细胞也有一定比例的凋亡。不同浓度的替加环素处理24 h后,PC12细胞凋亡率均有不同程度的增加,与对照组相比差异有统计学意义(P<0.05)。相同浓度下替加环素凋亡率远低于细胞生长抑制率。生长抑制率=(1-替加环素组吸光度/对照组吸光度)×100%。
2.3 替加环素多剂给药对PC12细胞的药动学和细胞毒性预测
2.3.1 多剂给药时的PK曲线预测
如图6所示,通过模拟5 mg q12 h连续3 d给药后,替加环素在脑脊液中药时曲线从第二剂给药后就进入稳态。在稳态阶段,替加环素Cmax约为55 mg/L,Cmin约为2.6 mg/L,AUC0-12h=195 h·mg/L,坪浓度Cav=16.3 mg/L,蓄积因子R为1.05,属于轻度蓄积。Vss=0.10 L, CLss=0.026 L/h。
2.3.2 细胞毒性预测
由图7可见,在稳态阶段,给药后,替加环素对PC12细胞毒性主要在给药后3 h内,从给药后4 h开始(此时替加环素仍有浓度,约为13 mg/L),PC12细胞活性基本恢复正常。
3 讨论
替加环素是治疗碳青霉烯类耐药革兰阴性杆菌,尤其是XDR A. baumannii的重要药物。治疗XDR A. baumannii感染通常需要2或3种抗菌药物的联合。根据美国传染病学会和欧洲临床微生物学和传染病学会的建议,对于严重和高危碳青霉烯类耐药A. baumannii感染的患者,建议使用包括多黏菌素、氨基糖苷、替加环素和舒巴坦钠制剂等中的至少两种体外活性抗生素的联合治疗(条件推荐,极低证据)[15-16]。一些研究表明,以替加环素为基础,与舒巴坦复方制剂、碳青霉烯类抗生素或多黏菌素B联合使用,对XDR A. baumannii具有协同抗菌作用[17-18]。然而,由于血脑屏障的限制,静脉注射替加环素无法用于治疗颅内感染。 根据神经外科中枢神经系统感染诊治中国专家共识(2021版),建议静脉注射结合鞘内或脑室内注射治疗鲍曼不动杆菌引起的神经系统感染(强推荐,低证据)[19]。目前鞘内注射多黏菌素B 5 mg/d是国际公认的推荐剂量,然而替加环素并没有公认的推荐剂量。根据中国专家共识,替加环素推荐剂量为每12 h 1~10 mg。这个剂量范围比较大,不够精确。循证学证据也只是基于少数病例报告,证据级别相对较低,给药方案的安全性和有效性缺乏充分客观依据。笔者希望通过一系列体内和体外研究,分析脑室内注射替加环素治疗XDR A. baumannii颅内感染的可行性,以及安全、有效的给药剂量和给药频率。
由于注射后1 h样本为引流管打开的第一时间取样,浓度最高,Cmax为37.894 mg/L,远高于细菌培养及药敏试验测得的替加环素MIC值。一些指南建议,颅内注射抗菌药物的剂量和间隔时间应根据脑脊液抗菌药物浓度调整至致病菌MIC的10~20倍(强推荐、低证据)[20],提示脑室内注射替加环素5 mg可以达到理想的抗菌初始浓度。注射后12 h的浓度为
2.38 mg/L,略高于MIC值。由于患者仅实施脑室内注射2次治疗后转院,未能测量多次注射后的稳态浓度。通过Phoenix WinNonlin模拟多次给藥达到稳态阶段后,替加环素Cmax和Cmin分别约为55 mg/L和2.6 mg/L,
峰谷浓度之间的差距较大。在Wu等[13]的研究中,替加环素静脉注射/脑室内注射(IV/ICV)联合给药时,3种不同剂量40 mg IV/10 mg ICV、45 mg IV/5 mg ICV和50 mg IV/1 mg ICV的,脑脊液中替加环素的谷浓度分别为2.886、1.290和0.313 mg/L。在脑室内注射
12 h后测得的浓度2.38 mg/L与介于45 mg IV/5 mg ICV和40 mg IV/10 mg ICV的谷浓度之间。根据替加环素浓度指数衰减计算得出的半衰期约为2.73 h。上述结果显示,脑室内注射替加环素5 mg至少每天两次才能维持CSF中对XDR A. baumannii的MIC,这与指南推荐q 12 h给药是一致的。如果要达到更理想的治疗浓度,可能需要进一步增加给药频次。遗憾的是,本研究中没有收集引流袋中的CSF,无法评估替加环素浓度下降通过引流管丢失的还是在颅内代谢的。在今后的研究中,需在这方面做更多的数据收集。本文对于替加环素脑室内注射的疗效评估基于药动学个案分析,实际的治疗效果还需要结合TDM观察更多临床案例。
腦室内或鞘内注射可使药物在脑脊液中达到高浓度,而药物对神经细胞的损害是不可逆转的,所以研究替加环素的神经毒性非常必要。PC12细胞来源于可移植的小鼠嗜铬细胞瘤,由神经生长因子诱导分化为神经内分泌细胞,它是研究药物神经毒性的常见细胞株之一。本研究评估了不同浓度的替加环素对PC12细胞的生长抑制作用。如CCK-8试验所示,替加环素诱导PC12细胞的细胞活力降低呈剂量依赖性,尤其是当浓度在20~100 μg/mL之间时细胞活力呈直线性下降,因此,替加环素可能存在潜在的神经毒性。流式细胞术分析表明,随着替加环素浓度的增加,细胞凋亡率逐渐增加。但是在相同的替加环素浓度下,PC12细胞凋亡率远低于细胞生长抑制率,提示凋亡可能不是替加环素抑制神经细胞生长的主要方式,具体机制还需要进一步研究。患者脑室内注射替加环素过程中未发生明显不良反应,随访时未见神经系统后遗症,笔者认为脑室内注射5 mg替加环素剂量是相对安全的。脑室内注射5 mg替加环素的Cmax为37.894 mg/L,表观分布体积与正常情况下人CSF的总量(130~150 mL)相当。由此推断脑室内注射替加环素的Cmax可以根据单次剂量与脑脊液容量比值来估计,这对研究药物单次最大剂量的安全性非常有意义。与IC50值相比,CSF中替加环素Cmax越低越安全。替加环素对PC12的IC50为51.35 mg/L,单次脑室内注射5 mg替加环素Cmax与之差距较小,通过模拟多剂给药的PK,预测稳态Cmax 为55 mg/L,已超过IC50值,可能需要减少单次剂量来降低峰值浓度,以减少神经毒性。通过拟合多剂给药时间-浓度曲线和细胞活性曲线,达到稳态阶段后,替加环素对PC12细胞毒性主要集中在给药后3 h内,提示临床在注射药物后的3 h应密切观察。诚然,神经系统包含许多相互作用不同的细胞,是一个复杂的系统。一种类型的细胞的研究并不代表整个神经系统[21],还需要研究更多类型的神经细胞,以确定替加环素的神经毒性。
综上所述,脑室内注射替加环素可能是治疗鲍曼不动杆菌颅内感染的一种很有前景的方法。但是高浓度的替加环素可能具有潜在的、不可逆的神经毒性作用。笔者不推荐替加环素作为脑室注射治疗
A. baumannii颅内感染的首选药物。如果作为最后手段添加,每次剂量最好少于5 mg,每天给药频次不少于2次。脑室内注射最好在TDM下进行,以确保安全和有效。
伦理声明:本研究获得湖南省人民医院医学伦理委员会批准(2022 Scientific Research Ethics Review NO: 15 )。
参 考 文 献
Hussein K, Rabino G, Feder O, et al. Risk factors for meningitis in neurosurgical patients with cerebrospinal fluid drains: Prospective observational cohort study[J]. Acta Neurochir, 2019, 161(3): 517-524.
Long W, Yuan J, Liu J, et al. Multidrug resistant brain abscess due to Acinetobacter baumannii ventriculitis cleared by intraventricular and intravenous tigecycline therapy: A case report and review of literature[J]. Front Neurol, 2018, 9: 518.
夏为, 侯云生, 卞晓华. 颅脑手术后并发颅内多重/泛耐药鲍曼不动杆菌感染24例治疗总结[J]. 临床误诊误治, 2016, 29(7): 71-74.
Hu F, Guo Y, Yang Y, et al. Resistance reported from China antimicrobial surveillance network (CHINET) in 2018[J]. Eur J Clin Microbiol, 2019, 38(12): 2275-2281.
Cook A M, Mieure K D, Owen R D, et al. Intracerebroventricular administration of drugs[J]. Pharmacotherapy, 2009, 29(7): 832-845.
Tsuji B T, Pogue J M, Zavascki A P, et al. International Consensus Guidelines for the Optimal Use of the Polymyxins: Endorsed by the American College of Clinical Pharmacy (ACCP), European Society of Clinical Microbiology and Infectious Diseases (ESCMID), Infectious Diseases Society of America (IDSA), International Society for Anti-infective Pharmacology (ISAP), Society of Critical Care Medicine (SCCM), and Society of Infectious Diseases Pharmacists (SIDP)[J]. Pharmacotherapy, 2019, 39(1): 10-39.
Lauretti L, D'Alessandris Q G, Fantoni M, et al. First reported case of intraventricular tigecycline for meningitis from extremely drug-resistant Acinetobacter baumannii[J]. J Neurosurg, 2017, 127(2): 370-373.
Deng Z W, Wang J, Qiu C F, et al. A case report of intraventricular and intrathecal tigecycline infusions for an extensively drug-resistant intracranial Acinetobacter baumannii infection[J]. Medicine (Baltimore), 2019, 98(15): e15139.
Li W, Li D, Yin B, et al. Successful treatment of pyogenic ventriculitis caused by extensively drug-resistant Acinetobacter baumannii with multi-route tigecycline: A case report[J]. World J Clin Cases, 2021, 9(3): 651-658.
司徒冰, 郑培英, 王颖, 等. 替加环素治疗泛耐药鲍曼不动杆菌所致医院获得性肺炎的PK/PD研究[J]. 中国新药杂志, 2018, 27(10): 1153-1158.
Xie J, Roberts J A, Alobaid A S, et al. Population pharmacokinetics of tigecycline in critically ill patients with severe infections[J]. Antimicrob Agents Chemother, 2017, 61(8): e00345-17.
Xing H, Cheng C, Zhang Y, et al. Successful treatment with intrathecal and intravenous polymyxin b-based combination against MDR Acinetobacter baumannii meningitis in pediatric patient: A case report[J]. Front Pediatr, 2021, 9: 564991.
Wu Y, Chen K, Zhao J, et al. Intraventricular administration of tigecycline for the treatment of multidrug-resistant bacterial meningitis after craniotomy: A case report[J]. J Chemother, 2018, 30(1): 49-52.
Chen i, Tang M, Liu M, et al. Neferine and lianzixin extracts have protective effects on undifferentiated caffeine-damaged PC12 cells[J]. BMC Complement Med Ther, 2020, 20(1): 76.
Tamma P D, Aitken S L, Bonomo R A, et al. Infectious diseases society of america guidance on the treatment of ampc beta-lactamase-producing enterobacterales, carbapenem-resistant Acinetobacter baumannii, and Stenotrophomonas maltophilia infections[J]. Clini Infect Dis, 2022, 74(12): 2089-2114.
Paul M, Carrara E, Retamar P, et al. European Society of Clinical Microbiology and Infectious Diseases (ESCMID) guidelines for the treatment of infections caused by multidrug-resistant Gram-negative bacilli (endorsed by European society of intensive care medicine)[J]. Clin Microbiol Infect, 2021, 28(4): 521-547.
Petersen P J, Labthavikul P, Jones C H, et al. In vitro antibacterial activities of tigecycline in combination with other antimicrobial agents determined by chequerboard and time-kill kinetic analysis[J]. J Antimicrob Chemother, 2006, 57(3): 573-576.
Sopirala M M, Mangino J E, Gebreyes W A, et al. Synergy testing by Etest, microdilution checkerboard, and time-kill methods for pan-drug-resistant Acinetobacter baumannii[J]. Antimicrob Agents Ch, 2010, 54(11): 4678-4683.
中國医师协会神经外科医师分会神经重症专家委员会,北京医学会神经外科学分会神经外科危重症学组. 神经外科中枢神经系统感染诊治中国专家共识(2021版)[J]. 中华神经外科杂志, 2021, 37(1): 2-11.
Tunkel A R, Hasbun R, Bhimraj A, et al. 2017 infectious diseases society of America's clinical practice guidelines for healthcare-associated ventriculitis and meningitis[J]. Clin Infect Dis, 2017, 64(6): e34-e65.
Annabi E, Salem I B, Abid-Essefi S. Acetamiprid, a neonicotinoid insecticide, induced cytotoxicity and genotoxicity in PC12 cells[J]. Toxicol Mech Methods, 2019, 29(8): 580-586.
