国内外抗菌药物复方制剂上市品种、相关目录收载的对比分析与思考
2024-01-01洪峻郑波赵志刚
洪峻 郑波 赵志刚


摘要:为探究抗菌药物复方制剂在我国的上市情况以及可及性。本研究对中国、美国、日本和欧盟地区抗菌药物复方制剂的上市品种、数量进行了统计,并对《国家基本药品目录(2021版)》(NEML)、《WHO基本药品目录(第22版)》(EML)、《WHO儿童基本药品目录(第8版)》(EMLc)中抗菌药物复方制剂的收录情况进行了对比。结果表明:①我国抗菌药物复方制剂的种类及数量位居前列,但其管理有待进一步规范化。②NEML同EML和EMLc相比重合药物仅占3种,建议收载新型复方制剂,例如头孢他啶/阿维巴坦和美罗培南/法硼巴坦,以完善用药体系。在此基础上,为提高我国抗菌药物复方制剂的研究和规范管理,需进一步研究。
关键词:抗菌药物;复方制剂;上市药物;基本药物目录;合理性;对比分析
中图分类号:R979.9 文献标志码:A
Comparative analysis and reflection on listed varieties and related catalogues of antibacterial combination drugs at home and abroad
Hong Jun1,2, Zheng Bo3, and Zhao Zhigang1,2
(1 Department of Pharmacy, Beijing Tiantan Hospital, Capital Medical University, Beijing 100070; 2 College of Pharmacy, Capital Medical University, Beijing 100069; 3 Institute of Clinical Pharmacology, Peking University First Hospital, Beijing 100034)
Abstracts To explore the listing situation and accessibility of antibacterial compound preparations in China. In this study, the listed varieties and quantities of antibacterial compound preparations in China, the United States, Japan, and the European Union were counted. The inclusion of antibacterial compound preparations in National Essential Medicines List (2021 edition) (NEML), WHO Essential Medicines List (22nd edition) (EML), and WHO Essential Medicines List for Children (8th edition) (EMLc) was compared. The results showed that: ① The types and quantities of antibacterial compound preparations were among the highest in China, but the management needed to be further standardized. ② NEML only has three overlapping drugs compared with EML and EMLc. It is suggested to include new compound preparations, such as ceftazidime/avibactam and meropenem/farborbactam, in order to improve the medication system. On this basis, in order to improve the research and regulation of antibacterial compound preparations, further research was needed.
Key words Antibacterial agents; Combination drugs; Listed drugs; National essential medicines list; Rationality; Comparative analysis
細菌耐药的问题已成为世界公共卫生事件之一。据报道,2019年有127万人因抗生素耐药直接死亡,495万人的死亡与抗生素耐药性相关[1]。为积极处理细菌耐药问题,世界卫生组织(WHO)于2016年建立了全球抗生素研究与研发伙伴关系(Global Antibiotic Research and Development Partnership),并于2017年发布了第一份“重点病原体”耐药清单,其中耐碳青霉烯鲍曼不动杆菌(CRAB)、耐碳青霉烯铜绿假单胞菌(CRPA)、耐碳青霉烯肠杆菌科细菌(CRE)及产超广谱β-内酰胺酶(ESBL)肠杆菌被列为重中之重[2]。我国国家卫生计生委等14部门联合制定了《遏制细菌耐药国家行动计划(2016—2020年)》,计划从国家层面实施综合治理策略,对抗菌药物的研发、生产、流通、应用等环节加强监管,应对细菌耐药带来的风险。计划实施至2021年间,我国共上市新型抗菌药物7种。
詹思延等[3]对1.7亿张门急诊抗菌药物处方的研究显示,中国二、三级医院门急诊抗菌药物处方率为10.9%,其中广谱抗菌药物占所有抗菌药物的80%左右。抗菌药物复方制剂是实现扩大抗菌谱的方式之一。自1976年,第一个β-内酰胺酶抑制剂克拉维酸被发现以来,β-内酰胺类联合β-内酰胺酶抑制剂作为重要的抗菌药物复方制剂(后称复方制剂)进入了抗菌药物舞台,发挥了抗击细菌感染的作用。本文旨在对国内外的抗菌药物复方制剂上市产品进行梳理和对比分析,以期为新型抗菌药物的研发及临床合理选用抗菌药物提供参考。
1 复方制剂概况
1.1 复方制剂历史
20世紀初期,市场上第一次出现“复方制剂”的概念。20世纪中叶,随着广谱抗菌药物需求量的增加,认为两种抗菌药物的组合可以有效地扩大抗菌谱[4],并得到了美国食品药品监督管理局(FDA)的认可,从而掀起了一股复方抗菌药物热潮[5]。这种缺乏理论依据的复方制剂药物最终没能成为主流,并有部分复方制剂药物因出现药物不良事件而退市。
1971年,FDA制定了更严格的准入机制,要求“复方制剂必须证明其疗效优于同时使用组方成分制成的单方制剂”。3年后,复方磺胺甲恶唑作为第一个符合上述要求的药物上市,从此开启了复方制剂的新章程。随着长期的探索和发展,国际上对于复方制剂的相关概念和注册管理办法开始逐渐明确和完善。
1.2 复方制剂概念
目前,我国没有法规对复方制剂的概念作出明确定义。参考WHO及日本定义,复方制剂(WHO: Fixed-dose combination finished pharmaceutical product,日:配合剤)通常指由两种或两种以上药物组成的制剂[6-7]。FDA对于组合药物(combination drugs)的定义为:①联合包装产品:两种或多种单独的药物包装在一起;②联合用药:使用两种药物治疗同种疾病;③固定剂量组合(fixed dose combinations):两种或多种药物组合在制剂中。此外应注意将复方制剂同FDA定义的组合产品(combination products)相区别,组合产品范围更加宽泛,包括治疗产品及诊断试剂,如:组合药物、医疗设备、生物制剂[7]。
复方制剂不应是单纯的多种药物进行组合。复方制剂需体现复方组方的必要性并保证药物质量的稳定和均一。与单药相比,复方制剂使组方药物产生协同作用、减少不良反应并减少服用药品的数量以提高患者治疗的依从性。
1.3 复方制剂分类标准
表1列出了人用药物注册技术要求国际协调会议(ICH)、WHO、FDA、欧洲药品管理局(EMA)对于复方制剂的分类标准,日本目前对于复方制剂的分类没有明确规定。我国原食品药品监督管理局于2007年制定的《药品注册管理办法》中,将复方制剂分为了化学药品、中药天然药品、生物制剂,但在2020最新版《药品注册管理办法》中未予以体现。
2 中美日欧抗菌药物复方制剂现状对比分析
2.1 已上市抗菌药物复方制剂
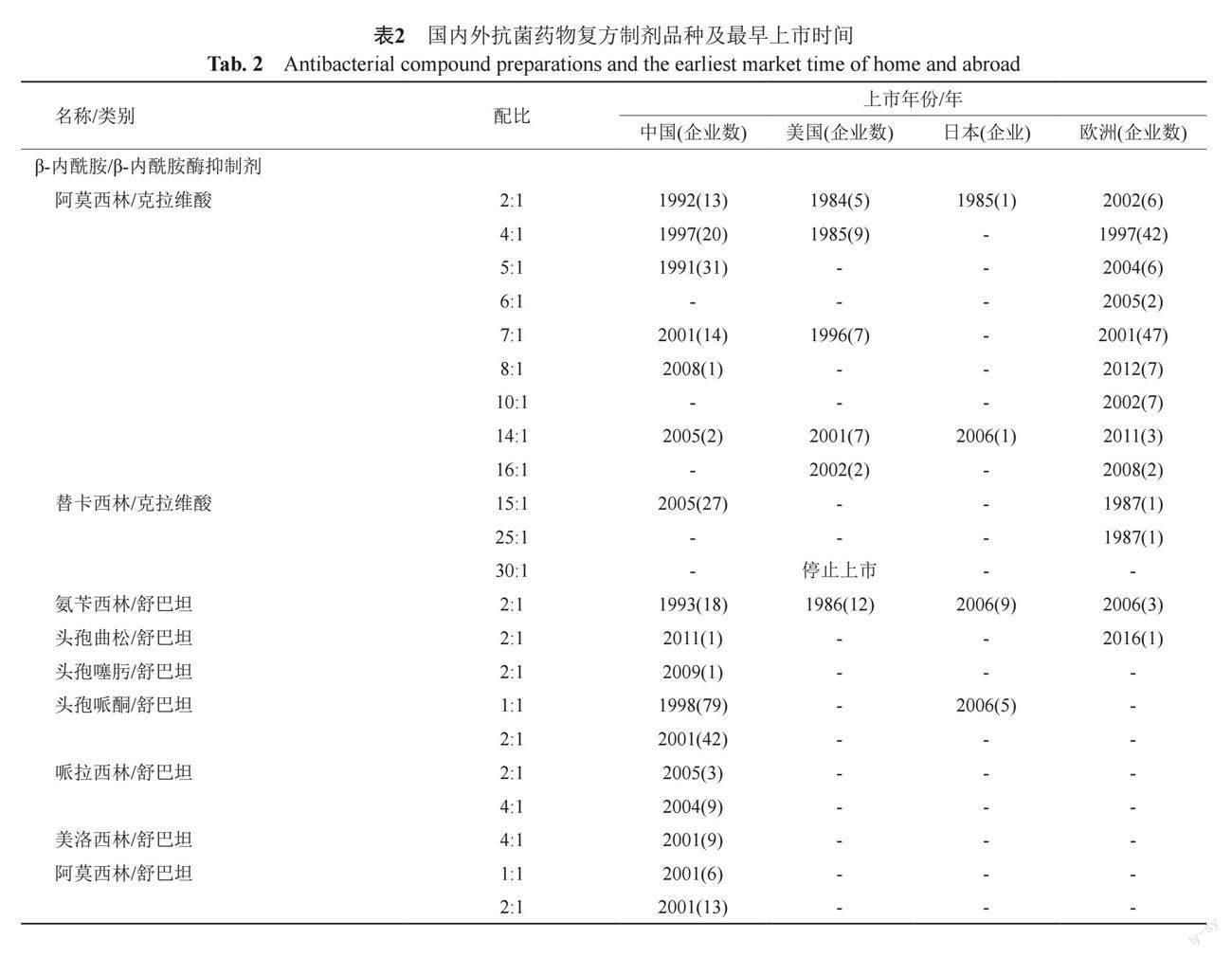
通过在国家药品批准目录[8]、FDA药品批准目录[9]、日本厚生省劳动局(PMDA)药品批准目录[10]、欧盟集中审批药品目录[11]、欧盟互认程序药品目录[12]、英国药品和保健品监管局(MHRA)药品批准目录[13]、德国联邦和医疗器械管理局(BfArM)药品批准目录[14]、法国药品和保健品安全署(ANSM)药品批准目录[15],查询抗菌复方制剂名称或单方活性成分,得到的相关抗菌复方制剂品种及上市时间,如表2。表2中列出了各国抗菌药物复方制剂首次获批时间及生产该复方制剂的企业数。
2.2 国内外抗菌药物复方制剂上市品种对比分析
国家食品药品监督管理局于2006年颁布《β-内酰胺酶抑制剂抗生素复方制剂指导原则》(后称《原则》),明确规定了对于首次将某抗菌药物与某酶抑制剂组成的新组方品种、已上市复方品种基础上增加新配比品种的评价标准,在一定程度上规范了我国复方制剂的研发。
根据表2中抗菌药物复方制剂的组成类别(将双抗菌药物和其他类药物归为“其他”),统计各国家各种类药物的数量如图1。
中、美、日、欧上市的复方制剂种类分别为45、14、11和24种,我国复方制剂种类及配比明显多于其他国家,是日本的4倍,多为已有复方制剂的不同配比、已上市β-内酰胺药物与β-内酰胺抑制剂的组合、两种抗菌药物的组合。其中,在美国和日本上市的复方制剂中,收录至EML的品种分别占35.7%(5种)、27.3%(3种),且除阿莫西林/克拉维酸以外的其他复方制剂只存在一种配比。在美国、日本和欧盟,含叶酸抑制剂类复方制剂仅上市1~2种,我国共上市12种。双抗菌药物类复方制剂仅在日本上市1种,我国上市3种。此外,欧盟由于由多个成员国组成,其复方制剂的配比呈现多样化的特点。在欧盟所上市的25种复方制剂中,阿莫西林/克拉维酸的配比占9种,但实际上还存在近似为9:2、7:2等不规则配比。由于这些配比不具代表意义且仅在某个成员国上市,笔者将这些种类归类至配比相近的主流配比进行了统计。
我国上市的45种复方制剂中,包括阿莫西林/克拉维酸、头孢哌酮/舒巴坦、哌拉西林/舒巴坦、阿莫西林/舒巴坦、哌拉西林/他唑巴坦、头孢哌酮/他唑巴坦、头孢他啶/他唑巴坦的多种配比。其中,阿莫西林/克拉维酸(AC)的配比多达9种。大量研究表明,不同配比的AC在体内代谢过程基本一致,无相互作用[16-20],其抗菌活性强度和克拉维酸的含量相关[21-22]。但有文献报道,克拉维酸在AC中的含量与肝毒性的发生率呈正相关,在AC(7:1)中不良反应发生率约为10/10000[23-24],且在10岁以下儿童中,3~10岁儿童群体不良反应发生率较高[25]。在FDA批准的14:1和16:1配比中,通过减少克拉维酸的方式,降低了不良反应的发生率,同时通过制成缓释制剂的方式缓解了释放剂量过高带来的隐患,并增加了儿科适应症。有试验表明[26]AC7:1和16:1临床疗效对比无劣效性。综上,从临床应用的角度分析,目前主流的7:1应为最佳配比,14:1、16:1的高剂量配比同样具有临床价值。同理对比头孢他啶/他唑巴坦2:1,3:1,5:1的3种配比。有实验表明,在对于不同配比(2:1, 4:1, 6:1, 8:1)的头孢他啶/他唑巴坦的体外抗菌活性比较中,2:1配比较其他配比具有明显优势,且2:1的配比长期应用毒性较小,且无停药后迟缓性毒性反应[27-28]。一项对于3:1和5:1配比的药敏试验结果显示3:1配比较5:1具有优势[29],即同质量下他唑巴坦比例高者杀菌效果明显,但由于缺乏2:1和3:1配比的毒性及抗菌活性比较,其最佳配比有待进一步验证。
美国抗菌药物发展较早,种类十分齐全,其中部分药物因安全性或有效性问题在步入21世纪前已宣布退市。美国、欧盟地区、日本发达国家对于复方制剂持有相对谨慎的态度。FDA特别规定[30]新开发的复方制剂应有以下特征:①以治疗严重疾病和症状为目的;②复方制剂与单方制剂相比应有明确的生物活性优势;③复方制剂的优势应当体现在该药能在临床上体现“协同”作用或延长作用时间,而非简单的单方组分“加和”效应;④复方制剂的安全性以及可能产生的副作用、单药生物活性的有限性等因素必须严格考虑。美国学者认为[31],在开复方药物处方之前,最重要的是考虑患者是否需要特定组合中的每种药物,或者使用单独一种成分是否足够。发达国家的政府监管机构正试图遏制复方药物的使用,复方制剂的研发变得更加严格。
2.3 抗菌药物复方制剂在相关目录收载情况对比
2.3.1 各目录中重合药品情况
表3种列出了各在《国家基本药品目录(2021版)》(NEML)、《WHO基本药品目錄(第22版)》(EML)、《WHO儿童基本药品目录(第8版)》(EMLc)中抗菌药物复方制剂的收录情况。
为应对多种临床状况NEML、EML、EMLc中包含了多种药物的不同配比。其中,重合的抗菌药物复方制剂品种有阿莫西林/克拉维酸、哌拉西林/他唑巴坦及磺胺甲恶唑/TMP。其中,NEML中收录的阿莫西林/克拉维酸的规格较EML及EMLc相比,剂量偏小,在使用上更加灵活。EML及EMLc中磺胺甲恶唑/TMP的收录情况相较于NEML,规格更多,下限更低。但并无文献报道磺胺甲恶唑/TMP 80 mg + 16 mg的不可替代性。NEML中收录的两种规格已足以应对多数临床应用场景,无需在此基础上增加规格。
2.3.2 各目录中独有药品情况
EML中收录的独有药品包括头孢他啶/阿维巴坦及美罗培南/法硼巴坦。头孢他啶/阿维巴坦已在我国上市。头孢他啶/阿维巴坦对大部分产丝氨酸酶对碳青霉烯类耐药的肠杆菌科细菌有较强抗菌活性,目前广泛用于碳青霉烯类耐药肠杆菌科细菌感染的治疗。头孢他啶/阿维巴坦与碳青霉烯类相比,用于治疗由革兰阴性菌引起的复杂性腹腔感染(cIAIs)、复杂性尿路感染(cUTIs)及医院获得性肺炎和呼吸机相关性肺炎(HAP/VAP)时,两者临床治愈率相当(P>0.05)。对于患有cUTIs的患者,头孢他啶/阿维巴坦具有更高的细菌清除率[RR=1.14, 95%CI(1.02~1.27), P=0.02]。表现出较好的有效性、安全性和经济性[32-33]。美罗培南/法硼巴坦于2017年被FDA批准用于治疗成人复杂性尿路感染及急性肾盂肾炎[34],其用于治疗CRE感染的Ⅲ期临床试验显示临床治愈率高、死亡率低以及肾毒性低等优点[35]。目前有关其临床研究已相对成熟,有望在我国上市。
3 对我国抗菌药物复方制剂思考与建议
结合上述对于各国抗菌药物复方制剂的分析,对我国抗菌药物复方制剂有以下几点思考与建议。
第一,国家食品药品监督管理局于2006年颁布《β-内酰胺酶抑制剂抗生素复方制剂指导原则》规定,对于已上市复方品种基础上增加新配比应有充分理由说明其的合理性,主要体现在:①必要性(新配比有特殊适应证范围、现配比不能完全满足临床需要等);②药效学优势性;③安全性;④临床试验需与老配比进行比较充分体现其优越性。对比其他发展国家的抗菌药物复方制剂上市情况,我国复方制剂上市种类偏多,以β-内酰胺/β-内酰胺酶抑制剂类为主。结合现有的相关资料可以得知部分复方制剂的最佳配比,例如:阿莫西林/克拉维酸(7:1)、头孢哌酮/他唑巴坦(4:1,8:1)等[36]。但对于其他复方制剂的合理性和必要性仍需作出进一步评价,规范药品种类和配比,对于应用价值低的药物进行删减,保证抗菌活性、安全性、耐药控制三者间的最佳平衡。
第二,2018年国务院办公厅发布《关于完善国家基本药物制度的意见》中提到对基本药物目录定期评估、动态调整。在下一版国家基本药物目录更新之际,建议对于新型复方制剂应加强综合评估,在保留现有品种的基础上,考虑国际认可、WHO目录收载的新型复方制剂。建议补充头孢他啶/阿维巴坦和美罗培南/法硼巴坦。此外,推进基本药物目录结构优化,减少无效和低端供给,扩大有效和中高端供给,提升供给体系对国内需求的适配性,实现低水平供需平衡向高水平供需平衡的跃升,以更好地服务于大众。
4 结语
前我国的抗菌药物复方制剂的种类和数量虽然位居前列,但其规范化仍有待进一步管理。例如:头孢曲松/舒巴坦、头孢噻肟/舒巴坦是否有必要制成复方制剂;双抗菌药物类复方制剂是否有必要保留;头孢哌酮/舒巴坦等多配比药物的最佳配比是否必要明确。上述问题有待进一步的文献计量学资料和药代动力学、药效动力学实验加以佐证。
参 考 文 献
Antimicrobial Resistance Collaborators. Global burden of bacterial antimicrobial resistance in 2019: A systematic analysis[J]. Lancet, 2022, 399(10325): 629-655.
World Health Organization. WHO publishes list of bacteria for which new antibiotics are urgently needed[EB/OL]. https://www.who.int/news/item/27-02-2017-who-publishes-list-of-bacteria-for-which-new-antibiotics-are-urgently-needed, (2017-02-27). [2022-05-01].
Zhao H, Wei L, Li H, et al. Appropriateness of antibiotic prescriptions in ambulatory care in China: A nationwide descriptive database study[J]. Lancet Infect Dis, 2021, 21(6): 847-857.
Hopwood D A, Chater K F. Fresh approaches to antibiotic production[J]. Philos Trans R Soc Lond B Biol Sci, 1980, 290(1040): 313-328.
冯志华. 复方药物的前世今生[EB/OL]. http://infect.dxy.cn/article/12065. [2022-06-01].
WHO. Guidelines for registration of fixed-dose combination medicinal products[EB/OL]. https://www.gmp-compliance.org/files/guidemgr/WHO_TRS_929_annex5.pdf. (2005-07-04). [2022-06-01].
厚生労働省醫薬食品局. 医薬品の承認申請について[EB/OL]. https://www.mhlw.go.jp/file/06-Seisakujouhou-11120000-Iyakushokuhinkyoku/0000092759.pdf. (2014-11-21). [2022-06-01].
国家药品监督管理局. 药品数据查询[EB/OL]. https://www.nmpa.gov.cn/datasearch/home-index.html?79QlcAyHig6m=1656898924058#category=yp, (2022). [2022-06-22].
FDA. Drug Approvals and Databases[EB/OL]. https://www.fda.gov/drugs/development-approval-process-drugs/drug-approvals-and-databases, (2022). [2022-06-20].
PMDA. 医薬品医疗机器総合机构[EB/OL]. https://www.pmda.go.jp/PmdaSearch/iyakuSearch/, (2022). [2022-06-22].
European Medicines Agency. Medicines Search[EB/OL]. https://www.ema.europa.eu/en, (2022).[2022-06-22].
Heads of Medicines Agencies. Human Medicines[EB/OL]. https://www.hma.eu/about-hma.html, (2022).[2022-06-22].
Medicines and Healthcare Products Regulatory Agency.Product information about medicines[EB/OL]. https://www.gov.uk/government/organisations/medicines-and-healthcare-products-regulatory-agency. [2022-06-22].
Bundesinstitut für Arzneimittel und Medizinprodukte. Arzneimittel[EB/OL]. https://www.bfarm.de/DE/Home/_node.html, (2022). [2022-06-22].
Agence nationale de sécurité du médicament et des produits de santé. Liste des médicaments[EB/OL]. https://ansm.sante.fr/, (2022). [2022-06-22].
王晨, 胡昌勤, 许明哲. 阿莫西林克拉维酸钾不同配比制剂中克拉维酸的生物利用度研究[J]. 中国新药杂志, 2019, 28(18): 2213-2216.
夏春华, 姜敏, 熊玉卿. 克拉维酸钾-阿莫西林的药动学参数与剂量间的线性关系研究[J]. 中国临床药理学与治疗学, 2002, 7(1): 54-56.
张娟红, 王荣, 谢华, 等. 阿莫西林与克拉维酸钾新配比(8:1)颗粒在中国健康志愿者体内的药代动力学研究[C]//.西北地区第六届色谱学术报告会甘肃省第十一届色谱年会论文集. 2010: 127-130.
黄英, 徐楠, 邹远高, 等. 阿莫西林克拉维酸钾(7:1)分散片人体生物等效性[J]. 中国临床药理学杂志, 2003, (4): 277-279.
苗佳, 南峰, 沈奇, 等. 注射用阿莫西林钠克拉维酸钾(10:1)临床药代动力学研究[J]. 四川大学学报(医学版), 2013, 44(2): 246-2450.
Center for Drug Evaluation and Research (CDER), Center for Biologics Evaluation and Research (CBER), Guidance for Industry: General Considerations for Pediatric Pharmacokinetic Studies for Drugs and Biological Products[EB/OL]. http://www.fda.gov/downloads/Drugs/GuidanceComplianceRegulatoryInformation/Guidances/ucm072114.pdf/. (2014-07-21). [2022-06-02].
Thomson C J, Miles R S, Amyes S G. Susceptibility testing with clavulanic acid: Fixed concentration versus fixed ratio[J]. Antimicrob Agents Chemother, 1995, 39(11): 2591-2592.
Gresser U. Amoxicillin-clavulanic acid therapy may be associated with severe side effects-review of the literature[J]. Eur J Med Res, 2001, 6(4): 139-149.
García Rodríguez L A, Ruigómez A, Jick H. A review of epidemiologic research on drug-induced acute liver injury using the general practice research data base in the United Kingdom[J]. Pharmacotherapy, 1997, 17(4): 721-728.
胡文琴, 邱力波. 药物不良反应582例报告分析[J]. 临床合理用药杂志, 2022, 15(11): 173-176.
Sethi S, Breton J, Wynne B. Efficacy and safety of pharmacokinetically enhanced amoxicillin-clavulanate at 2,000/125 milligrams twice daily for 5 days versus amoxicillin-clavulanate at 875/125 milligrams twice daily for 7 days in the treatment of acute exacerbations of chronic bronchitis[J]. Antimicrob Agents Chemother, 2005, 49(1): 153-160.
裴斐, 杜丽华, 王培兰, 等. 阿莫西林钠舒巴坦钠与其它4种抗菌药物的体外抗菌活性比较[J]. 解放军药学学报, 2002, 18(5): 283-287.
李佩琼, 曾祥周, 符健, 等. 注射用头孢他啶他唑巴坦钠(2:1)毒性实验研究[J]. 海南医学, 2003, 14(5): 63-65.
暴婧, 洪丽萍, 刘新民, 等. 注射用头孢他啶他唑巴坦钠(3:1)在呼吸及泌尿系统感染中的多中心随机对照临床试验[J]. 中国临床药理学杂志, 2021, 37(22): 3019-3023.
FDA. Guidance for industry nonclinical safety evaluation of drug combinations[S]. 2005-01-21.
Shenfield G M. Fixed combination drug therapy[J]. Drugs, 1982, 23(6): 462-480.
傅源源, 陈平钰, 房文通, 等. 头孢他啶阿维巴坦治疗革兰阴性菌感染的快速卫生技术评估[J]. 医药导报, 2021, 40(12): 1724-1731.
郭晓龙, 崔向丽, 李激扬. 头孢他啶/阿维巴坦与碳青霉烯类疗效和安全性比较[J]. 中国新药杂志, 2022, 31(7): 713-720.
FDA. Meropenem-vaborbactam, approval label[EB/OL]. https://www.accessdata.fda.gov/drugsatfda_docs/label/2017/209776lbl.pdf, (2017-08-29). [2022.06-22].
Wunderink R G, Giamarellos-Bourboulis E J, Rahav G, et al. Effect and safety of meropenem-vaborbactam versus best-available therapy in patients with carbapenem-resistant enterobacteriaceae infections: The TANGO II randomized clinical trial[J]. Infect Dis Ther, 2018, 7(4): 439-455.
李忠思, 張小娜, 张琳, 等. 注射用头孢哌酮/他唑巴坦的体外抗菌活性研究[J]. 中国药师, 2010, 13(4): 476-479.
