中药抑菌活性成分及其作用机制研究进展
2024-01-01蒋庆佳杨放杨安迪武英卢文婷雷诗懿吴小林
蒋庆佳 杨放 杨安迪 武英 卢文婷 雷诗懿 吴小林
摘要:由于抗生素的广泛使用,细菌耐药性问题日趋严重,常用抗生素的局限性不断显露。近年来研究表明中药有效成分具有一定的抑菌效果且不易产生耐药性的特点,在临床上广泛用于呼吸道、消化道等多种感染性疾病的治疗。但由于中药具有多成分、多靶点特点,其细菌作用特点机制可能并不单一,不同的药物抑菌作用也存在差异。本文对近年来中药抗菌的主要成分对其抑菌机制进行总结,同时对中药逆转耐药性机制讨论,为中药抗菌研究提供参考。
关键词:抑菌活性;抗生素;抑菌机制;耐药性;中药
中图分类号:R978.1 文献标志码: A
Research progress of bacteriostatic mechanism of traditional Chinese medicine based on chemical components
Jiang Qingjia1, Yang Fang2, Yang Andi3, Wu Ying4, Lu Wenting5, Lei Shiyi1, and Wu Xiaolin4
(1 Chengdu University School of Pharmacy, Chengdu 610106; 2 Chengdu Tianhe Chinese and Western Medicine Conservation Co., Ltd., Chengdu 610000; 3 College of Food and Bioengineering, Chengdu University, Chengdu 610106; 4 Chengdu University Journal Center, Chengdu 610106; 5 College of Pharmacy, Guangxi University of Traditional Chinese Medicine, Nanning 530200)
Abstract Due to the widespread use of antibiotics, the problem of bacterial drug resistance is becoming increasingly serious, and the limitations of commonly used antibiotics are constantly exposed. In recent years, studies have shown that the active ingredients of traditional Chinese medicine have certain bacteriostatic effect and are not easy to produce drug resistance. They are widely used in the treatment of respiratory tract, digestive tract and other infectious diseases in clinic. However, due to the multi-component and multi-target characteristics of traditional Chinese medicine, the mechanism of its bacterial action may not be single, and the bacteriostatic effect of different drugs may also be different. In this paper, the main components of traditional Chinese medicine in recent years and their antibacterial mechanisms were summarized, and the mechanism of reversal of drug resistance of traditional Chinese medicine was discussed to provide reference for the antibacterial research of traditional Chinese medicine.
Key words Bacteriostatic activity; Antibiotic; Bacteriostatic mechanism; Drug resistance; Traditional
Chinese medicine
1940年科学家成功提炼出青霉素结晶用于细菌感染性疾病治疗,由此开创了抗生素的“黄金年代”。近百年来,抗生素广泛应用于传染性疾病的治疗,还用于外科手术、器官移植等临床应用,救治了数以万计的生命,抗生素的发现也被称为20世纪人类有史以来最伟大的发明之一[1]。
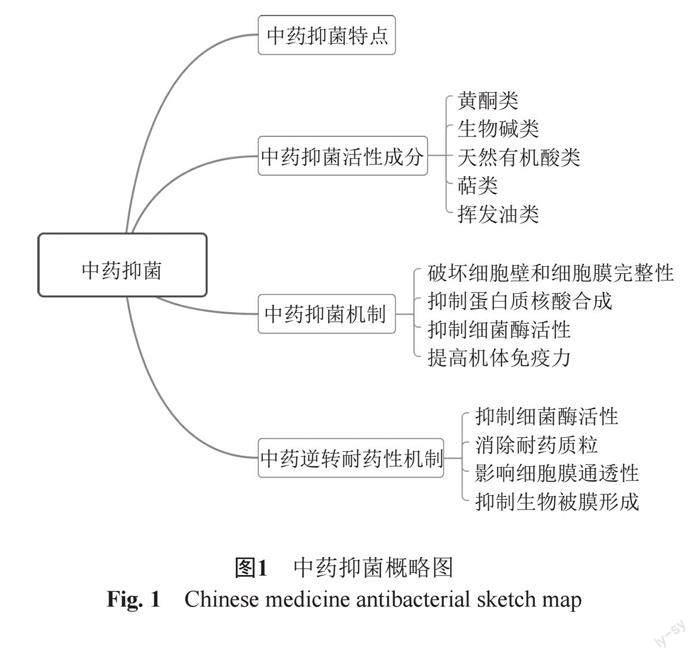
全球每年约有50%的抗生素被滥用、误用,导致病菌产生较强的耐药性,并随着病菌适应各种强效抗生素,超级细菌也相继产生。为避免细菌耐药性进一步威胁人民的健康生活,除加强对抗生素的合理应用,寻找更加安全有效的优质抗生素迫在眉睫。而现代研究表明,中草药有效活性成分具有一定的抑菌效果,且不易产生耐药性,甚至还存在逆转耐药菌的疗效[2],在临床及科学研究中得到越来越多的重视。单味中药的组分复杂多样,其主要活性成分可大致分为黄酮类、生物碱类、有机酸类、萜类和挥发油类等[3],都具有一定的抑菌活性,其抑菌活性不同,作用机制有异,图1。现代药理学认为药物主要从细胞壁合成、细胞膜通透性以及干扰核酸蛋白质合成等途径影响细菌的生長,本文就中药中有效成分对细菌的作用机制及其耐药性消除机制进行讨论,为日后研究提供参考。
1 中药抑菌特点
抗生素产生耐药性,其主要原因来自于其抑菌特点。抗生素常见的作用机理主要是[4]:①阻止糖肽交联, 抑制细菌细胞壁合成;②引起菌体合成异常的蛋白质, 改变细胞膜通透性;③阻止病菌DNA、RNA或者蛋白质的合成。另外抗生素作用机制包括4点:抑制细菌细胞壁的合成;使细菌细胞膜通透性改变;抑制或干扰细菌细胞蛋白质合成;抑制细菌核酸转录和复制。而在长期使用抗生素后,敏感菌株不能被杀灭,产生耐药性。细菌产生耐药性原因与抗生素抑菌机制相关,细菌能够产生水解酶或者钝化酶,改变抗生素结构,使其丧失抗菌活性,还可以降低细菌外膜通透性或者细菌细胞壁增厚,减少药物进入。除此之外,细菌在受到抗菌药物作用时能够增加主动外排系统或形成生物膜抵御抗生素对细菌的损害[5]。
由于中药组成是多成分,多靶点,多通路, 综合发挥协同的抗菌效应,体现出全方位抗菌效果的优势。赵妍等[6]研究中药提取物与单体药代动力学差异发现,中药中复杂的成分能够影响其有效成分在体内的药动学行为,增加口服利用度。姚姗姗等[7]借助网络药理学研究中药黄连抗菌机制,发现其发挥抗菌作用的活性成分多达11种,对应270个作用靶点涉及蛋白、酶、转录因子和受体等,并且对靶点进行KEGG通路分析发现黄连抗菌对应靶点不仅能够影响蛋白质合成,还可以间接抑制细菌核酸复制转录、影响酶的合成及外排泵的功能,促进细菌凋亡,提高机体免疫力等多条通路达到抗菌的目的,即中药多成分、多靶点、多通路和相互协同的抗菌作用特点。赵治伟等[8]临床上采用中药外洗辅助治疗,发现中药不但能够抑制伤口细菌生长,还能够促进肉芽组织生长、提高机体免疫力,其治疗率高达90%。
2 中药抑菌活性成分
大部分中药属于广谱抗菌药物,具有高质量的抑菌活性。中药成分繁多复杂,随着现代研究水平的深入,中药中的活性成分被不断提取分离,主要发挥抗菌作用的活性成分可大致分为黄酮类、生物碱类和有机酸类等。
2.1 黄酮类
黄酮类(图2)化合物是广泛存在于自然界的一大类由2个苯环通过3个碳原子连接而成的化合物。黄酮类化合物具有较好的生理活性,已经被用于治疗人类心血管疾病、抗炎、抗病毒、抗氧化、抗菌和抗肿瘤[9]。黄芩中的黄芩苷、黄芩素等丰富的黄酮类化合物具有较好的抑菌效果,临床上主要用于肺结核、细菌性痢疾病,还用于调节肠道菌群[10-11]。槐米中的黄酮类化合物芦丁对枯草芽胞杆菌、大肠埃希菌、金黄色葡萄球菌具有抑菌活性,且MIC值呈现高敏性[12]。此外,大豆苷、橙皮苷、槲皮素和葛根素等黄酮类化合物都具有一定的抑菌活性。
2.2 生物碱类
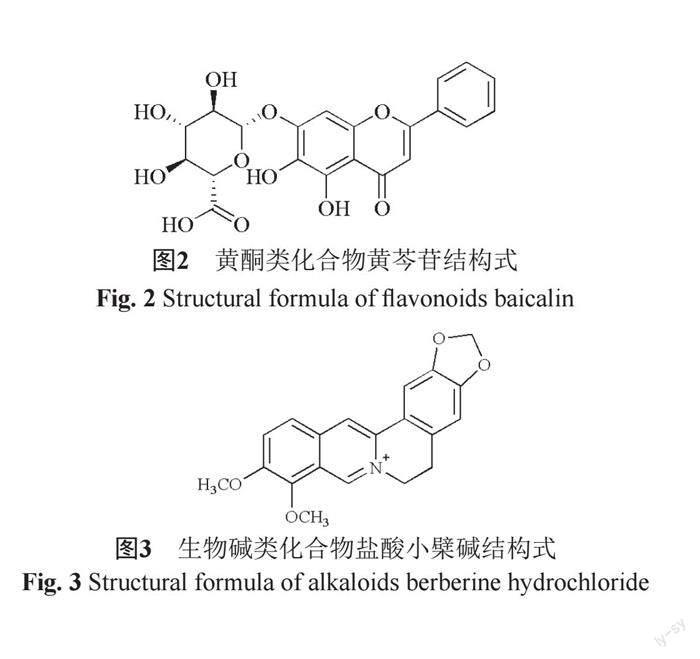
生物碱(图3)是一类含氮的有机化合物,是中药发挥药理作用的重要成分之一,镇痛、抗菌、止咳平喘、抗癌等作用均与药物中生物碱类物质有关[13]。根据其结构特点,可分为数多种类型,如异喹啉类、咪唑类、吲哚类等。现有研究表明,绝大多数生物碱具有抑菌活性,马爽等[14]研究显示有机胺类生物碱麻黄碱对大肠埃希菌、金黄色葡萄球菌都有较好的抑菌活性。生物碱中盐酸小檗碱对大肠埃希菌、金黄色葡萄球菌和枯草芽胞杆菌等多种细菌有较好的抑菌活性,临床上用于细菌性痢疾等细菌感染类疾病治疗[15]。苦参、防己、黄柏、麻黄、乌头和贝母等中药中的生物碱同样具有广泛的抑菌活性。
2.3 天然有机酸类
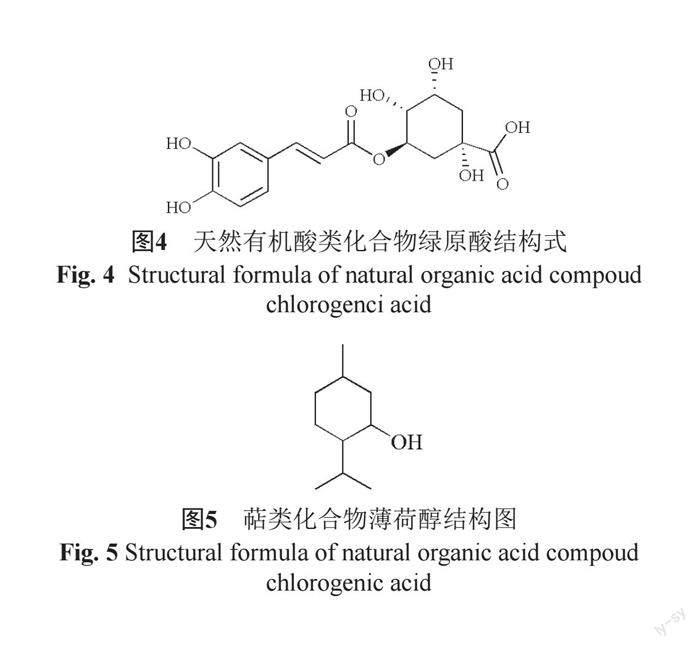
天然有机酸(图4)是从植物中提取分离得到的具有生理活性的一类化学物质,中草药中含有丰富的有机酸类物质,如柠檬酸、阿魏酸和绿原酸等。天然有机酸具有抗氧化、抗炎、抗菌和抗肿瘤的作用,并且天然有机酸还可控制血脂异常,治疗代谢性疾病[16]。研究表示,熊果酸、阿魏酸、延胡索酸、琥珀酸、甘草酸、没食子酸、奎尼酸、绿原酸和咖啡酸等多种有机酸具有广谱抗菌作用,且绿原酸在低于MIC浓度下仍然能够有效降低细菌毒性,利于机体免疫功能清除细菌[17]。
2.4 萜类
萜类(图5)物质是所有异戊二烯的聚合物以及它们衍生物的总称,广泛存在于高等植物中,是次生代谢物中种类最多的一类[18]。沈思等[19]研究表明,茯苓皮中的三萜类化合物对大肠埃希菌、金黄色葡萄球菌等多种细菌有较好抑菌活性。郭映雪等[20]确定核桃楸外果皮三萜类物质的最佳提取工艺,并确定该三萜类物质具有较强的抑菌活性。研究表明,益母草二萜类化合物能够显著抑制金黄色葡萄球菌,且其抑菌效果与青霉素相接近[21]。萜类物质中的二萜化合物,对金黄色葡萄球菌、大肠埃希菌、枯草芽胞杆菌、肺炎链球菌和芽胞杆菌等多种细菌具有较好的抑菌活性[22]。
2.5 挥发油类
中药挥发油又称精油,是一类随水蒸气蒸馏的挥发性油状液体总称,具有芳香、矫味、发汗、安神、抗焦虑和抗抑郁等药理活性[23],是芳香中药中的典型成分。罗勒和紫苏挥发油对多种霉菌具有良好的熏蒸抑制作用[24];丁香挥发油草果挥发油、鬼针草挥发油等对细菌也有显著的抑制作用。
3 抑菌作用机制
中药化学成分多样,都具有较好的抑菌活性,但其作用机制可能并不单一。明确中药发挥抗菌活性的作用机制,能够为临床治疗感染性疾病的用药提供更广阔的选择空间,更好地帮助临床用药。
3.1 破坏细菌细胞壁和细胞膜的完整性
中药中有效成分接触细菌后,能诱导菌体产生降解细胞壁和细胞膜的酶类,影响细菌渗透压,导致细菌内部电解质不断渗出, 引起菌体固缩、塌陷,甚至是死亡[25-26]。刘昊等[27]研究发现黄芩苷可以通过对大肠埃希菌细胞膜造成损伤而增加其通透性,使菌体物质大量外渗,进而实现其抗菌活性。潘旭迟等[28]研究发现柠檬花、茶树叶和留兰香叶挥发油具有较好的抑菌活性,并借助测定电导率与扫描电子显微镜观察法发现上述3种植物挥发油中有效成分柠檬烯、1,8-桉叶素和左旋香芹酮主要通过破坏细胞壁和细胞膜,使细胞膜通透性增加,引起胞内核酸与蛋白质泄漏,抑制细菌生长繁殖, 最终可以导致细菌细胞死亡。郭俸钰等[29]研究发现芳樟醇由于疏水作用,聚集在细胞膜上,造成细胞膜表面皱缩,引起细胞膜、细胞壁形成孔洞,导致小分子物泄漏,从而干扰细菌内部ATP生成系统的正常运行,破壞质子动力,抑制细胞功能特性,并且随着作用时间的延长,其破坏程度随药物浓度的增加而增加。
3.2 抑制蛋白质核酸合成
蛋白质和核酸是细菌结构的重要组成部分,与细胞生长繁殖密切相关。娄在祥等[30]对香豆酸和绿原酸的抑菌机制研究发现,香豆素与绿原酸可以结合到细菌DNA的链上以后,使其双螺旋结构变得松散,造成了细菌DNA构象的改变,从而改变了细菌的各种生理功能,最终导致细菌死亡。李兆亭等[31]采用iTRAQ法测定胡椒单萜类化合物与细菌接触后一段时间内蛋白质的变化,发现胡椒单帖化合物可使维持单增李斯特菌正常生命活动的ATP和蛋白质不能及时合成, 从而导致菌体衰亡,并且随着时间的增加,细菌体内差异蛋白质数量逐渐显著。云宝仪等[32]采用SDS-PAGE电泳法测定结果显示在一定时间范围内,可溶性蛋白总量随着黄芩素作用持续时间而减少,表明黄芩素可通过影响金黄色葡萄球菌菌体内的蛋白表达,发挥其抑菌作用。
3.3 抑制细菌酶活性
酶是一类重要的生物催化剂,主导着各种生命活动。DNA拓扑异构酶是核酸代谢的关键酶之一,参与DNA的复制、转录等过程。大部分化学物质通过影响DNA拓扑异构酶的活性进而影响细菌的生理活性。云宝仪等[32]通过紫外吸收光谱对黄芩素作用于金黄色葡萄球菌测定结果显示DNA拓扑异构酶的活性被受到抑制,并推断黄芩素作用机制可能是与阻止了DNA拓扑异构酶催化DNA断链的再连接,导致核酸合成受阻有关。汪叶菊等[33]通过琼脂糖凝胶电泳法研究秦皮素对DNA拓扑异构酶活性的影响,发现药物对拓扑异构酶Ⅰ和拓扑异构酶Ⅱ均具有明显的抑制作用。大豆异黄酮能明显抑制拓扑异构酶Ⅰ和拓扑异构酶Ⅱ介导的DNA解旋,且在大豆异黄酮浓度为6.4 mg/mL时,可完全抑制拓扑异构酶活性[34]。
研究表示,部分中药中有效成分还可作用于ATP相关酶类活性,通过影响细胞内能量代谢、氧代谢和糖代谢等生命活动,从而对菌体造成损伤,达到抑菌作用[35]。目前研究显示,绝大多数化学成分都是通过影响酶的活性,从而对细菌能量代谢产生影响。小檗碱通过上调与碳水化合物摄取有关酶系统,干扰细菌的能量代谢来抑制细菌生长,发挥抑菌作用[36]。有机酸化合物多呈弱酸性,Kpa较小,在细菌内部可水解出H+离子,改变细菌内部pH,从而使得细菌体内酶活性下降,生命活动受到抑制,同时迫使细菌主动释放氢离子,消耗部分ATP,减缓其生长速度[37]。
3.4 提高机体免疫力
免疫调节是体内免疫细胞与免疫分子之间,与其他各系统相互协同调节,使机体免疫应答处于稳定合适状态。当机体受到外来病菌感染时,会同时使得机体识别、清除外来抗原性异物的能力下降,损害机体免疫力。中药普遍具有抗病毒、抗肿瘤等多种功效,能够对体内的各种因素产生不同的免疫应答,对机体精确地完成免疫调节,维持体内环境相对稳定,从而产生保护作用,提高机体免疫力。同时,中药成分作用于细菌时,还可以减少毒性因子释放,更好地保护机体。
4 中药逆转耐药机制研究
中药具有良好的抑菌活性,并且难以产生耐药性。目前不断将中药与抗生素联合使用,不但可以达到更好的疗效,还可以避免细菌产生耐药性。
4.1 抑制细菌酶活性
细菌可产生β-内酰胺酶、氨基糖苷类钝化酶等水解酶或钝化酶,使抗生素中具有抑菌活性的成分无效。张娟等[38]对多种中药作用于产超广谱β-内酰胺酶大肠埃希菌耐药性消除研究显示,五倍子、乌梅和黄芩等多味对大肠埃希菌的耐药消除效果较好,且耐药性消除后,敏感性显著提高,具有稳定遗传特性。曹敏等[39]研究发现,芦荟大黄素、苦参碱、克拉维酸和木犀草素等7种中药化学成分对β-内酰胺酶有明显的抑制作用,其抑制效果随浓度的增加而增加。7种单体分别联合头孢他啶、头孢噻肟等5种常用抗菌药物联用时,能够抑制β-内酰胺酶活性,增加抗菌药物活性。
4.2 消除耐药质粒
细菌的耐药性主要是由耐药质粒上的耐药基因控制,消除耐药质粒,能够提高耐药菌对抗生素的敏感性[40]。汪東海等[41]采用碱裂解法检测黄芩苷作用后质粒消除率维持在37.5%,能够恢复菌株对庆大霉素和环丙沙星的敏感性。盐酸小檗碱、芦荟大黄素和姜黄素等多种中药对耐药质粒都具有消除的作用[42]。
利用外部途径对耐药质粒的消除是现阶段主要的控制途径。目前消除耐药质粒的方法较多,包括物理消质法、化学消质法等,但采用中药消除耐药质粒的方法安全性更高,能够用于人体,且可供选择的中药种类多,经济实惠[43]。
4.3 影响细胞膜通透性
现有研究表示,细菌产生耐药性后,细菌外膜通透性降低或是细胞壁增厚,从而减少抗菌药物的进入,降低细菌敏感性。张凯睿等[44]以AKP活性作为检测细胞壁完整性的指标,其实验结果显示地榆正丁醇部位提取物可破坏多重耐药大肠埃希菌的细胞壁,提高菌体细胞膜的通透性。匡秀华等[45]研究发现通过测定电导率发现,黄藤素能使细菌细胞壁变薄细胞膜通透性增大。
4.4 抑制耐药菌外排泵
外排泵是细菌细胞膜上的一类蛋白质,能够将抗菌药物泵出胞外,细菌存在着天然的外排系统,与耐药性形成密切相关。周帆等[46]研究表示黄连素可能通过下调外排泵基因的表达量抑制细菌多重耐药性。潘夕春等[47]研究发现青蒿琥酯能够抑制多药外排泵转运子AcrB的表达,减少药物外排,增加抗菌药物在细菌体内积聚。研究表明,黄芩苷能够结合大肠埃希菌多药转运蛋白AcrB抑制其外排活性,并且与其他外排抑制剂相比,黄芩苷具有天然价廉和来源广泛等优势,有望成为新的AcrB外排泵抑制剂,对于治疗耐药菌引起的疾病有着重大意义[48]。
4.5 抑制生物被膜形成
生物被膜是多细菌在生长过程中附着于固体表面而形成的特殊生物结构[49]。生物被膜能够阻止抗菌药物进入细菌体内,从而导致细菌产生耐药性。张凯等[50]研究表示,和厚朴酚能够影响生物被膜形成的相关基因表达量来抑制大肠埃希菌生物被膜的形成,且其不同浓度下对于生物被膜的影响途径不同。宫海燕等[51]研究表示长叶薄荷酮能够下调LuxS基因,从而影响耐药大肠埃希菌的生长与生物被膜的形成。解光艳等[52]利用i TRAQ技术测定结果显示1/2×MIC抑菌浓度黄芩苷通过对细菌蛋白表达产生影响来干预大肠埃希菌生物被膜的形成。黄芩苷和盐酸小檗碱等常见中药有效成分都能够通过下调相关基因从而阻止细菌产生生物被膜[53-54]。
5 讨论
20世纪抗生素的发现与应用使得人们在感染类疾病的治疗上取得了质的突破。而由于耐药菌株的出现,有效抑菌率不断下降,甚至衍生了超级细菌,加大了治疗难度。现代研究不断明确中药抗菌机制,并且其抗菌机制也并不单一,能够通过多成分、多靶点协同发挥抗菌作用。目前研究显示,中药主要通过影响细胞膜与细胞壁完整性、抑制核酸蛋白质合成、影响酶活性多种途径达到抑菌效果。相较于常用抗生素,中药有效成分具有广谱抗菌、高质量抑菌活性、难以出现耐药性,甚至可以逆转某些耐药现象等多项优势。中药活性成分在发挥抑菌活性的同时,还能够有效对细菌外排泵、耐药质粒等结构发挥作用,减少细菌耐药性,增强抑菌率。面对抗菌药物对耐药菌治疗难度增大,开发全新抑菌药物周期长的背景下,加强中药对耐药菌作用机制的研究,推动临床中药与抗生素联用,对于细菌感染性疾病的治疗具有重大意义。除此之外,现有研究多为体外抑菌,目前虽已有借助网络药理学搭建“疾病-基因-靶点”通路模型,来探求中药在机体内的作用机制和途径,但对于药物或者单体在消化道内抑菌活性强度是否发生变化等情况仍存在疑问,值得进一步地思考。
参 考 文 献
孙双勇, 王蒙蒙, 李丽, 等. 抗生素耐药与抗生素新药开发的研究进展[J]. 现代药物与临床, 2022, 37(2): 221-229.
李晏乐, 岳肖华, 孙卫东. 中草药抑菌作用的现代研究进展[J]. 中国中医基础医学杂志, 2018, 24(6): 860-862.
林真亭, 隋華秀, 王皇斌. 中药抗菌活性的研究进展[J]. 海峡药学, 2019, 31(10): 57-60.
谢春英. 抗生素的临床合理应用[J]. 广东微量元素科学, 2005, (6): 66-70.
杨玲, 王燕, 贾立敏, 等. 细菌对抗生素产生耐药性的研究进展[J]. 中国动物保健, 2018, 20(12): 13-14.
李煦颖, 赵妍, 王琳, 等. 葛根素及葛根提取物在大鼠体内药代动力学研究[J]. 中国生化药物杂志, 2009, 30(6): 383-386.
姚姗姗, 刘静茹, 陈静, 等. 基于网络药理学探究中药黄连抗菌作用机制[J]. 中国畜牧兽医, 2020, 47(5): 1593-1601.
赵治伟, 程春生, 马文龙, 等. 三黄汤外洗治疗围手术期小腿感染性骨皮缺损359例[J]. 陕西中医, 2010, 31(1): 62-63.
党剑, 赵民. 大蒜中黄酮类化合物的提取及抗疲劳活性研究[J]. 中国调味品, 2022, 47(8): 71-74.
庄丽, 马子风, 蒋雨薇, 等. 基于网络药理学的中药组方“芩部丹”治疗肺结核作用机制研究[J]. 中国防痨杂志, 2022, 44(3): 273-283.
Zhu L, Xu L Z, Zhao S, et al. Protective effect of baicalin on the regulation of Treg/Th17 balance, gut microbiota and short-chain fatty acids in rats with ulcerative colitis[J]. Appl Microbiol Biotechnol. 2020, 104(12): 5449-5460.
祖晓宁, 王金宏, 于宛鑫. 槐米中芦丁的提取及抑菌活性研究[J]. 哈尔滨商业大学学报(自然科学版), 2018, 34(6): 648-652.
李璐, 亓正良, 刘新利. 生物碱类中药成分微生物转化研究进展[J]. 齐鲁工业大学学报, 2022, 36(2): 6-12.
马爽, 白佳美, 谢春杰, 等. 麻黄草中麻黄碱的提取及其抑菌活性的研究[C]. 第十五届沈阳科学学术年会论文集(理工农医). 2018: 460-466.
杨慧, 刘晓凤, 刘钱, 等. Q-marker思路下的黄连花薹抗菌作用及机制研究[J]. 中国抗生素杂志, 2022, 47(6): 550-555.
王庆华, 杜婷婷, 张智慧, 等. 绿原酸的药理作用及机制研究进展[J]. 药学学报, 2020, 55(10): 2273-2280.
樊荣, 羿国娟, 鲁兰, 等. 绿原酸及其13种体内主要代谢物的体外抗菌作用研究[J]. 中草药, 2020, 51(24): 6239-6245.
张海朋, 刘翠华, 刘园, 等. 柑橘中挥发性萜类物质代谢研究进展[J]. 园艺学报, 2020, 47(8): 1610-1624.
沈思, 李孚杰, 梅光明, 等. 茯苓皮三萜类物质含量的测定及其抑菌活性的研究[J]. 食品科学, 2009, 30(1): 95-98.
郭映雪, 孙墨珑. 核桃楸外果皮三萜类物质的提取及抑菌活性[J]. 森林工程, 2020, 36(3): 37-43.
曹付威, 刘福林, 任莹莹, 等. 益母草二萜类化合物的提取工艺及其抑菌活性[J]. 山东第一医科大学(山东省医学科学院)学报, 2021, 42(10): 739-743.
韦春玲, 崔培梧, 肖瑾, 等. 具有抗菌活性的天然二萜类化合物研究进展[J]. 中成药, 2022, 44(7): 2240-2249.
白昀川, 马贝娜, 宋萍, 等. 中药挥发油固化方法及载体系统研究进展[J]. 中国中医药信息杂志, 2022, 29(7): 149-152.
智亚楠, 赵筱岑, 常卫格, 等. 罗勒和紫苏挥发油的化学组分及其抑菌活性分析[J]. 信阳农林学院学报, 2022, 32(2): 92-97.
周琦, 张宝善, 韦露莎, 等. 魔芋飞粉生物碱的抑菌活性及抑菌机理研究[J]. 西北农林科技大学学报(自然科学版), 2019, 47(3): 121-128.
李璐, 胡欢欢, 张华峰, 等. 淫羊藿生物碱对大肠杆菌的抑菌作用[J]. 陕西师范大学学报(自然科学版), 2016, 44(6): 74-79.
刘昊, 赵自冰, 王新. 黄芩苷对大肠埃希菌的抗菌活性及其作用机制[J]. 中国生物制品学杂志, 2019, 32(9): 983-986.
潘旭迟, 许剑锋, 傅昱晟, 等. 3种植物挥发油抑制食源性细菌生长活性成分及机理[J]. 食品科学, 2017, 38(13): 143-149.
郭俸钰, 陈文学, 陈海明, 等. 芳樟醇对大肠杆菌的抑菌作用机制[J]. 现代食品科技, 2020, 36(4): 113-118.
娄在祥. 牛蒡功能性成分及其抗氧化、抗菌活性研究[D]. 无锡, 江南大学, 2010.
李兆亭, 陈文学, 韩迎洁, 等. 胡椒单萜类化合物对单增李斯特菌抑菌机理的研究[J]. 食品工业科技, 2018, 39(23): 154-158.
云宝仪, 周磊, 谢鲲鹏, 等. 黄芩素抑菌活性及其机制的初步研究[J]. 药学学报, 2012, 47(12): 1587-1592.
汪业菊. 秦皮素对金黄色葡萄球菌的抑菌活性及其机制研究[D]. 沈阳: 辽宁师范大学, 2012.
王海涛. 大豆异黄酮的抑菌活性及其機制的研究[D]. 沈阳: 辽宁师范大学, 2009.
张译同, 郭锰, 董丽妍, 等. 香雪兰精油对金黄葡萄球菌的抑菌机制[J]. 香料香精化妆品, 2021, (5): 14-19.
李凡凡, 郑越超. 天然生物碱抗菌活性及机理研究[J]. 医学信息, 2021, 34(17): 49-52.
张军, 田子罡, 王建华, 等. 有机酸抑菌分子机理研究进展[J]. 畜牧兽医学报, 2011, 42(3): 323-328.
张娟. 中药对产超广谱β-内酰胺酶(ESBL)大肠杆菌耐药性消除效果[D]. 西北农林科技大学, 2021.
曹敏. 天然β-内酰胺酶抑制剂的筛选研究[D]. 贵阳: 贵州大学, 2016.
Rozwandowicz M, Brouwer M S M, Fischer J, et al. Plasmids carrying antimicrobial resistance genes in Enterobacteriaceae[J]. J Antimicrob Chemother. 2018, 73(5): 1121-1137.
汪东海, 陈敏, 姜志强, 等. 黄芩苷消除鲍曼不动杆菌耐药质粒的实验研究[J]. 中国现代应用药学, 2012, 29(5): 400-404.
陈璐, 邓翔文, 郑婷婷, 等. 4种中药单体对IncX4型质粒pSD11稳定性的影响[J]. 应用与环境生物学报, doi:10.19675/j.cnki.1006-687x.2021.10027
陈明清, 林昭春. 中药在消除R质粒中的应用[J]. 四川中医, 2008, (6): 41-42.
张凯睿, 刘增援, 王利利, 等. 地榆提取物对多重耐药大肠埃希氏菌的抑菌活性及机制研究[J]. 动物医学进展, 2021, 42(10): 61-65.
匡秀华, 李艳玲, 李向辉, 等. 黄藤素对动物源耐药沙门氏菌抑菌作用的初步研究[J]. 现代牧业, 2020, 4(2): 6-12.
周帆. 黄连素在幽门螺杆菌多重耐药与外排泵基因调控中的作用研究[D]. 上海, 上海中医药大学, 2019.
潘夕春, 周红. 青蒿琥酯抑制大肠埃希菌多药外排泵转运子AcrB的作用机制研究[C]. 中国药理通讯, 2013: 67.
赵子玉, 张鹏, 王春光, 等. 黄芩苷对大肠杆菌AcrB外排泵的抑制作用及其机制[J]. 中国兽医学报, doi: 10.16303/j.cnki.1005-4545.2022.09.21.
王同慧, 凌保东. 抗细菌生物被膜感染中药的研究进展[J]. 中药药理与临床, 2021, 37(1): 260-264.
张凯, 陈菲, 谷劲松, 等. 和厚朴酚对大肠埃希氏菌生物被膜形成的抑制机制[J]. 微生物学报, 2022, 62(7): 2521-2529.
宫海燕, 赵智龙, 熊文娟, 等. 长叶薄荷酮对耐药大肠埃希菌生物被膜及其调控基因LuxS的影响[J]. 中华中医药学刊, 2022, 40(3): 33-36.
解光艳, 段强军, 项红梅, 等. 黄芩苷对大肠杆菌生物被膜蛋白表达的干预作用[J]. 时珍国医国药, 2020, 31(8): 1858-1862.
Sun T, Li X D, Hong J, et al. Inhibitory effect of two traditional Chinese medicine monomers, berberine and matrine, on the quorum sensing system of antimicrobial-resistant Escherichia coli[J]. Front Microbiol. 2019, 13(10): 2584.
Peng L Y, Yuan M, Wu Z, et al. Anti-bacterial activity of baicalin against APEC through inhibition of quorum sensing and inflammatory responses[J]. Sci Rep, 2019, 9(1) : 1-11.
