山西地区15家医院抗菌药物使用及耐药的断面时点流行病学调查
2024-01-01杨书程张蕊李晓霞冀晓鹏郭茜段金菊
杨书程 张蕊 李晓霞 冀晓鹏 郭茜 段金菊
摘要:目的 调查并分析山西地区抗菌药物使用、耐药和院感情况,以期为细化抗菌药物管理和耐药控制制定相关干预策略提供依据。方法 调查对象为山西省11个地市共15家三级甲等综合医院,采用全球-断面时点流行病学调查(point prevalence survey, PPS)方法收集各医院患者抗菌药物使用、医院获得性感染(hospital acquired infection, HAI)和细菌分离及耐药情况,采用logistics多因素回归模型分析HAI的危险因素。结果 被调查的15家医院共6664名患者计入。抗菌药物使用率为30.06%,单一用药占比为67.20%,联合用药占比为32.80%,其中呼吸科抗菌药物使用率及联合用药占比最高,分别为72.97%和44.27%,均高于ICU的66.54%和40.22%。感染类型以社区感染(community acquired infection, CAI)为主,占91.59%;治疗CAI经验性用药的比例为89.96%,高于HAI的67.17%。肺炎或下呼吸道感染比率最高37.46%,其次是胃肠感染11.54%。调查当日,抗菌药物医嘱应用前3位分别为左氧氟沙星、头孢他啶和依替米星。1259例手术患者,手术类型以Ⅱ类切口最多占51.72%,第二代头孢菌素头孢呋辛钠为手術预防用药的主要药物;术后预防用药疗程大于1 d的比例为67.43%。发生医院获得性感染的多因素分析结果显示,疾病类型、入院前住院史、入住重症医学科为HAI的独立危险因素(P<0.05)。微生物种类前5位为革兰阴性菌,肠杆科细菌耐碳青霉烯类的比率为10%。结论 被调查各医院之间抗菌药物使用存在差别,整体呼吸系统抗菌药物使用率及联合用药率较高,手术预防用抗菌药物术后疗程偏长,需制定相应的管理措施进行干预。
关键词:PPS;抗菌药物使用;外科预防;抗菌药物管理;医院获得性感染
中图分类号:R978.1 文献标志码:A
Antimicrobial consumption and resistance in 15 hospitals inpatients in Shanxi province: Results of a point prevalence survey
Yang Shucheng1, Zhang Rui2, Li Xiaoxia3, Ji Xiaopeng4, Guo Qian3, and Duan Jinju3
(1 Department of Pharmacy, Taiyuan Peoples Hospital,Taiyuan 030001;2 School of Pharmacy, Shanxi Medical University,Taiyuan 030001;3 Department of Pharmacy, The Second Hospital of Shanxi Medical University,Taiyuan 030001;4 Medical Administration and Hospital Administration of Shanxi Provincial Health Commission,Taiyuan 030001)
Abstract Objective This research was conducted to investigate and analyze antimicrobial use, resistance and hospital-acquired infections in areas of Shanxi province, providing the basis for the development of interventions to refine antimicrobial management and resistance control. Methods A total of 15 grade A tertiary-level general hospitals in 11 cities of Shanxi province were surveyed. The use of antimicrobial, hospital-acquired infection (HAI), isolation of bacterial strain, and antimicrobial resistance of patients in each hospital were collected using the global-PPS (point prevalence survey) method. In addition, the risk factors of HAI were analyzed by multinomial logistic regression. Results A total of 6664 patients from the 15 hospitals in the province were investigated. The rate of antimicrobial use was 30.06% and 67.25% for a single drug. Among them, respiratory department had the highest rate of antimicrobial use and combination use with 72.97% and 44.27%, which were higher than 66.54% and 40.22% in the ICU. The main type of infection was community-acquired infection (CAI, 91.59%), and the proportion of empirical medication for CAI was 89.96%, which was higher than that for HAI (67.17%). The highest infection rate of pneumonia or lower respiratory tract was 37.46%, followed by gastrointestinal infections at 11.54%. On the day of the survey, the top three antimicrobial prescriptions were levofloxacin, ceftazidime, and etimicin. Type II was the
largest number of surgical incision for the 1259 patients who underwent surgery, accounting for 51.72%. Cefuroxime is the main drug for surgical prophylaxis. Moreover, the proportion of postoperative prophylactic medication courses more than 1 day was 67.43%. The results of multivariate analysis showed that disease type, history of hospitalization before admission, and admission to intensive care unit were independent risk factors for HAI. The top five were all G- bacteria in the isolated strains, and the rate of carbapenem resistance in Enterobacteriaceae was 10%. Conclusion There are differences in the use of antimicrobial among hospitals. The respiratory system has a high rate of antimicrobial use and combination use, and the postoperative course of antimicrobial for surgical prophylaxis is long, therefore, corresponding management measures should be developed for intervention.
Key words PPS; Antimicrobial drug use; Surgical prophylaxis; Antimicrobial management; Hospital-acquired infections
抗菌藥物管理是全国乃至全世界关注的热点,但是缺乏关于抗菌药物处方数量和质量的信息、数据是国际上成功制定和实施抗菌药物管理规划的一个关键障碍[1]。因此需要建立监测抗菌药物使用和耐药性的监测系统,以改进决策和评估干预措施的效果[2-3]。断面时点流行病学调查(point prevalence survey, PPS)是医疗卫生专业人员用来评估和改进地方、国家和全球抗菌药物使用数据的一个重要工具,它是在某一具体时间节点下,对特定区域开展调查的方法,简单可行,已在世界多个国家成功实施[4-5]。
因此,本研究采用PPS方法,对山西地区15家综合性三甲医院进行抗菌药物使用、耐药和院感情况调查。全面了解和分析各医院不同专业科室住院患者治疗用抗菌药物、外科手术预防用抗菌药物的使用情况以及细菌的流行病学特征及耐药性特点、院感发生的危险因素,为山西地区制定细化抗菌药物管理和耐药控制相关干预策略提供依据。
1 研究方法
1.1 研究对象
本研究共纳入山西15家综合性三甲医院,编号A~O。在2020年7月15日8:00各单位对所调查科室的所有住院患者开展信息收集。
本研究对纳入的医院开展至少500张床位调查(不足500张床位的医院全部纳入调查)。
调查科室纳入标准:
(1)外科系统(250张床位),必选科室为普外科(腹部外科必选)、泌尿外科、神经外科、妇科;备选科室(如果前述科室床位不足)为骨科、心胸外科等。
(2)内科系统(200~220张床位),必选科室为感染科、呼吸科、血液科、肿瘤科;备选科室(如果前述科室床位不足)为肾病科、内分泌科、神经内科、风湿科等。
(3)重症医学科(30~50张床位),至少保证30张床位,如果全院重症加强护理病房(intensive care unit, ICU)不足30张床位,则全部纳入。
调查对象:以所选定科室在该时间点的所有住院患者作为调查分母进行是否使用抗菌药物的筛选,以调查当时(2020年7月15日8:00)所有正在使用抗菌药物的患者、正在发生医院获得性感染但没有使用抗菌药物的患者以及在入院后到调查点前行外科手术的患者为具体的调查对象。
调查对象纳排标准:如果住院患者在调查期间有暂时性的离开病房、接受检查等,仍可纳入调查;未能在调查结束前回到病房且患者信息不全的住院患者,不纳入本研究。
1.2 研究指标
(1)患者基本信息:年龄、体重、性别、住院号、入院诊断、入院前住院史等。
(2)调查科室抗菌药物使用情况:纳入患者所使用抗菌药物的名称、用法用量、给药途径、感染诊断及用药指征。
(3)医院获得性感染风险评估:McCabe分数(非致死疾病、终致死疾病、迅速致死疾病、未知),侵入性装置类型及置入日期,入院后手术史及日期等。
(4)手术预防用抗菌药物的使用情况:手术类型及手术预防用抗菌药物的名称、用法用量、用药疗程。
(5)微生物检验结果:送检标本的类型、数量、科室,细菌分离结果,药敏结果。
1.3 数据收集、管理和统计分析
对纳入单位的工作人员(包括医生、护士、药师及护工)进行关于PPS调查表填写、数据收集和统计方面的相关培训。各医院收集的数据统一使用软件 Microsoft Office Excel汇总,然后交由本研究调查组进行数据审核、整理、统计分析。
采用SPSS 23.0进行统计分析。数据资料分析采用构成比、百分率等描述性分析。医院获得性感染的单因素分析中计数资料及等级资料均采用χ2检验,单因素分析有统计学意义(P<0.1)的则纳入多因素分析,多因素分析采用二元logistic回归模型。P<0.05为差异有统计学意义。
2 结果
2.1 调查对象人数
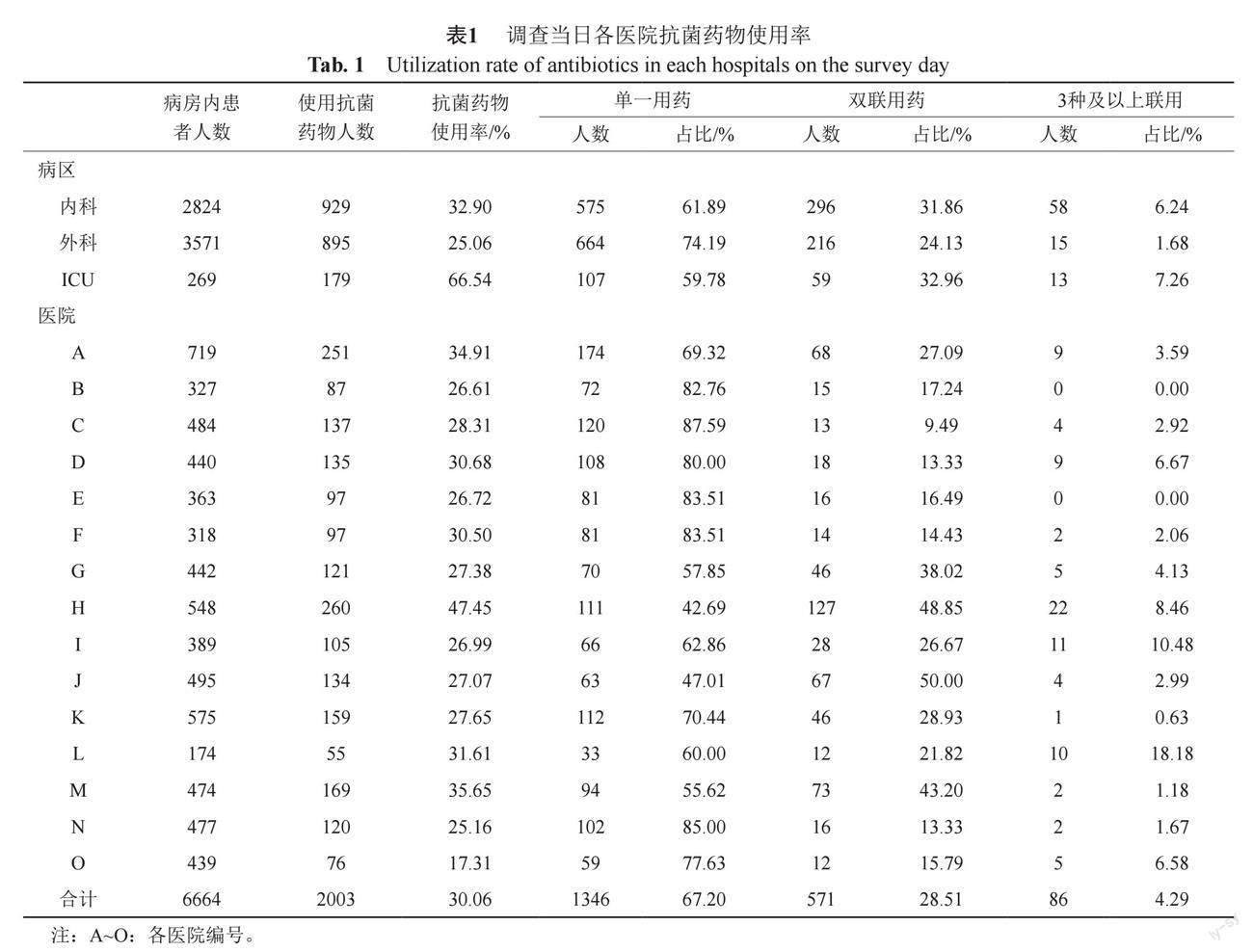
15家调查医院纳入科室的患者人数合计为6664人,其中内科病区有2824名患者(42.38%),外科病区患者人数为3571人(53.59%),ICU病区269名患者(4.03%)。11家医院纳入患者300~500人,3家医院纳入患者大于500人,1家医院174人参与调查(表1)。
符合方法中调查对象及其纳排标准的患者共有2894人,其中调查当时(2020年7月15日8:00)所有正在使用抗菌药物的患者人数为2003人,在入院后到调查点前行外科手术的患者人数为1259人。
2.2 调查当日抗菌药物使用情况
在调查当日,抗菌药物使用率为30.06%(2003/ 6664);ICU抗菌药物使用率(66.54%)要远高于内、外科(32.90%和25.06%);外科患者使用单一抗菌药物的占比相对更高,达到了74.19%;296个内科患者使用2种抗菌药物,双联用药的占比为31.86%,略低于ICU病区(32.96%);ICU病区3种及以上联合用药的占比为7.26%,略高于内科病区的6.24%,远高于外科(1.68%)(表1)。其中B、C、D、E、F和N等6家医院抗菌药物单药治疗的占比最高,均超过80%;H、J和M等3家医院的抗菌药物双联用药的占比最高,均超过40%;I和L等2家医院抗菌药物3种及以上的联合用药占比最高,均超过10%。
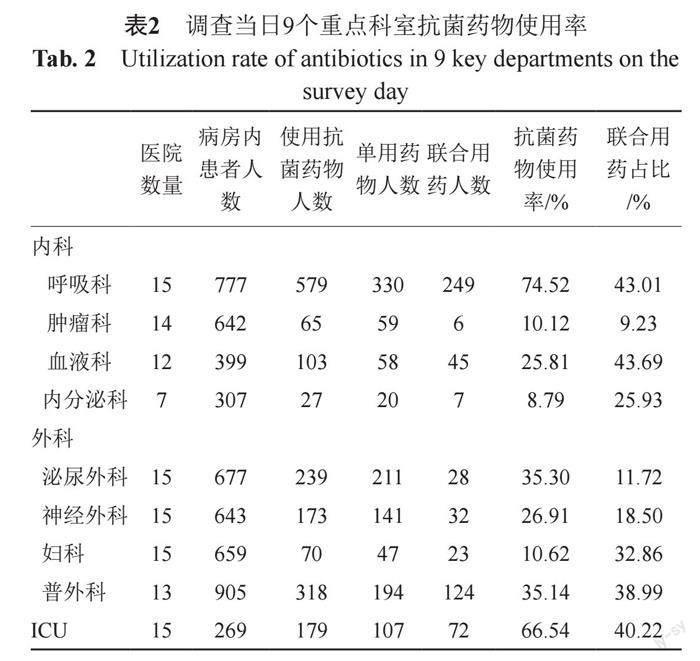
本研究纳入的内科科室包括呼吸科、血液科和神经内科等10个科室,外科科室包括普外科、泌尿外科和神经外科等7个科室,以及ICU。由于参与调查的医院中,各医院科室的组成并非完全相同,本研究选取了内科、外科各4个重點科室及ICU进行比对(表2)。内科病区,呼吸科抗菌药物使用率最高达74.52%,其次是血液科25.81%,且两个科室中联合用抗菌药物的比率显著高于其他科室;外科病区,泌尿外科和普外科较高,分别达35.30%和35.14%,普外科抗菌药物联合使用率最高,为38.99%。ICU的抗菌药物使用率为66.54%,联合使用率为40.22%。
调查当日,共有2782条医嘱与纳入患者的感染治疗有关,治疗CAI的医嘱数为2548条(占91.59%),治疗HAI的医嘱为234条(占8.41%);经验治疗的医嘱数量要远高于目标治疗(2322条 vs 460条),其中治疗CAI经验性用药的比例为89.96%,高于HAI的67.17%。
将调查当日使用抗菌药物的医嘱条目数按照感染诊断分别统计后排序,排在前10位的感染诊断(表3),肺炎或下呼吸道感染(1042,37.46%)的占比远高于其他的感染诊断,其次是胃肠感染(321,11.54%)、下尿路感染(182,6.54%)及急、慢性支气管炎病情加重(106,3.81%)。
对治疗明确感染诊断所开具的抗菌药物医嘱数共2782条(口服给药为101条,占3.63%),排在第一位的抗菌药物是左氧氟沙星注射剂(314,11.29%),其他依次是头孢他啶注射剂(239,8.59%),依替米星注射剂(160,5.75%)、哌拉西林/舒巴坦钠注射液(157,5.64%)、头孢哌酮钠/舒巴坦钠注射剂(157,5.64%)、哌拉西林钠/他唑巴坦钠注射剂(120,4.31%)、阿莫西林氟氯西林钠注射剂(104,3.74%)、美罗培南注射液(97,3.49%)、头孢西丁钠注射液(89,3.20%)、头孢哌酮/他唑巴坦注射剂(80,2.88%)。该日使用数量前十位的抗菌药物占总医嘱的半数以上(1665,59.85%)。
不同类型的感染所使用的抗菌药物也不相同,表4为本次调查中各类感染及其最常用的5种抗菌药物,头孢他啶、左氧氟沙星被广泛用于各种感染的治疗,其中肺部感染使用左氧氟沙星的医嘱居多,252例;血液系统、泌尿系统等感染更多地使用头孢他啶;中枢神经系统感染则更常用万古霉素进行治疗;胃肠感染除了头孢他啶,奥硝唑也是一种常用选择;依替米星则常用于治疗肺部、胃肠道以及泌尿系统的感染。
2.3 手术预防用抗菌药物的使用情况
在入院后到调查点前行外科手术的患者中,抗菌药物预防感染的手术患者共计839例,比率为66.64%(839/1259)。其中Ⅱ类切口手术占比最多,占51.72%(434/839),其次是Ⅰ类切口手术占34.45%(289/839)。围手术期预防用药大多数为单药治疗(706,84.15%),少部分为联合用药(133,15.85%)。表5分别列出了Ⅰ类、Ⅱ类切口手术以及不区分切口类型的所有手术最常预防用的5种抗菌药物。结果显示第二代头孢菌素头孢呋辛钠使用最广泛。
手术预防用抗菌药物疗程分布情况见图1,手术预防用抗菌药物疗程大于1 d的例数为677例,占67.43%。
2.4 医院获得性感染的危险因素分析
在调查当日,发生HAI的患者有212例,本研究对发生HAI的危险因素进行分析。本次共纳入11个因素(表6)。单因素分析结果显示,疾病类型、入院前住院史、有中央血管插管、留置导尿管、有呼吸插管、有机械通气和入住重症医学科为HAI的危险因素(P<0.1)。
将上述单因素分析中有意义的变量纳入logistic回归多因素分析,结果如表7所示,疾病类型、入院前住院史、入住重症医学科为HAI的独立危险因素(P<0.05)。
2.5 微生物送检标本及药物敏感性检出结果
本研究收集了15家医院调查当日所有使用抗菌药物的患者送检的微生物标本,并对检出情况进行了统计。纳入调查的送检标本共计739份,其中大部分为痰标本,387例,占所有标本的52.37%,其次是尿标本(136,18.40%),血标本排第三位(116,15.70%),其余各类型的标本数均小于20例。
送检标本的科室组成见表8,重症医学科(188,25.44%)、呼吸科(169,22.87%)和血液内科(90,12.18%)的送检标本较多。
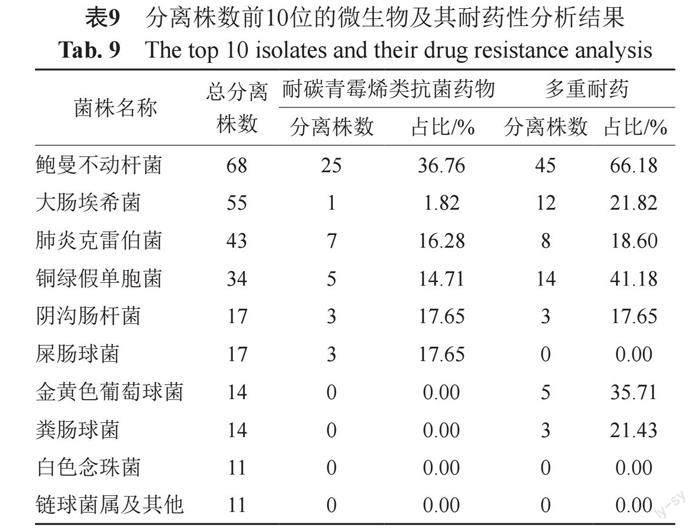
微生物分离株数前10位的微生物及其耐药性分析结果如表9。其中鲍曼不动杆菌耐碳青霉烯类抗菌药物的比例为36.76%,耐碳青霉烯类大肠杆菌、肺炎克雷伯菌及阴沟肠杆菌分离菌株共11株,其耐碳青霉烯肠杆菌(carbapenem-resistant enterobacteriaceae,CRE)分离率近10%。鲍曼不动杆菌、铜绿假单胞菌及金黄色葡萄球菌分离出的多药耐药菌株的分离率较高,分别为66.18%、41.18%和35.71%。
3 讨论
本次PPS调查在全省范围内进行,研究纳入了15家综合医院,分布于全省11个地市。因此,此次调查的结果可以反映全省抗菌药物的使用情况,并且调查遵循统一Global-PPS规则,即内科和外科都有必选科室,调查时间点一致,调查项目一致,所有结果每家医院有一定的可比性。
15家医院总体抗菌药物使用率为30.06%(其中13家医院分布在25%~35%之间,1家医院高达到47.45%,1家医院使用率最低为17.31%)。与一项纳入了全球53个国家(包括欧洲、亚洲、美洲和非洲)303家医院的研究结果相比,相似于欧洲某些国家的抗菌药物使用率(27.4%~39.0%),低于美洲、亚洲、非洲某些国家的抗菌药物使用率(分别为38.6%、37.2%~43.8%、50.0%)[5]。也明显低于印度一项调查的57.4%[6]。
15家医院抗菌药物联合率总体较低,为32.8%,但其中有4家医院超过40%(分别为42.15%、44.38%、52.99%和57.31%)。先前巴西、法国、新加坡的研究显示联合用药率分别为43.2%、40.6%和22.2%[7-9]。另外,呼吸系統用药抗菌药物使用率较高74.52%,联合用药率43.01%,高于重症ICU的66.54%和40.22%,也存在一些不必要联合情况。例如,呼吸系统特别是上呼吸道疾病如病毒感染或一些哮喘疾病等一些非细菌感染性疾病存在不该用而用抗菌药物的情况,即使是感染性疾病也提示存在广覆盖的问题。在调查当日13家医院至少使用了3种及以上抗菌药物,使用3种及以上抗菌药物的科室主要集中在妇产科、普通外科,这些科室感染性疾病在没有取得微生物证据前,阴性菌、阳性菌(特别是肠球菌)及厌氧菌都不能排除,因此为了同时覆盖这些菌使用了三联及以上抗菌药物,结果体现了不合理使用的情况,首先没有考虑主要病原菌,特别是对于一些非重症感染,这样广覆盖不符合《2015版抗菌药物指导原则》[10];其次,很多抗菌药物都兼有抗厌氧菌的作用,再联合硝基咪唑类存在重复用药情况。
在本研究中,社区获得性感染的经验用药率均特别高,总体为91.59%。这与欧洲和美洲等国家的结果相似[11-12]。造成这种结果的原因一方面可能是微生物的有效培养率低[11,13](如:标本送检率低、送检标本不合格等)。另一方面可能是患者病情较重,需要先经验性治疗控制感染症状待细菌培养及药敏结果回报后再进行适当调整。
本研究中左氧氟沙星是最常用的抗菌药物,而欧洲国家常用的抗菌药物为哌拉西林/舒巴坦[5]。在一项涉及中国湖南省和一项涉及巴基斯坦[14-15]的研究中显示,被调查地区最常用的抗菌药物是头孢曲松。造成这种被调查医院之间抗菌药物使用模式的差异可能与区域细菌耐药性程度、指南实施水平、经验治疗程度、处方习惯的多样性以及抗菌药物引进品种有关。
对于手术预防用药,研究显示I、Ⅱ类手术切口预防用药的品种基本符合原则,但疗程大于1 d的比例高,达到67.43%。这与其他国家的研究发现类似[16],但是这与现在正在施行的指南要求不符。有研究表明大多数的手术类型,使用抗菌药物大于24 h并不比使用小于24 h感染的发生率更低,反而会增加不良反应的发生风险[17]。并且多项研究表明抗菌药物的暴露是增加多重耐药菌出现的危险因素[18-19],这样长疗程的用药方案无疑也是会增加调查医院多重耐药菌的出现。因此在没有术前发生感染或有严重并发症的情况下,延长预防用抗菌药的时间是不必要的,这将作为下一步全省抗菌药物管理内容之一。
在对发生院感的危险因素进行分析时发现,患者是否从下级医院和别的医院转入院的、出院小于6个月内再入院以及入住重症医学科,是发生院内感染的独立危险因素,因此对于这些情况入院的患者,严格的院内感控和必要隔离是非常重要的。同时,疾病的严重程度特别是致死性疾病也是院内感染的危险因素,这类患者往往涉及多脏器功能损害甚至衰竭,低蛋白等免疫功能低下,这些无疑会增加院内感染的机会。当然,各医院的危险因素也有不一致的情况。
微生物送检标本及药物敏感性检出结果显示送检的微生物标本大部分为痰标本,无菌体液的送检率较低,如中枢神经系统感染的病例为41例,脑脊液的标本仅有15份,提示需要进一步对无菌体液的送检及临床意义进行宣教或管理。分离菌株中耐碳青霉烯类比率较高,鲍曼不动杆菌达36.76%,铜绿假单胞菌为14.71%,耐碳青霉烯类肠杆菌(CRE)包括大肠埃希菌、肺炎克雷伯菌和阴沟肠杆菌,共11株,分离率为10%,这些细菌的出现增加了临床治疗的难度,也是增加联合用药的一个原因。
综上,本研究采用PPS方法从抗菌药物使用的数量和质量、医院获得性感染发生情况、微生物分离及耐药现状着手,全面了解和分析全省15家三级不同地市、不同医疗机构、不同专业科室住院患者抗菌药物的使用情况以及医院获得性感染细菌的流行病学特征及耐药性特点,每家医院AMS团队可以根据本院调查结果中暴露的问题进行精细化管理,耐药控制,并制定相关干预策略。对于全省来说调查结果给卫生行政部门制定针对性的管理方案提供了依据,通过暴露普遍问题和严重问题,可以制定针对性的管理策略,有了开展重点工作的切入点,大大增加全省合理使用抗菌药物的水平。
倫理声明:该调查得到了各参与单位伦理委员会的支持。
参 考 文 献
MacDougall C, Polk R E. Antimicrobial stewardship programs in health care systems[J]. Clin Microbiol Rev. 2005, 18(4): 638-656.
Harbarth S, Balkhy H H, iGoossens H, et al. Antimicrobial resistance: One world, one ?got![J] Antimicrobi Resist Infect Control. 2015, 4: 49-64.
WHO. Global antimicrobial resistance surveillance system (GLASS) report: Early implementation 2016-2017[E/OL]. http://apps.who.int/iris/bitstream/10665/259744/1/9789241513449-eng.pdf?ua=1 (accessed Feb 7, 2018).
Raka L, Spahija G, Gashi-Gecaj A, et al. Point prevalence survey of healthcare-associated infections and antimicrobial use in Kosovo hospitals[J]. Infect Dis Rep. 2019,11(1): 7975.
Versporten A, Zarb P, Caniaux I, et al. Antimicrobial consumption and resistance in adult hospital inpatients in 53 countries: Results of an internet-based global point prevalence survey[J]. Lancet Glob Health, 2018, 6(6): e619-e629.
Singh S K, Sengupta S, Antony R, et al. Variations in antibiotic use across India: Multi-centre study through Global Point Prevalence survey[J]. J Hosp Infect, 2019, 103(3): 280-283.
Porto A P M, Goossens H, Versporten A, et al. Global point prevalence survey of antimicrobial consumption in Brazilian hospitals[J]. J Hosp Infect, 2020, 104(2): 165-171.
Robert J, Péan Y, Varon E, et al. Point prevalence survey of antibiotic use in French hospitals in 2009[J]. J Antimicrob Chemother. 2012, 67(4): 1020-1026.
Cai Y, Venkatachalam I, Tee N W, et al. Prevalence of healthcare-associated infections and antimicrobial use among adult inpatients in Singapore acute-care hospitals: Results from the first national point prevalence survey[J]. Clin Infect Dis, 2017, 64(suppl_2): S61-S67.
国家卫生计生委办公室, 国家中医药管理局办公室, 总后卫生部药品器材局. 关于印发《抗菌药物临床应用指导原则(2015年版)》的通知[S]. 国卫办医发[2015]43号.
Labi A K, Obeng-Nkrumah N, Sunkwa-Mills G, et al. Antibiotic prescribing in paediatric inpatients in Ghana: A multi-centre point prevalence survey[J]. BMC Pediatr, 2018, 18(1): 391.
Chukwuma D U, Ugochukwu C M, Cosmas K O, et al. Point prevalence survey of antimicrobial prescription in a tertiary hospital in South East Nigeria: A call for improved antibiotic stewardship[J]. J Glob Antimicrob Resist. 2019, 17: 291-295.
吴浩, 房华, 汪瑞忠, 等. 抗菌药物管理协作干预改进抗菌药物使用前微生物标本送检[J]. 诊断学理论与实践, 2019, 18(1): 93-97.
Ren N, Zhou P, Wen X, et al. Point prevalence survey of antimicrobial use in Chinese hospitals in 2012[J]. Am J Infect Control, 2016, 44(3): 332-339.
Singh S K, Sengupta S, Antony R, et al. Variations in antibiotic use across India: Multi-centre study through Global Point Prevalence survey[J]. J Hosp Infect, 2019, 103(3): 280-283.
Schuts E C, Hulscher M E J L, Mouton J W, et al. Current evidence on hospital antimicrobial stewardship objectives: A systematic review and meta-analysis[J]. Lancet Infect Dis, 2016, 16(7): 847-856.
Hagel S, Scheuerlein H. Perioperative antibiotic prophylaxis and antimicrobial therapy of intra-abdominal infections[J]. Viszeralmedizin, 2014, 30(5): 310-316.
邵华, 李春玲, 李栋. 医院多药耐药菌感染影响因素分析[J]. 中华医院感染学杂志, 2017, 27(8): 1702-1705.
赵晓青, 肖伟霞, 于双月. 呼吸机相关性肺炎与多药耐药菌感染临床研究[J]. 中华医院感染学杂志, 2018, 28(24): 3751-3754.
