脾胃培源方含药血清对鹅去氧胆酸诱导胃上皮细胞肠化生的影响
2023-12-22魏思源郝文哲郑艳敏李学军
裴 蓓,魏思源,张 艺,郝文哲,郑艳敏,李学军
(1. 安徽中医药大学研究生院,安徽 合肥 230000;2. 安徽中医药大学第二附属医院,安徽 合肥 230000;3. 中国科学院合肥物质科学研究院,安徽 合肥 230000)
慢性萎缩性胃炎(chronic atrophic gastritis,CAG)是临床较为常见的一种消化系统疾病,在我国发病率较高,以胃黏膜固有腺体萎缩为基本病理特点,中-重度CAG有一定的癌变率[1]。在其基础上伴发的肠上皮化生和(或)异型增生,被称为癌前病变,是胃黏膜从正常向胃癌发展过程中的一个重要阶段[2]。胃癌是一种分子和表型高度异质性的疾病,是第三大常见癌症死亡原因[3]。尽管在过去一个世纪中胃癌的全球发病率有所下降,但它仍然是威胁人类健康的主要杀手[4]。根据Correa级联学说,肠型胃腺癌是胃黏膜逐步从萎缩、肠上皮化生、异型增生发展而来的[5-6],而胃黏膜肠上皮化生与肠型胃癌的发生发展密切相关[7]。因此针对CAG进行及时有效的干预,是预防胃癌发生、发展的重要举措。目前西医对于肠上皮化生尚无有效的治疗方法,而中医药治疗有着独特的自身优势。中医认为,正气不足是疾病发生的内在因素。肠上皮化生者多素体脾虚,或因感邪损伤脾胃,卫外之力不足,邪气易侵入体内,而正气不足,无力鼓邪外出,进一步导致脾气虚衰。李学军教授基于脾胃虚弱的病机特点,结合自身的临床实践自拟脾胃培源方治疗CAG。前期研究表明,脾胃培源方治疗胃癌前病变及胃癌疗效确切,可抑制细胞增殖,促进细胞凋亡[8-10],但其对胃黏膜肠上皮化生是否有影响及其机制尚不明确。基于此,本研究以鹅去氧胆酸诱导人胃上皮细胞(GES-1)肠上皮化生,探讨了脾胃培源方含药血清对肠上皮化生标志物的影响及其可能作用机制。
1 实验材料与方法
1.1细胞株与动物 人GES-1购于河北北纳生物科技有限公司(BNCC337969)。SPF级成年雄性SD大鼠28只,体重180~220 g,购自安徽省实验动物中心,动物合格证号:SCXK(辽)2020-0001。大鼠饲养于安徽中医药大学实验动物中心,室温为22~25 ℃,相对湿度45%~60%。动物实验经安徽中医药大学伦理委员会批准(AHUCM-rats-2021012)。
1.2实验药物 脾胃培源方(白术20 g、炙黄芪18 g、石斛15 g、白芍10 g、香附10 g、刘寄奴6 g)购自安徽中医药大学第二附属医院中草药房。
1.3试剂与仪器 鹅去氧胆酸购自北京索莱宝科技有限公司;CDX1、MUC2购自HUABIO公司;CDX2购自Affinity公司;白细胞介素-6(IL-6)ELISA KIT(Human) 、白细胞介素-8(IL-8) ELISA KIT(Human)、肿瘤坏死因子-α(TNF-α)ELISA KIT(Human)、丙二醛(MDA) ELISA KIT(Human)、超氧化物歧化酶(SOD) ELISA KIT(Human)购自RUIXIN Biotech公司。酶标仪(RT6100)、全自动PCR 仪(Bio-Rad)、超微量分光光度计(南京五义科技有限公司)、电泳仪(上海天能科技有限公司)、电泳槽(上海天能科技有限公司)、转膜仪(上海天能科技有限公司)、ChemiDoc成像仪(Bio-Rad)。
1.4实验方法
1.4.1细胞培养 常规培养GES-1细胞,加入胰酶消化,培养基重悬,使细胞密度为1×105;将细胞悬液轻轻混匀,按2×103个/孔接种在96孔板中,每组设置5个复孔,且设置空白对照组,边缘孔用无菌PBS填充;将接种好的细胞培养板放入5%CO2、37 ℃培养箱中孵育过夜。
1.4.2脾胃培源方水煎剂的制备 将白术、炙黄芪、石斛、香附、白芍、刘寄奴6味药煎煮2次,过滤取出药液,将所得药液混匀合并并浓缩成50 mL,得生药量为1.4 g/mL,置于4 ℃冰箱保存待用。
1.4.3脾胃培源方含药血清的制备 将大鼠随机分为空白对照组及脾胃培源方高、中、低剂量组。每组7只。依据人和大鼠等效药量换算方法,脾胃培源方高、中、低剂量组分别灌胃23.2 g/kg、11.6 g/kg、5.8 g/kg的脾胃培源方浓缩液,空白对照组灌胃等量生理盐水,均2次/d,,连续灌胃7d。末次灌胃1 h后,腹主动脉取血,离心,收集血清,放入56 ℃恒温水浴箱30 min对血清进行灭活后,置于-80 ℃冻存备用。
1.5检测指标及方法
1.5.1鹅去氧胆酸、脾胃培源方对GES-1细胞活性的影响 ①将GES-1接种于96孔板中,待细胞贴壁生长24 h后,加入不同浓度的鹅去氧胆酸(0,20,50,100,150,200 μmol/L)及不同浓度的脾胃培源方含药血清(0,2.5%,5%,10%,20%,30%,40%)各100 μL/孔,分别处理细胞24 h、48 h、72 h后,每孔加入CCK-8试剂10 μL,放入细胞培养箱继续培养1 h,用酶标仪在450 nm处检测各孔的吸光值。重复实验3次,取平均值。②实验分为5组,空白对照组加入正常血清培养,鹅去氧胆酸组加入100 μmol/L的鹅去氧胆酸培养,鹅去氧胆酸+5%脾胃培源方含药血清组、鹅去氧胆酸+10%脾胃培源方含药血清组、鹅去氧胆酸+20%脾胃培源方含药血清组先加入100 μmol/L的鹅去氧胆酸干预48 h后,再分别加入相应浓度的脾胃培源方含药血清再次培养24 h。每孔加入CCK-8试剂10 μL,放入细胞培养箱继续培养1 h,用酶标仪在450 nm处检测各孔的吸光值。重复实验3次,取平均值。
1.5.2细胞中炎症因子及氧化应激相关标志物水平 将GES-1细胞接种于6孔板中,待细胞生长至合适密度后分为4组,空白对照组加入正常血清培养,20%脾胃培源方含药血清组加入20%脾胃培源方含药血清培养,鹅去氧胆酸组加入100 μmol/L的鹅去氧胆酸培养,鹅去氧胆酸+20%脾胃培源方含药血清组先加入100μmol/L的鹅去氧胆酸干预48 h,再加入20%脾胃培源方含药血清培养24 h后,收集各组细胞上清液,置于EP管中,在8 000 r/min条件下离心10 min,收集各组上清液后,根据制造商说明,使用相应试剂盒检测IL-6、IL-8、TNF-α、MDA、SOD水平。
1.5.3细胞中CDX1、CDX2、MUC2蛋白表达情况将GES-1细胞接种于6孔板中,待细胞生长至合适密度后分为5组,空白对照组加入正常血清培养,鹅去氧胆酸组加入100 μmol/L的鹅去氧胆酸培养,鹅去氧胆酸+5%脾胃培源方含药血清组、鹅去氧胆酸+10%脾胃培源方含药血清组、鹅去氧胆酸+20%脾胃培源方含药血清组先加入100 μmol/L的鹅去氧胆酸干预48 h,再加入不同浓度脾胃培源方含药血清培养24 h后,将6孔板置于冰上,去除细胞培养基,使用提前预冷的无菌PBS清洗细胞2遍,每次5 min。去除PBS,加入RIPA裂解液充分裂解细胞。裂解完成后,收集各组细胞样本,置于EP管中,在4 ℃、14 000 r/min条件下离心20 min,收集上清液样本于EP管中,每管加入适量Loading buffer,在100 ℃条件下金属浴10 min以备后续实验。将各组细胞蛋白样本依次加入提前配置完成的SDS-PAGE中,在100 V恒压条件下进行电泳。电泳完成后,配置转膜“三明治”,在350 mA恒流条件下转膜25 min。转膜完成后,将PVDF膜置于5%脱脂牛奶中,常温封闭2 h。封闭完成后,使用TBST洗膜3遍,每次5 min,再配置目的蛋白对应I抗溶液,4 ℃孵育过夜。I抗孵育完成后,使用TBST洗膜3遍,每次5 min,再配置目的蛋白对应种属的II抗溶液,常温孵育2 h。最后使用ECL显影液,在凝胶图像处理系统中对目的蛋白条带进行可视化分析。本实验以GAPDH为内参蛋白,使用Image J软件对目的蛋白CDX1、CDX2、MUC2的条带进行定量分析。
1.5.4细胞中CDX1、CDX2、MUC2 mRNA表达情况 实验分组及培养同1.5.3。去除细胞培养基后,使用总RNA提取试剂盒,提取细胞总RNA。经过裂解、离心、提取等工序后,获得各组细胞RNA样本,使用紫外分光光度计对RNA样本进行浓度测定。使用反转录试剂盒,通过PCR仪获得各组细胞cDNA样本。另取提前设计完成的目的基因引物与cDNA样本配置反应体系,使用PCR仪,经预变性、变性、退火、延伸过程,获得各目的基因的Ct值,使用2-ΔΔCT方法计算各目的基因的相对表达量。引物序列见表1。
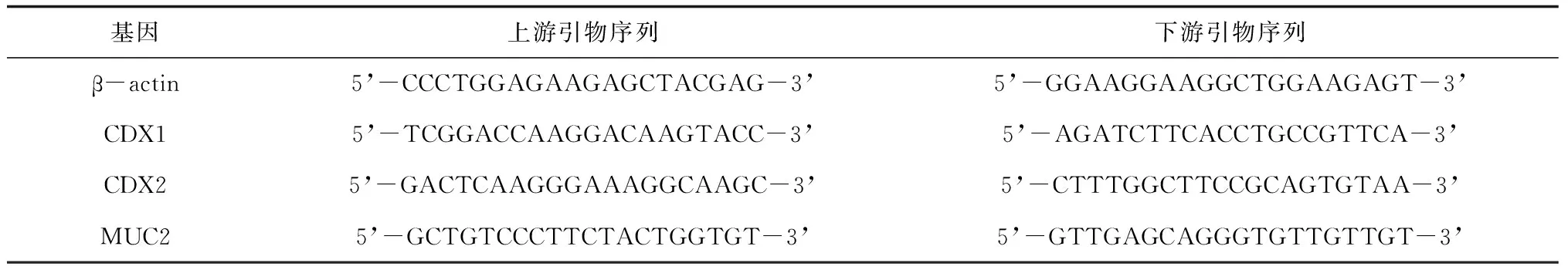
表1 引物序列
1.6统计学方法 采用Graphpad prism 9统计软件进行统计学分析,组间比较采用单因素方差分析,两两比较采用LSD检验,P<0.05为差异有统计学意义。
2 结 果
2.1不同浓度鹅去氧胆酸对GES-1细胞活性的影响 随着鹅去氧胆酸处理浓度的升高及时间的延长,GES-1细胞活性逐渐下降,当鹅去氧胆酸浓度大于150 μmol/L、处理时间大于48 h时,GES-1细胞活性低于50%(见图1)。因此,本研究选择100 μmol/L的鹅去氧胆酸、干预48 h作为最佳干预条件进行后续实验。

图1 不同浓度鹅去氧胆酸对人胃上皮细胞活性的影响
2.2不同浓度脾胃培源方含药血清对GES-1细胞活性的影响 随着脾胃培源方含药血清处理浓度的升高及时间的延长,GES-1细胞的活性逐渐下降,当脾胃培源方含药血清浓度为20%、处理时间为24 h时,GES-1细胞活性最接近50%(见图2)。因此,本研究选择浓度5%,10%,20%的脾胃培源方含药血清进行后续实验。
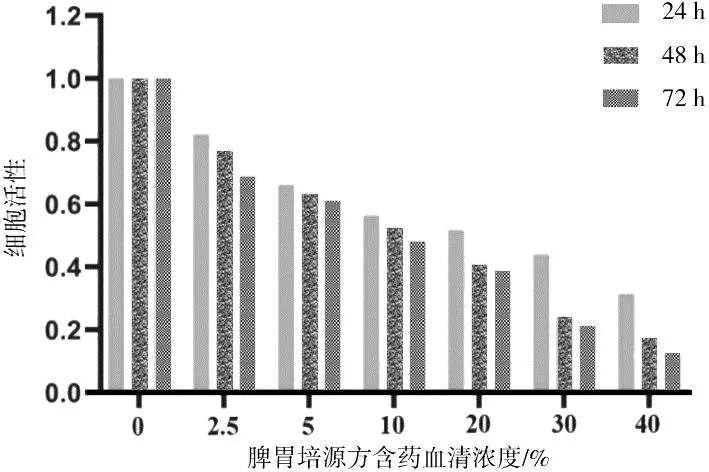
图2 不同浓度脾胃培源方含药血清对人胃上皮细胞活性的影响
2.3不同组别GES-1细胞活性比较 鹅去氧胆酸组GES-1细胞活性与空白对照组比较差异无统计学意义(P>0.05)。各浓度脾胃培源方含药血清组GES-1细胞活性均明显低于鹅去氧胆酸组(P均<0.05),且各浓度脾胃培源方含药血清组GES-1细胞活性呈剂量依赖性降低,两两比较差异均有统计学意义(P均<0.05)。见图3。
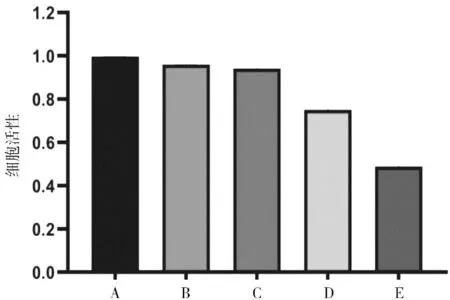
A为空白对照组;B为鹅去氧胆酸组;C为鹅去氧胆酸+5%脾胃培源方含药血清组;D为鹅去氧胆酸+10%脾胃培源方含药血清组;E为鹅去氧胆酸+20%脾胃培源方含药血清组
2.4不同组别炎症因子与氧化应激相关标志物水平比较 空白对照组和20%脾胃培源方含药血清组IL-6、IL-8、TNF-α、MDA、SOD水平比较差异均无统计学意义(P均>0.05)。与空白对照组和20%脾胃培源方含药血清组比较,鹅去氧胆酸组IL-6、IL-8、TNF-α、MDA水平均明显升高(P均<0.05),SOD水平明显降低(P均<0.05)。与鹅去氧胆酸组比较,鹅去氧胆酸+20%脾胃培源方含药血清组IL-6、IL-8、TNF-α、MDA水平均明显降低(P均<0.05),SOD水平明显升高(P<0.05)。见图4。
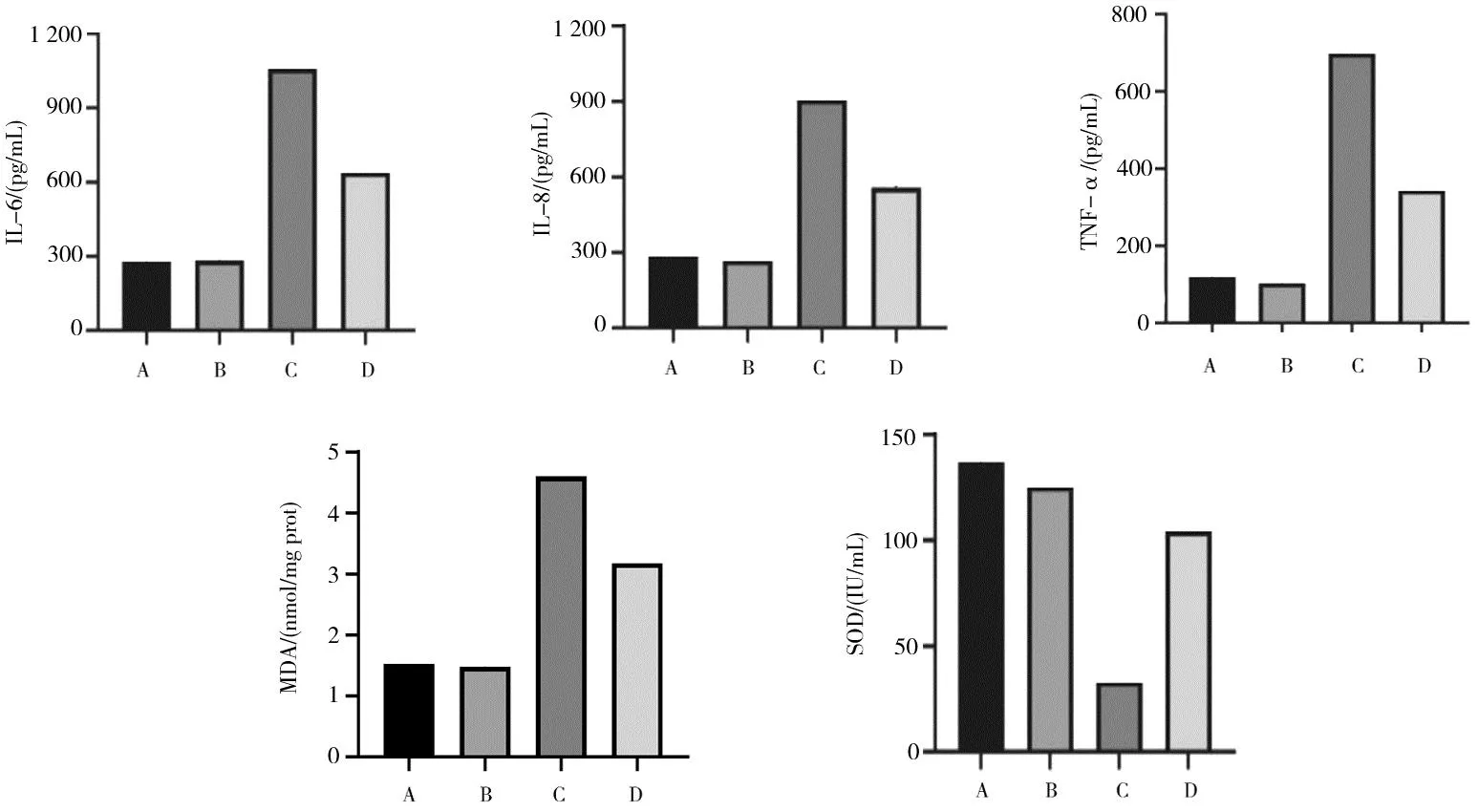
A为空白对照组;B为20%脾胃培源方含药血清组;C为鹅去氧胆酸组;D为鹅去氧胆酸+20%脾胃培源方含药血清组图4 空白对照组和鹅去氧胆酸处理各组人胃上皮细胞中炎症因子与氧化应激相关标志物水平
2.5不同组别CDX1、CDX2、MUC2 蛋白表达情况比较鹅去氧胆酸组CDX1、CDX2、MUC2蛋白相对表达量均明显高于空白对照组(P均<0.05);鹅去氧胆酸+10%脾胃培源方含药血清组和鹅去氧胆酸+20%脾胃培源方含药血清组CDX1、CDX2蛋白相对表达量和各浓度脾胃培源方含药血清组MUC2蛋白相对表达量均明显低于鹅去氧胆酸组(P均<0.05),且各指标呈一定浓度依赖性降低。见图5。

A为空白对照组;B为鹅去氧胆酸组;C为鹅去氧胆酸+5%脾胃培源方含药血清组;D为鹅去氧胆酸+10%脾胃培源方含药血清组;E为鹅去氧胆酸+20%脾胃培源方含药血清组图5 空白对照组和鹅去氧胆酸处理各组人胃上皮细胞中CDX1、CDX2、MUC2 蛋白表达情况
2.6不同组别CDX1、CDX2、MUC2 mRNA表达情况比较 鹅去氧胆酸组CDX1、CDX2、MUC2 mRNA相对表达量均明显高于空白对照组(P均<0.05);各浓度脾胃培源方含药血清组CDX1、CDX2 mRNA相对表达量和鹅去氧胆酸+10%脾胃培源方含药血清组、鹅去氧胆酸+20%脾胃培源方含药血清组MUC2 mRNA相对表达量均明显低于鹅去氧胆酸组(P均<0.05),且各指标呈一定浓度依赖性降低。见图6。

A为空白对照组;B为鹅去氧胆酸组;C为鹅去氧胆酸+5%脾胃培源方含药血清组;D为鹅去氧胆酸+10%脾胃培源方含药血清组;E为鹅去氧胆酸+20%脾胃培源方含药血清组图6 空白对照组和鹅去氧胆酸处理各组人胃上皮细胞中CDX1、CDX2、MUC2 mRNA表达情况
3 讨 论
胃黏膜肠上皮化生是由于胃黏膜长期慢性炎性损伤导致胃黏膜正常上皮细胞被肠型上皮细胞取代,进而出现杯状细胞、潘氏细胞及吸收上皮细胞的一种病理形态学改变[11]。在炎症及氧化应激反应的长期作用下,胃黏膜上皮持续遭到破坏,逐步向胃癌方向演变[12-13]。肠上皮化生通常无特异性临床表现,可通过胃镜和病理检查来明确诊断。
氧化应激与炎症密切相关,参与Barrett食管、消化性溃疡、CAG、胃癌等多种慢性疾病的发生、发展过程[14]。一方面,慢性炎症是氧化应激反应激活的结果。氧化应激反应是由活性氧等氧化物质的产生引起的,这些活性物质是正常炎症反应的一部分,但其过度产生异常积累,可导致炎症的进展[15]。在机体的氧化应激反应中,SOD与MDA是其重要指标。MDA是体内脂质过氧化物的代谢产物,过多的MDA可加剧氧化应激带来的损伤[16]。SOD是针对氧化应激的首道防线,可预防细胞损伤及细胞核的裂解,从而减轻氧化应激反应[17]。另一方面,慢性炎症也会导致氧化应激的产生。化学刺激、感染或免疫失衡引起的慢性炎症也会增加活性氧的产生,从而加剧氧化应激。这种持续的炎症/氧化环境引发恶性循环,进一步损伤临近细胞,最终导致恶性肿瘤的发生[18]。因此,CAG在长期炎症反应的作用下不仅能够诱发胃黏膜肠上皮化生及异型增生,还能够引发胃黏膜氧化应激反应,加重胃黏膜上皮组织损伤,加重疾病的进程,增加胃癌的发病风险。本实验结果显示,脾胃培源方干预后,IL-6、IL-8、TNF-α、MDA水平显著降低,SOD水平显著升高,表明脾胃培源方可抑制炎症与氧化应激反应,从而在一定程度上阻止胃黏膜肠上皮化生的进程。
MUC2黏蛋白是一种在人体肠道中发现的重要分泌蛋白,在保护肠道屏障、调节微生物组稳态和预防疾病等方面发挥着重要作用,其破坏与多种疾病和癌症有关[19]。MUC2在正常胃黏膜中不表达,而在肠化的胃黏膜组织中呈高表达,是肠化生的重要标志物[20]。CDX1是肠道分化的重要转录因子,正常的胃黏膜中不表达转录因子CDX1,但在动物和人胃肠上皮化生中可发现CDX1的异常表达,其在人胃肠上皮化生的发展中起关键作用,是胃炎-化生-癌发生进程中的一个重要标志[21-22]。CDX2和CDX1同属于尾型同源框基因家族成员,是肠上皮细胞分化的关键转录因子,与肠道上皮细胞的发育密切相关[23]。本实验结果显示,脾胃培源方干预后,CDX1、CDX2、MUC2的表达水平显著降低,提示脾胃培源方可抑制胃黏膜肠上皮化生。
综上所述,脾胃培源方可通过抑制炎症与氧化应激反应,下调CDX1、CDX2、MUC2的表达,从而抑制胃黏膜肠上皮化生。但胃黏膜肠上皮化生的机制较为复杂,本研究内容有限,今后将进一步开展动物实验、分子实验研究等,探究其具体的药理成分及作用机制。
利益冲突:所有作者均声明不存在利益冲突。
