苦参素注射液通过TGF-β1/Smads通路减轻糖尿病大鼠肝纤维化的研究
2023-12-22姚飞,王丽
姚 飞,王 丽
(邯郸邯钢医院,河北 邯郸 056001)
糖尿病是严重威胁人类生命健康的三大慢性非传染性疾病之一,我国糖尿病患病人数接近1.4亿[1]。肝脏是糖代谢的主要场所,长期高血糖所致肝纤维化是糖尿病常见并发症之一,是导致肝功能受损甚至肝衰竭的重要因素[2]。由强致纤维化因子转化生长因子-β1(TGF-β1)及其下游Smads家族蛋白构成的TGF-β1/Smads信号通路对组织纤维化过程发挥着关键调控作用,既往研究发现通过调控TGF-β1/Smads通路可有效抑制糖尿病大鼠肝、肾、心肌等组织纤维化[3-5]。因此,以TGF-β1/Smads通路为作用靶点探索防治糖尿病后肝纤维化的新型药物,对延缓糖尿病肝脏并发症进展具有重要意义。中药苦参是《中国药典》收录品种,性寒味极苦,归心、肝、大肠经,具有清热燥湿、抗菌消炎等功效。苦参素是苦参的主要活性成分,具有降脂、抗炎、抗纤维化等多种生物学活性[6-7],其能够通过调控TGF-β1/Smads通路对放射性肺损伤小鼠肺纤维化和大鼠心肌纤维化起到抑制作用[8-9]。苦参素注射液是以苦参素为主要成分制成的中药注射剂,本研究探讨了该注射液对糖尿病大鼠肝纤维化的影响,并基于TGF-β1/Smads通路探索其作用机制,以期为临床防治糖尿病后肝纤维化提供依据及新的思路。
1 实验材料与方法
1.1实验动物 55只SPF级健康雄性SD大鼠,6周龄,体重200~230 g,由赛业(固安)生物科技有限公司提供,许可证号:SCXK(冀)2021-003。在室温23~25 ℃、相对湿度45%~65%、光照黑暗12 h/12 h的控制环境分笼饲养,饮水进食不限。实验动物相关操作均严格遵循3R原则。
1.2药物与试剂 苦参素注射液(山东新华制药股份有限公司,批号:2201A05019,规格:2 mL:0.2 g);SB431542(TGF-β1/Smads通路抑制剂)、链脲佐菌素、RIPA裂解液、ECL显色液(上海碧云天生物技术有限公司,货号分别为SF7890、ST1668、P0013B、P0018S);透明质酸(HA)、层黏连蛋白(LN)、Ⅲ型前胶原(PCⅢ)、Ⅳ型胶原(CⅣ)放射免疫法检测试剂盒(北京华英生物技术研究所,货号分别为HY-10088、HY-10087、HY-2385、HY-2490);HE染色、天狼星红染色试剂盒和BCA蛋白浓度测定试剂盒(北京索莱宝生物技术有限公司,货号分别为G1120、G1472、PC0020);TGF-β1抗体、Ⅰ型胶原蛋白(Col-Ⅰ)抗体、Ⅲ型胶原蛋白(Col-Ⅲ)抗体、β-actin抗体和IgG二抗(武汉三鹰生物技术有限公司,货号分别为21898-1-AP、14695-1-AP、22734-1-AP、81115-1-RR、30000-0-AP);Smad3抗体、p-Smad3抗体、Smad7抗体、基质金属蛋白酶-2(MMP-2)抗体、基质金属蛋白酶-9(MMP-9)抗体(北京博奥森生物技术有限公司,货号分别为bs-3484R、bs-5459R、bs-0566R、bs-4605R、bs-41146R)。
1.3主要仪器 GA-3型血糖仪(长沙三诺生物传感股份有限公司);Aplio 500型超声诊断仪(日本东芝公司);KZ4GC-1200型放射免疫分析仪(北京中西远大科技有限公司);JJ-12J型脱水机、JB-P5型石蜡包埋机(武汉俊杰有限公司);RM2125RT型石蜡切片机(徕卡上海分公司);JY300HE型电泳仪(北京君意东方有限公司);VE586型转移槽(上海天能公司);CS 6100型化学发光成像系统(上海勤翔科学仪器有限公司)。
1.4实验方法 随机取10只大鼠作为正常组,给予常规饲料喂养。剩余45只大鼠参照李芬等[10]报道,采用高脂高糖饮食喂养4周后腹腔注射60 mg/kg链脲佐菌素的方法构建糖尿病模型,腹腔注射链脲佐菌素24 h和72 h后检测空腹血糖(FPG)水平均≥16.7 mmol/L即可判断糖尿病模型制备成功。共造模成功41只,去除FPG水平最低的1只大鼠后,将剩余40只成模大鼠随机分为模型组、苦参素注射液组、SB431542组和苦参素注射液+SB431542组,每组10只。苦参素注射液组给予50 mg/kg(参照人临床剂量,运用大鼠与人剂量换算公式计算所得)腹腔注射,SB431542组给予0.1 mg/kg SB431542(给药剂量参考文献[11])腹腔注射,苦参素注射液+SB431542组给予50 mg/kg苦参素注射液和0.1 mg/kg SB431542腹腔注射,模型组腹腔注射等量生理盐水,均1次/d,连续注射4周。
1.5检测指标及方法
1.5.1FPG水平 末次注射完成后,禁食12 h,由尾静脉取血并通过血糖仪检测FPG水平。
1.5.2肝脏超声相关指标 采用30 mg/kg戊巴比妥钠腹腔注射麻醉大鼠,通过超声诊断仪测量距门静脉起始部0.5~0.75 cm处内径[门静脉近段内径(PDPV)]和1.5~2.0 cm处内径[门静脉远段内径(DDPV)];脉冲多普勒模式下,检测门静脉主干血流速度(VPV);在剪切波弹性成像模式下,测定肝脏杨氏模量值。
1.5.3肝脏质量指数(LVI) 称量大鼠体重后,颈椎脱臼处死,开胸取肝脏,拭干血液后称量肝脏质量,计算LVI(肝脏质量/体重)。
1.5.4肝组织中肝纤4项指标水平 取肝脏右叶相同部位部分肝组织,加入9倍量pH7.3磷酸盐缓冲液后进行研磨匀浆,制备质量比10%的肝组织匀浆液,3 500 r/min离心(离心半径10 cm)10 min取上清,严格遵照放射免疫法检测试剂盒操作说明进行处理后,通过放射免疫分析仪检测HA、LN、PCⅢ、CⅣ水平。
1.5.5肝组织病理学形态 取肝脏右叶相同部位部分肝组织,置于10%中性福尔马林溶液中固定72 h,经脱水、石蜡包埋、连续4 μm厚度切片、贴片、烤片、脱蜡处理后,部分切片行HE染色,然后在光学显微镜下观察肝组织病理学形态。
1.5.6肝组织纤维化情况 取制备好的部分脱蜡后切片,按照天狼星红染色试剂盒说明进行染色,然后在光学显微镜下观察肝组织纤维化情况。天狼星红染色切片中红色为胶原纤维着色,采用Image-Pro Plus 6.0图像处理软件分析,计算胶原容积分数(红色面积/总面积×100%)。
1.5.7肝组织中TGF-β1/Smads通路相关蛋白及纤维化相关蛋白表达情况 采用Western blot法检测:取肝脏右叶相同部位肝组织100 mg,加入1 mL RIPA裂解液,研磨匀浆,冰上静置30 min充分裂解,12 000 r/min离心(离心半径10 cm)30 min取上清,BCA法试剂盒检测总蛋白浓度并配平,分别取30 μg总蛋白量样本,10%聚丙烯酰胺凝胶电泳分离蛋白、半干法转移至硝酸纤维素膜、5%牛血清白蛋白室温封闭1 h,滴加一抗稀释液TGF-β1(1:1 500)、Smad3(1:1 000)、p-Smad3(1:1 000)、Smad7(1:1 000)、Col-Ⅰ(1:1 500)、Col-Ⅲ(1:1 500)、MMP-2(1:1500)、MMP-9(1:1500)、β-actin(1:2 000)4 ℃孵育过夜,洗膜后滴加二抗稀释液IgG(1:3 000)室温孵育1.5 h,滴加ECL显色,采用Image-Pro Plus 6.0图像处理软件分析条带灰度值,与β-actin为内参计算目标蛋白相对表达量。
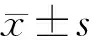
2 结 果
2.1各组大鼠FPG水平比较 模型组大鼠FPG水平明显高于正常组(P<0.05);各药物组大鼠FPG水平均明显低于模型组(P均<0.05),且苦参素注射液+SB431542组明显低于苦参素注射液组和SB431542组(P均<0.05),苦参素注射液组和SB431542组比较差异无统计学意义(P>0.05)。见图1。
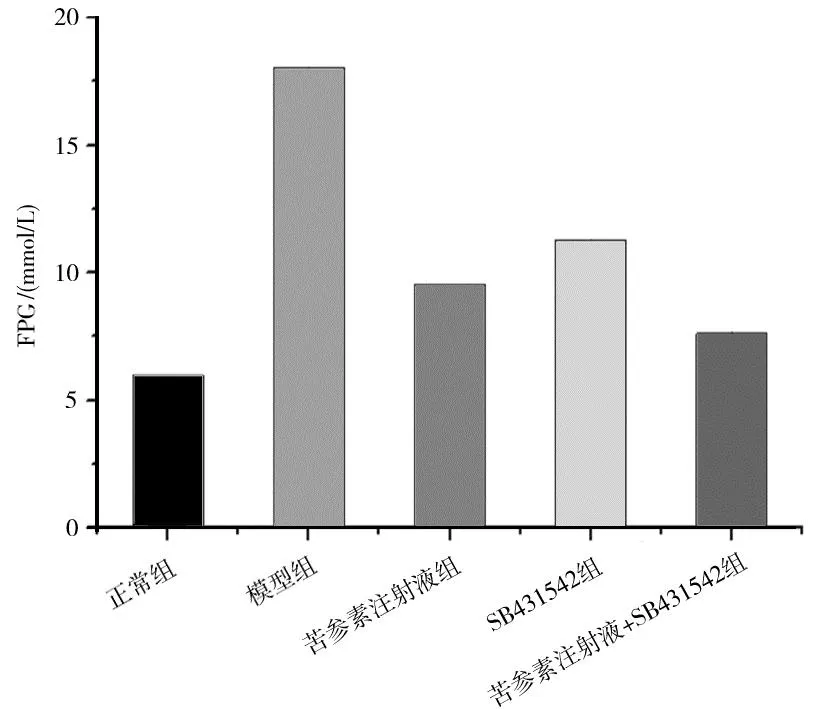
图1 正常组和糖尿病各组大鼠FPG水平比较
2.2各组大鼠PDPV、DDPV、VPV、杨氏模量比较与正常组比较,模型组大鼠PDPV、DDPV、杨氏模量均明显增高(P均<0.05),VPV明显减慢(P<0.05)。与模型组比较,各药物组大鼠PDPV、DDPV、杨氏模量均明显降低(P均<0.05),苦参素注射液组和苦参素注射液+SB431542组VPV均明显增快(P均<0.05);与苦参素注射液组和SB431542组比较,苦参素注射液+SB431542组PDPV、DDPV、杨氏模量均更低(P均<0.05),VPV均更快(P均<0.05),苦参素注射液组各指标与SB431542组比较差异均无统计学意义(P均>0.05)。见表1。
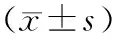
表1 正常组和糖尿病各组大鼠肝脏超声门静脉内径、血流速度、杨氏模量比较
2.3各组大鼠LVI比较 模型组大鼠LVI明显高于正常组(P<0.05);各药物组大鼠LVI均明显低于模型组(P均<0.05),且苦参素注射液+SB431542组明显低于苦参素注射液组和SB431542组(P均<0.05),苦参素注射液组和SB431542组比较差异无统计学意义(P>0.05)。见图2。
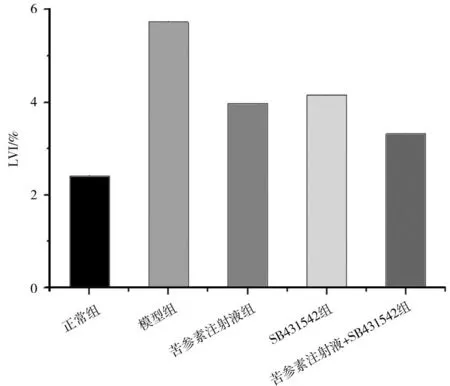
图2 正常组和糖尿病各组大鼠肝脏质量指数比较
2.4各组大鼠肝组织中HA、LN、PCⅢ、CⅣ水平比较 模型组大鼠肝组织中HA、LN、PCⅢ、CⅣ水平均明显高于正常组(P均<0.05);各药物组大鼠肝组织中HA、LN、PCⅢ、CⅣ水平均明显低于模型组(P均<0.05),且苦参素注射液+SB431542组各指标水平均明显低于苦参素注射液组和SB431542组(P均<0.05),苦参素注射液组各指标水平与SB431542组比较差异均无统计学意义(P均>0.05)。 见表2。
表2 正常组和糖尿病各组大鼠肝组织中HA、LN、PCⅢ、CⅣ水平比较
2.5各组大鼠肝脏组织病理学形态比较 正常组大鼠肝组织着色均匀,肝索排列规整,肝小叶结构清晰,细胞形态正常、结构完整;模型组大鼠肝索排列紊乱,肝小叶结构破坏,肝细胞脂肪变性、肿胀、坏死,汇管区和门静脉周围结缔组织增多,炎性细胞浸润;与模型组比较,各药物组大鼠肝组织病变不同程度改善,其中苦参素注射液+SB431542组改善更明显。见图3。
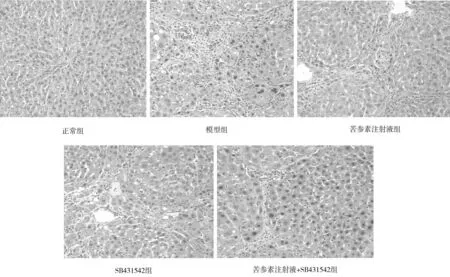
图3 正常组和糖尿病各组大鼠肝脏组织病理学形态(HE染色,×400)
2.6各组大鼠肝脏组织纤维化情况比较 正常组大鼠肝组织汇管区和门静脉周围可见少量散在胶原纤维沉积(红色着色),胶原容积分数为(1.39±0.17)%;模型组大鼠肝组织汇管区、门静脉周围和肝小叶周围胶原纤维明显增多,假小叶和胶原纤维隔形成,胶原容积分数为(31.86±5.33)%,明显高于正常组(P<0.05);与模型组比较,苦参素注射液组、SB431542组和苦参素注射液+SB431542组大鼠肝组织胶原纤维明显减少,胶原容积分数分别为(12.58±1.71)%,(15.04±1.92)%,(7.82±1.04)%,均明显低于模型组(P均<0.05),且苦参素注射液+SB431542组明显低于苦参素注射液组和SB431542组(P均<0.05),苦参素注射液组与SB431542组比较差异无统计学意义(P>0.05) 。见图4。
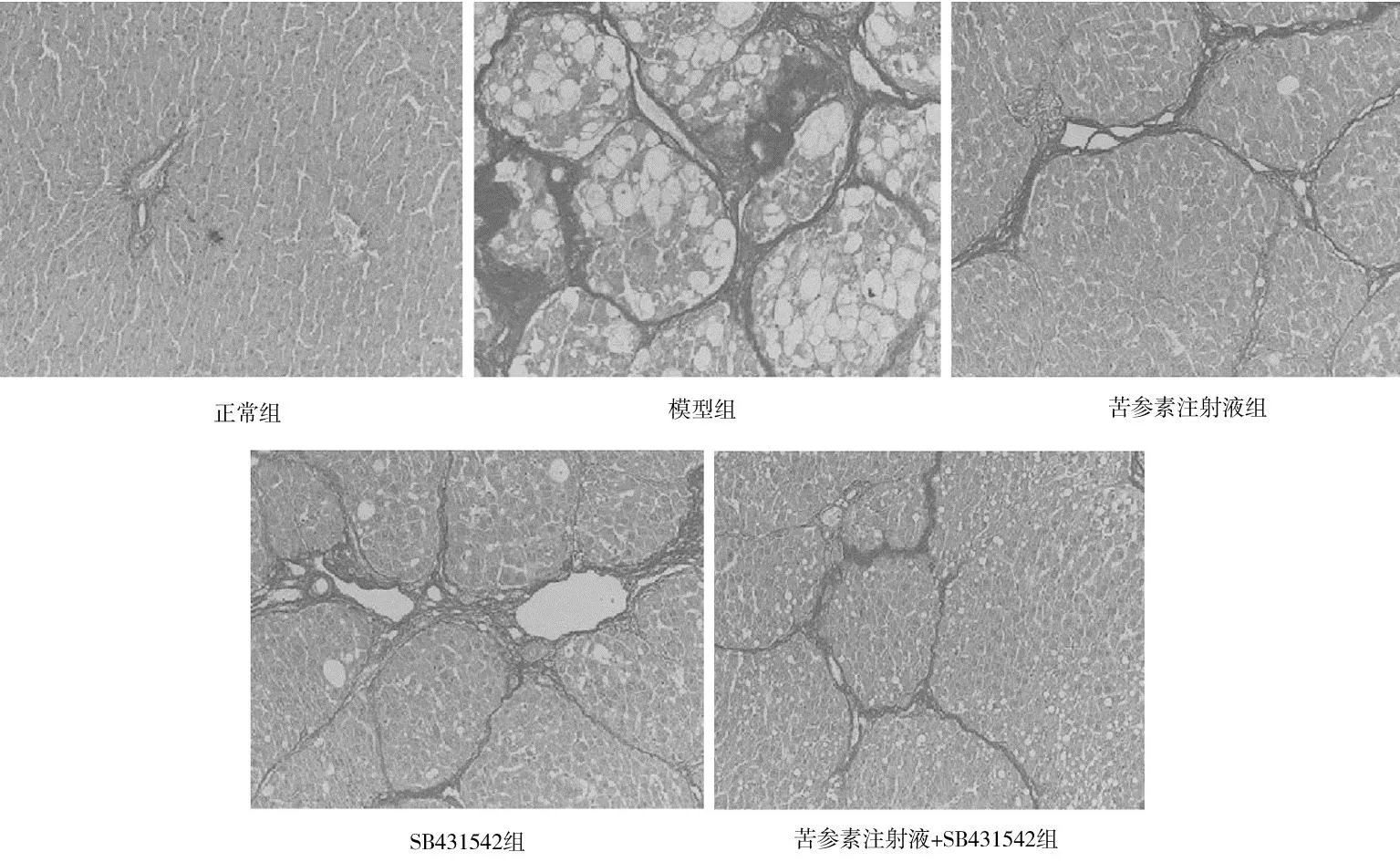
图4 正常组和糖尿病各组大鼠肝脏组织纤维化情况(天狼星红染色,×400)
2.7各组大鼠肝组织中TGF-β1/Smads通路相关蛋白及纤维化相关蛋白表达情况比较 与正常组比较,模型组大鼠肝组织中TGF-β1、p-Smad3、Col-Ⅰ、Col-Ⅲ蛋白相对表达量和p-Smad3/Smad3比值均明显升高(P均<0.05),Smad7、MMP-2、MMP-9蛋白相对表达量明显降低(P均<0.05)。与模型组比较,各药物组大鼠肝组织中TGF-β1、p-Smad3、Col-Ⅰ、Col-Ⅲ蛋白相对表达量和p-Smad3/Smad3比值均明显降低(P均<0.05),Smad7、MMP-2、MMP-9蛋白相对表达量均明显升高(P均<0.05);与苦参素注射液组和SB431542组比较,苦参素注射液+SB431542组大鼠肝组织中TGF-β1、p-Smad3、Col-Ⅰ、Col-Ⅲ蛋白相对表达量和p-Smad3/Smad3比值均更低(P均<0.05),Smad7、MMP-2、MMP-9蛋白相对表达量均更高(P均<0.05);苦参素注射液组各指标与SB431542组比较差异均无统计学意义(P均>0.05)。见图5及表3。
表3 正常组和糖尿病各组大鼠肝组织中TGF-β1/Smads通路相关蛋白及纤维化相关蛋白相对表达量及比值比较
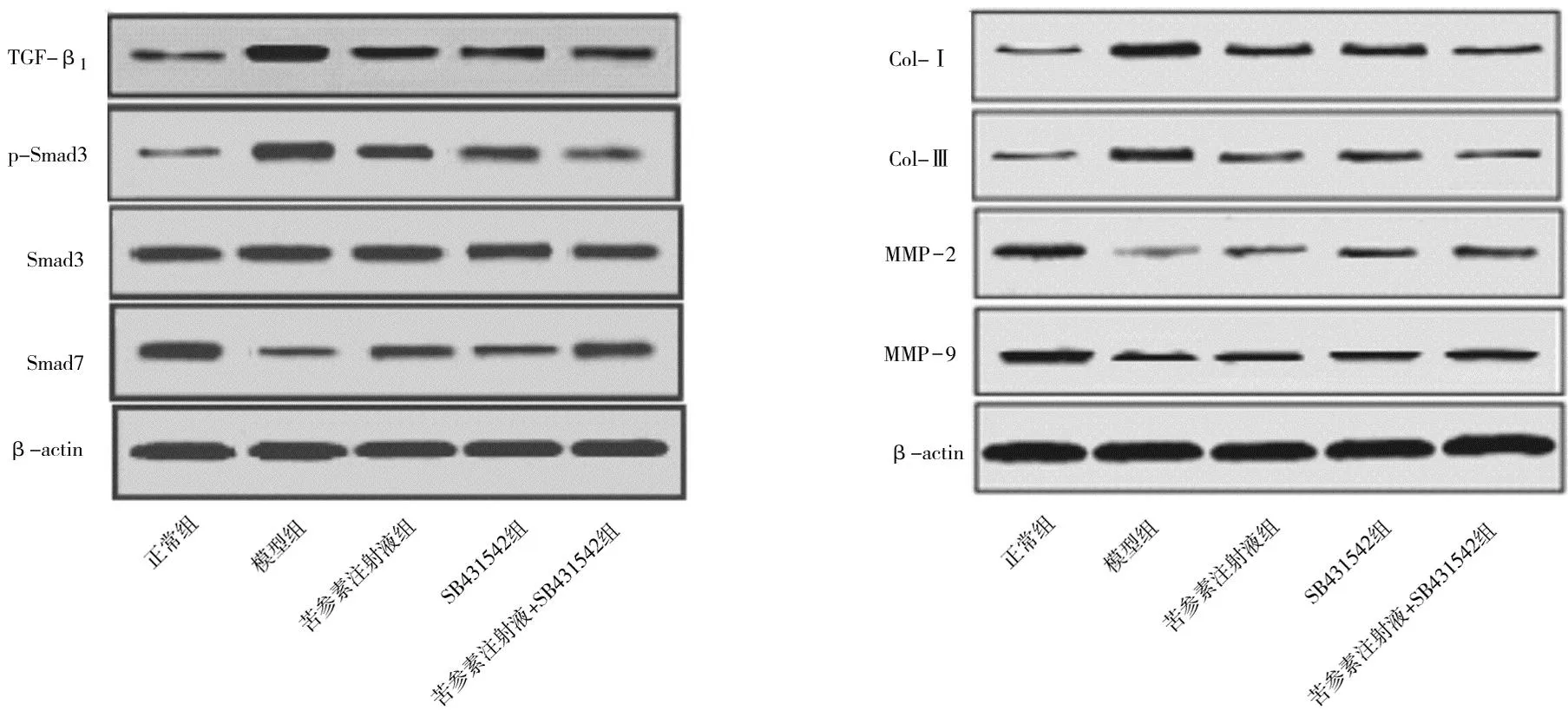
图5 正常组和糖尿病各组大鼠肝组织中纤维化相关蛋白表达情况
3 讨 论
肝纤维化是糖尿病患者常见的并发症之一,是引发肝硬化、肝衰竭及糖尿病患者死亡的主要原因[12]。目前,临床上对于糖尿病肝纤维化的治疗主要采取降糖调脂、保肝、调节免疫等药物综合治疗,但仍不能有效阻断糖尿病肝纤维化进行性加重,仍是亟待解决的医学难题。
细胞外基质(ECM)合成与降解平衡失调所致异常沉积,是导致结缔组织增生及组织纤维化的共同病理通路[13]。肝脏超声和肝纤4项是临床诊断肝纤维化的常用方法,肝纤维化导致肝脏结构性改变,因此通过肝脏超声检测门静脉内径、血流、肝脏弹性(杨氏模量值越高,肝脏弹性越差)等指标能够反映肝纤维化情况[14]。肝纤4项中HA为ECM主要成分,LN是肝细胞生成ECM必需非胶原糖蛋白,肝纤维化将导致肝细胞间隙LN大量沉积,PCⅢ和CⅣ则是早期肝纤维化标志性指标[15]。本实验结果显示,糖尿病大鼠FPG水平、LVI、PDPV、DDPV、杨氏模量及肝组织中HA、LN、PCⅢ、CⅣ水平明显升高,VPV明显降低;肝索排列紊乱、肝小叶结构破坏、肝细胞脂肪变性、汇管区和门静脉周围结缔组织增多、炎性细胞浸润,汇管区、门静脉周围和肝小叶周围胶原纤维明显增多,假小叶和胶原纤维隔形成,与苟芳等[16]报道一致;各药物组大鼠上述指标和肝组织病变及纤维化情况明显改善,且苦参素注射液+SB431542组各指标改善更明显,说明苦参素注射液对糖尿病大鼠肝纤维化具有抑制作用,且作用可能与调控TGF-β1/Smads通路有关。
TGF-β超家族参与调控细胞增殖、分化、凋亡以及ECM生成等多种生物学过程,其中TGF-β1亚型在哺乳动物细胞广泛存在且具有较强的促ECM生成作用,被认为是强促纤维化因子[17]。Aimaiti等[18]报道TGF-β1可刺激肝星状细胞分化为具有分泌ECM功能的肌成纤维细胞,ECM分泌对创伤修复至关重要,但病理性ECM过度沉积将导致进行性肝纤维化。Smads家族参与TGF-β1信号传导与ECM表达调控,TGF-β1首先与Ⅰ型受体(TβR-Ⅰ)和Ⅱ型受体(TβR-Ⅱ)结合使其活化,进而诱导Smad3亚型磷酸化,p-Smad3核转位后可诱导Col-Ⅰ、Col-Ⅲ转录与表达,Col-Ⅰ和Col-Ⅲ是构成ECM的主要成分,二者所占比例之和超过90%[19-20]。Smad7为TGF-β1信号转导抑制剂,通过与TβR-Ⅰ、TβR-Ⅱ竞争性结合而阻断Smad3磷酸化与核转位[21]。MMP-2和MMP-9为基质金属蛋白酶家族成员,具有降解胶原及分解ECM的生物学作用,Yuan等[22]报道p-Smad3可下调MMP-2、MMP-9表达。本实验结果显示,各药物组大鼠肝组织中TGF-β1、Col-Ⅰ、Col-Ⅲ蛋白相对表达量和p-Smad3/Smad3比值均明显低于模型组,Smad7、MMP-2、MMP-9蛋白相对表达量均明显高于模型组,且苦参素注射液+SB431542组各指标改善更明显,说明苦参素注射液对糖尿病大鼠TGF-β1/Smads通路具有抑制作用,这可能是苦参素注射液抑制糖尿病大鼠肝纤维化的重要分子机制。
综上所述,苦参素注射液可明显减轻糖尿病大鼠肝纤维化,其作用机制可能与抑制TGF-β1/Smads通路,减少细胞外基质沉积有关。本实验结果为苦参素注射液用于防治糖尿病后肝纤维化提供了一定实验依据,但其作用机制尚需进一步探讨。
利益冲突:所有作者均声明不存在利益冲突。
