物质结构与性质模块的考点分析及复习建议
2023-12-18林增辉
林增辉


从2023年开始,《物质结构与性质》模块成为广东高考的必考内容,长期以来,该模块一直作为选考内容,选考的学生较少,因此无论是新授课,还是高三的复习备考,对师生来说,都有一定的挑战性,笔者希望通过分析课标、教材及高考试题,能给同学们的复习备考带来一点帮助。
一、认识《物质结构与性质》与必修模块的联系
《物质结构与性质》虽然是一个独立的模块,但它是高中化学知识体系中不可或缺的一部分,该模块内容与必修模块密切联系(如表1),是必修模块内容的深化和提升,通过该模块的学习,同学们能从微观视角更加深刻地理解物质的结构与性质的关系,不会孤立地看待该模块的知识点,而是将其作为学科思想或理论工具,解决在学习过程中遇到的问题。
二、了解《物质结构与性质》模块在高考中的考查情况
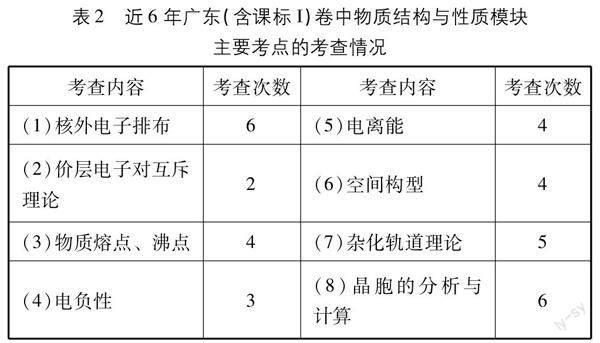
以往《物质结构与性质》只是一个选考人数很少的模块,因此对大多数师生来说,该模块的备考经验几乎是空白的,笔者通过分析近6年广东(含2018~2020年课标I)卷试题,从宏观上了解该模块的考查方式和常见考点,以期能让同学们更有针对性地进行复习备考。
表2显示,在近6年的广东(含2018~2020年课标I)卷中,《物质结构与性质》模块的主要考点是比较集中的,考点的考查频率相对来说都比较高,多数考点在6年中出现了4次以上,特别是核外电子排布、杂化轨道理论、晶胞的分析与计算等考点更加突出,值得重点关注。
但值得注意的是,在前5年的试卷中,物质结构与性质模块是以单独的大题出现,在2023年试卷中,是将考点分散到选择题和填空题中,没有独立的大题,这一考查方式的变化,也说明了该模块是作为“化学思维或理论工具”的核心观点,是同学们深入研究物质结构与性质的核心理论知识,因此,该模块的试题考查方式也将变得更加灵活,但无论如何,只要同学们掌握核心考点的必备知识,相信也能轻松驾驭该模块的试题。
三、《物质结构与性质》模块核心考点分析
结合近年来考点的出现频率,在这里重点分析基态原子(离子)核外电子排布、原子结构与元素的性质、分子(离子)的空间结构、晶体类型的判断与晶胞的分析等核心考点。
1.基态原子(离子)核外电子排布
在高考中,常要求同学们书写基态原子(离子)的价电子排布式,或价层电子排布图(轨道表示式),这一考点虽然考查频率很高,但所写的元素基本都是同学们比较熟悉的,难度不是很大。
【例1】按要求填空。
①(2023·广东)基态Fe2+的3d电子轨道表示式为。
②(2022·甲卷)基態F原子的价层电子排布图(轨道表示式)为。
③(2023·乙卷)基态Fe原子的价电子排布式为。
④(2022·广东)Se与S同族,基态硒原子价电子排布式为。
⑤(2021·广东、2023·北京)基态硫原子价电子排布式为。
⑥(2018·课标I)下列Li原子电子排布图表示的状态中,能量最低和最高的分别为______、______(填标号)。
A.___ B.
C.D.
答案:① ②
③3d64s2④4s24p4 ⑤ 3s23p4 ⑥D C
在近几年的高考中,这类题目的要求,基本都符合构造原理的规律,所以只要掌握构造原理的电子排布顺序,基本都能正解作答。但在此也给同学们几点提示:(1)要注意题目是要求书写电子排布式,还是价层电子排布图(轨道表示式)?(2)构造原理是一个经验规律,1~20号元素都符合这个规律,但不是所有元素的电子排布都符合构造原理,当然,如果出现这类原子,一般都会有提示,要注意题目信息;(3)当原子失去电子形成阳离子时,总是首先失去最外层电子,例如过渡元素铁和铜的原子、离子价层电子排布如下:Fe(3d64s2)、Fe2+(3d6)、Fe3+(3d5) 、Cu(3d104s1)、Cu +(3d10)、Cu2+ (3d9),另外,也要注意按能层的顺序写,不能写成4s23d6。
2.原子结构与元素的性质
原子结构与元素的性质主要包含电离能、电负性或物质熔沸点等考点,由于电离能、电负性和物质熔沸点与原子结构或物质结构有关,元素核外电子的周期性变化,也使元素的电离能或电负性呈现出了一定的规律,同周期或同主族元素组成的物质的熔沸点也呈现出了一定的规律。
角度一:根据原子结构判断电负性或电离能的大小
【例2】(2023·广东)化合物XYZ4ME4可作肥料,所含的5种元素位于主族,在每个短周期均有分布,仅有Y和M同族。Y的基态原子价层p轨道半充满,X的基态原子价层电子排布式为nsn-1,X与M同周期,E在地壳中含量最多。下列说法正确的是
A. 元素电负性:E>Y>Z
B. 氢化物沸点:M>Y>E
C. 第一电离能:X>E>Y
D. YZ3和YE—3的空间结构均为三角锥形
解析:由题干可知,5种元素位于主族,且在每个短周期均有分布,可知必定有H元素,而E在地壳中含量最多,为O元素,Y的基态原子价层p轨道半充满,Y和M同族,可知Y、M分别为氮、磷元素之一,结合XYZ4ME4的化学式,可推断Z为氢元素、M为磷元素、E为氧元素、Y为氮元素,而X元素的化合价应为+2,X的基态原子价层电子排布式为nsn-1,X与M同周期,可推断n=3,即X为镁元素。电负性表示原子对电子的吸引能力,一般来说,非金属性越强,电负性也相应越强,因此可知元素电负性:O>N>H,A正确;液氨、水中都存在氢键,沸点高,磷化氢中没有氢键,沸点低,B错误;短周期元素中,同周期元素第一电离能从左往右总趋势逐渐增大,但第ⅡA族和第ⅤA族元素略高于两侧元素,所以氮元素的第一电离能大于氧元素的,而镁是较为活泼的金属,易失电子,第一电离能低于氧元素的,C错误;NH3中心原子价层电子对为3+1=4,有一对孤电子对,空间结构为三角锥形,NO—3价层电子对为3,没有孤对电子,NO—3空间结构为平面三角形,D错误。
答案:A
对于这一类题目,同学们要正确理解电负性和电离能概念的本质,掌握短周期主族元素的电负性和电离能的变化规律及特殊情况,例如第ⅡA族和第ⅤA族元素因为原子轨道的全满或半满结构,而导致第一电离能高于两侧的元素。
角度二:分析元素电负性或电离能差异的原因
【例3】按要求填空:
①(2023·北京)比较S原子和O原子的第一电离能大小,从原子结构的角度说明理由:___。
②(2022·甲卷)图a、b、c分别表示C、N、O和F的逐级电离能I变化趋势(纵坐标的标度不同)。第一电离能的变化图是______(填标号),判断的根据是____________;
第三电离能的变化图是______(填标号)。
解析:结合题干信息,①中,S和O为同主族元素,O原子核外有2个电子层,S原子核外有3个电子层,O原子半径小,原子核对最外层电子的吸引力大,不易失去1个电子,即O的第一电离能大于S的第一电离能。②中,图a表示第一电离能的变化图,因为同周期元素第一电离能的总体趋势是依次升高的,但由于N元素的2p能级为半充满状态,因此N元素的第一电离能较C、O两种元素高; 同一周期原子的第三电离能的总体趋势也是依次升高的,但由于C原子在失去2个电子之后的2s能级为全充满状态,因此其再失去一个电子时需要的能量稍高,满足这一规律的图像为图b。
这类题目,不但要求同学们能正确判断元素的电负性或电离能的大小,而且还能用简洁的语言进行描述,为了更好地解答这类题目,同学们不但要学会“说理”,也要加强文字表达的训练。
角度三:根据物质的宏观性质进行推理分析
【例4】按要求填空:
①(2023·山东)已知电负性Cl>H>Si,SiHCl3在浓NaOH溶液中发生反应的化学方程式为___ 。
②(2023·甲卷)AlF3的熔点为1090℃,远高于AlCl3的192℃,由此可以判断铝氟之间的化学键为___ 键。
③(2023·乙卷)已知一些物质的熔点数据如下表:
分析同族元素的氯化物 SiCl4、GeC14、SnCl4 熔点变化趋势及其原因____________。
④(2021·浙江)已知3种原子晶体的熔点数据如下表:
解析:结合题干信息,①中,已知电负性Cl>H>Si,则SiHCl3中氯元素的化合价为-1,氢元素的化合价为-1,硅元素化合价为+4,所以SiHCl3在浓NaOH溶液中发生反应时,-1价氢被氧化生成H2,同时得到氯化鈉、硅酸钠,化学方程式为SiHCl3+5NaOH=Na2SiO3+3NaCl+H2↑+2H2O。②中,AlF3的熔点为1090℃,远高于AlCl3的192℃,由于F的电负性最大,其吸引电子的能力最强,因此,可推断铝氟之间的化学键为离子键。③中,三种氯化物熔点都比较低,可知都是由结构相似的分子构成的分子晶体,相对分子质量由SiC14至SnCl4递增,故熔化时需克服的范德华力也递增,导致熔点升高。④中,由于金刚石和晶体硅都属于共价晶体,共价晶体中,原子半径越小,共价键键能越大,熔点越高,而硅原子半径大于碳原子,所以键能:C—C>Si—Si,金刚石熔点比晶体硅熔点高。
这一类题目,是根据不同物质的性质,进行推理分析,但考查点多数是立足于“同周期”或“周主族”的递变规律,同学们要学会根据同周期或同主族元素在性质上的相似性和递变性规律进行分析。
3.分子(离子)的空间结构
分子(离子)的空间结构主要考查价层电子对互斥模型和杂化轨道理论,在近年来的试题中考查的频率非常高,同学们要高度重视。
角度一:杂化轨道理论
【例5】按要求填空:
①(2023·甲卷)气态AlCl3通常以二聚体Al2Cl6的形式存在,其空间结构如下图所示,二聚体中Al的轨道杂化类型为______。
②(2021·甲卷)SiCl4是生产高纯硅的前驱体,其中Si采取的杂化类型为______。SiCl4可发生水解反应,机理如下:
含s、p、d轨道的杂化类型有:①dsp2、②sp3d、③sp3d2,中间体SiCl4(H2O)中Si采取的杂化类型为______(填标号)。
③(2021·湖南)N-甲基咪唑( )中碳原子的杂化轨道类型为______。
解析:结合①中信息可知,Al原子与其周围的4个氯原子形成四面体结构,而且Al原子不可能存在孤对电子,因此可推断二聚体中A1的轨道杂化类型为sp3。②中,根据SiCl4的结构式可知,Si的价层电子对数为4,故Si采取sp3杂化;根据SiCl4(H2O)的结构式可知Si的价层电子对数为5,采取sp3d杂化。③中,N-甲基咪唑分子中含有甲基和碳碳双键,甲基的碳原子的杂化轨道类型为sp3,而碳碳双键的为sp2。
同学们要特别注意,由于杂化轨道用于形成σ键或容纳未参与成键的孤对电子,因此判断中心原子与多少个原子成键,有多少对孤对电子,就可以够轻松地判断中心原子的杂化轨道类型。
角度二:分析分子(离子)的空间结构
【例6】(2023·湖北)价层电子对互斥理论可以预测某些微粒的空间结构。下列说法正确的是
A. CH4和H2O的VSEPR模型均为四面体
B. SO2-3和CO2-3的空间构型均为平面三角形
C. CF4和SF4均为非极性分子
D. XeF2与XeO2的键角相等
解析:题干明确用价层电子对互斥理论预测微粒的空间结构,甲烷分子中心原子的价层电子对为4,水分子的中心原子价层电子对也为4,所以CH4和H2O的VSEPR模型都是四面体,A正确;SO2-3的孤电子对为1,CO2-3的孤电子对为0,所以SO2-3的空间构型为三角锥形,CO2-3的空间构型为平面三角形,B错误;CH4为正四面体结构,是非极性分子,SF4中心原子有孤电子对,为极性分子,C错误;XeF2和XeO2分子中,F、O原子和中心原子结合的电子数目不同,中心原子孤电子对不相等,孤电子排斥力不同,所以键角也不相等,D错误。
答案:A
【例7】按要求填空:
①(2023·乙卷)SiCl4的空间结构为______ ,
②(2022·广东)SeO2-4的立体构型为______,
③(2020·课标Ⅰ)磷酸根离子的空间构型为______。
解析:题①中,中心原子Si和四个氯原子成鍵,没有孤对电子,因此SiCl4的空间结构为正四面体;②中SeO2-4中Se价层电子对数为4+1/2(6+2-2×4)=4 ,其立体构型为正四面体形;③中,PO3-4中P原子不含孤电子对,价层电子对数为4,因此其构型为正四面体形。
这一类题目的难度不大,但要求同学们要明确概念,价层电子对数等于σ键电子对数加上中心原子的孤电子对数,不计算π键,σ键电子对数等于中心原子结合的原子数;此外,同学们也要熟悉中心原子价层电子对数为2~4的分子或离子的空间结构,在考试时才能快速作出判断。
角度三:分析比较键角大小
【例8】按要求填空:
①(2020·山东)NH3、PH3、AsH3的键角由大到小的顺序为_________ 。
②(2022·北京)比较SO2-4和H2O分子中的键角大小并给出相应解释:______ 。
③(2022·湖南)比较键角大小:气态SeO3分子______SeO2-3离子(填“>”“<”或“=”),原因是______。
解析:根据题目信息,①中,NH3、PH3、AsH3的中心原子都是sp3杂化,都有1对孤电子对,中心原子的电负性越小,成键电子对之间的斥力越小,键角越小,所以键角由大到小的顺序为NH3>PH3>AsH3;②中,SO2-4中S原子的价层电子对数为4、孤电子对数为0,离子的空间结构为正四面体形,H2O分子中O原子的价层电子对数为4、孤电子对数为2,分子的空间结构为V形,受孤对电子挤压,H2O分子的键角小于SO2-4的键角;③中,SeO3分子中硒原子的价层电子对数为3,孤对电子对数为0,分子的空间构型为平面三角形,键角为120°,SeO2-3离子中硒原子的价层电子对数为4,孤对电子对数为1,离子的空间构型为三角锥形,键角小于120°,因此气态SeO3分子的键角大于SeO2-3离子的键角。
键角的比较,一般有下几种情况:(1)依据杂化方式和空间结构比较,键角大小规律:直线形>平面三角形>正四面体形>三角锥形>V形;(2)杂化方式相同,孤电子对数不同,中心原子上孤电子对越多,孤电子对对成键电子对的斥力越大,键角越小;(3)中心原子不同,配位原子相同,中心原子的电负性越大,键角越大,例如NH3的键角大于PH3的键角;(4)中心原子相同,配位原子不同,配位原子的电负性越大,键角越小,例如NF3的键角小于NH3的键角。
4.晶体类型的判断与晶胞的分析
晶体类型的判断与晶胞的分析是高考的热门考点,前者相对简单,而晶胞的分析难度较大,对同学们的计算能力和空间观察能力有较高的要求。
角度一:晶体类型的判断
【例9】(2021·辽宁)单质硫和氢气在低温高压下可形成一种新型超导材料,其晶胞如下图。下列说法错误的是
A.S位于元素周期表p区
B.该物质的化学式为H3S
C.S位于H构成的八面体空隙中
D.该晶体属于分子晶体
解析:S元素是第ⅥA族元素,位于元素周期表的p区,A正确;应用均摊法计算,该晶胞中含S原子数为1+1/8×8=2,含H原子数为1/2×6+1/4×12=6,可知该物质的化学式为H3S,B正确;以体心的S为研究对象,其位于面心上的6个H原子构成的八面体空隙中,如图所示,C正确;该物质为超导材料,而分子晶体不导电,D错误。
答案:D
【例10】(2023·山东)-40℃时,F2与冰反应生成HOF利HF。常温常压下,HOF为无色气体,固态HOF的晶体类型为___ ,
解析:根据题目信息,常温常压下,HOF为无色气体,可知HOF的沸点较低,可推断固态HOF的晶体类型为分子晶体。
这类题目虽然比较简单,但同学们还是要熟悉四种晶体类型,除了利用基本概念进行判断,也应熟悉四类晶体的特殊性质,例如熔沸点,分子晶体相对比较低,而离子晶体、共价晶体一般都比较高;又如导电性,分子晶体不能导电,少部分共价晶体能导电,而离子晶体在熔融状态或水溶液中能导电;纵观近年来的高考试题,利用宏观性质判断晶体类型是常见的考查方式。
角度二:晶胞的分析和计算
【例11】(2023·湖北改编)镧La和H可以形成一系列晶体材料LaHn,在储氢和超导等领域具有重要应用。LaHn属于立方晶系,晶胞结构和参数如图所示。高压下,LaH2中的每个H结合4个H形成类似CH4的结构,即得到晶体LaHx。下列说法错误的是
A. LaH2晶体中离La最近且等距离的H有8个
B. 晶体中H和H的最短距离:LaH2 > LaHx
C. 在LaHx晶胞中,H形成一个顶点数为40的闭合多面体笼
D. LaHx单位体积中含氢质量的计算式为40/(4.84×10-8)3×6.02×1023g·cm-3
解析:由LaH2的晶胞结构可知,La位于顶点和面心,晶胞内8个小立方体的中心各有1个H原子,若以顶点La研究,与之最近且等距离的H原子有8个,A正确;由LaHx晶胞结构可知,每个H结合4个H形成类似CH4的结构,H和H之间的最短距离变小,则晶体中H和H的最短距离:LaH2 > LaHx,B正确;在LaHx晶胞中,每个H结合4个H形成类似CH4的结构,这样的结构有8个,顶点数为4× 8=32,且不是闭合的结构,C错误;1个LaHx晶胞中含5× 8=40个H原子,含H质量为40/NA g,晶胞的体积为(484.0×10-10cm)3=(4.84×10-8)3cm3,则LaHx单位体积中含氢质量的计算式为40/(4.84×10-8)3×6.02×1023g·cm-3 ,D正确。
答案:C
【例12】按要求填空:
①(2023·甲卷)AlF3结构属立方晶系,晶胞如图所示,若晶胞参数为a pm(即立方体边长),晶体密度ρ=___g·cm-3 (列出計算式,阿伏加德罗常数的值为NA)。
②(2022·广东)我国科学家发展了一种理论计算方法,可利用材料的晶体结构数据预测其热电性能,该方法有助于加速新型热电材料的研发进程。化合物X是通过该方法筛选出的潜在热电材料之一,其晶胞结构如图1,沿x、y、z轴方向的投影均为图2。
X的化学式为______,设X的最简式的式量为Mr,晶体密度为ρg·cm-3,则X中相邻K之间的最短距离为______nm(列出计算式,NA为阿伏加德罗常数的值)。
③(2023·乙卷)一种硼镁化合物具有超导性能,晶体结构属于六方晶系,其晶体结构、晶胞沿c轴的投影图如下所示,该物质化学式为___ ,B-B最近距离为______。
解析:题①中,AlF3结构属立方晶系,即晶胞结构为正方体,晶胞棱上大球个数为12×1/4=3 ,顶点小球个数为8×1/8=1 ,则大球为F—,小球为Al3+,正方体晶胞边长为a pm,则晶胞的体积为(apm)3=a3×10-30cm3 ,晶胞的质量为84g/NA ,则其晶体密度ρ=84×1030/NA·a3g·cm3 ;
题②中,分析晶胞结构,可知有8个K,个数为8×1/8+6×1/2=4 ,则X的化学式为K2SeBr6,X的最简式的式量为Mr,晶体密度为ρg·cm-3,设晶胞参数为anm,得到
ρ=m/V=Mrg·mol-1/NA mol-1×4/(a×10-7cm)3=ρg·cm-3,
解得a=3/4Mr/NAρ×107nm ,X中相邻K之间的最短距离为晶胞参数的一半即1/2×3/4Mr/NAρ×107nm ;题③中,由硼镁化合物的晶体结构、晶胞沿c轴的投影(即光线平行于c轴)图可知,Mg位于正六棱柱的顶点和面心,由均摊法可以求出正六棱柱中含有12×1/6+2×1/2=3 个Mg,B在正六棱柱体内共6个,则该物质的化学式为MgB2,由晶胞沿c轴的投影图可知,B原子在图中两个正三角形的中心,根据晶胞参数(棱长和夹角),可计算出B-B最近距离为3/3a。
通过上述例题,同学们可发现晶胞的分析和计算,考查角度是很多的,但重点依然是在落在晶胞的计算上,例如晶胞密度、原子距离等的计算。在这里给同学们提几点建议:(1)要熟悉常见的晶胞类型,例如常见的长方体形(包含立方晶系)和六方晶系(如例12③),熟悉均摊法在这些晶型中的应用;(2)对于晶胞投影,如果是沿X轴,则光线平行于X轴,如果是在某个面上投影,则光线垂直于该面。(3)平时多观察分析实际的晶胞模型,强化空间想象能力。(4)计算过程要严谨细致,注意单位换算,不漏写错写字母符号。
四、复习备考建议
1.熟练运用物质结构与性质的基本理论,将其作为学习化学的金钥匙。例如在高考中,常常要求同学们运用原理分析物质的电离能变化、电负性对物质性质的影响等,如果同学们在平时的学习过程中,能经常运用这些理论去认识、解释常见的化学现象,不但有利于同学们应对高考中的试题,也能不断深化同学们对化学原理的理解。
2.提高复习的针对性和有效性。物质结构与性质模块的知识线非常清晰,讲授了原子、分子和晶体的相关概念和理论,同学们要把握知识的主线,同时通过历年来的高考试题,明确核心考点和热门考点,做到知己知彼,方能百战不殆,但要提醒同学们的是,在新教材中,有些概念已经删除,但一些省市的题目仍有提及,例如配位数、晶格能等概念,同学们在碰到这些题目时,可以回避这些概念,减少学习的负担。总之,应立足教材,有针对性地挑选练习题目,明晰考点,有针对性地复习。
责任编辑 李平安
