分子中键角大小的比较
2022-09-14张变霞
张变霞
(山东省潍坊新纪元学校)
在多原子分子中,2个相邻共价键之间的夹角称为键角.键角是描述分子空间结构的重要参数.资料表明,影响分子中键角大小的因素为中心原子的价层电子对数及孤电子对数、中心原子及配位原子的电负性、分子中化学键的类型等.
1 影响分子中键角大小的因素
1.1 中心原子的价层电子对数是决定键角大小的主要因素
当中心原子不存在孤电子对时,分子的立体构型与价层电子对互斥模型一致,中心原子的价层电子对数是决定键角大小的主要因素之一,如表1所示.

表1
1.2 中心原子孤电子对数目对键角的影响
在相同的杂化类型条件下,中心原子上孤对电子越多,成键电子对受到的排斥力越大,导致键角越小.H2O、NH3、CH4的键角大小如表2所示.
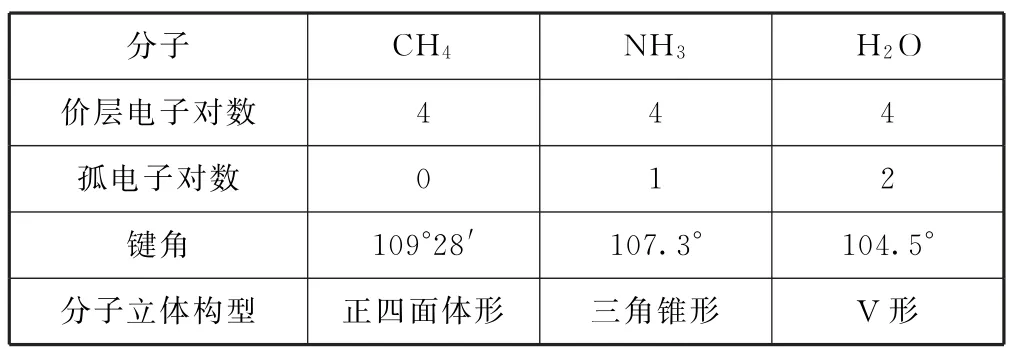
表2
1.3 中心原子及配位原子电负性对键角的影响
电负性是影响键角大小的因素之一.改变中心原子或配位原子的电负性对具有对称结构的非极性分子的键角不会产生影响,如CH4、CF4、CCl4和CBr4都是正四面体结构,键角都是109°28′,不会受电负性影响.在具有相似结构的极性分子中,中心原子的电负性和配位原子的电负性对分子的键角会产生影响.
1)当中心原子相同,配位原子不同时,键角随着成键的配位原子电负性增大而减小.
当中心原子相同时,与中心原子键合的配位原子电负性越大,配位原子吸引成键电子对的能力越强,成键电子对将向配体方向移动,远离中心原子,成键电子对之间的排斥力减小.
例如,比较NH3与NF3键角的大小.由于电负性:F>N>H,所以,NF3中成键电子对间距离更远,键角更小,如图1所示,具体键角大小如表3所示.
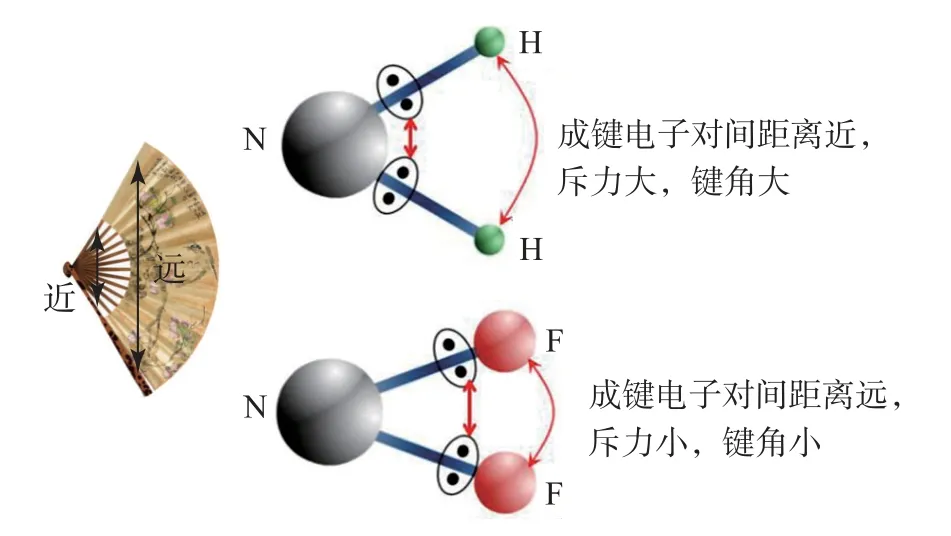
图1
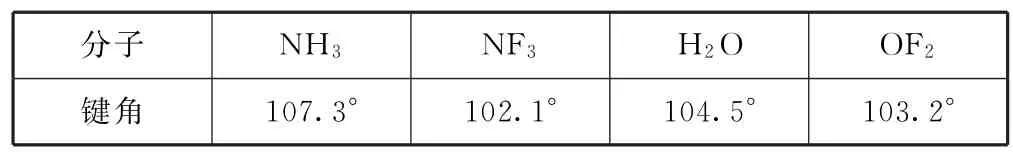
表3
2)当配位原子相同,中心原子不同时,键角随着中心原子电负性增加而增大.
当配位原子相同时,中心原子的电负性越大,中心原子吸引成键电子的能力越强,成键电子对越靠近中心原子,成键电子对之间距离变小,排斥力增大,键角变大,如表4所示.H2O 与H2S的键角大小比较如图2所示.
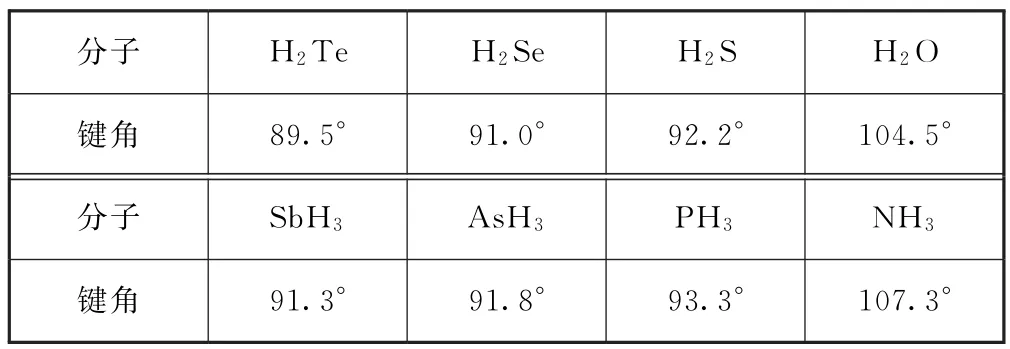
表4
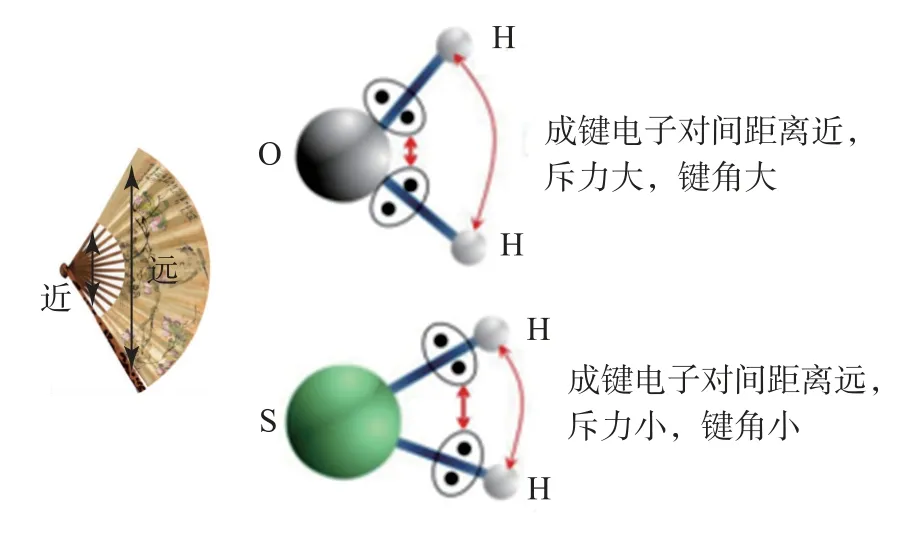
图2
1.4 价层电子对间的斥力顺序对键角的影响
1)l-l≫l-b>b-b(l为孤电子对;b为键合电子对).
这一斥力顺序是经常要考虑的.可以这样理解:键合电子对受左右两端带正电的原子核的吸引,而孤电子对只受到一端原子核吸引,相比之下,孤电子对较“胖”,占据较大的空间,而键合电子对较“瘦”,占据较小的空间,图3为孤电子对与键合电子对的斥力不同使VSEPR 模型发生畸变.此外,有时还要考虑如下几种顺序.
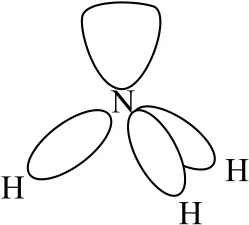
图3
2)t—t>t—d>d—d>d—s>s—s(t为三键,d为双键,s为单键).
3)Xw-Xw>Xw-Xs>Xs-Xs(X代表配位原子的电负性,下标w 代表弱,s代表强).
4)处于中心原子的全充满价层里的键合电子之间的斥力大于处在中心原子的未充满价层里键合电子之间的斥力.
价层电子对之间的以上“斥力顺序”使分子或离子的空间结构偏离VSEPR 模型而适当畸变;当VSEPR 模型不止一个时,还决定了哪种空间结构更稳定.这些顺序规则中,最经常要考虑的,最重要的,是第一种斥力顺序.
例1用斥力顺序分析分子中的键角:
(1)H2O 中∠H—O—H 比109°28′大还是小?
(2)SO2Cl2分子中的键角 ∠O—S—O、∠Cl—S—Cl、∠O—S—Cl比109°28′大还是小?
(3)实测值:SO2F2中 ∠F—S—F 为98°,SO2Cl2中∠Cl—S—Cl为102°,为什么后者的键角较大?
(4)NH3、PH3均为三角锥形.实测值:NH3中∠H—N—H 为106.7°,PH3中∠H—P—H 为93.5°,为什么这两种分子的键角有这种差别?
(5)SF5的VSEPR 模型为三角双锥体,排除孤电子对的分子的空间结构有2 种可能的模型(如图4),哪一种空间结构更合理呢?
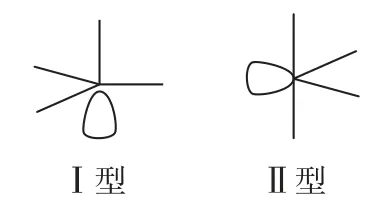
图4
解析(1)根据VSEPR 理论可知,H2O 的成键电子对数为2,孤电子对数为2,空间结构为V形;VSEPR 模型为正四面体形,价层电子对夹角均为109°28′.根据斥力顺序1)应有:
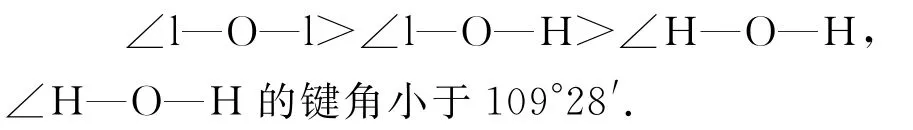
(2)根据VSEPR 理论可知,SO2Cl2的VSEPR模型为正四面体形,S=O 是双键,S—Cl是单键,根据斥力顺序2)应有:

同理,双键—单键之间的键角大于单键—单键之间的键角,例如,C2H4中∠H—C—C>120°(如图5).
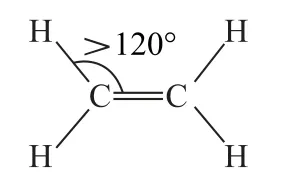
图5
(3)由于电负性F>Cl,根据斥力顺序3)可知,Cl、Cl间的斥力大于F、F间的斥力,所以,∠Cl—S—Cl>∠F—S—F.
(4)NH3中N 的价电子层全充满,PH3中P的价电子层未充满,根据斥力顺序4)可知,NH3中成键电子对间的斥力大于PH3中成键电子对间的斥力,所以键角∠H—N—H>∠H—P—H.
(5)Ⅰ型中有3 个呈90°的∠l—S—F 和3 个呈90°的∠F—S—F,Ⅱ型中只有2个呈90°的∠l—S—F和4个呈90°的∠F—S—F,由于孤电子对的斥力较大,因而Ⅱ型比Ⅰ型稳定.
需要指出的是:该分子中120°夹角的电子对间的斥力与90°夹角的电子对间的斥力相比小得可以忽略不计,无须加以考虑,实测呈Ⅱ型.
2 键角大小的比较
2.1 比较不同物质间的键角大小
1)利用常见物质分子的空间构型直接判断键角大小.
例2比较CO2、CH4、H2O、BF3、NH3、P4键角的大小.
解析根据VSEPR 理论可判断:CH4为正四面体形、NH3为三角锥形、H2O 为V 形、P4为正四面体形.CH4、NH3、H2O 均为sp3杂化,但中心原子的孤电子对依次为0、1、2 对.根据斥力顺序1)可知,孤电子对数增多,对成键电子对的斥力增大,故三者键角依次减小.
CH4与P4相比,CH4的正四面体中心有C原子,P4的正四面体的体内空心,故二者键角有别,CH4的键角大于P4.CH4、NH3、H2O、P4的键角分别为109°28′、107.3°、104.5°、60°.
BF3为平面三角形,CO2为直线形.
键角由大到小依次为CO2>BF3>CH4>NH3>H2O>P4.
2)利用原子的电负性比较键角大小.
例3比较下列各组物质的键角大小:PI3、PBr3、PCl3、PF3.
解析在PF3、PCl3、PBr3、PI3中,中心原子均为P原子,它与电负性不同的卤原子成键时,成键电子对偏向电负性较大的卤原子一边,F 原子的电负性最大,使成键电子对间的距离最远,斥力最小,所以PF3键角最小.随着F、Cl、Br、I电负性依次减小,成键电子对间的距离减小,斥力增大,键角增大.所以键角大小为:PF3<PCl3<PBr3<PI3.
3)利用等电子体规律判断粒子的空间构型,直接判断键角大小.
例4比较下列各组粒子中的键角大小:
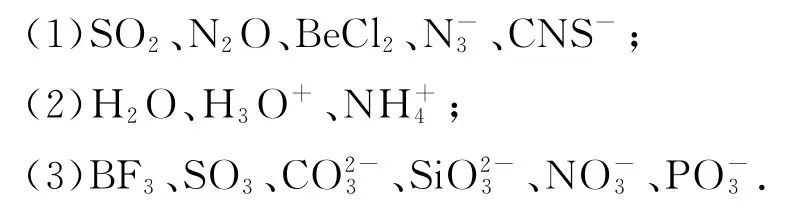
解析(1)SO2为V 形,N2O、BeCl2、、CNS-等都是CO2的等电子体,直线形,键角均为180°,所以,键角:
(2)H2O 为V 形,H3O+与NH3互为等电子体,三角锥形,与CH4互为等电子体,正四面体形,类比H2O、NH3、CH4的键角可知,键角:>H3O+>H2O.
考点链接等电子体:原子总数相同、价电子数总数相同的分子或离子.等电子体具有相似的结构特征.
2.2 比较同一物质中不同共价键的键角大小
例5分别比较甲醛(HCHO)分子、光气(COCl2)分子中不同共价键的键角大小.
解析HCHO 与COCl2分子中的C 原子均属于sp2杂化,平面形结构,由于分子中存在不同的共价键,故键角不是120°.根据斥力顺序2)可知HCHO 分子中:∠H—C—O>∠H—C—H;COCl2分子中:∠Cl—C—O>∠Cl—C—Cl.
3 小结
比较物质中的键角大小的方法:先根据价层电子对互斥理论判断中心原子价层电子对数及空间构型,再结合中心原子的孤电子对数、中心原子的电负性、配原子电负性、分子中化学键的类型等综合判断,同时还要注意一般之外的特殊情况.
链接练习
1.NH4+中H—N—H 的键角比NH3中H—N—H 的键角________(填“大”或“小”),原因是_________.
2.比较NH3和[Cu(NH3)4]2+中H—N—H 键角的大小:NH3________________[Cu(NH3)4]2+(填“>”或“<”),并说明理由.
4.H3O+中H—O—H 键角比H2O 中H—O—H 键角大,原因是_________.
5.H2S键角比H2Se大的原因是________.
链接练习参考答案
2.<;由于[Cu(NH3)4]2+中NH3与Cu2+形成配位键后,N原子没有孤电子对,而NH3中N 原子有1对孤电子对,所以[Cu(NH3)4]2+中H—N—H 键角较大.
4.H2O 中的O 有2对孤电子对;H3O+中O 有1对孤电子对,排斥力较小,键角较大.
5.电负性S 大于Se,H2S中共用电子对间距离较近,排斥力较大,键角较大.
(完)
