关于电负性的一些思考
2018-06-25叶明富陈丙才周安娜贾志刚李春生
叶明富,陈丙才,肖 雪,周安娜,贾志刚,李春生
(1.安徽工业大学化学与化工学院,安徽马鞍山 243002;2.华北理工大学化学工程学院,河北唐山 063009;3.武汉大学化学与分子科学学院,湖北武汉 430072)
[通讯作者]李春生(1981-),男,副教授,硕士生导师,博士,从事能源化学研究。
1 电负性的概念与标度
元素的电离能和元素的电子亲合能分别反映了某元素的原子得失电子的能力。当两个原子形成分子,那么电子对成键电子的吸引能力如何度量呢?为较准确说明在化合物中原子推拉电子的能力大小,需要统一考虑原子结合电子能力与原子失去电子能力的难易程度。原子在化合物中吸引电子能力的标度叫做元素的电负性,也叫电负度[1-4]。通常希腊字母X为电负性的符号。元素的电负性越大,其原子在化合物中吸引电子的能力越强。电负性有多种不同的定义方法,其定量标度各不相同。
1.1 Pauling(鲍林)电负性XP
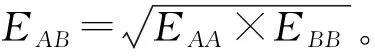
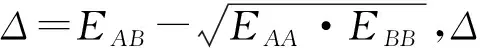

表1 元素的电负性数值表
1.2 Mulliken(密立根)电负性XM
Robert Sanderson Mulliken认为比较原子电负性的大小应考虑原子吸引电子的能力和抵抗丢失电子的能力,前者与电子亲和能成正比,后者与电离能成正比。因此,1934年Mulliken提出了以电离能I和电子亲和能A的平均值作为电负性的量度,I和A都以eV为单位。
Mulliken电负性和Puling电负性的差别是前者是由单一原子的性质来定义的,而后者是由两种原子的成键性质定义的。为了和Pauling电负性进行比较,Mulliken总结出如下关系式:
XP=0.336XM-0.207=0.168(A+I-1.23).
或
1.3 Allred-Rochow(阿莱-罗周)电负性XAR
1957年A.Louis Allred和Eugene G.Rochow定义电负性为核对价电子施加的静电吸引力,可按下式计算:
XAR=3.590Z*/r2+0.744.
其中,Z*为有效电荷,r为原子半径(pm)。
根据此式可以看出电负性的周期性变化规律与电荷和原子半径之间的关系。阿莱-罗周电负性的值与鲍林的电负性数值吻合得很好。
1.4 Allen(阿伦)电负性XA
1989年,Leland C.Allen根据光谱数据,以基态自由原子价层电子的平均单电子能量为基础获得了主族元素的电负性:
其中,m和n分别为p轨道和s轨道上的电子数,Ep和Es分别为p轨道和s轨道上的电子的平均能量。
表2列出部分元素的XP、XM、XAR电负性值[4]。
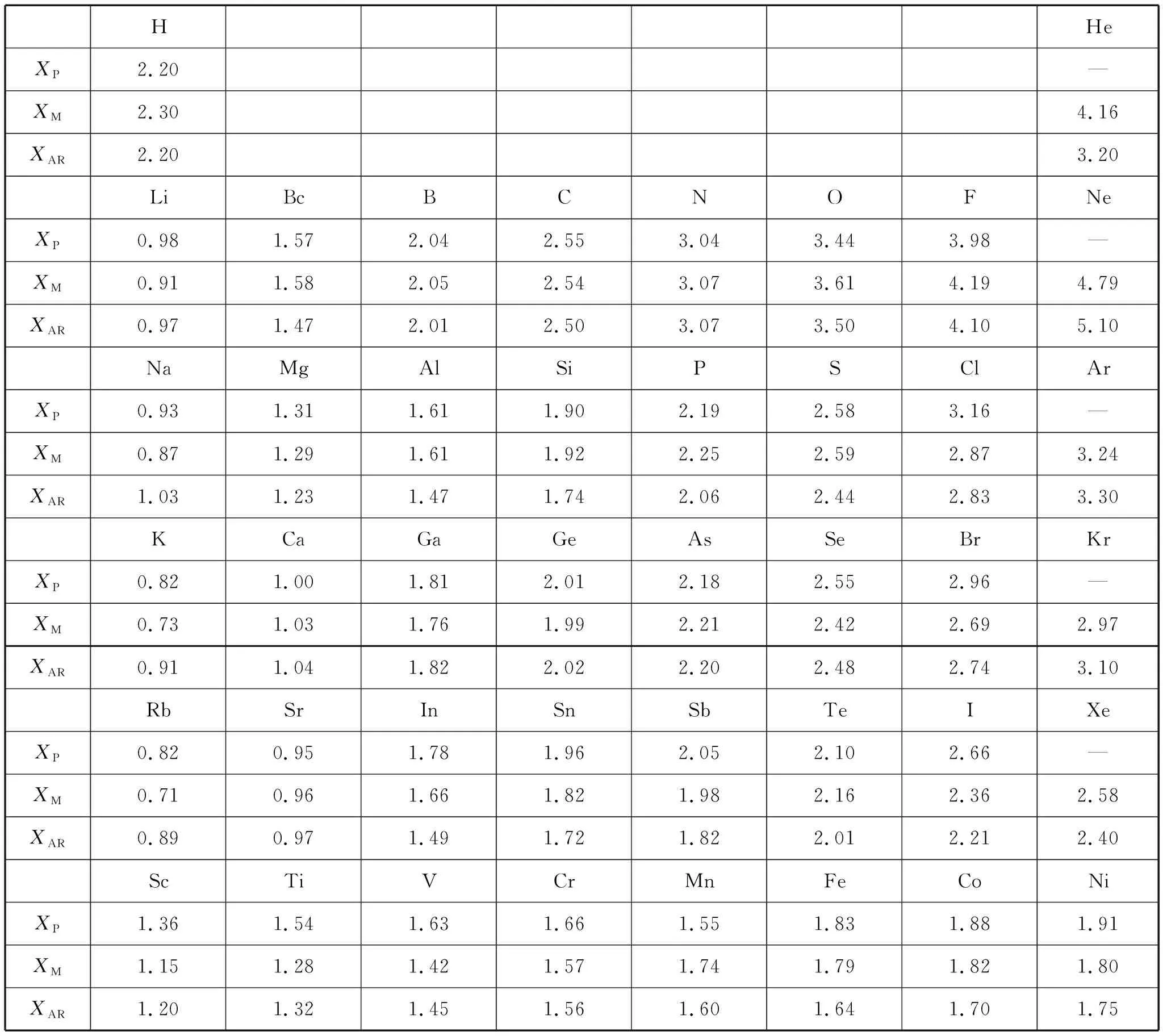
表2 部分元素的电负性值
2 电负性的影响因素和变化规律
电负性X并非单独原子的固有特性,它是表示原子在分子中吸引电子的能力。那么,原子上所带的电荷、原子在成键时采用的杂化形式以及周围其他原子环境都会对电负性有不同程度的影响[5-7]。
2.1 原子的杂化(hybridization)方式对电负性的影响
若干不同类型、能量相近的原子轨道重新组合形成一组新轨道,该新轨道称为杂化轨道。若其中含s成分多,则其原子的电负性越大。例如氢、碳原子在杂化轨道sp、sp2和sp3中s成分分别占50%、33%和25%,其中,氢、碳相应的电负性分别为4.67、3.94、3.08和3.29、2.75、2.48。这是因为s轨道的能量较低,s电子的钻穿效应较强,有较大的吸引电子的能力。
通常取氮的XP为3.04,碳的XP为2.55,这是对应于sp3杂化轨道时的电负性。当它们为sp杂化时,此时碳的XP约接近于氧(3.44),氮的XP甚至比氟(3.98)还要大。
2.2 键联原子诱导作用对电负性的影响
因受周围原子诱导作用的影响可以导致原子的电负性发生变化。例如在三氟碘甲烷中碳原子的电负性就大于碘甲烷中的碳原子的电负性。其根源是氟的电负性远大于H(2.2),在氟原子的诱导作用下,三氟碘甲烷中碳的电负性显著增加,甚至超过了I(2.66)。结果导致在这两种化合物中C-I键的极性方向完全相反;在三氟碘甲烷中碳带负电,而在碘甲烷中碳带正电。
鉴于中心原子受其他原子影响导致电负性值改变[如上述甲基(-CH3)和三氟甲基(-CF3)],Wilmshurst等人提出了基团电负性的概念,一个给定的基团对应特定的电负性值(表3)。

表3 一些常见基团的电负性值(Pauling标度)
2.3 原子所带电荷对电负性的影响
原子所带电荷对电负性的影响[8]可以通过中性原子的电负性加修正项计算:
X=a+bδ.
其中,a代表中性原子的电负性,δ为分子中原子所带的部分电荷(中性原子的δ=0),b为电荷参数,是电负性随电荷改变而改变的变化率。难以极化、电荷小的原子b值相对较大;易极化、电荷大的原子b值相对较小。例如Cu2+和Cu+的电负性值分别为2.0和1.9,Fe3+和Fe2+的电负性值分别为1.9和1.8。
2.4 电负性的周期性变化规律
电负性在周期表中有一定的递变规律,同一主族元素的电负性一般随着周期的增加而减小(副族元素的电负性没有明显的变化规律),同一周期的元素的电负性从左向右随着族序数的增加而增加。因此,电负性大的元素集中在周期表的右上角,电负性小的元素在左下角。同一周期中稀有气体电负性最高,这是因为它们的第一电离能I1特别大,具有极强的保持电子的能力。通过实验证实,氙和碳的电负性相近,可以形成共价键;氙比氟、氧的电负性低,可以形成氟化物和氧化物。
3 电负性的应用
3.1 衡量元素金属性和非金属性
总体来看,金属的电负性值小于非金属的电负性值[9]。非金属元素的XP绝大多数在2.0以上,电负性大而原子半径小的几种非金属有N(3.0)、O(3.4)、F(4.0)。而金属的电负性一般在2.0以下,碱金属和碱土金属(除去Be、Mg)电负性均在1.0和1.0以下。根据电负性的变化规律,同一周期中从左到右元素XP递增,元素的非金属性也逐渐增强;同一主族中从上到下XP递减,元素的非金属性也依次减弱。但过渡元素电负性变化不明显。在周期表中,右上方的元素氟是电负性最大的元素,而左下方的铯则是电负性最小的元素。氟的非金属性最强而铯的金属性最强,故电负性数值是判断元素金属性和非金属性的重要参数。应注意的是,元素的非金属性和金属性之间没有决然的界限,以电负性2.0划分非金属元素和金属元素也不是绝对的。
3.2 判断化学键的键型
电负性数据是研究化合物中键型变异的重要参数,电负性相差大的元素相互间结合以离子键为主(例如NaCl),电负性相近或相同的非金属元素之间相互结合以共价键为主(例如H2、NO、CH4),电负性相近或相同的金属元素之间以金属键结合,形成合金或金属。离子键、共价键和金属键是三种极限键型,他们之间有一系列的过渡性化学键[10]。
4 结语
不同的电负性标度方法得到的电负性数值也不同,但是差异不大,其中鲍林标度应用较为广泛。电负性作为化学领域里重要的原子参数,对分析化学键键型、元素周期律、元素的金属性和非金属性的意义重大。80多年来,从电负性概念的建立到人们对电负性的认识逐渐深入,过程是充满艰辛的。目前,电负性的概念仍处于研究和发展中,应用领域也在不断拓宽。
[参考文献]
[1]宋天佑,程鹏,徐家宁,等.无机化学(上册)[M].2版.北京:高等教育出版社,2015.
[2]华彤文,王颖霞,卞江,等.普通化学原理[M].4版.北京:北京大学出版社,2013.
[3]李克艳,薛冬峰.电负性概念的新拓展[J].科学通报,2008(20):2442-2448.
[4]唐宗薰.中级无机化学[M].2版.北京:高等教育出版社,2009.
[5]喻典.一种价态元素电负性的新标度[J].无机化学学报,2005(7):955-959.
[6]王广昌.电负性和价态[J].化学通报,1983(7):39-45.
[7]聂长明.基团电负性[J].武汉大学学报:自然科学版,2000(2):176-180.
[8]胡振明.原子的价态电负性与价键轨道特性[J].化学通报,1993(10):54-58.
[9]武永兴.浅谈电负性[J].大学化学,1998(3):46-49.
[10]李克艳,薛冬峰.电负性概念的发展与功能无机新材料的设计研究[J].河南大学学报:自然科学版,2012(1):24-36.
