元素不同氧化态电负性的一种简单标度方法
2020-12-21梁永锋员蓉曹江平马新贤安玉民
梁永锋,员蓉,曹江平,马新贤,安玉民
(宁夏师范学院化学化工学院,宁夏固原756000)
1932 年Pauling 第一次提出电负性概念以来,已有八十多年的历史[1]。八十多年来,电负性已成为化学科学中应用最广泛的概念之一。许多专家学者对电负性进行了大量研究,取得了令人瞩目的成就。但是,教学中关于这一概念的几个基本问题仍然值得思考和探讨。
(1)电负性的物理意义不是十分清楚。Pauling 将电负性定义为“分子中原子吸引电子的能力”,而这种能力究竟指什么,是能还是力?不同的学者,基于自身对电负性概念的不同理解,提出了不同的电负性标度,例如,Pauling认为电负性是能量标度(Xp),而A.L.Allred和E.G.Rochow 则定义电负性为核对价电子施加的静电吸引力(XAR)[2-3]。
(2)电负性是“分子中原子吸引电子的能力”,然而,根据电负性均衡原理即“在化学键形成时,两个原子的电负性相等”[4-5]。分子中原子的电负性应该相等的原理与Pauling电负性的概念显然是矛盾的。
(3)电负性难以在理论基础上定量地解释和预见问题。
(4)如何测量元素的电负性?时至今日,电负性仍然不能直接测量,只能间接计算。
(5)按照Pauling 的定义,电负性是“分子中原子吸引电子的能力”。当一种元素处于不同的价态时,元素的电负性应该是其价态的函数。
1 关于电负性物理意义的探讨
1.1 电负性定义
在Pauling 电负性定义的基础上,如果把电负性定义为“电负性是原子的一种性质,是原子对参与成键的属于自己的价电子的吸引能力”。
电负性的这种定义优势是:①电负性的概念(原子吸引自己参与成键电子的量度)和电负性均衡原理的矛盾就会自然消除;②排除了键合原子对电负性的影响;③电负性值就有可能更为确定。
1.2 电负性的物理意义
如果电负性指的是原子对参与成键的属于自己的价电子的吸引能力,这样原子的这种吸引能力应该和参与成键的价电子数目及其能量有关,也就是和原子的价态以及这些价态的能量有关。显然,电负性是分子中原子吸引电子的一种能量大小的量度。
2 元素不同氧化态原子电负性的定量计算
既然电负性是原子对参与成键的属于自己的价电子吸引能力大小的量度,当元素的氧化态为零时,其电负性的大小可以用电子亲和势EA来量度,即:

当原子的氧化态为+1时,其电负性的大小可以用第一电离势I1和电子亲和势EA共同来量度,即:

同理,当元素的氧化态为i时,就有:

电负性实际上是各种元素的原子吸引电子能力的一种比较,因此,选取Ne作为基准元素,并且规定Ne的电负性为4.00,而且,相同氧化态原子ki相等,其余元素各氧化态原子的电负性则可用下式计算:
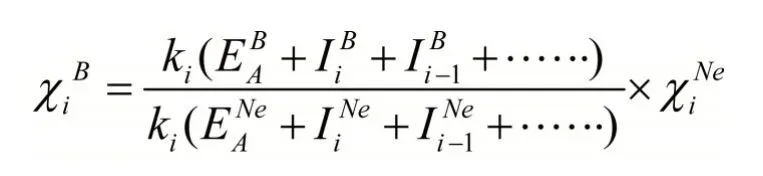
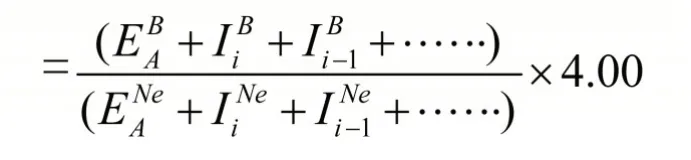
利用上式计算的元素常见氧化态原子的电负性列于表1。
将表1 中元素氧化态为+1 的原子电负性和元素常见氧化态的电负性数据按元素周期表的形式排列成表2。
3 讨论与结论
(1)通过上式计算的元素各氧化态原子的电负性值与元素周期表具有非常好的对应关系,其变化规律与元素周期律相吻合。
(2)计算结果表明,大多数元素不同氧化态原子的电负性值随着氧化数的升高而增大;但元素氯、溴、硫、砷、硒等少数元素的电负性随着氧化数的升高而减小。氧化态原子电负性的这一特点,正好解释了这些元素的含氧酸及其盐一般是低氧化态不稳定而高氧化态比较稳定的事实。
(3)元素氧化态原子电负性更能反映出元素的第二周期性的特征,而且其变化趋势与元素在不同价态的Eθ变化趋势相同。
(4)由此得出的元素氧化态原子电负性值与Pauling电负性值相比,更能反映出配合物的Irving-Williams序列:
Mn2+(1.42)<Fe2+(1.56)<Co2+(1.65)<Ni2+(1.73)<Cu2+(1.97)>Zn2+(1.76)
通过以上讨论,表明元素不同氧化态原子电负性的标度方法是科学的、合理的,结论是正确的,并且能用氧化态原子的电负性解释许多化学事实。但是,不可否认的是,影响元素电负性的因素很多,本文只是对电负性概念及其含义进行粗浅的讨论,对氧化态原子电负性的标度进行初步探索。
