人工智能对使用呋塞米的住院患者发生急性肾损伤及死亡风险的个性化预测价值
2023-12-06崔连顺徐翎钰李天阳管陈杨成宇张凝馨宋卓徐岩
崔连顺 徐翎钰 李天阳 管陈 杨成宇 张凝馨 宋卓 徐岩
(1 青岛大学附属医院肾病科,山东 青岛 266003; 2 青岛大学第一临床医学院; 3 东营市人民医院肾内科)
急性肾损伤(acute kidney injury,AKI)是一种常见的临床综合征,以患者短时间内血肌酐(SCr)突然升高、尿量减少为特征,常伴有多种并发症[1-2]。住院患者AKI的患病率为10%~15%,其中危重患者达30%~60%,病死率高达50%[3-4]。而通过扩容增加肾脏血流灌注是改善患者AKI的主要手段[5]。呋塞米是治疗充血性心力衰竭和水肿最常用的利尿药之一,AKI患者体内的水电解质紊乱难以纠正,通常会使用大剂量呋塞米增加尿量,逆转肾损伤[6-7]。目前呋塞米与AKI之间的关系仍未完全阐明,研究发现预防性使用呋塞米反而会导致AKI发生。早期识别使用呋塞米后发生AKI的风险因素并评估预后,对于指导呋塞米的临床用药具有重要意义。
机器学习(ML)是人工智能(AI)领域的重要分支,对大样本及高维数据分析极具优势,经常被用于疾病预测、预后分析等医疗工作。本研究基于多种ML算法构建使用呋塞米的住院患者继发AKI及死亡风险的预测模型,并对最优模型预测效能进行全面评估。通过多种SHAP图在总人群及患者个体层面对概率决策过程进行解析,以实现对患者的个体化预测。
1 资料与方法
1.1 一般资料
本研究为单中心回顾性研究,选取2017年10月—2020年10月我院使用呋塞米的住院患者共计18 998例。患者纳入标准为:①住院期间使用呋塞米(以入院为起始时间,至末次SCr检测时间为止使用过呋塞米,平均剂量>40 mg/d[8])且病历资料完整者;②使用呋塞米后SCr检测≥2次者。患者排除标准:①年龄<18岁者;②入院诊断为AKI,或在入院第1天SCr改变≥26.5 μmol/L者;③两次SCr检测间隔时间>7 d者;④患有终末期肾病、进行血液透析或肾脏移植者;⑤住院时间<24 h者。
根据文献数据及临床经验[9-10],将包括人口信息学特征(如年龄、性别、吸烟史、饮酒史、体质量指数)、实验室指标(如血常规、肝肾功能等)、合并症(如糖尿病、高血压、冠心病等)、合并用药(如肾毒性抗生素、非甾体类抗炎药、质子泵抑制剂、降压药、调脂药等)等200余个临床指标纳入本研究的资料收集范围,通过正则表达式提取住院电子病历中患者的上述信息,并基于2012年全球肾病改善(KDIGO)标准[11]对所有患者进行AKI诊断及分期。
1.2 模型的选择、构建与解析
将纳入的病例以76.5∶8.5∶15.0的比例随机分为训练集、验证集与测试集。训练集与验证集用于建立与优化模型,使用10折交叉验证与网格搜索确定模型最优参数并防止过度拟合,测试集用于测试模型预测效能。使用轻量梯度提升机(LightGBM)、梯度提升机(GBM)、朴素贝叶斯(NB)分类器、随机森林(RF)、K最近邻(KNN)、支持向量机(SVM)和逻辑回归(LR)等多种ML模型,预测使用呋塞米的住院患者发生AKI及死亡风险,并通过比较曲线下面积(AUC)、精确率、召回率、准确度、F1分数、Brier分数和马修斯相关系数选择最优模型用于后续分析。由于ML模型的“黑匣子”效应,其中的运算过程往往难以展现,使预测结果的可信度受到质疑。本研究使用SHAP条形图、摘要图、力图及决策图在总人群及患者个体层面对最优预测模型中的特征进行可视化分析。
1.3 统计学分析
使用Python语言(3.9.13)以及Visual Studio Code(1.81.1)集成开发环境进行数据分析。分类变量以例(率)表示,比较采用χ2检验,以P<0.05为差异有统计学意义。绘制受试者工作特征(ROC)曲线并计算AUC,通过决策曲线分析(DCA)、精确率、召回率、F1分数、Brier分数和马修斯相关系数等指标评价模型效能。
2 结 果
2.1 发生与未发生AKI的使用呋塞米患者病死率比较
本研究纳入患者18 998例,其中发生AKI患者4 803例,非AKI患者14 195例,AKI发生率为25.28%,AKI的1、2、3期发生率分别为22.58%、2.01%、0.70%。全部患者中,AKI死亡患者共502例(病死率10.5%),非AKI死亡患者共306例(病死率2.2%),两者差异有显著性(χ2=606.542,P<0.05)。
2.2 使用呋塞米患者AKI发生及死亡风险预测模型的评估
排除患者缺失值≥15%[12]的临床指标后,最终有175个指标纳入构建的预测模型。基于网格搜索确定模型超参数,并通过输出AUC值等确定最优模型。ROC曲线显示,训练集及验证集的8种ML模型中LightGBM模型区分度最好(图1),LightGBM模型预测AKI发生风险的AUC、精确率、召回率、准确度、F1分数、Brier分数和马修斯相关系数分别为0.814、0.677、0.358、0.800、0.468、0.139和0.387,LightGBM模型预测死亡风险的AUC、精确率、召回率、准确度、F1分数、Brier分数和马修斯相关系数则分别为0.949、0.720、0.261、0.959、0.383、0.031和0.418。对LightGBM模型测试集数据进行进一步分析显示,AKI发生及死亡风险预测的AUC分别为0.803(95%CI=0.793~0.813)以及0.921(95%CI=0.917~0.926),结合ROC及DCA曲线分析,该模型预测AKI发生与死亡风险均具有较好的校准度和临床实用性(图2)。
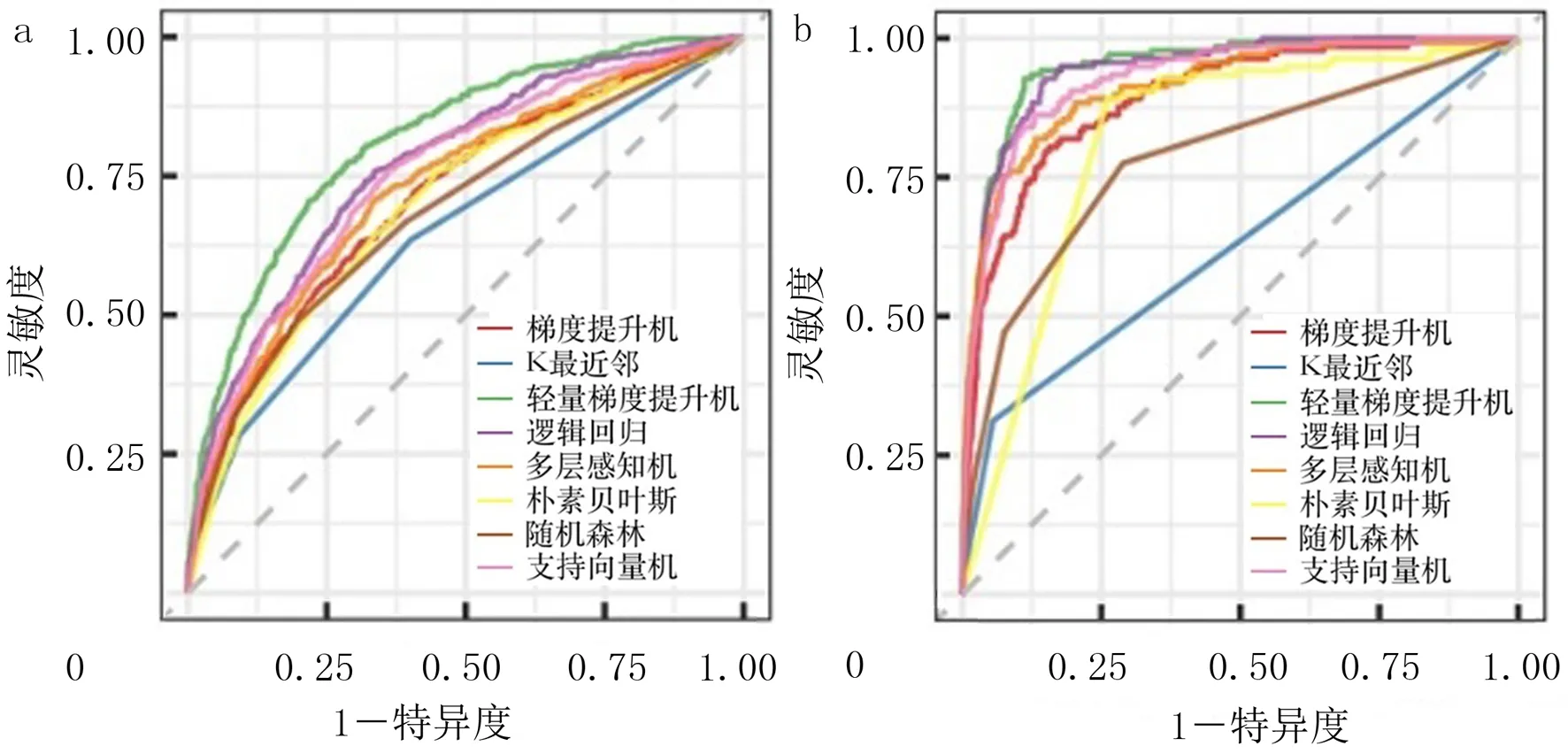
a:患者AKI发生风险的ROC曲线,b:患者死亡风险的ROC曲线
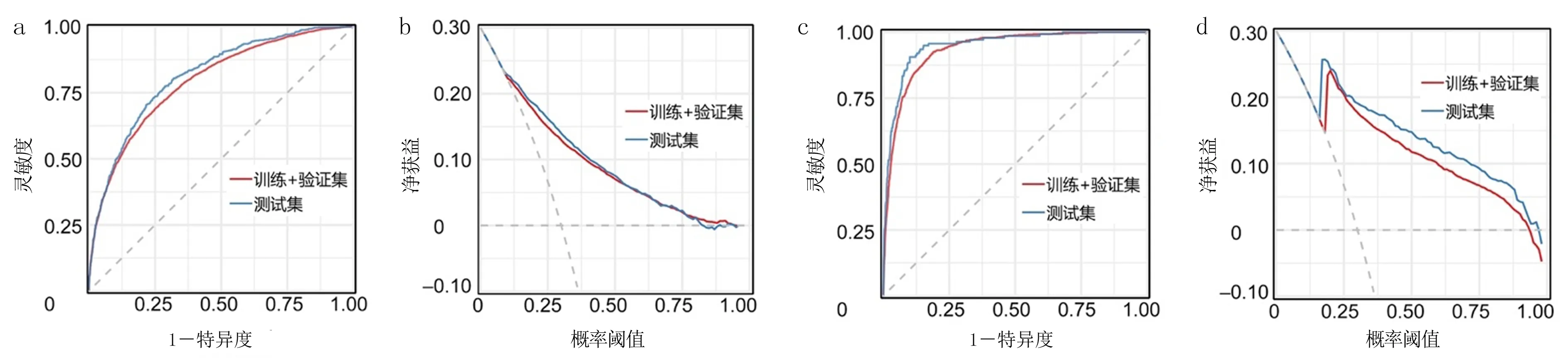
a:患者AKI发生风险的ROC曲线,b:患者AKI发生风险的DCA曲线,c:患者死亡风险的ROC曲线,b:患者死亡风险的DCA曲线
2.3 LightGBM预测模型的可视化分析
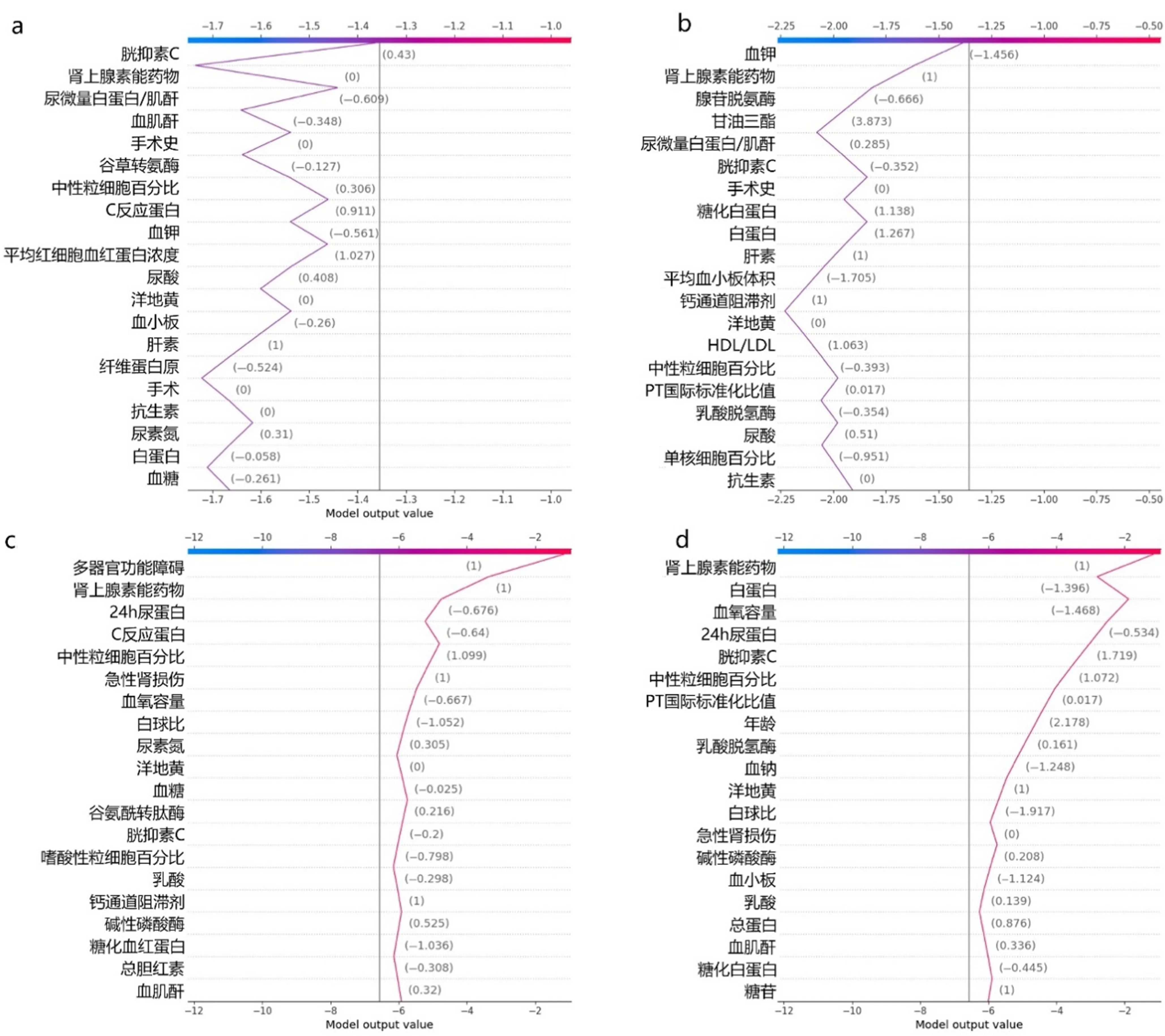
为明确使用呋塞米的住院患者AKI发生与死亡风险的关键指标,我们使用SHAP法对预测模型中的指标进行了重要性排序及可视化分析。SHAP条形图及摘要图显示,使用呋塞米后患者的血肌酐、血清胱抑素C、尿微量白蛋白/肌酐比值、联合使用肾上腺素及联合使用肝素是影响AKI发生的5个最主要因素(图3a、b);使用呋塞米后的24 h尿蛋白定量、血浆凝血酶原时间国际标准化比值、血浆血小板计数、联合应用肾上腺素及住院期间发生AKI是导致使用呋塞米患者死亡的5个最主要因素(图3c、d)。在SHAP力图中,箭头的长度对应于特征的相关SHAP值,箭头越长表示特征值的重要性越大(图4);在SHAP决策图中线的上下轨迹反映了相应特征对模型输出的影响(图5)。SHAP力图与决策图显示了具有相似AKI发生或死亡概率的使用呋塞米的住院患者具体的决策过程。

a:模型预测患者AKI发生风险的SHAP条形图,b:模型预测患者AKI发生风险的SHAP摘要图,c:模型预测患者死亡风险的SHAP条形图,d:模型预测患者死亡风险的SHAP摘要图
a、b:AKI风险相似的2例患者LightGBM预测模型的SHAP决策图,c、d:死亡风险相似的2例患者LightGBM预测模型的SHAP决策图
3 讨 论
AKI是一种以短时间患者SCr突然升高及尿量减少为特征的临床常见的综合征,目前呋塞米的使用与AKI发生的关联存在争议[13-14,11]。既往研究表明呋塞米在成年患者的AKI预防和治疗方面无明显临床优势,呋塞米治疗可能会延长住院时间,对ICU住院患者不利[15-16]。有研究显示,呋塞米的平均使用剂量高于40 mg/d即可能显著增加患者发生AKI风险[8]。我们的前期研究也发现,住院患者AKI的发生与呋塞米的使用密切相关[17]。本研究中呋塞米相关AKI总体发病率高达25.28%,与前期HO等[18]报道的21.62%的结果相近,如此高的发生率可能与呋塞米的长期、大剂量使用有关[8]。此外本研究发现,使用呋塞米的AKI患者病死率显著高于未发生AKI患者,因此呋塞米相关AKI患者带来的死亡风险不应被忽视。
为精准预测使用呋塞米的住院患者发生AKI的风险因素,本研究使用LightGBM等8种机器学习方法,对18 998例使用呋塞米的住院患者进行AKI发生及预后分析,并获得了影响AKI发生和全因死亡的主要因素,提示在呋塞米使用时密切关注患者肾功能,有助于早期识别使用呋塞米后易发生AKI及预后不良的患者。ML预测模型是指利用机器学习的方法对现有数据进行分析和建模,从而预测某指标未来趋势及结果,该方法在医学领域已得到广泛应用[19]。LightGBM模型在平衡相对简单的模型结构、变量选择以及对结果进行通俗解释方面具有创新性,其通过使用非线性交互作用模型,可以灵活预测涵盖大量患者、多种诊断和合并症的结果[20]。通过ML的方法,本研究构建了使用呋塞米的住院患者AKI发生及死亡风险因素的预测模型,其中LightGBM模型在AKI诊断及死亡风险的预测方面均表现出优越的性能,预测概率高达0.814和0.949,结合ROC及DCA决策曲线评估,该模型具备良好的预测能力和临床适用性。
对结果缺少解释是目前常规使用的风险预测模型(如LR模型等)普遍存在的不足之处,也是此类模型难以进行临床推广的重要原因之一。本研究使用SHAP值对预测AKI诊断及死亡风险的主要指标进行可视化分析,并将其进行重要性排序,发现使用呋塞米后的血肌酐、血清胱抑素C、尿微量白蛋白/肌酐比值、联合使用肾上腺素及联合使用肝素是影响AKI发生的5个最重要因素;而使用呋塞米后24 h尿蛋白定量、血浆凝血酶原时间国际标准化比值、血浆血小板计数、联合应用肾上腺素及住院期间发生AKI是导致使用呋塞米患者死亡的5个最重要因素。最新研究显示,血清胱抑素C是评估肾小球滤过率的理想指标[21]。本研究结果亦提示,血清胱抑素C对于使用呋塞米患者的AKI发生风险预测贡献度仅次于SCr。已有研究证实,急性主动脉夹层患者的凝血功能障碍的存在与AKI发生风险增加相关,凝血功能障碍的严重程度则与AKI发生率呈正相关[22]。本研究中,凝血相关指标同样是使用呋塞米患者AKI发生及全因死亡风险的主要预测指标,这可能与肾脏血流丰富,对血流动力学变化敏感有关,该结论也提示临床使用呋塞米患者应关注凝血功能与肾功能之间关系。
本研究存在一定不足之处。首先,这是一项单中心研究。其次,AKI是一种非常复杂且难以预测的疾病,尽管我们收集了患者近乎所有指标,并使用了合理的统计方法来消除偏差,但仍可能存在被忽略的导致AKI发生的潜在因素。另外,本研究未区分AKI的病因及使用呋塞米的原因,并纳入了液体潴留的患者,因此使结果产生的偏差需要进一步的研究来纠正。
本研究为呋塞米的临床应用提供了必要证据,提示在呋塞米使用时应密切关注患者肾功能的变化,此有助于早期识别使用呋塞米后易发生AKI患者及预后不良患者。未来可以进一步搭建在线预测网站进行呋塞米使用患者的实时AKI发生与死亡风险的预测,实现该模型的临床转化与推广应用。
伦理批准和知情同意:本研究涉及的所有试验均已通过青岛大学附属医院医学伦理委员会的审核批准(文件号QYFYWZLL25838)。所有试验过程均遵照《涉及人的生物医学研究国际伦理准则》的条例进行。受试对象或其亲属已经签署知情同意书。
作者声明:崔连顺、徐翎钰、李天阳、管陈、徐岩参与了研究设计;崔连顺、徐翎钰、管陈、杨成宇、张凝馨、宋卓、徐岩参与了论文的写作以及修改。所有作者均阅读并同意发表该论文,且均声明不存在相关利益冲突。
