超声下肺腺癌血流分级与肿瘤组织MVD、VEGF、HIF-1α表达及临床分期的关系及其意义
2023-12-06雷威李慧
雷威 李慧
(1 郑州大学第一附属医院超声科,河南 郑州 450052; 2 河南大学第一附属医院超声科)
目前,全球范围内肺腺癌的发病率逐年上升[1],并且在早期即可发生血液以及淋巴结的转移[2]。微血管密度(MVD)能够定量地反映血管的生成情况,与肿瘤患者的预后紧密相关[3]。血管内皮生长因子(VEGF)是参与肿瘤血管生成的主要正向调节因子,与肿瘤血管的发生、增殖以及肿瘤细胞浸润转移等均有关[4]。缺氧诱导因子-1α(HIF-1α)是肿瘤细胞缺氧的核心因子,可参与血管生成、细胞凋亡、肿瘤细胞侵袭、转移等过程[5]。超声检测具有无创、无辐射、切面灵活等优点,但超声下肺腺癌血流分级对患者病情早期评估的价值尚不明确。本研究通过回顾性分析本院收治的108例确诊为肺腺癌患者的临床资料,探讨超声下肺腺癌血流分级与肿瘤组织中MVD、VEGF、HIF-1α阳性表达情况及临床分期的关系及其意义。
1 资料与方法
回顾性分析2015年1月—2019年12月河南大学第一附属医院收治的108例肺腺癌患者的临床资料。纳入标准:①经手术切除标本病理学检查或肺组织活检确诊为肺腺癌者[6];②影像学检查首次发现肺内占位性病变者;③超声检测前均未接受放疗、化疗及手术治疗等任何形式的治疗者;④临床资料完整者。排除标准:①有其他部位肿瘤者;②有心、肝、肾等重要器官疾病者。
收集所有患者一般资料,包括年龄、性别、肺腺癌TNM分期、肿瘤组织分化情况;收集患者肿瘤血流分级超声检测结果,依据文献[7]将所有患者分为血流0级(A)组、Ⅰ级(B)组、Ⅱ级(C)组、Ⅲ级(D)组;收集患者肿瘤组织的MVD值及VEGF、HIF-1α表达情况,其中MVD值采用Weidner法来进行计数[8];VEGF、HIF-1α表达分为阴性、弱阳性、中等阳性、强阳性4个等级[9],并计算患者肿瘤组织中VEGF、HIF-1α的阳性表达比例。
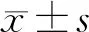
2 结 果
2.1 一般资料
108例肺腺癌患者中,男77例,女31例;年龄42~75岁,平均(56.13±9.76)岁;肺腺癌临床分期情况:Ⅰ期18例,Ⅱ期46例,Ⅲ期31例,Ⅳ期13例;组织分化情况:低分化19例,中分化43例,高分化46例。血流分级平均(1.57±0.28)级,其中A组26例,B组19例,C组38例,D组25例。
2.2 患者肿瘤组织MVD值及VEGF、HIF-1α阳性表达情况比较
4组患者肿瘤组织MVD值和VEGF、HIF-1α阳性表达比例比较差异均有显著性(F=116.487,χ2=7.143、6.982,P<0.05);各组间肿瘤组织MVD值比较差异均有显著性(P<0.05);C、D组VEGF、HIF-1α阳性表达比例均高于A组,D组高于B、C组(χ2=4.589~112.502,P<0.05)。见表1。
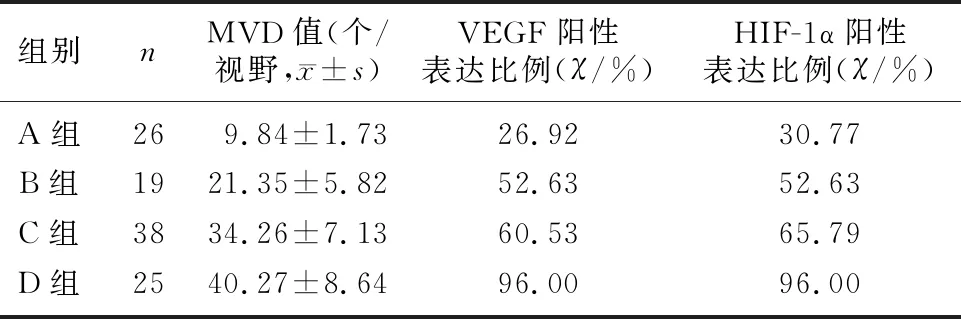
表1 4组患者的MVD值及VEGF、HIF-1α阳性表达情况比较
2.3 患者血流分级与肿瘤组织VEGF、HIF-1α阳性表达的相关性
肺腺癌血流分级与肿瘤组织中VEGF、HIF-1α阳性表达情况均呈现正相关(r=0.791、0.713,P<0.05)。见表2。
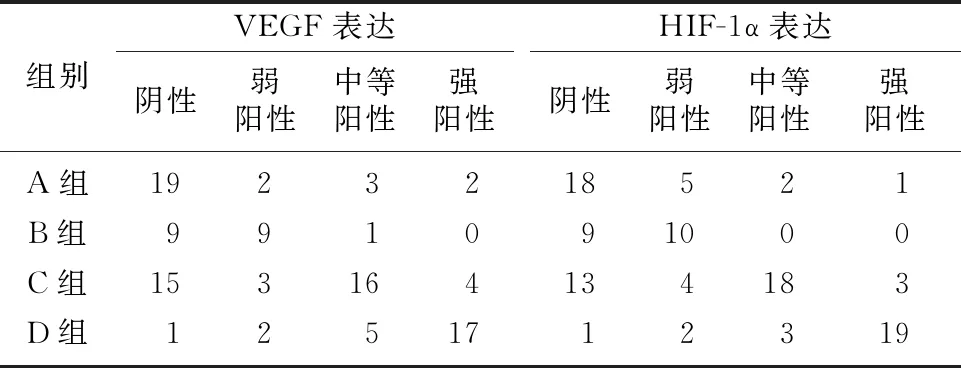
表2 血流分级与VEGF、HIF-1α表达的相关性(例)
2.4 肺腺癌患者血流分级与临床分期的相关性
肺腺癌患者血流分级与临床分期呈正相关(r=0.705,P<0.05)。见表3。

表3 肺腺癌患者血管生成与临床分期的相关性(例)
3 讨 论
目前临床上可通过血流储备分数检测技术、CT灌注成像技术等多种方法检测肺腺癌患者的血供情况,其中超声检测方法较为常用,并且还具有简便、无创等的优势[10-13]。血管生成是肺腺癌细胞生长的必要条件,与血流分级密切相关,MVD和组织中VEGF、HIF-1α等血管形成相关因子仅可应用于术后的病理检查,无法评估肺腺癌患者术前病情,超声下血流分级则可在术前对肺腺癌患者的血流情况进行分析,能够直观地反映肿瘤组织的血供状态,可在术前对患者的病情进行评估。
血液循环可为肺腺癌的癌细胞增殖、转移提供必需的营养物质[14],MVD以及组织中的VEGF、HIF-1α表达水平均为反映肿瘤组织血管生成情况的指标。MVD是衡量肿瘤血管密度、评估肿瘤血管生成程度的指标。在肺腺癌中,MVD值越高表示血管生成程度越活跃,血管密度也越高,可为肿瘤组织提供足够的氧和营养物质,促进其生长和扩散,因此,MVD值可作为肺腺癌诊断和治疗参考依据之一[15]。VEGF是血管生成早期的持续性启动因子,具有高度特异性,可促进血管内皮细胞生成,诱导新血管形成,并且还可促进血管通透性的增高和细胞外基质变性,进一步促进血管内皮细胞迁移、增殖和血管形成,对肺腺癌血管和淋巴管生成、淋巴结转移等均有促进作用[16]。HIF-1α则是调节细胞对缺氧环境适应的蛋白质,是在缺氧状态下发挥活性的转录因子,研究表明,HIF-1α在缺氧相对明显、分化程度较低的肿瘤组织中表达水平显著升高[17],可参与缺氧反应基因的转录、表达及血管生成、肿瘤生长及能量代谢等过程[18]。目前研究报道,肺腺癌组织VEGF的高表达与患者的生存期呈负相关,而与MVD值则呈正相关[19]。另有研究表明,肿瘤组织中VEGF、HIF-1α的表达与肝癌血管生成密切相关,且肿瘤血流分级越高,VEGF、HIF-1α阳性表达比例越高,且均呈正相关[20]。本研究结果显示,在肺腺癌患者中,超声下肿瘤组织的血流分级越高,MVD值和组织中VEGF、HIF-1α表达水平越高。这些结果提示,超声下血流分级可作为评估肺腺癌患者术前病情的有效指标。与传统的术后检测患者肿瘤组织中MVD值及VEGF、HIF-1α表达水平以评估患者病情相比,超声下血流分级可以较为直观地反映病变位置的血供状态,间接反映肿瘤组织中VEGF、HIF-1α表达水平,有助于医生在初诊或术前了解患者病情,以选择合适的诊疗方案。
最近有研究显示,乳腺癌患者超声血流参数(血流搏动指数、血流阻力指数、峰值流速、容量转移常数、速率常数值)及MRI定量动态增强参数的数值越高,表明疾病分期越高,肿瘤的分化程度越低[21],提示在恶性肿瘤组织中,肿瘤的血供越丰富,超声血流参数变化越显著。本研究结果与此一致,本研究显示肺腺癌患者血流分级与临床分期呈正相关,即随着血流分级的增加,患者的临床分期也随之升高。这提示我们可以通过血流分级来评估肺腺癌患者的临床分期,并在临床上进行更加精准的治疗和管理。而且超声下血流分级是一种完全无创的、简便易行的检查方法,成本低,但诊断的准确度高,有望为肺癌患者的治疗提供指导帮助。
综上所述,肺腺癌患者超声下血流分级与肿瘤组织中MVD值和VEGF、HIF-1α阳性表达比例均呈正相关,且血流分级与临床分期呈正相关。超声下血流分级可以用于评估肺腺癌的MVD值以及VEGF、HIF-1α阳性表达特征和临床分期,以辅助临床医生制定个性化诊疗方案,建议在临床中推广。
伦理批准和知情同意:本研究涉及的所有试验均已通过河南大学第一附属医院科学伦理委员会的审核批准(文件号2021-03-036)。受试对象或其亲属已经签署知情同意书。
作者声明:所有作者均参与了研究设计及论文的写作和修改。所有作者均阅读并同意发表该论文,且均声明不存在利益冲突。
