神经调节素1β对氧糖剥夺/复氧诱导PC12细胞损伤的保护作用及其机制
2023-12-06孙珊珊于曦翟秋月于竹芹
孙珊珊 于曦 翟秋月 于竹芹
(1 山东大学齐鲁医院(青岛)神经内科,山东 青岛 266035; 2 青岛大学医学部中西医结合中心; 3 青岛大学医学院松山医院内科)
随着世界人口的老龄化,缺血性卒中的发病率逐年增加[1]。目前普遍认为,脑缺血后血液供应恢复对于挽救缺血区受损组织、降低缺血性卒中患者的残疾率和病死率至关重要。然而,再灌注也会引起一系列细胞应激反应,加重神经血管损伤,导致血-脑屏障破坏和神经细胞死亡,造成脑缺血再灌注损伤[2-4]。据报道,神经调节素1β(NRG1β)在大脑海马、大脑皮质、梨状皮质等部位均有表达,可减轻脑卒中后的脑损伤[5-6]。本课题组的前期研究发现,NRG1β可通过调节大鼠脑缺血再灌注损伤后缺血半影区神经细胞的JNK和Cdk5信号转导通路发挥神经保护作用[7-8]。最新研究表明,缺血半影区神经细胞铁死亡与脑缺血再灌注损伤密切相关[9-10]。GUAN等[11]指出,香芹酮可通过增强缺血半影区神经细胞谷胱甘肽过氧化物酶4(GPX4)的表达来抑制铁死亡,从而修复缺血再灌注损伤引起的海马神经元损伤。因此,抑制铁死亡可能是干预脑缺血再灌注损伤的潜在治疗方法。基于上述研究,本研究将构建PC12细胞氧糖剥夺/复氧(OGD/R)模型,旨在探讨NRG1β对OGD/R诱导的PC12细胞损伤的保护作用及其可能的机制。
1 材料与方法
1.1 实验材料
PC12细胞系购自上海iCell公司;CCK-8试剂盒、ROS荧光检测试剂盒、丙二醛(MDA)试剂盒、还原型谷胱甘肽(GSH)试剂盒、氧化型谷胱甘肽(GSSG)试剂盒、RIPA裂解液购自上海碧云天生物技术有限公司,BCA蛋白定量试剂盒购自北京康为世纪生物科技有限公司,β-actin抗体购自武汉Proteintech公司,GPX4抗体购买于成都正能生物有限公司。
1.2 OGD/R模型构建及细胞分组
将PC12细胞接种于96孔板中,待汇合度达到70%~80%时将原培养基(改良型RPMI培养液+体积分数0.10的马血清+体积分数0.05的胎牛血清+10 g/L双抗)更换为无糖RPMI-1640培养液,转移至厌氧盒中(含体积分数0.94 N2、体积分数0.01 O2和体积分数0.05 CO2)继续培养6 h完成氧糖剥夺后,更换为原培养基置于培养箱复氧(O2体积分数0.21)培养48 h。然后将PC12细胞分为对照组、模型组和干预组,每组均设置2个复孔,实验重复3次。对照组使用原培养基培养72 h,模型组在复氧培养结束后,更换为原培养基处理48 h,干预组同样更换为原培养基并且加入NRG1β(终浓度10 nmol/L)处理48 h。
1.3 各组细胞形态观察及活力检测
细胞OGD/R 48 h后,将孔板直接置于倒置显微镜下,观察各组细胞的细胞形态。各组细胞处理结束后,以PBS洗涤孔板中的细胞2次,然后每孔中按照10∶1加入细胞培养液和CCK8检测液,置于培养箱37 ℃下孵育90 min。使用酶标仪测定波长450 nm处各孔的吸光度值,计算各组细胞的细胞活力。细胞活力=(实验组吸光度均值-空白组吸光度均值)/(对照组吸光度均值-空白组吸光度均值)×100%。
1.4 细胞中活性氧(ROS)水平检测
各组细胞处理结束后,以PBS洗涤细胞2次,然后每孔按DCFH-DA和PBS 1∶1 000比例加入稀释好的DCFH-DA工作液(终浓度为10 μmol/L)100 μL,置于培养箱37 ℃下孵育20 min后,用无血清细胞培养液洗涤细胞3次,设置酶标仪(激发波长488 nm,发射波长525 nm,检测波长450 nm),检测各组细胞的荧光强度,以荧光强度来表示细胞中ROS水平。
1.5 细胞中MDA水平的检测和GSH/GSSG吸光度比值的计算
各组细胞处理结束后,首先加适量RIPA充分裂解细胞,然后按照试剂盒说明书的要求,分别配置MDA和GSH/GSSG检测所需试剂,并按照要求依次加入相关试剂。反应完成后,以酶标仪分别测定532 nm(MDA)和560 nm(GSH/GSSG)波长处的吸光度值,并绘制相应的标准曲线,计算各组细胞中MDA的相对含量和GSH/GSSG 吸光度比值。
1.6 透射电镜观察各组细胞的超微结构
各组细胞处理结束后,将96孔板置于25 g/L的戊二醛中4 ℃下固定过夜,再经10 g/L的锇酸处理2 h,以PBS洗涤细胞3次,每次20 min;梯度乙醇脱水后,置于丙酮中渗透,于包埋板中完成包埋。采用超薄切片机将包埋烘干好的样品以50 nm厚切片后置于铜网上,硝酸铅和醋酸铀染色,透射电子显微镜下观察各组细胞的超微结构。
1.7 Western blot方法检测细胞中GPX4蛋白相对表达水平
各组细胞处理结束后,加适量RIPA裂解液充分裂解细胞,加入5×SDS煮沸后变性处理,BCA法检测蛋白的浓度。根据配胶试剂盒说明书配制10%凝胶,加入10~20 μL各组细胞提取的蛋白样品,100 V恒压电泳后,120 V恒压转膜;然后依次用脱脂奶粉进行封闭和β-actin及GPX4一抗孵育,次日,以辣根过氧化物酶标记山羊抗兔IgG(H+L)二抗孵育2 h后显影。应用Image J软件分析蛋白条带灰度值。以同一标本的β-actin为内参照,目的蛋白与β-actin条带灰度值的比值即为目的蛋白相对表达量,试验重复3次,结果取均值。
1.8 统计分析
2 结 果
2.1 3组细胞形态及活力比较
OGD/R 48 h后,倒置显微镜下观察发现,对照组PC12细胞呈圆形或不规则形贴壁生长,细胞透亮,生长速度较快(图1A);模型组细胞生长缓慢,可见部分死亡后漂浮的细胞(图1B);与模型组相比,干预组细胞生长状态和速度均有改善(图1C)。对照组、模型组和干预组细胞活力分别为91.09±1.44、62.18±2.49、71.69±2.35,3组比较差异有显著性(F=48.031,P<0.01);与对照组相比,模型组细胞活力显著降低(t=25.76,P<0.01);与模型组相比,干预组细胞活力显著升高(t=8.03,P<0.05)。

a:对照组,B:模型组,C:干预组,100倍
2.2 3组细胞中ROS、MDA水平及GSH/GSSG 吸光度比值比较
荧光显微镜下观察显示,对照组细胞中绿色荧光较弱(图2A),模型组细胞中绿色荧光较亮(图2B),干预组细胞中绿色荧光变暗(图2C)。酶标仪检测结果显示,3组PC12细胞中ROS、MDA水平及GSH/GSSG吸光度比值比较具有显著差异(F=7.118~58.724,P<0.05);模型组细胞中ROS水平较对照组显著升高(t=12.43,P<0.01),干预组细胞的ROS水平较模型组显著降低(t=10.34,P<0.01),模型组细胞GSH/GSSG吸光度比值较对照组显著降低(t=9.17,P<0.01),干预组较模型组显著升高(t=15.71,P<0.01);模型组细胞中MDA水平相较于对照组显著升高(t=29.46,P<0.01),干预组较模型组则显著降低(t=2.96,P<0.05)。见表1。
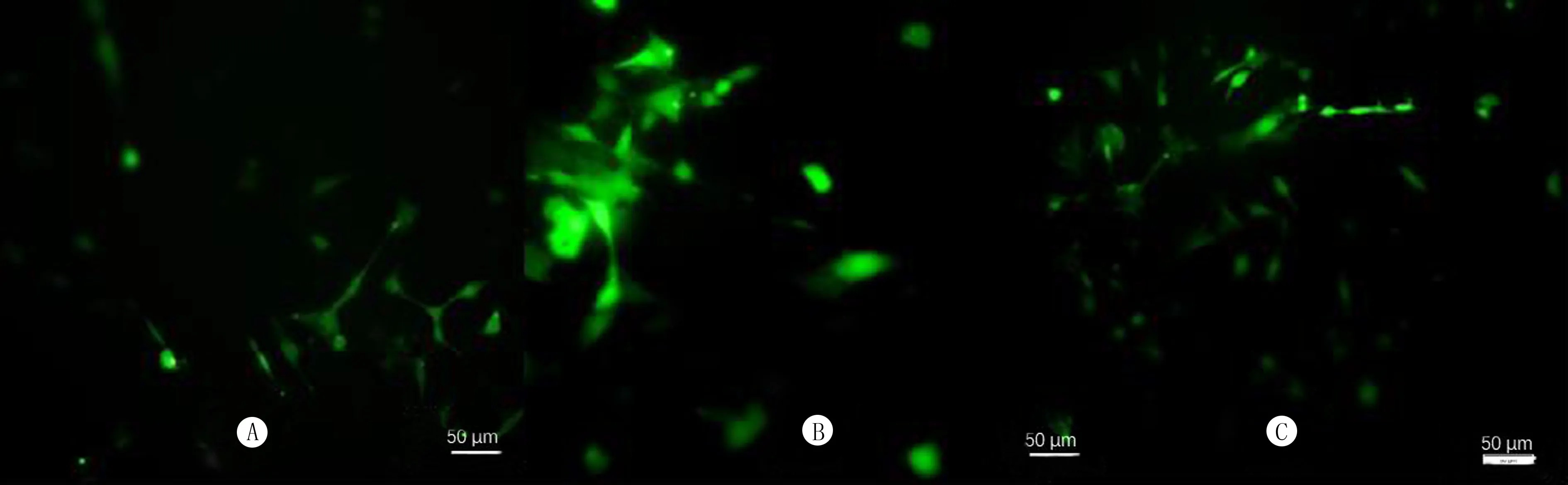
a:对照组,B:模型组,C:干预组,DCFH-DA荧光染色,200倍

表1 3组细胞中ROS、MDA水平及GSH/GSSG吸光度比值比较
2.3 3组细胞中线粒体损伤情况比较
透射电镜观察结果显示,对照组细胞中线粒体形态规则,结构完整,线粒体嵴排列有序(图3A);和对照组及干预组相比,模型组线粒体损伤较重,表现为线粒体内膜破裂,线粒体嵴消失(图3B);与模型组相比,干预组线粒体损伤得到一定改善(图3C)。
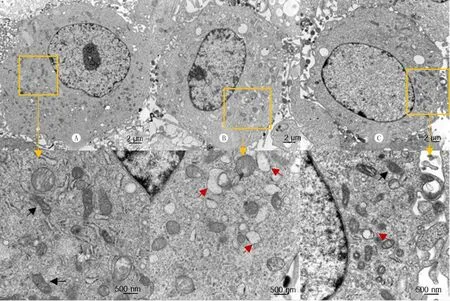
A:对照组,B:模型组,C:干预组;铅染色,上排放大倍数12 000倍,下排为上排黄色框中局部区域的放大(50 000倍);图中黑色箭头指示正常线粒体,红色箭头指示损伤线粒体
2.4 3组细胞中GPX4蛋白相对表达水平比较
Western blot方法检测显示,对照组、模型组和干预组细胞中GPX4蛋白的相对表达水平分别为1.58±0.02、0.75±0.07、1.09±0.09,3组比较差异具有显著性(F=37.498,P<0.05);模型组细胞中GPX4蛋白的相对表达水平较对照组显著降低(t=23.06,P<0.01),干预组细胞中GPX4相对表达水平较模型组显著升高(t=6.07,P<0.05)。见图4。

图4 3组细胞中GPX4蛋白相对表达水平比较
3 讨 论
既往研究显示,脑缺血再灌注损伤是一个复杂病理生理过程,是兴奋性毒性、钙失调、氧化应激、炎症反应和细胞凋亡等相互作用的结果[12-13]。神经保护剂治疗可能是一种潜在的干预脑缺血再灌注损伤的策略。
NRG属表皮生长因子家族,通过激活ErbBs蛋白的受体络氨酸激酶进行一系列信号转导,从而发挥生物学作用。根据编码基因的不同,NRG可以分为NRG1~NRG4 4种同分异构体[14]。NRG1β/ErbB4信号传导与神经元迁移、轴突引导、神经胶质细胞发育、轴突髓鞘化、发育中的突触形成以及成人大脑突触的可塑性有关[15]。NRG1β可以保护神经元免受缺血性损伤,并且NRG1β通过抑制促炎反应和PI3K/Akt信号通路发挥神经保护作用[16]。本项目组前期的研究表明,在大鼠脑缺血再灌注损伤模型中,NRG1β能够通过抑制缺血半影区神经细胞Cdk5信号通路,降低神经元凋亡,减小脑梗死体积,改善大鼠的神经行为[17]。
铁死亡是一种非凋亡形式的细胞死亡,其特征是细胞内铁和脂质ROS积累。铁死亡的细胞形态学特征为线粒体萎缩,线粒体嵴减少,内膜压缩,外膜破裂及细胞核完整,其发生与铁、氨基酸和过氧化脂质的代谢过程有关[18]。大量研究证明,神经细胞铁死亡与缺血性脑卒中的病理生理过程密切相关,抑制缺血半影区神经细胞铁死亡可以减轻脑卒中后继发性脑损伤,提示铁死亡通路可能是脑卒中的潜在治疗靶点[19]。此外,LAN等[20]研究发现,中草药脑泰方化合物也可以通过调节转铁蛋白受体1/二价金属转运蛋白1以及溶质载体家族7成员11/GPX4通路,减少缺血性卒中后的神经元铁死亡。值得注意的是,蒲公英醇通过诱导Nrf2核积累和铁死亡关键蛋白GPX4表达,可显著抑制OGD/R诱导的海马神经元中ROS和MDA的产生。由此推测,蒲公英醇可能是通过调节脑缺血再灌注损伤神经元中Nrf2信号通路而使其免受氧化应激和发生铁死亡[19]。综上所述,神经细胞铁死亡可能是脑缺血再灌注损伤的重要机制,但NRG1β是否通过调控铁死亡发挥脑细胞保护作用尚不清楚。
本研究结果显示,与对照组相比,模型组细胞活力下降,干预组细胞活力得到改善,这提示NRG1β的干预治疗可以改善PC12细胞损伤;同时,荧光显微镜下观察和酶标仪检测结果显示,与模型组比较,经NRG1β处理后,PC12细胞的绿色荧光强度减弱,细胞中MDA水平显著下降,GSH/GSSG吸光度比值显著升高。由于细胞中ROS、MDA水平和GSH/GSSG吸光度比值与细胞铁死亡密切相关,因此干预组在一定程度上改善了受损PC12细胞的铁死亡状况。线粒体损伤是细胞铁死亡的关键形态学特征,本研究又进一步对各组PC12细胞线粒体损伤情况进行检测,结果显示,干预组和模型组相比,线粒体损伤程度得到改善。本研究进一步检测了PC12细胞中抑制细胞铁死亡的关键蛋白GPX4的表达水平,结果显示,干预组GPX4的相对表达水平较模型组显著升高,从而进一步提示NRG1β干预治疗可改善受损PC12细胞的铁死亡程度[21]。
综上所述,本研究结果显示,NRG1β可以降低OGD/R模型PC12细胞的ROS、MDA水平以及GSH/GSSG吸光度比值,改善线粒体超微结构,上调细胞铁死亡关键蛋白GPX4的表达,表明NRG1β干预治疗可能是通过影响受损PC12细胞的铁死亡关键蛋白GPX4的表达而发挥细胞保护作用的,本研究结果为探究NRG1β治疗脑缺血再灌注损伤提供了实验依据。
作者声明:于竹芹、孙珊珊、翟秋月参与了研究设计;孙珊珊、于曦、翟秋月、于竹芹参与了论文的写作和修改。所有作者均阅读并同意发表该论文,且均声明不存在利益冲突。
