高强度阿托伐他汀致肝损伤小鼠肠道菌群的改变及其与肝脏CYP2E1的关系
2023-12-06宋冰雪宋雨晴刘鑫于海初辛辉梁惠
宋冰雪 宋雨晴 刘鑫 于海初 辛辉 梁惠
(1 青岛大学附属医院心血管内科,山东 青岛 266100; 2 青岛大学医学部; 3 青岛大学公共卫生学院)
目前临床对于动脉粥样硬化斑块不稳定患者普遍采用高强度他汀类药物治疗[1-3]。研究发现,高强度阿托伐他汀(ATO,40~80 mg/d)可使低密度脂蛋白胆固醇(LDL-H)降低幅度>50%,但强度增加的同时,不良反应发生率也随之增加,如肝损伤、胃肠道反应等[4-6]。细胞色素P450酶超家族(CYP)参与的氧化应激损伤是目前公认的他汀类药物致肝损伤机制之一。CYP2E1属于肝脏CYP之一,不仅参与药物或外源性物质转化,同时也参与了氧化应激反应激活和调节,是氧自由基产生的关键酶[7-8]。CYP2E1基因的过度表达能够降低抗氧化酶水平,增加氧化应激损伤,介导炎症反应的发生[9-10]。
人体肠道存在大量正常菌群,当机体内外环境变化时,比如受药物、疾病等影响,肠道内各菌种间的比例可发生改变,即引起菌群失调[11-12]。在不同肝损伤模型中均发现有肠道菌群失调以及肝组织中CYP2E1表达增加的现象[13]。目前,他汀类药物致肝损伤与肠道菌群稳态失调及CYP2E1表达水平的相关性仍不明确。本研究旨在探讨高强度他汀类药物致肝损伤后,对肠道菌群分布的影响及其与肝脏中CYP2E1水平的关系。
1 材料与方法
1.1 材料来源
C57BL/6小鼠40只,体质量21~24 g,由青岛大学无特定病原体动物实验室提供。随机分为对照组(CON组)、低强度ATO组(ATO-L组)、中强度ATO组(ATO-M组)、高强度ATO组(ATO-H组),每组10只。
1.2 各组小鼠的处理
ATO-L组、ATO-M组和ATO-H组小鼠每天清晨分别灌胃含有10、20、30 mg/kg ATO的生理盐水1 mL,CON组小鼠每天灌胃等量生理盐水,持续4周。于末次灌胃后,收集每组小鼠新鲜粪便;同时每组小鼠禁食不禁水12 h,腹腔麻醉后,眼眶取血,分离血清;并迅速解剖分离出肝脏,用生理盐水漂洗,滤纸拭干后备用。
1.3 肝脏形态学评估
1.3.1肝组织病理学观察 切取各组小鼠肝大叶相同部位约0.9 cm×0.9 cm×0.5 cm大小的组织块,置于40 g/L的多聚甲醛溶液中固定24 h后脱水,二甲苯透明30 min以后,常规石蜡包埋,以4~5 μm厚度连续切片,苏木精-伊红(HE)染色,梯度乙醇脱水,二甲苯透明后,中性树脂封片。显微镜下进行病理学观察并拍照。
1.3.2肝组织超微结构观察 再次切取各组小鼠肝大叶相同部位约3 mm×1 mm×1 mm的组织块,置于4 ℃的0.28 mol/L戊二醛溶液中固定24 h后,用0.10 mol/L磷酸缓冲液漂洗,0.03 mol/L锇酸固定,梯度丙酮脱水,环氧树脂(EPON812)包埋,采用超薄切片机50~70 nm厚切片,经醋酸双氧铀及柠檬酸铅各染色15 min后,透射电镜下进行超微结构观察并拍照。
1.4 血清及肝脏组织中各项指标检测
采用双抗体夹心法检测每组小鼠血清中谷丙转氨酶(ALT)、谷草转氨酶(AST)水平;采用酶联免疫吸附试验检测每组小鼠血清中IL-6、IL-10以及TNF-α水平;采用黄嘌呤氧化酶法检测每组小鼠肝脏组织中SOD活力;采用实时定量PCR方法检测各组小鼠肝脏组织中CYP2E1 mRNA的相对表达水平。以上所有的操作步骤均严格按照说明书的要求进行。
1.5 肠道菌群的测定
取ATO-H组与CON组小鼠新鲜粪便,委托山东锐翌基因科技有限公司提取粪便样品中基因组DNA并质检,采用16SrDNA测序法分析粪便中肠道菌群的分布。采用运算分类单位分析、物种分类与丰度分析、显著性差异分析等方法,比较优势菌株在门、科、属分类等级的丰度及差异。
2 结 果
2.1 各组小鼠肝脏形态学比较
HE染色显示,CON组小鼠肝小叶结构清楚,细胞排列整齐,胞浆均匀,肝细胞索以中央静脉为中心呈放射状排列;ATO-L组小鼠肝小叶结构基本正常,中央静脉有少量红细胞聚集,肝索排列较为整齐;ATO-M组小鼠肝小叶结构紊乱,中央静脉有红细胞聚集,肝索排列不齐,肝窦扩张,中央静脉和汇管区见炎性细胞浸润,空泡数量增多;ATO-H组小鼠肝小叶结构模糊,中央静脉充满红细胞和液体渗出物,肝细胞肿胀、排列紊乱,细胞核变形,扩张的充血性窦压迫周围肝细胞板,中央静脉和汇管区可见大量炎性细胞浸润,并且可见空泡化的细胞质和凋亡细胞。
透射电镜观察结果显示,CON组肝细胞核呈规则圆形或椭圆形,染色质分布较细,核膜完整清晰,线粒体形态正常,嵴结构清晰,粗面内质网扁平、排列整齐,细胞边界中有毛细胆管和紧密连接,偶见溶酶体和脂滴;ATO-L组胞质脂滴、溶酶体数量较CON组增多;ATO-M组细胞核形态基本正常,细胞膜欠清,线粒体大小不一,数目较ATO-L组增多,粗面内质网肿胀、排列紊乱,溶酶体、脂滴数量较ATO-L组增多;ATO-H组细胞核出现萎缩、变形,形状不规则,染色质浓缩,核膜不规则、模糊,细胞膜界限不清,线粒体数量较ATO-M组明显增多,形态不一,嵴结构模糊,粗面内质网肿胀扩张断裂,排列紊乱无序,脂肪滴较ATO-M组增多,溶酶体减小,数目增多,糖原颗粒增多。
2.2 各组小鼠血清及肝组织中各项指标的比较
各组小鼠血清中ALT、AST、IL-6、TNF-α和肝组织中SOD活力比较差异均有显著性(F=4.57~7.74,P<0.05),其中ATO-H组小鼠血清中ALT、AST水平与CON组、ATO-L组及ATO-M组比较差异均有显著性(P<0.05),ATO-M组小鼠血清中AST水平与CON组比较均差异有显著性(P<0.05);CON组小鼠血清中IL-6水平与ATO-L组、ATO-M组以及ATO-H组比较差异均有显著性(P<0.05);ATO-H组小鼠血清中TNF-α水平与CON组、ATO-L组比较差异有显著性(P<0.05);CON组小鼠的肝组织中SOD活力与ATO-L组、ATO-M组及ATO-H组比较差异均具有显著意义(P<0.05);各组小鼠血清中IL-10水平和肝组织中CYP2E1 mRNA表达水平比较差异无显著性(P>0.05)。见表1。
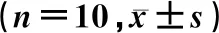
表1 各组小鼠血清及肝组织中各项指标比较
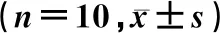
表2 CON组与ATO-H组小鼠肠道菌群优势物种在门水平的相对丰度比较
2.3 高强度ATO干预对小鼠肠道菌群分子生态学的影响
在门水平,与CON组比较,ATO-H组拟杆菌门的相对丰度显著降低(t=2.89,P<0.05),而厚壁菌门、变形菌门和脱铁杆菌门相对丰度则显著升高(t=3.30~5.22,P<0.05),见表2。ATO-H组与CON组厚壁菌门/拟杆菌门(F/B)丰度比值分别为0.73±0.09和0.27±0.16,两组比较差异有显著性(t=5.56,P<0.05)。在科水平,与CON组比较,ATO-H组毛螺菌科、紫单孢菌科、普氏菌科和乳杆菌科相对丰度显著降低(t=2.45~5.33,P<0.05),螺杆菌科的相对丰度显著升高(t=5.46,P<0.05)。见表3。在属水平,与CON组比较,ATO-H组小鼠肠道菌群优势物种螺杆菌属相对丰度显著性升高(t=7.41,P<0.05),拟普雷沃菌属、普氏菌属和乳杆菌属相对丰度则明显减低(t=2.46~3.20,P<0.05)。见表4。
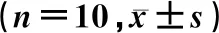
表3 CON组与ATO-H组小鼠肠道菌群优势物种在科水平的相对丰度比较
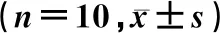
表4 CON组与ATO-H组小鼠肠道菌群优势物种在属水平的相对丰度比较
2.4 肠道菌群与肝组织SOD活力和CYP2E1水平的相关性分析
将上述在属水平相对丰度差异有显著性的螺杆菌属、拟普雷沃菌属、普氏菌属和乳杆菌属与肝组织SOD活力及CYP2E1 mRNA表达行相关性分析结果显示,乳杆菌属相对丰度与肝组织SOD活力呈显著正相关(r=0.48,P<0.05),与肝组织CYP2E1 mRNA表达呈负相关(r=-0.62,P<0.05)。
3 讨 论
他汀类药物相关的肝损伤是临床上十分关注的不良反应之一[14-15]。目前,全球应用他汀类药物的人群广泛,高强度ATO的应用会增加肝损伤的发生率[6]。本研究结果显示,中强度及高强度的ATO可导致显著的肝损伤,ATO-M组、ATO-H组小鼠肝脏组织HE染色及肝脏组织透射电镜下的超微结构均提示有明显的改变,血清ALT、AST水平升高显著,炎症反应被激活,肝组织SOD活力下降,提示中高强度他汀类药物可导致小鼠肝损伤,引起了小鼠抗氧化酶活力下降。本研究结果还显示,肝损伤严重的ATO-H组小鼠肝组织中CYP2E1 mRNA表达水平有升高趋势,与其他研究结果一致。如MOTAWI等[16]发现他汀类药物导致的大鼠肝脏损伤模型中,肝脏CYP2E1活性显著升高,而通过柚皮素抑制肝脏CYP2E1的上调可以发挥肝保护作用;REN等[17]发现CYP2E1特异性抑制剂(二烯丙基硫化物)可以抵消氧化应激损伤、细胞内Ca2+稳态失调及细胞凋亡等。另外,多酚类物质(丁香苷)、大蒜素及生物碱提取物等天然成分对肝脏的保护作用,其机制均是抑制肝脏CYP2E1的表达和抗氧化的作用[18]。所以,CYP2E1的表达水平升高,可能是他汀类药物致肝损伤的重要机制。
本研究进一步对高强度ATO干预后小鼠肠道菌群分布进行分析,结果显示ATO-H组小鼠肠道菌群稳态失调,菌群相对丰度显著改变,ATO-H组和CON组小鼠肠道菌群F/B差异有显著性。由于厚壁菌门囊括了几乎所有革兰阳性菌(G+),而拟杆菌门包含了大部分革兰阴性菌(G-),因此上述结果提示他汀类药物干预后肠道中G+与G-构成比发生改变,使肠道菌群紊乱、稳态失衡。ATO-H组小鼠肠道菌群中乳杆菌属相对丰度明显下降。进一步对乳杆菌属与肝组织中CYP2E1 mRNA的表达水平进行相关性分析,结果显示,小鼠肠道中乳杆菌属与肝组织中CYP2E1 mRNA表达水平呈显著负相关,与肝组织SOD活力呈显著正相关,提示当高强度他汀类药物干预以后,肠道菌群乳杆菌属占比下降,CYP2E1 mRNA表达水平升高,肝组织SOD活力随之下降。由此可以推测,肝脏损伤小鼠的肠道存在菌群稳态失调,肠道中乳杆菌属的占比与肝组织中CYP2E1 mRNA表达水平密切相关。
本研究分析了高强度ATO肝损伤小鼠的肠道菌群组成,与CON组相比,ATO-H组优势菌群及菌群的相对丰度具有明显的差异,提示他汀类药物干预后小鼠肠道菌群丰度及多样性可能受到显著影响,菌群稳态失衡与肝脏损伤之间可能存在相互促进的关系。有研究发现,肠道菌群的改变在肝损伤的进展中起着重要的作用,肝脏通过门脉系统和胆道系统与肠道菌群密切关联,肝功能异常时,会削弱肠道的屏障功能,引起肠道菌群的稳态失衡,而菌群失衡可能会促使肝脏氧化应激及炎性反应的激活,导致肝细胞损伤和凋亡[19-20]。同时,本研究发现他汀类药物干预后肠道菌群乳杆菌属的相对丰度与肝组织SOD水平及CYP2E1 mRNA表达水平均具有显著相关性。目前,已有研究发现肝脏组织中CYP2E1的表达水平,受机体肠道菌群稳态的影响。JOUROV等[21]通过比较正常小鼠和无菌小鼠的肠道菌群分布,提出肠道菌群影响肝组织中CYP2E1的表达水平。ZHANG等[22]在四氯化碳诱导的肝损伤模型中发现肝组织SOD表达水平下降,CYP2E1表达水平增加,激活了机体氧化应激反应,给予补充羊奶,即改善肠道菌群分布后,肠道菌群失衡得到改善,且CYP2E1的表达下调。CHO等[23]在对乙酰氨基酚诱导肝损伤模型中证实肠道菌群稳态与肝组织中CYP2E1表达及SOD活力密切相关,且改善肠道菌群稳态可以调节CYP2E1的表达以及SOD的活力。此外,乳杆菌属作为一种重要的肠道益生菌,参与肠道中糖、蛋白质等物质代谢及乳酸、丁酸等短链脂肪酸的产生,并对维护肠道微生态稳定发挥重要调节作用[24-25]。
综上所述,本研究结果显示,高强度他汀类药物致肝损伤后可能通过影响肠道菌群稳态,使肝组织中CYP2E1的表达水平上调,激活氧化应激,降低抗氧化酶的水平,从而导致肝损伤的发生,其中,肠道菌群乳杆菌属的减少可能促进肝脏氧化应激。但具体机制均需进一步验证。
伦理批准和动物权利声明:本研究涉及的所有动物实验均已通过青岛大学附属医院医学伦理委员会的审核批准(文件号QYFYWZLL-27294)。所有实验过程均遵照动物实验的“3R”原则及《关于善待实验动物的指导性意见》的条例进行。
作者声明:宋冰雪、辛辉、梁惠参与了研究设计;宋冰雪、宋雨晴、刘鑫、于海初参与了论文的写作和修改。所有作者均阅读并同意发表该论文,且均声明不存在利益冲突。
