COVID-19患者脑小血管病变机制研究进展
2023-12-06刘悦王琳李颖兰惠玞李翠萍杨绍楠
刘悦 王琳 李颖 兰惠玞 李翠萍 杨绍楠
(1 青岛大学附属医院神经内科,山东 青岛 266100; 2 青岛市中心医院; 3 临清市人民医院;4 滨州医学院烟台附属医院; 5 青岛大学附属医院重症医学科)
冠状病毒是一类核糖核酸病毒,这类病毒在致病机制等方面有相似的特点,但彼此之间仍存在差异[1]。该类病毒可通过突变适应环境得以生存,因此对人类的威胁可能持续存在[2]。近几年爆发的新型冠状病毒肺炎(COVID-19)即是由新型冠状病毒(SARS-CoV-2)引发。在结构上,SARS-CoV-2主要由核衣壳蛋白、膜蛋白、S蛋白和包膜蛋白构成[1],机体被感染后,S蛋白首先被蛋白酶分割成S1和S2两个亚基。S1亚基的主要作用是促进病毒与受体结合,S2亚基的主要作用是使病毒RNA与细胞膜融合[3]。受体结合及膜融合是病毒感染的初始和重要步骤。
脑小血管主要包括小穿支毛细血管以及穿通和供应大脑皮质及皮质下区域的小静脉。脑小血管病(cerebral small vessel diseases,CSVDs)主要包括以下分型:小动脉硬化、脑淀粉样血管病、其他遗传性的CSVDs、炎性和免疫学介导的CSVDs、静脉胶原病和其他CSVDs[4]。SARS-CoV-2不仅能够攻击呼吸系统,也会损伤神经系统,表现为癫痫发作、中风、脑病、精神错乱等[5]。CSVDs是COVID-19损伤神经系统的表现之一[6]。既往研究发现,COVID-19患者即使康复后,神经系统疾病的发病率也会显著升高[7]。本文探讨了COVID-19患者继发的不同类型CSVDs及SARS-CoV-2诱发CSVDs的机制,现总结报告如下。
1 COVID-19和CSVDs的关系
1.1 COVID-19和伴有皮质下梗死和白质脑病的常染色体显性遗传性脑动脉疾病(CADASIL)的关系
CADASIL是由NOTCH3基因突变所致的人类单基因疾病[8],该病患者的主要特征是复发性缺血性卒中、认知障碍和情绪障碍等[9],发病机制主要是内皮功能障碍及血流动力学改变[9-10]。SARS-CoV-2病毒的感染会导致肾素-血管紧张素系统(RAS)的激活及炎症因子释放,从而致血管内皮功能障碍,进一步导致卒中的发生[11];同时SARS-CoV-2的感染也阻碍了脑内少突胶质细胞分化,进而导致脑组织慢性脱髓鞘的发生[12];病毒感染肺组织后,还可使肺功能下降,机体缺氧,同时,CADASIL患者由于NOTCH3基因突变导致的细胞内内质网功能障碍,使细胞对缺氧特别敏感,细胞缺氧进一步促进凋亡途径的激活[9]。研究也证明CADASIL患者缺血性中风的风险显著增高[10]。
CRUCIANI等[10]及TRIFAN等[11]各报道了1例CADASIL患者在感染SARS-CoV-2以后出现新发卒中的情况;ZHANG等[13]以及RAJENDRAN等[14]也分别报道了1例COVID-19患者在感染SARS-CoV-2期间脑内多处出现梗死灶,结合脑磁共振图像及临床表现,并经基因检测最终确诊为CADASIL。针对以上报道分析,CADASIL的发病或复发可能与SARS-CoV-2感染有关。
1.2 COVID-19和脑微出血(CMBs)的关系
高血压和脑淀粉样血管病是CMBs最常见病因[15]。
CMBs的主要发病机制为脑内小动脉硬化导致血管压力增高,进而导致血管内皮细胞损伤[16]。在COVID-19爆发期间,许多COVID-19患者脑部磁敏感加权成像结果发现有CMBs,同时COVID-19患者的神经病理学尸检报告也发现,大量患者脑部有微血栓和急性出血性梗死[17]。但COVID-19对CMBs的影响目前并不明确,有如下几种假说:①可能与低氧血症有关[18-19]。部分COVID-19患者在发生急性呼吸窘迫综合征(ARDS)后行脑磁共振扫描,发现CMBs病灶,推测可能与缺氧导致的血脑屏障破坏有关[19-20]。②可能与微血管病有关[17-18]。SHOSKES等[21]报道了1例同时伴有抗心磷脂抗体阳性和紫癜性皮疹的COVID-19患者,其脑磁共振图像提示脑部有弥漫性微出血,皮肤活检显示真皮血管小腔内有血栓性血管病变,这些临床特征均提示该患者又继发了微血管病变,可能与病毒感染诱发的一系列的炎症反应有关。同时,在COVID-19并CMBs患者的尸检中,也观察到在脑血管壁内有炎症浸润[17]。
SABINO等[8]报道了1例SARS-CoV-2感染后同时继发CADASIL和CMBs的患者,脑磁共振图像显示中央前回皮质下和半卵圆中心区域有对称的T2高信号及小点状出血灶。由于CADASIL与CMBs两种疾病的发病均与缺氧有关,因此当CADASIL或CMBs患者感染SARS-CoV-2后,应需格外注意其神经系统并发症发生情况。
1.3 COVID-19和中枢神经系统血管炎(CNSV)的关系
CNSV是累及中枢神经系统内中小型动脉的一类疾病,且病毒感染是该疾病的一大触发机制[22]。VASCHETTO等[23]报道了1例COVID-19患者继发CNSV的病例。患者感染SARS-CoV-2后入院,后出现ARDS,在ARDS好转后患者仍处于昏迷状态;行脑磁共振检查显示患者的顶叶、顶枕区以及脑桥水平的皮质存在一些信号限制,提示存在皮质炎症和亚急性期缺血;行腰椎穿刺后发现脑脊液蛋白量较高,提示可能存在CNSV。大剂量激素冲击治疗后神经功能显著恢复,支持了CNSV的诊断结果。在COVID-19流行期间,SARS-CoV-2感染后出现CNSV的病例报道很多,但均未进行脑活检。SARS-CoV-2入侵人体后均会产生血管内皮损伤、凝血功能障碍以及过度炎症反应等情况,这些情况均可以导致中枢神经系统的损伤。这可以用来解释为什么COVID-19患者容易诱发CNSV。
1.4 COVID-19和血管周围间隙(PSV)变化的关系
PSV是大脑中充满液体的小空隙,PSV内的液体主要在人体睡眠期间被清除[24]。研究表明在感染SARS-CoV-2后,大脑中PVS的大小和数目会有所增加[25]。DEL BRUTTO等[24]的一项研究表明COVID-19幸存者大脑中PVS扩大且睡眠质量明显恶化。这可能是由于患者睡眠时间较短导致PSV内液体无法有效清除所致。
2 SARS-CoV-2感染诱发CSVD的机制
目前,SARS-CoV-2感染诱发CSVDs的机制并不十分清楚,但RAS、炎症、血栓形成、病毒的神经营养特性及细胞缺氧等都发挥着重要的作用。在目前的研究结果中,RAS机制占主导地位。但SARS-CoV-2感染诱发CSVDs的机制比较复杂,应该是多种机制共同作用的结果。
2.1 RAS
RAS途径主要是指肾素刺激血管紧张素原(AGT)产生血管紧张素Ⅰ(AngⅠ)途径。血管紧张素转化酶(ACE)催化AngⅠ产生AngⅡ,AngⅡ与血管内皮上相关受体(如AngⅡ 1型受体)结合可致血管收缩[26-27]。病毒进入呼吸道后,SARS-CoV-2的受体结合结构域靶向与肺泡2型上皮细胞内的ACE2结合并不断进行增殖[28]。该靶向过程可以诱发炎症因子、黏附分子的释放,进而导致内皮功能障碍以及凝血级联反应[1]。ACE2可将AngⅡ分解成Ang1-7。由于SARS-CoV-2中的受体结合结构域与ACE2结合,细胞中ACE2的表达显著下调,导致Ang1-7水平下调,在ACE的作用下反而生成更多的AngⅡ[27]。上述过程可以导致患者血压升高,增加急性脑出血的风险。同时,AngⅡ水平升高可促进神经细胞凋亡,致神经退行性病变[1]。Ang1-7在大脑局部发挥抗炎、抗氧化和血管舒张作用。随着Ang1-7水平的下调,上述作用也随之减弱。ACE2可以减少血小板聚集和NO释放,发挥显著的抗血栓作用。随着ACE2的减少,抗血栓作用也随之下降,进而导致凝血级联反应的发生[27]。在COVID-19患者中,RAS失衡是诱发血管病变的重要机制。RAS途径流程图详见图1。
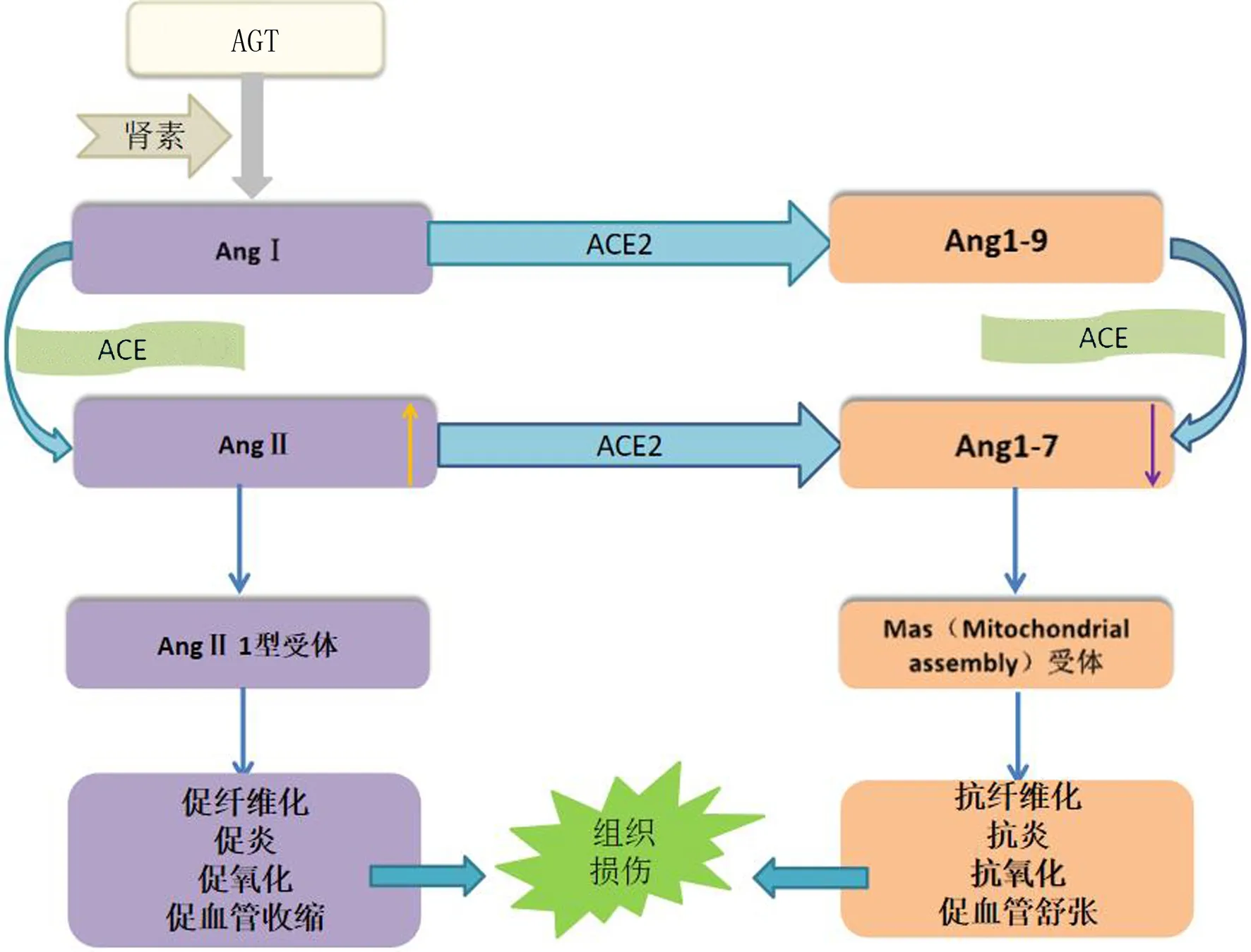
图1 RAS系统功能流程图
ACE2受体也在肾脏、心脏、脑及肠道等多部位表达[7]。SARS-CoV-2与脑血管内皮细胞相互作用破坏血脑屏障,血脑屏障破坏可以增加CSVDs的发生风险[1]。另外,SARS-CoV-2还可以经血行途径到达大脑,进入血液循环后活化炎性细胞、释放炎症因子导致血管内皮功能障碍[29]。SARS-CoV-2也可导致心肌细胞损伤,导致心律失常、心力衰竭和心内血栓形成[30-31]。随后的低灌注限制了脑内血液供应,引发脑部缺血[12]。心律失常会导致血源性血栓形成,进而导致脑栓塞的发生。
2.2 炎症和血栓形成
SARS-CoV-2进入人体会使循环细胞(巨噬细胞、中性粒细胞、内皮细胞和血小板)活化并释放炎症因子(如IL-1、IL-6)及黏附分子(如VCAM-1、ICAM-1)[31]。其中IL-1可以引发发热、全身性炎症反应和组织破坏[1];IL-6与受体结合,可增加黏附分子的表达,促进炎症细胞积累使炎症因子持续释放[32]。内皮细胞的损伤及炎症因子释放均会导致活性氧的产生[33]。活性氧的激活导致脑血管内皮功能障碍及斑块进展,形成正反馈循环[34]。血小板活化可以聚集大量的炎症细胞,导致脑内微血栓形成[30]。在这种高炎症状态下,局部激活的血小板诱导中性粒细胞胞外陷阱的释放,进而激活外部凝血级联反应,导致凝血酶形成[27]。中性粒细胞胞外陷阱诱导促凝反应,并在引发动脉和静脉血栓形成中起关键作用。
外来病毒的入侵通常伴随着凝血功能的激活,这一定程度上有助于局部感染的控制。但过度和广泛的凝血功能激活可导致弥散性血管内凝血[35]。在SARS-CoV-2感染的背景下,血液内IL-6以及内皮细胞的激活可以促进组织因子(TF)的表达[36]。TF是病毒感染中凝血激活的关键介质[35]。在TF诱导的外源性凝血途径中,TF与因子Ⅶa结合形成TF-Ⅶa复合酶,该酶通过激活Ⅸ和Ⅹ因子来启动血液凝固。随后活化的Ⅹ因子被组装成凝血酶原酶,将凝血酶原转化为凝血酶,凝血酶激活纤维蛋白原,最终产生纤维蛋白凝块[36]。此外,病毒衍生的多磷酸盐可能会在凝血途径中诱导因子Ⅻ的活化,从而放大下游凝血级联反应的内在途径[1]。凝血级联反应流程图见图2。
脑内皮细胞的破坏、细胞因子及炎症细胞的激活以及凝血级联反应的发生,这三者之间相互促进,形成正反馈循环,最终导致脑内血栓的形成,引发缺血性脑卒中。但是倘若凝血级联反应过度激活,则会发生凝血功能障碍,造成多器官出血的发生。
2.3 病毒的神经营养特性
通过对确诊为病毒性脑炎的COVID-19患者脑脊液进行基因测序证实了脑脊液中存在着SARS-CoV-2[37],表明SARS-CoV-2可以直接入侵神经系统。SARS-CoV-2还可通过嗅神经、肠神经元的逆行轴突[12]、脉管系统、淋巴系统[37]等不同途径进入中枢神经系统,从而引发神经细胞的后续免疫反应。COVID-19患者嗅觉味觉的丧失就是由于病毒逆行感染导致的。
2.4 缺氧
SARS-CoV-2通过使肺泡塌陷及破坏肺泡与毛细血管之间的上皮-内皮细胞屏障导致机体缺氧。对COVID-19死亡患者的尸检发现,肺的微血管内有血栓形成,这进一步加重患者缺氧[35]。缺氧使会酸性物质积累,从而导致脑血流量降低,严重的缺氧还会导致脑实质结构和功能的破坏[1]。SARS-CoV-2直接或间接感染肺泡、心脏、平滑肌及神经元等的机制详见图3。

图3 SARS-CoV-2直接或间接感染肺泡、心脏、平滑肌及神经元等的机制示意图
3 结论
SARS-CoV-2对脑小血管有着不可逆的影响,及时发现SARS-CoV-2对脑小血管的影响并积极预防与处理是神经内科医生应持续关注的问题。对患COVID-19且合并神经系统症状的患者,应行脑磁共振等相关检查,并尽早用药以控制病情进展,以减少不良预后的发生。
作者声明:刘悦、李颖、兰惠玞、李翠萍、杨绍楠参与了研究设计;刘悦、王琳参与了论文的写作和修改。所有作者均阅读并同意发表该论文,且均声明不存在利益冲突。
