鼠伤寒沙门氏菌回复突变试验中通过吸光度值测定菌液浓度的方法研究
2020-02-12朱鸿雁张志超唐黎明
周 谡 ,李 睿,朱鸿雁,张志超,方 静,唐黎明,
(1.上海市食品药品检验所,上海 201203;2.化妆品监测评价重点实验室,上海 201203)
鼠伤寒沙门氏菌回复突变试验,也称作Ames试验,由Bruce Ames教授于1970年建立[1]。Ames试验是一个广泛应用的通过细菌检测化合物突变性的试验,通常使用营养缺陷型的鼠伤寒沙门氏菌(Salmonellatyphimurium)。它可以检测90%的化学致癌物和非致癌物[2]。由于此试验方便、快捷、检出率高,因此已被各大实验室广泛应用。
Ames试验中最主要的试验材料就是过夜培养的菌液,菌液的浓度、活性对试验的结果影响很大。诸多试验规范和参考文献中列出了对菌液浓度的要求为活菌数(1~2)×109个/mL[2-3],虽然作出了这项规定,但如何获得此浓度的菌液仍是一个问题,有规范标示37℃、100 r/min培养10 h或37℃静置16 h即可达到这一浓度[4-5],但是却没有任何试验证明,且不同实验室菌液扩增的体系不同、旋转培养箱的型号不同也会导致不同的结果,即使按上述条件操作也未必能获得上述浓度的菌液。由于菌液的浓度在一定的范围内和其吸光度值[D(λ)值,λ为波长数值]呈正比,因此本试验中,拟寻找出通过吸光度值测定鼠伤寒沙门氏菌回复突变试验中菌液浓度的方法。
1.1 材料
1.1.1 菌种 营养缺陷型鼠伤寒沙门氏菌TA102购于美国Moltox公司。
1.1.2 试剂 2号营养肉汤培养基购于英国Oxoid公司,琼脂粉购于美国BD公司,0.9%生理盐水购于华裕(无锡)制药有限公司,L-组氨酸和D-生物素购于美国Sigma公司。
1.1.3 仪器 LA2-6AX生物安全柜购于新加坡ESCO公司,BD240恒温培养箱购于德国Binder公司,Vortex-Genie2漩涡混合器购于美国Scientific Industries公司,INNOVA 40R恒温培养摇床购于德国Eppendorf公司,数显恒温金属浴购于美国Boekel公司,CKX41SF倒置显微镜购于德国Leica公司,Spectra Max Plus384酶标分析仪购于美国Molecular Devices公司。
1.2 方法
1.2.1 测定波长的确定取培养过夜的营养肉汤和菌液,按每孔100μL加入96孔板,每个样本加8个复孔,用酶标仪测定540和600 nm波长下菌液的吸光度值,选取吸光度值较大的波长数值。
1.2.2 菌液扩增时间取顶层琼脂500 mL,加热融化后,加入50 mL组氨酸-生物素,混匀,按每管2 mL分装,再每管加入0.5 mL PBS,备用。
从-80℃冰箱中取出冻存的菌液,37℃融化后,按每25μL菌液加入5 mL营养肉汤培养基的比例扩增,放入旋转培养箱,于37℃、100 r/min条件下培养,选取接种后0、2、4、6、8、10、12、14 h共8个时间点,取出菌液,按每孔100μL加入96孔板,每个时间点加8个复孔,同时将培养相同时间的营养肉汤培养基作为本底对照,用酶标仪于540 nm波长下测定D(540)值。
同时取上述8个时间点的菌液,进行平板菌落计数。取每个时间点的菌液1 mL,加入9 mL生理盐水,混匀,此稀释倍数为1×101倍;再从此稀释倍数中吸取菌液1 mL,加入9 mL生理盐水,混匀,此稀释倍数为1×102倍;按此10倍稀释的方法逐步稀释成1×101~1×1010倍共10个稀释倍数。每个稀释倍数取0.1 mL加入已准备好的顶层琼脂,在振荡器上混匀,浇入营养肉汤平板,铺匀。每个稀释倍数重复制作3皿,待冷凝后,倒置放入培养箱,24 h后选取1×101~1×1010共10个个稀释倍数中平皿总菌落数在30~300范围内的平皿进行计数,计算3皿菌落数均值,将菌落数均值乘以稀释倍数,得到各时间点的菌液浓度。菌液浓度的计算公式为:菌液浓度(个/mL)=菌落数均值×进行菌落计数的稀释倍数×10。以菌液扩增时间为横坐标,菌液浓度和D(540)值为纵坐标,绘制菌株生长曲线,确定菌液最佳扩增时间。
1.2.3 菌液D(540)值和平板菌落计数法测定菌液浓度取顶层琼脂500 mL,加热融化后,加入50 mL组氨酸-生物素,混匀,按每管2 mL分装,再每管加入0.5 mL PBS,备用。
根据1.2.2中确定的最佳扩增时间扩增菌液,取扩增好的菌液5 mL,加入5 mL营养肉汤,混匀,此稀释倍数为1×21倍;再从此稀释倍数中吸取菌液5 mL,加入5 mL营养肉汤,混匀,此稀释倍数为1×22倍;按此2倍稀释的方法逐步稀释成1×21~1×29倍共9个稀释倍数;未进行任何稀释的菌液记为1×20倍(见表1)。取1×20~1×29共10个稀释倍数的菌液,按每孔100 μL加入96孔板,每个稀释倍数加8个复孔,同时将培养相同时间的营养肉汤培养基作为本底对照,测定D(540)值。
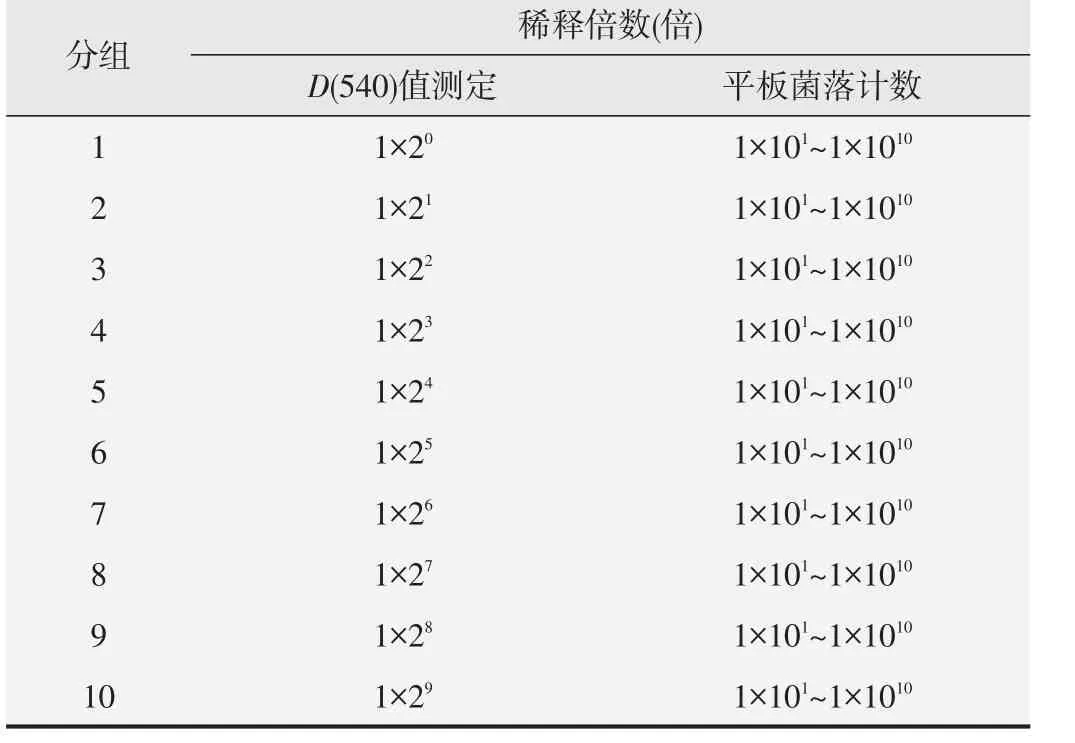
表1 菌液D(540)值测定和平板菌落计数时的稀释倍数
取1×20~1×29共10个稀释倍数的菌液,按1.2.2中的方法进行平板菌落计数(见表1)。以各稀释倍数的D(540)值为横坐标,菌液浓度为纵坐标,作散点图,求回归方程。
2 结果
2.1 吸光度值测定波长
培养过夜的营养肉汤和菌液在96孔板中分别测定了D(540)值和D(600)值,测得8个复孔的吸光度值见表2。在540 nm下菌液的吸光度值显著高于600 nm,因此选取吸光度值较大的540 nm进行测定。
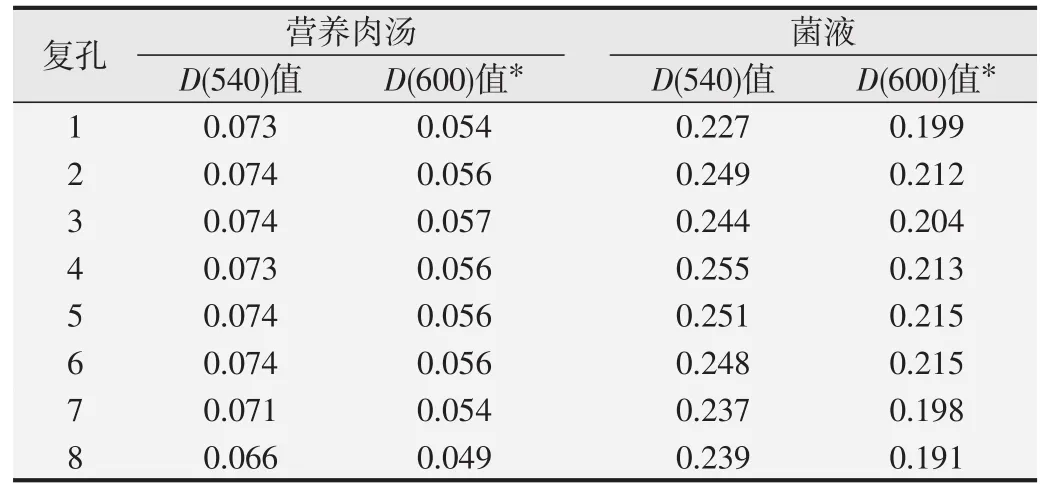
表2 营养肉汤和菌液在不同测定波长下的吸光度值
2.2 菌液扩增时间
根据不同扩增时间下的D(540)值-菌液浓度绘制曲线见图1。菌液的吸光度值基本呈现出了逐渐上升的趋势,而菌液浓度在培养2 h后迅速升高,约10 h达到最高值,随后逐渐下降,因此最佳的扩增时间为培养10 h。

图1 不同扩增时间下的D(540)值和菌液浓度
2.3 菌液D(540)值和菌液浓度测定
菌液在1×20~1×29等10个稀释倍数测定了吸光度值,8个复孔的D(540)值(扣除营养肉汤的本底值)结果见表3。

表3 菌液D(540)值的测定
根据表3各复孔的D(540)值分别计算1×20~1×29共10个稀释倍数的D(540)均值,选取1×101~1×1010共10个稀释倍数中平板菌落数在30~300范围内的稀释倍数计算出菌液浓度,结果见表4。

表4 菌液浓度的计算和选择
以1×20~1×29共10个稀释倍数的D(540)均值为横坐标,菌液浓度为纵坐标,作散点图(见图2)。设置截距为0后,添加趋势线,可得直线回归方程y=4×109x(R2=0.999 6,方程中x为D(540)值,y为菌液浓度,单位为个/mL)。

图2 D(540)值-菌液浓度图(第1次)
随后,按照相同的方法选取了另一株冻存的菌株TA102进行了重复测试,确认直线回归方程的准确性。选取1×20~1×29共10个稀释倍数,测得的D(540)值和菌液浓度结果见表5,绘制的D(540)值-菌液浓度图见图3。
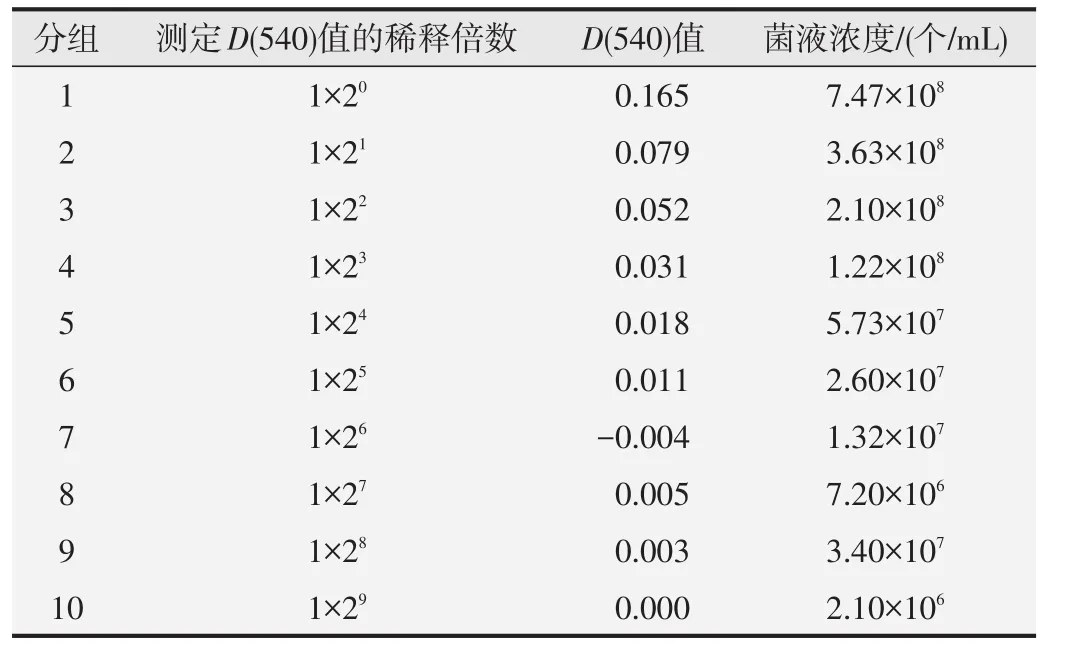
表5 第2次试验测定的D(540)值和菌液浓度
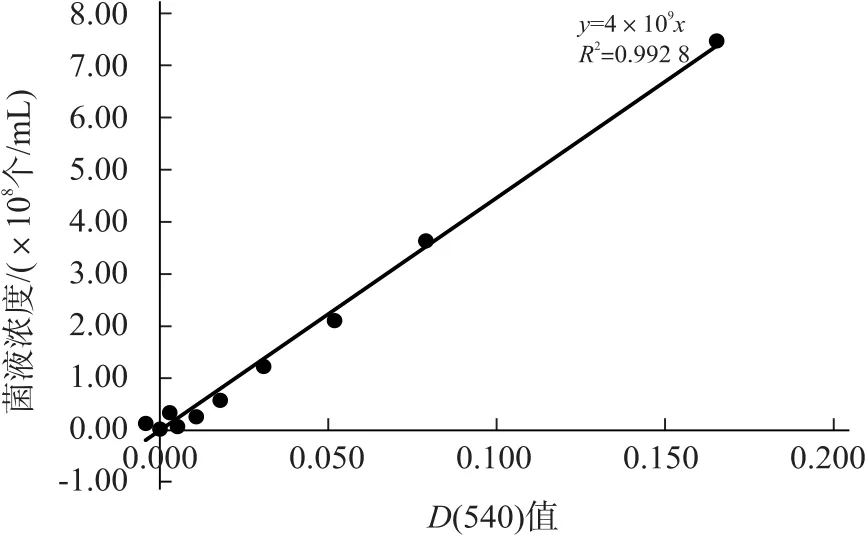
图3 D(540)值-菌液浓度图(第2次)
根据同样的方法,可得直线回归方程y=4×109x(R2=0.992 8,方程中x为D(540)值,y为菌液浓度,单位为个/mL)。
3 讨论
由于培养过程中菌液浓度是一个动态变化的过程,因此如何准确的得出所要菌液的浓度一直是一个让试验人员头疼的问题。常用的方法包括比浊法和平皿计数法,但是浊度仪在实验室中并不普及,而平板菌落计数法需要等24 h后菌落长出方可计数,有一定的时间延迟,故也不方便应用[6]。由于菌液浓度和吸光度值之间存在线性关系,故可以通过吸光度值的测定来判断菌液浓度。林静等[7]报道了在600 nm测定5种常见致病菌的吸光度值,段梦奇等[8]发现550 nm比600 nm更适用于百日咳菌液的吸光度值测定,计芬芬等[9]比较了各种波长,认为国内微生物定量细菌一般使用600 nm。对于Ames试验中所用到的营养缺陷性鼠伤寒沙门氏菌,有的研究人员在540 nm下测定吸光度值,认为D(540)值在0.1~0.2的范围内可满足试验要求[2],有的研究人员在600 nm下测定吸光度值[10],因此在本试验中主要选择这两个波长进行了研究,结果发现在540 nm时菌液的吸光度值显著高于600 nm,因此选择540 nm测定。
Ames试验中,菌液的浓度对试验影响较大,如菌液浓度太低,则会降低试验的敏感性[10],如果菌液浓度太高,则细菌的活力会下降。针对本实验室冻存的营养缺陷型鼠伤寒沙门氏菌,通过接种后连续测定其0~14 h的菌液浓度和D(540)值,发现菌液的浓度变化基本呈现一个“S形”曲线,大约在培养10 h后达到了菌液的最大浓度,虽然此后吸光度值仍在上升,但是活菌数却在下降,这是由于死亡的菌体也有一定的吸光度值所导致[11]。因此在本试验中,将接种物放于旋转培养箱中于37℃、100 r/min培养10 h,即可获得对数生长末期的菌液。
各规范和文献均要求菌液浓度为活菌的数目,即CFU(Colony-Forming Units)/mL,通过平板菌落计数法折算出的菌液浓度就是CFU/mL,和业内要求一致。随后,本研究通过吸光度值测定和平板菌落计数法,建立了菌株TA102菌液浓度和吸光度值的直线回归方程,两次试验的结果均表明菌液浓度和D(540)值之间存在良好的线性关系,可通过直线回归方程y=4×109x由D(540)值计算获得菌液浓度。如菌液的D(540)值(扣除营养肉汤的本底值)在0.25~0.50之间即可保证获得菌液的浓度在(1~2)×109个/mL。2次试验培养10 h后获得的菌液浓度分别为7.50×108个/mL和7.47×108个/mL,未达到109个/mL,但是考虑到稀释时的损耗和2个粘连的菌体只会生长出1个CFU,因此平板稀释法的结果往往偏低。因此,本扩增条件完全可以满足(1~2)×109个/mL这个范围。
在条件相同(同一批次冻存的菌液,相同的接种体系,相同的仪器)时,每次扩增出来的菌液浓度都应相近,即D(540)值相近,每次只需测定菌液的D(540)值(扣除营养肉汤的本底值)是否在0.25~0.50之间即可知道这次扩增的菌液浓度是否在(1~2)×109个/mL范围内。如D(540)值太低,则表明生长状态不好,菌液浓度不足,无法进行试验;如D(540)值太高,则表明可能产生污染,也无法进行试验。通过TA102菌液扩增条件的摸索和确定,证明通过测定菌液吸光度值可对菌液浓度进行预测和质量控制,此法科学、简单、快捷。
