红曲霉合成莫纳克林K的研究进展
2023-08-30秦昱晖王海蛟王聪聪赵宇飞王成涛
张 婵, 程 颖, 秦昱晖, 王海蛟, 王聪聪, 赵宇飞,王 蓓, 王成涛
(1.北京工商大学 食品与健康学院,北京 100048;2.北京市食品添加剂工程技术研究中心,北京 100048)
红曲霉(Monascus)又称红曲菌[1],是一种典型的丝状真菌,是我国重要的药食两用微生物资源之一,其发酵产品红曲在我国及东南亚地区有上千年的应用历史,是我国传统的特色出口产品之一。红曲霉产生多种有益活性物质,广泛应用于食品发酵、食品防腐、食品添加剂和中药等领域[2]。
对于红曲霉的相关研究也一直受到广泛关注,特别是近30年来,关于红曲霉的基础研究发展迅速,并取得了丰硕的科研成果。以天然可食用的红曲色素和降血脂的活性物质莫纳克林K(monacolin K,MK;又称洛伐他汀)应用最为广泛[3]。MK是红曲霉在发酵过程中产生的具有降低胆固醇活性的次级代谢产物,在20世纪70年代末,由日本的 Endo[4]发现,MK是与胆固醇合成相关的3-羟基-3-甲基戊二酸单酰辅酶A还原酶(3-hydroxy-3-methyl glutaryl coenzyme A reductase,HMGCR)的竞争性抑制剂,可抑制胆固醇合成过程中的关键酶羟甲基戊二酰辅酶A(hydroxymethylglutaryl coenzyme A,HMG-CoA)还原酶的活性,从而有效降低人体中胆固醇的合成量[5]。1987年9月1日,美国默克(Merck)公司研制的胆固醇合成抑制剂Mevacor(主要成分为MK)得到美国食品和药品监督管理局(Food and Drug Administration,FDA)批准[6],此后利用红曲霉加工合成MK受到研究者的关注。
据《中国心血管健康与疾病报告2020》,中国心血管疾病患者数量高达3.3亿,高胆固醇血症发生率正以惊人的速度增长,如何有效提高红曲霉发酵MK的产量已成为红曲发酵产业发展中必须解决的重要问题。
本研究从MK的生物合成途径、功能、红曲产品的开发及高产MK的方法等方面展开论述,希望可为红曲霉广泛应用,开发绿色、安全的活性物质提供理论依据。
1 红曲霉产MK的合成途径研究进展
MK(分子式C24H36O5,相对分子质量404,熔点157~159 ℃)在常态下为透明白色针状晶体,易溶于甲醇、乙醇、丙酮、氯仿、苯等有机溶剂,不易溶于水、正己烷、石油醚。红曲霉中MK以内酯式(闭环结构)和酸式(开环结构)2种形式存在,见图1。酸式MK的结构与人体内胆固醇合成途径中HMG-CoA还原酶结构相似,是HMG-CoA还原酶的竞争性抑制剂,可抑制胆固醇的合成。内酯式MK需要被人体肝脏分泌的羟基酸酯酶转化为酸式结构,才能够发挥降胆固醇的作用[7]。酸式MK结构对HMG-CoA还原酶抑制效果比内酯式MK结构的抑制效果更好。
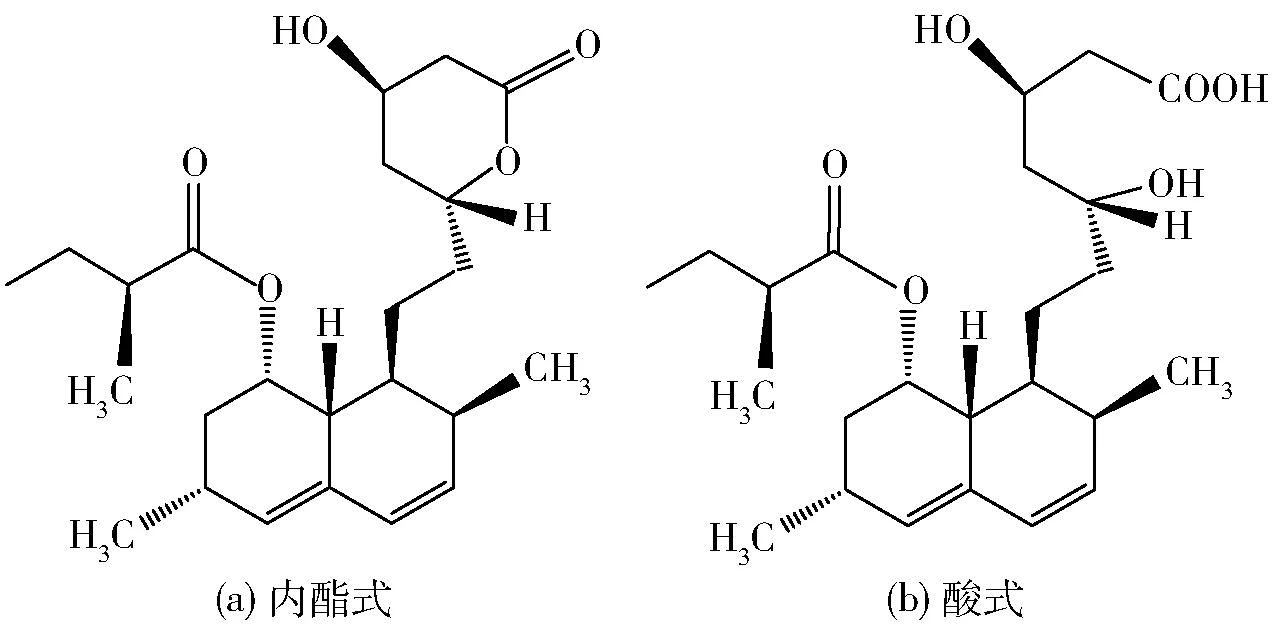
图1 Monacolin K的结构式
1979年,日本学者Endo[4]从红色红曲霉菌株中分离出一种降血脂成分称为MK;1980年,美国研究人员Alberts等[5]发现,土曲霉(Aspergillusterreus)也能产生MK。对于MK的生物合成途径、相关酶及基因的研究,最早认识来源土曲霉[8],现阶段在红曲霉中MK的生物合成途径相较于土曲霉中的研究较少[9-10]。土曲霉中MK的合成基因簇共包含18个基因[11],而丛毛红曲霉(Monascuspilosus)中MK的合成基因簇包含9个基因,这些基因与土曲霉MK基因簇中的对应基因高度同源[12]。
2005年,周礼红[13]根据GenBank中公布的相关基因设计引物(引物序列未公布),克隆得到紫色红曲霉M34的monK1基因,敲除monK1后,MK合成途径被中断,即未产生MK。2008年,Chen等[14]利用土曲霉中lovB基因的保守序列为探针克隆一段DNA序列,长度共为45 kbp,经序列分析发现,该片段为一个包含与土曲霉MK合成基因高度同源的基因片段mokA-mokI的MK合成基因簇,推测mokA和mokB用于合成肽链骨架;还包括P450单氧酶基因(mokC),氧化还原酶基因(mokD),脱氢酶基因(mokE),转酯酶基因(mokF),HMG-CoA还原酶基因(mokG),转录因子基因(mokH)及外排泵基因(mokI),见表1。Chen等[14]还利用基因打靶载体敲除丛毛红曲霉BCRC38072中的mokA基因,以潮霉素抗性基因标记,得到了44株转化体,再经DNA杂交技术筛选得到一株mokA基因敲除株BCRC38135,后经发酵实验证实其失去了生产MK的能力,研究证实了mokA参与MK合成中的作用。随后,Sakai等[15]敲除丛毛红曲霉中的mokB基因,通过HPLC分析丛毛红曲霉的发酵产物,结果显示未检测到MK,但检测到MK的前体物莫纳克林J(monacolin J,MJ)的存在,这说明mokB参与洛伐他汀二酮侧链的合成。Chen等[16]又利用丛毛红曲霉内源的3-磷酸甘油醛脱氢酶启动子的mokH超表达载体转化丛毛红曲霉BCRC38072,筛选得到3个p基因多拷贝菌株。经检测发现,mokH基因多拷贝菌株合成MK的能力提高了2倍左右。而且,通过PT-PCR分析发现,mokH基因多拷贝菌株中MK合成相关基因的表达均高于野生菌株,证实了mokH作为转录因子对MK合成的正调控作用。
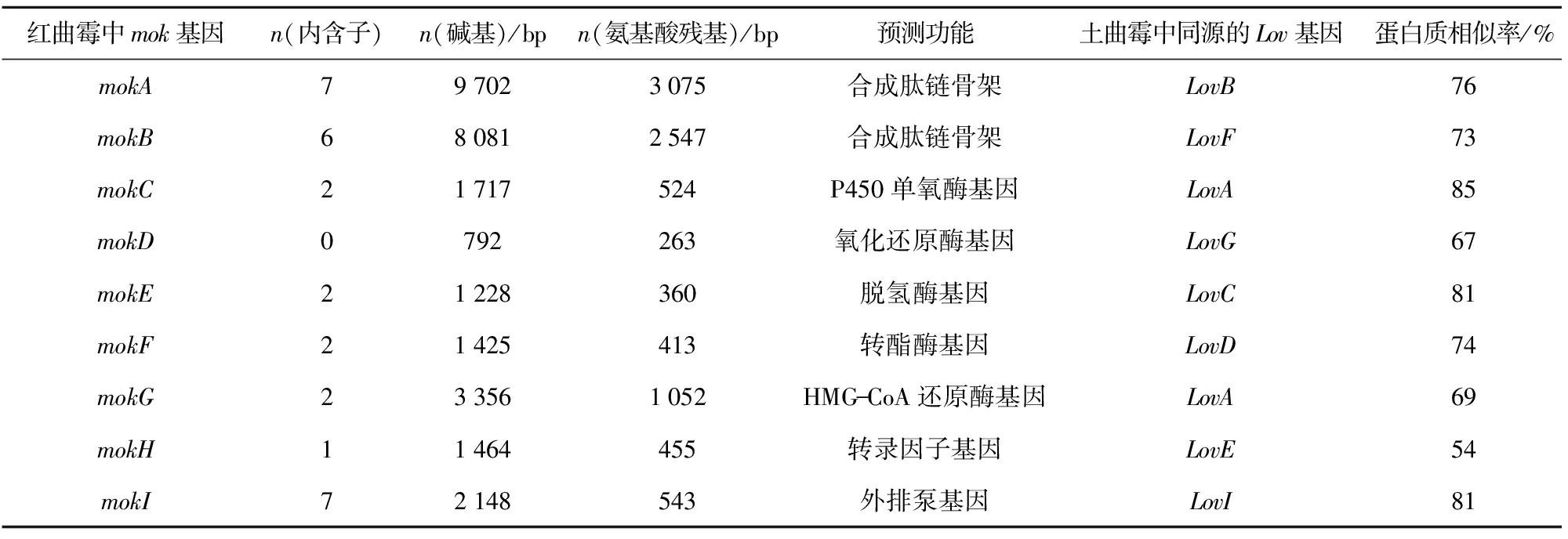
表1 红曲霉中的MK合成基因簇
大量研究表明,丝状真菌次级代谢产物的合成不仅受到生物合成途径特异性调控因子的调节,还可能受到全局性调控因子的调节。研究者们发现laeA编码的调控因子对于曲霉属的MK合成也具有调控作用。Bok等[17]研究了构巢曲霉(Aspergillusnidulans)的laeA基因对在其异源表达的MK合成基因的调控作用。研究表明,敲除laeA基因的菌株,lovC和lovE表达量明显降低,MK的产量也随之下降;而过量表达laeA基因的菌株lovC和lovE表达量显著提高,MK的产量提高了4倍。红曲霉中也存在类似的调控因子MplaeA。Zhang等[18]研究了红曲霉中MplaeA的两种mRNA(d-MplaeA和L-MplaeA)的选择性拼接方式,发现MplaeA对红曲霉MK的合成能力具有明显的调控作用。
目前,关于红曲霉合成MK的途径只是推测与土曲霉MK合成途径相似。MK是由红曲霉聚酮体合成酶(polyketide synthase,PKS)调控合成的次级代谢产物[9,19],在合成过程中先形成中间体,依次转化为莫纳克林L(monacolin L,ML)、MJ,最后形成MK,基本过程如图2。1)洛伐他汀九酮合成酶(lovastatin nonaketide synthase,LNKS)催化1分子丙二酰辅酶A依次与9分子乙酰辅酶A进行缩合反应,最终生成MK的主体结构—九酮体化合物(nonaketide)二氢莫纳克林L(dihydromonacolin L),进一步经过氧化、脱水等步骤生成monacolin L,再经单加氧酶催化发生羟基化反应生成monacolin J;2)洛伐他汀二酮合成酶(lovastatin diketide synthase,LDKS)催化1分子丙二酰辅酶A与2分子乙酰辅酶A缩合,生成甲基丁酰辅酶A;3)在转酯酶(transesterase)的作用下,甲基丁酰辅酶A通过酯键连接到monacolin J上,完成MK的合成[9-10,19-20]。

图2 红曲霉中MK合成途径
2 红曲霉产MK的生物活性及其应用领域研究进展
MK具有降脂功能,可通过抑制HMG-CoA还原酶活性,减少内源性脂质合成和外源性脂质吸收,并促进脂质运输和排泄。除此之外,有研究发现MK还具有抗疲劳、抗菌、抗癌和保护神经等生物活性[21-22]。多数研究结果显示MK对肝癌、宫颈癌、肺癌等多种恶性肿瘤均具有明显的抑制作用,并与常见化疗药物具有显著的协同作用。此外,MK具有抗病原细菌和真菌的生物活性。有研究表明,MK能够通过抑制病原真菌麦角甾醇合成基因ERG11和ERG3的转录水平来抑制其生长,从而起到抗病原真菌的效果[23]。
Shi等[24]探究了MK对人胶质瘤U251细胞的潜在抗肿瘤作用及其可能的分子机制。结果显示,应用10 μmol/L的MK抑制了U251细胞的增殖,抑制率高达53.4%。此外,MK诱导了活性氧的产生,并激活了线粒体介导的途径,导致细胞内还原-氧化平衡的破坏。同时,MK激活了MAPKs和NF-κB途径,上调了P38活性,下调了JNK/ERK/P65/IκBα表达,最终导致U251细胞凋亡。得出结论为MK可以通过触发ROS介导的氧化损伤和调节MAPKs和NF-κB途径诱导U251细胞的凋亡。
Zhang等[25]利用WGCNA(weighted gene co-expression network analysis)和CMap(connectivity map)软件识别和验证可能对胃癌(gastric cancer,GC)患者产生积极影响的治疗化合物:组蛋白去乙酰化酶(histone deacetylase,HDAC)抑制剂——丙戊酸(valproic acid,VPA)和洛伐他汀。体外实验显示VPA和洛伐他汀对胃癌细胞的生长具有剂量依赖性的抑制作用。胃癌细胞系中HDAC2过表达,VPA和洛伐他汀均通过抑制HDAC2表达诱导胃癌细胞凋亡,显示洛伐他汀可能显示出治疗胃癌的潜力。
Zhang等[26]研究红曲米对酒精性肝病(alcoholic liver disease,ALD)的影响作用,将C57/B6雄性小鼠每天灌胃4 g/kg体积分数为50%乙醇,连续8周诱导慢性ALD。实验组每天给予红曲米150 mg·kg-1·d-1,结果显示,补充红曲米可显著减轻酒精补充小鼠的高脂血症、循环炎症因子升高、肝脏结构损伤和氧化应激。此外,红曲米显著抑制酒精诱导的肝脏NF-κB活化和细胞凋亡。最终得到红曲米主要通过减轻肝脏氧化应激和炎症反应来预防ALD。Zou等[27]研究红曲米对非酒精性脂肪性肝病(non-alcoholic fatty liver disease,NAFLD)的保护机制。采用小鼠高脂饮食喂养模型和脂多糖及棕榈酸刺激的HepG2细胞模型,通过检测相关基因和蛋白的表达,探索NF-κB/NLRP3炎性体和mTORC1-SREBPs信号通路可能的分子机制。结果表明红曲米在体内和体外改善脂质积累和肝脏炎症,红曲米通过调节mTORC1-SREBPs及其与甘油三酯和胆固醇合成相关的靶基因改善脂质积累;还通过抑制NF-κB/NLRP3炎性体信号传导来抑制肝脏炎症。结论为调节NF-κB/NLRP3炎性体和脂质合成可能有助于红曲米对高脂型诱导的NAFLD的改善作用。
2.1 医药和保健食品领域中的应用
1987年,洛伐他汀在美国上市,成为首个上市的调脂药,是他汀类调脂的代表药。红曲米是红曲霉固态发酵的产物。血脂康是一种以红曲米为主要成分的中成药,被列入中国心血管疾病一级预防指南[28]。Xu等[29]为评价含有红曲的中成药治疗高脂血症的疗效,涉及1项4 824名受试者的47项随机对照试验。评估了3种不同的中国红曲米补充剂(最常见的是血脂康600 mg,每日2次),结果显示红曲米与安慰剂相比显著降低了低密度脂蛋白胆固醇、总胆固醇和甘油三酯。Kandelouei等[30]评估他汀类药物对心血管疾病患者的C反应蛋白和高敏C反应蛋白,发现他汀类药物降低血清中的高敏C反应蛋白水平。Minamizuka等[31]研究低日剂量的红曲米对轻度血脂异常患者的动脉硬化的影响。18名没有已知心血管疾病、仅通过饮食疗法控制的低密度脂蛋白胆固醇[(3.96±0.19) mmol/L]的患者被随机分配接受含有2 mg MK的低剂量红曲米(200 mg/d)或单独饮食疗法8周。结果显示红曲米组的患者表现出低密度脂蛋白胆固醇、总胆固醇、载体蛋白B和血压的明显降低,而没有任何公认的不良反应。这表明低日常剂量的红曲米可以降低血脂异常患者的心血管风险。
保健食品是一种具有调节身体机能,纠正身体的亚健康状态,使身体保持健康活力且对人体不产生危害性的功能性食品。覃爱红等[32]将红曲与芹菜膳食纤维、白藜芦醇、核桃仁等物质按一定比例加入,获得食用安全,无副作用,可促进人体正常排泄,并具有降胆固醇、降血脂和降血压作用的保健食品。何晓磊等[33]将石榴作为原料进行红曲霉发酵获得了果醋,该果醋营养丰富,具有一定的降糖、降脂、抗氧化功能。
2.2 饲料中的应用
随着人们对健康饮食和心血管疾病的重视,低胆固醇的畜禽产品备受关注。红曲霉代谢产生的MK已被作为降低胆固醇的添加剂用于家禽生产中。崔培等[34]在喂养红白锦鲤幼鱼时添加红曲米,结果表明饲料中添加红曲米能显著提高试验鱼的增重率、特定生长率及饲料效率(P<0.05),且显著降低试验鱼血糖含量及血清中谷草转氨酶(aspartate aminotransferase,AST)活性(P<0.05),研究表明,在饲料中添加红曲米能有效提高红白锦鲤幼鱼的生长性能,降低其血糖含量。陈冬[35]对紫色红曲霉固态发酵玉米粉和豆粕的条件进行探索,想要生产适合于蛋鸡的红曲功能性饲料,最终结果表明基础日粮中添加红曲霉发酵饲料可提高蛋鸡产蛋率,降低料蛋比,有助于提升蛋鸡的生产性能,可降低蛋鸡血清甘油三酯和血清胆固醇含量。表明红曲霉发酵饲料在蛋鸡养殖中有较好的应用潜力。
2.3 其他领域中的应用
傅静等[36]为了实现定向发酵洛伐他汀普洱茶,开发功能普洱茶产品,试验利用已筛选出的红曲霉株M13制成固体发酵剂,外源接种该菌种进行普洱茶发酵,结果表明,制备的普洱茶中洛伐他汀含量达到0.299 mg/g,得到富含洛伐他汀的普洱茶产品,得出了定向生产洛伐他汀普洱茶的加工工艺,对有益微生物在普洱茶发酵中的推广应用具有一定意义。
3 红曲霉高产MK的生物技术方法研究进展
Blanc等[37]在研究红曲霉发酵过程中发现有真菌毒素桔霉素的产生,摄入桔霉素可对肾脏、肝脏、心脏和生殖系统产生毒性作用。基于此,红曲霉发酵产品的安全性,使红曲霉工业化发展受到一定程度的限制。此外,红曲霉产生的MK是安全、高效、低毒的降血脂物质,且在国内外的市场需求量都很大。但天然红曲霉产生的MK产量较低,不稳定,限制了其应用,如何提高红曲霉的MK产量,并降低桔霉素的产量,是解决功能红曲问题的重要途径。
MK的产量和品质由红曲霉的菌种以及红曲霉发酵工艺决定。红曲霉生长有其特定的规律,根据红曲霉菌种的生长规律选择适宜的红曲霉菌种和发酵条件,来确定其培养温度、碳氮比和培养时间等,来实现MK高产[38]。高产MK的传统方法有优化培养基、控制环境因子、诱变育种或通过基因工程技术改造菌种。
3.1 诱变育种
桔霉素对红曲类产品的污染严重影响了该产业的健康发展。筛选高产红曲色素及MK且不产或低产桔霉素的红曲霉显得尤为重要。常用的菌种改良手段是常规的诱变,其中包括紫外诱变和常压室温等离子诱变方式。Huang等[39]采用紫外照射和甲磺酸乙酯对红曲霉进行诱变研究。发现紫外光照射2 h后的红曲霉(U-2)MK的产量,比紫外光照射10 h后的红曲霉和经甲磺酸乙酯处理的红曲霉MK产量高得多。在最初的潜伏期,U-2菌株的MK产量异常低。孵育7 d后,细胞生长达到最大值1.1 g/L。在培养过程中,红曲霉U-2的MK产量最高可达8 437.6 mg/kg。Dikshit等[40]用紫外照射或甲磺酸乙酯处理红曲霉孢子,得到不产生红曲色素和桔霉素的菌株,但其MK产量显著高于原菌株。Kanpiengjai等[41]利用X-射线诱变红曲霉,并对其发酵条件进行优化。结果表明在初始含水量为72.5%、发酵时间为38 d的条件下,MK产率可达6 428 mg/kg。
3.2 构建工程菌株
随着分子生物学理论知识的不断完善和技术水平的持续提高,应用于微生物领域的基因工程技术也已经越来越成熟。基因工程是从20世纪70年代开始发展起来的新型生物技术,在基因水平,用分子生物学的技术手段对基因进行操纵、改变、重建、缺失、过表达等操作,从而使生物体的遗传性状按要求发生定向的变异。因其具有不受种属限制、可根据需要有目的地进行人为改造等优点,迅速成为工业微生物育种的重要手段。
Zhang等[42]对MK合成基因簇中mokC、mokD、mokE、mokI四段基因进行过表达,获得了4株高产MK的菌株,产量较原始菌株分别提高了234.3%、220.8%、89.5%和10%。Lin等[43]在红曲霉菌株CG-6中过表达mokE,使其MK产量显著提高。林琳等[44]成功构建了mokE基因过表达菌株,结果显示,mokE基因的过表达不仅提高了MK的产量,还对红曲霉菌丝体及孢子形态产生了一定影响。王娇等[45]研究红曲霉中orf5基因过表达对MK含量的影响,结果表明,过表达菌株的MK含量比对照明显提高,高达36.89%。红曲霉过表达orf5有利于增加MK的积累,为深入研究红曲霉orf5基因的功能提供参考。Zhang等[46]研究了全局调节因子LaeA对紫色红曲霉MK合成的影响,将LaeA过表达得到L3菌株,结果显示MK产量比原始菌株提高了48.6%。
对于构建高产MK的红曲霉菌株,大多集中在对mokA-mokI基因的操作,相对红曲色素的研究是较少的。所以需要加快对红曲霉MK生物合成相关基因和酶的全面研究,更有利于深入理解红曲霉MK的生物合成途径,为应用基因工程技术定向选育高产MK的红曲霉菌株提供了基础理论和技术手段。
3.3 优化培养基
对于红曲霉培养基条件的优化,一般集中在碳氮源种类、添加量及比例、无机盐的种类及添加量,还有一些外源添加物质等。碳氮源是菌种发酵非常重要的成分,碳源为微生物提供能量及细胞碳链,氮源是构成细胞的核酸、蛋白质等物质的主要成分,对微生物生长起重要作用。MK产率通常与稳定阶段氮源限制有关,当红曲霉生长受到氮源限制产生抑制作用,可以利用多余的碳源产生次级代谢物,从而提高次级代谢物产量。
Liu等[47]研究红曲霉固态发酵高产MK的影响因素,通过7个单因素实验、Plackette-Burman和Box-Benhnken设计试验,探讨MK生产的关键因素。结果表明,初始水分(50%~55%)和麸皮含量(4.5%~5.5%)是红曲霉固态发酵过程中营养物质和氧气运输的关键因素。Zhang等[48]使用不同谷物进行了固态发酵实验,发现小米作为培养基质时,MK产量最高,其产量达到了7.12 mg/g,此外还对其他发酵条件以及外加碳源、氮源等进行了优化,使小米培养基在最佳条件下MK产量达到了19.81 mg/g,极大地提高了MK的产量。Suraiya等[49]研究发现,用褐海藻Saccharinajaponica作为发酵基质,在最佳条件下MK产量可以达到13.98 mg/g,而且经检测发酵产生的MK具有较高的热稳定性、超氧化物歧化酶活性以及胆固醇抑制活性。Lin等[50]考察二价金属阳离子Mn2+、Zn2+和Mg2+的浓度对红曲霉的细胞生长和MK产量的影响,当Mn2+、Zn2+、Mg2+质量分数为0.33%、0.16%、1.00%时MK增产,质量分数达到9.57 mg/g。
近几年研究发现,一些外源添加物如中药薏米、玉米油等的添加,能较大幅度地提高食药用菌代谢产物的产量,或是产生新的代谢物,采用外源添加物对代谢产物的生物合成进行调控成为食药用菌发酵调控的新策略和新手段。Zhang等[51]发现在培养基中添加谷氨酸使得MK产量增加了3.5倍,上调相关基因mokB-mokI的表达,增加了MK产量。通过扫描电镜观察红曲霉菌丝形态发现,谷氨酸显著增加了红曲霉菌丝的含量,改变了红曲霉菌丝的通透性,增加了细胞中MK的分泌,从而提高了MK的产量。Huang等[52]发现亚油酸可能为群体感应信号分子,56 μmol/L和512 μmol/L亚油酸可以上调mokH和mokA基因转录水平。特别是512 μmol/L亚油酸的添加,使红曲霉的MK产量增加1.35倍。Zhang等[53]添加质量分数为0.6%精氨酸可提高MK的产量,MK产量从94.6 mg/L 增加到228.4 mg/L,并且RT-qPCR结果显示,mokA-mokI基因的表达均上调。
3.4 控制环境因子
影响红曲霉发酵条件有培养基初始pH、接种量大小、培养温度和发酵时间等。培养环境对于红曲霉的生长和次级代谢物的产生至关重要,通常红曲霉在18~45 ℃可生长,其最适培养温度为30~38 ℃[54]。优化这些参数,可以改变红曲霉的MK产量,从而达到MK高产的目的。
Pengnoi等[55]对红曲霉固态发酵温度进行研究,表明在30 ℃下培养5 d,然后在25 ℃下培养到30 d,有助于产生更多的MK,分别是30 ℃和25 ℃恒温培养的2.8倍和1.4倍。pH值对红曲霉中酶的催化作用和细胞膜各种组分的运输有显著影响,Mohan-Kumari等[56]发现,在低酸(pH=5)发酵条件下MK产率显著高于其他pH值,且对红曲霉的生物量有显著影响。研究者对红曲霉与大米、小米、小麦、大麦等不同谷物进行了固态发酵。结果表明,以小米为发酵基质的MK产量最高(7.25 mg/g),而小麦(2.45 mg/g)和大麦(2.69 mg/g)吸水性差,菌丝不易生长,所以MK产量较低[48,57]。
Wen等[58]对红曲霉发酵条件进行总结,发现变温培养有利于提高MK产量。由于红曲霉细胞的生长发育与MK合成相关酶的最适温度不同,生长发育和MK合成受变温培养的分段调节。红曲霉在30 ℃下孵育3~5 d,然后调整到大约25 ℃,会显著提高MK产量。对于培养基的初始pH值,控制在4~6为好。最佳条件为红曲种子液的接种量不超过固态培养基的20%,发酵时间保持在15 d左右。
4 展 望
红曲霉是食药两用的安全菌株,具有悠久的使用历史,其代谢产物MK因其降血脂功能,被应用于医药领域。近年来,心血管疾病的发病率和死亡率在全球均已跃居首位,主要是因为血液中积聚了过多的胆固醇。而MK作为降低胆固醇的有效成分,其研究与开发具有较大意义。因此,世界各国相继以红曲发酵产物开发各种治疗药物和保健食品。但是由于野生菌株MK产量不高及桔霉素超标等问题限制其应用。因此应加大对红曲霉及MK的研究,明确莫纳克林类物质合成代谢途径和调节机制,以便进一步控制和利用。这样也有利于新型红曲保健食品和降低胆固醇治疗药物的开发,具有广阔的市场和发展前景。
