红曲霉洛伐他汀的液态发酵及其分离纯化研究
2019-02-15陈景智王力超李亮叶秀云林娟
陈景智,王力超,李亮,叶秀云,林娟
(福州大学,福建省海洋酶工程重点实验室,福建 福州,350116)
红曲,在我国已有1000多年历史,是古代食疗两用的中药材[1],红曲中含有多种功能性成分,如红曲色素、氨基丁酸、洛伐他汀、麦角甾醇等[2],还含有淀粉酶、蛋白酶、果胶酶、酯化酶等多种酶类物质[3-5],具有很好的研究意义。
洛伐他汀为日本学者远藤章于1979年从红色红曲霉菌(Monascusrubber)的发酵液中分离出来,发现其具有强烈抑制胆固醇合成的作用,命名为Monacolin K[6]。之后,远藤章又相继分离出Monacolin J、Monacolin L[7]、Monacolin X[8]和Monacolin M[9],将这些物质统称为Monacolins,但Monacolin K还是主要作用物质。
随着人们生活水平的日益提高,患有心血管疾病的人越来越多,洛伐他汀作为治疗心血管疾病的理想药剂[10-11],需求量日益增大,但生产过程中的产量低、周期长、成本高等问题限制了红曲洛伐他汀的实际应用。因此,本文对实验室选育得到的高产洛伐他汀红曲霉突变株R”-30进行液态发酵和分离纯化工艺研究,为工业化生产和应用提供参考依据。
1 材料与方法
1.1 材料与仪器
1.1.1 菌种与试剂
红曲霉突变株R”-30(MonascusR”-30),由福建省海洋酶工程重点实验室利用基因组重排技术选育得到。
蛋白胨购于Oxiod公司;柱层析用硅胶:80~120目,购自青岛海洋化工有限公司; Sephadex LH20,购自西格玛奥德里奇(上海)贸易有限公司;酵母膏、甘油、葡萄糖、乙酸乙酯、MgSO4·7H2O、NaNO3、ZnSO4·7H2O、KH2PO4等均为分析纯,购自国药集团化学试剂有限公司。
1.1.2 主要仪器设备
T6新世纪紫外可见分光光度计,北京普析通用仪器有限责任公司;SW-CJ-2F洁净工作台,苏州安泰空气技术有限公司;HWS24电热恒温水浴锅,上海一恒科技有限公司;SHP-250生化培养箱,上海精宏实验设备有限公司;ZWYR-2102C恒温振荡培养箱,上海智城分析仪器制造有限公司);CF16RXⅡ高速冷冻离心机,日本HITACHI公司; D-2000 Elite型高压液相色谱仪,日本HITACHI。
1.1.3 培养基
PDA培养基:配制方法参照文献[12]。
种子培养基(g/L):葡萄糖30,蛋白胨20,酵母膏20,黄豆粉10,甘油(分析纯)50,MgSO4·7H2O 1,NaNO32,ZnSO4·7H2O 2,KH2PO41。
液体发酵培养基(g/L):葡萄糖20,甘油(分析纯)50,蛋白胨10,酵母膏10,NaNO32,MgSO4·7H2O 1,ZnSO4·7H2O 2,KH2PO41。
无碳源发酵培养基(g/L):蛋白胨10,酵母膏10,MgSO4·7H2O 1,NaNO32,ZnSO4·7H2O 2,KH2PO41。
无氮源发酵培养基(g/L):葡萄糖20,甘油50,MgSO4·7H2O 1,ZnSO4·7H2O 2,KH2PO41。
缺无机盐发酵培养基(g/L):葡萄糖20,甘油50,蛋白胨10,酵母膏10,NaNO32。
1.2 实验方法
1.2.1 洛伐他汀测定方法
1.2.1.1 紫外分光光度法
洛伐他汀在229、237和246 nm处有最大紫外吸收,其中以237 nm处吸光值最大,可通过测量OD237来初步判定洛伐他汀含量的高低[13]。取1 mL发酵液,加入9 mL乙醇(70%)振荡混匀,55 ℃,130 r/min 振荡提取1 h;4 200 r/min离心5 min,取上清,适当稀释后测量OD237。
1.2.1.2 高效液相色谱法(HPLC)
(1)HPLC检测条件[14]
色谱柱:HITACHI LaChromUltra C18(5 μm);流动相:乙腈∶0.01%磷酸=60∶40;检测波长:238 nm;进样体积:10 μL;流速:1 mL/min;柱温:28 ℃。
(2)洛伐他汀(内酯型)标准曲线的绘制
准确称取洛伐他汀内酯型标准品5 mg,用甲醇定容至25 mL,得到200 mg/L的母液,系列稀释得到5,10,50,100,150 mg/L的样品。以洛伐他汀浓度为横坐标,以峰面积值为纵坐标绘制洛伐他汀浓度-峰面积标准曲线,每组实验重复3次。
由图1可知,当洛伐他汀浓度在0~200 mg/L时,线性关系良好,R2=0.998 4,回归方程为y=16 689x-1 202.6,内酯型洛伐他汀标准品的液相色谱图如图2所示。
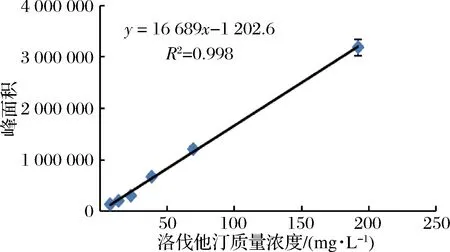
图1 洛伐他汀(内酯型)浓度与峰面积关系曲线Fig.1 Curve of lovastatin(lactone form) concentration and peak area
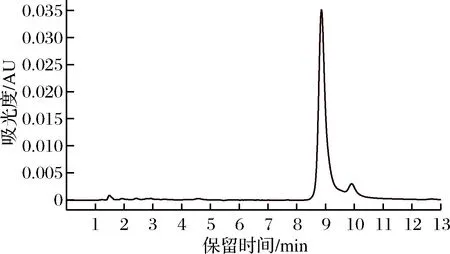
图2 洛伐他汀(内酯型)标准品的液相色谱图Fig.2 HPLC chromatogram of standard substance concentration and peak area of lovastatin(lactone form)
(3)洛伐他汀开环酸型溶液制备方法
准确称取洛伐他汀内酯型标准品5 mg,加4 mL甲醇溶解,加20 mL 0.2 mol/L NaOH溶液混匀后采用超声波处理30 min,取出冷却,用3 mol/L H3PO4调pH至6左右,加甲醇定容至25 mL,然后进行液相色谱检测,若洛伐他汀内酯型标准品全部转化为开环酸型,则洛伐他汀开环酸型浓度约为200 mg/L。
(4)洛伐他汀(开环酸型)标准曲线的绘制
方法同内酯型标准曲线的绘制。由图3可知洛伐他汀浓度在0~200 mg/L时,线性关系良好,R2=0.995 32,回归方程:y=20 339x+21 205。开环酸型洛伐他汀标准品的液相色谱图,如图4所示。
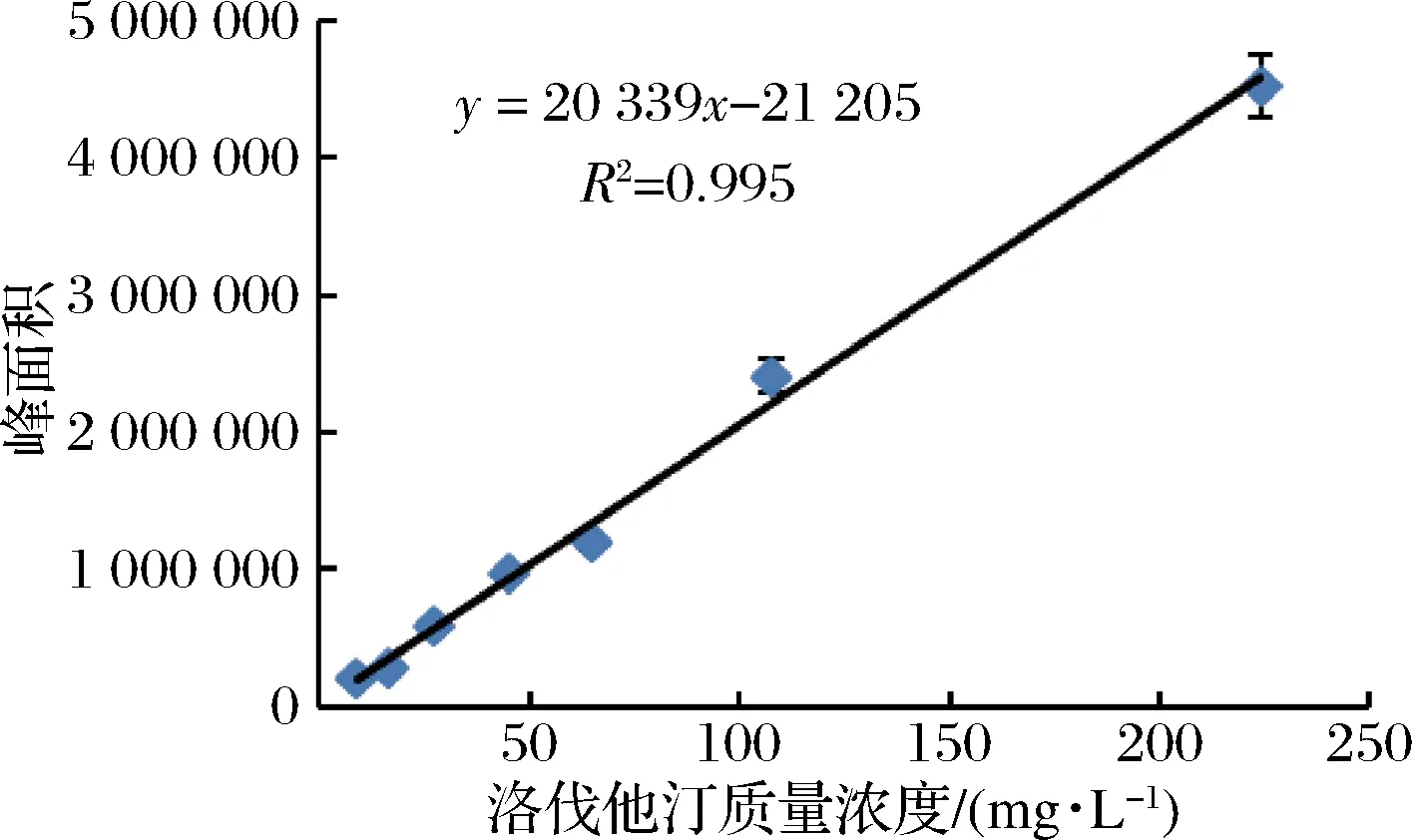
图3 洛伐他汀(开环酸型)浓度与峰面积关系曲线Fig.3 Curve of lovastatin(acid form) concentration and peak area

图4 洛伐他汀(开环酸型)标准品的液相色谱图Fig.4 HPLC chromatogram of standard concentration and peak area substance of lovastatin (acid form)
(5)发酵液中洛伐他汀的检测
取1 mL发酵液,加入70%乙醇9 mL振荡混匀, 55 ℃,130 r/min振荡提取1 h,4 200 r/min离心5 min,取上清液用0.22 μm的有机微孔滤膜过滤,取滤液采用HPLC检测洛伐他汀含量,如方程(1)所示。
ρ(内酯型洛伐他汀)/mg·L-1)=(y+1 202.6)/16 689×稀释倍数
(1)
式中:y—内酯型洛伐他汀峰面积。
ρ(开环酸型洛伐他汀)/(mg·L-1)=(y-21 205)/20 339×稀释倍数
(2)
式中:y—酸型洛伐他汀峰面积。
1.2.2 红曲霉发酵培养基的优化
(1)碳源对洛伐他汀产量的影响:分别选取葡萄糖、蔗糖、可溶性淀粉、甘油、半乳糖、麦芽糖6种碳源添加到缺碳发酵培养基中(添加量均为2%表示100 mL 发酵液添加2 g碳源),考察不同碳源对洛伐他汀产量的影响;确定最适碳源后,进一步研究不同添加量(1%、2%、3%、4%、5%、6%)的影响。
(2)氮源对产洛伐他汀的影响:分别取有机氮源—蛋白胨、牛肉膏、酵母膏、玉米浆、黄豆粉等(添加量1%);无机氮源—NaNO3、NH4NO3、(NH4)2SO4(添加量0.2%)添加到缺氮培养基中,考察不同氮源对洛伐他汀产量的影响。确定最佳氮源后,进一步研究不同添加量(0.5%、1%、1.5%、2%、2.5%、3%)的影响。
(3)无机盐对产洛伐他汀的影响:选择KH2PO4、MgSO4·7H2O、ZnSO4·7H2O、FeSO4(添加量0.1%)添加到缺无机盐培养基中,考察不同无机盐对洛伐他汀产量的影响。确定最佳无机盐后,进一步研究不同添加量(0.05%、0.1%、0.15%、0.2%、0.25%、0.3%)的影响。
(4)碳源、氮源、无机盐配比的正交试验:在上述实验基础上,对碳源、氮源、无机盐进行正交试验研究各自适宜的添加量。利用L9(34)正交表进行实验设计确定这些因素的最优配比。因素水平编码如表1所示。
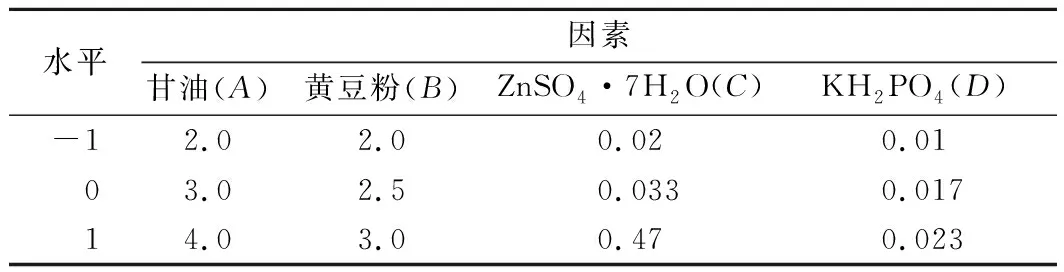
表1 正交实验设计因素水平编码表 单位:%Table 1 Factors and levels of orthogonal experimental design
1.2.3 红曲霉发酵条件的优化
(1)培养基初始pH的影响:调节发酵培养基pH分别为4、5、6、7、8,研究不同初始pH对菌株产洛伐他汀的影响,确定最适初始pH。
(2)种龄的影响:分别将不同菌龄(48、56、64、72、80 h)的种子液接种到发酵液中培养,确定最佳菌龄。
(3)接种量的影响:分别控制接种量为4%、8%、12%、16%、20%,研究最适接种量。
(4)发酵温度的影响:将摇瓶分别置于25、30、35 ℃和变温(28 ℃,2 d;26 ℃,2 d;25 ℃,2 d;23 ℃,数天)的摇床中进行发酵培养,确定适宜的发酵温度。
(5)摇床转速的影响:将摇瓶分别置于转速为100、150、200、230 r/min的摇床中进行发酵培养,确定适宜的转速。
(6)摇瓶装液量的影响:在250 mL锥形瓶中分别装25、50、75、100、125 mL发酵培养基,研究不同装液量对洛伐他汀产量的影响。
1.2.4 洛伐他汀的分离纯化
1.2.4.1 红曲中洛伐他汀提取分离路线
液态发酵液→洛伐他汀提取→离心→上清液浓缩→硅胶柱层析→洛伐他汀粗品→浓缩→LH20柱层析→收集→检测纯度[15-17]。
1.2.4.2 洛伐他汀提取
调节发酵液pH至碱性,于30 ℃、180 r/min的水浴摇床中提取1 h后,4 200 r/min离心5 min,取上清液。
2 结果与分析
2.1 红曲霉液态发酵产物中洛伐他汀类型的判定
采用HPLC检测发酵液中的洛伐他汀,色谱图见图5。
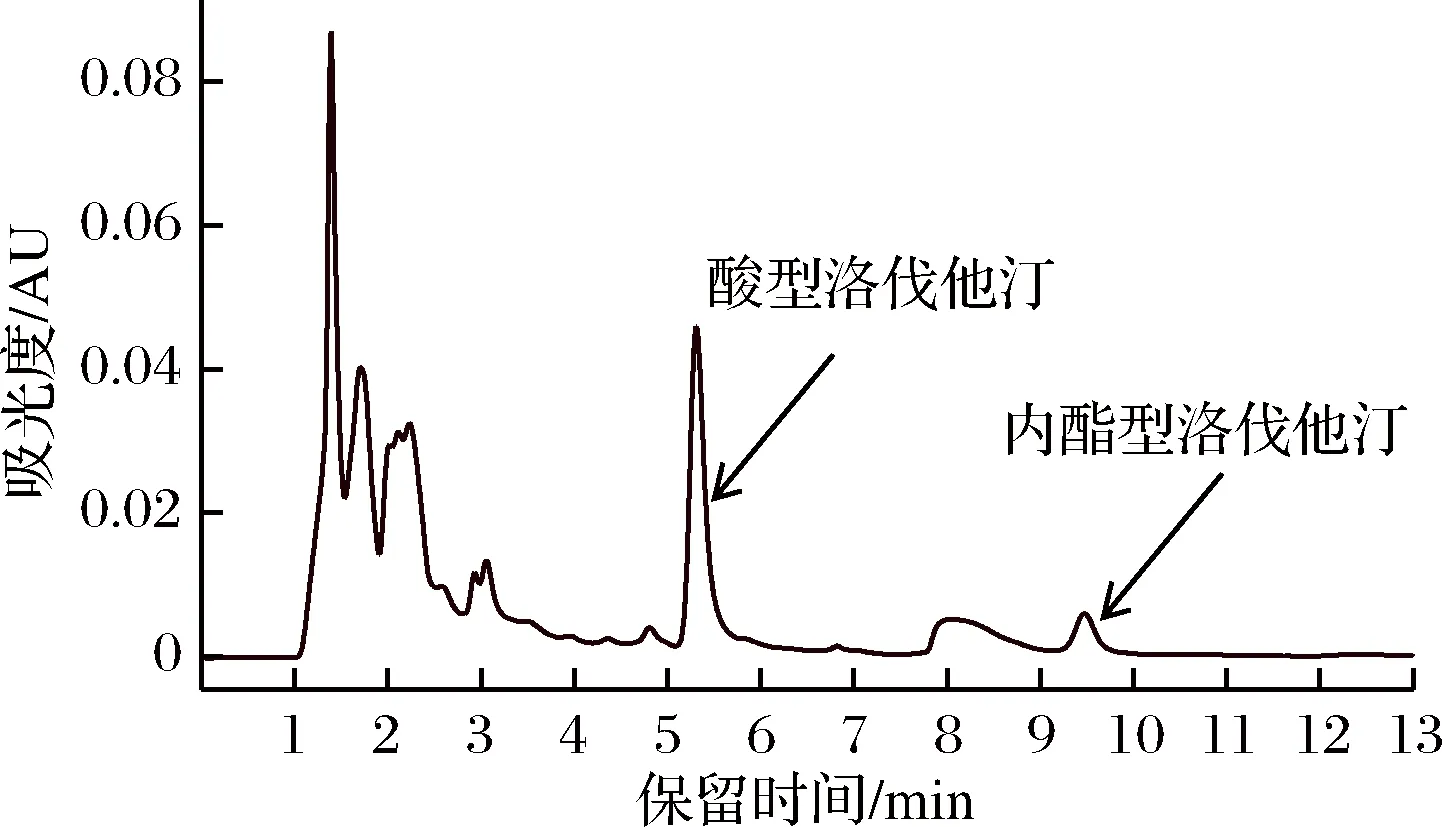
图5 发酵液中洛伐他汀的HPLC检测色谱图Fig.5 HPLC detection chromatogram of fermentation broth for the content of lovastatin
由图5可知,红曲霉液态发酵所产的洛伐他汀主要为开环酸型。据文献报道,天然红曲产的洛伐他汀多为酸型,其药效约为内酯型的2倍[18],因此红曲霉洛伐他汀具有很好的药用功效。
2.2 洛伐他汀液态发酵工艺研究
2.2.1 发酵培养基优化
2.2.1.1 碳源对洛伐他汀产量的影响
不同碳源对洛伐他汀产量的影响如图6所示,碳源为甘油时洛伐他汀产量最高(定义为100%),确定最佳碳源为甘油。进一步研究其不同添加量甘油对洛伐他汀产量的影响,从图7可以看出,在3%时达到最大值(定义为100%)。
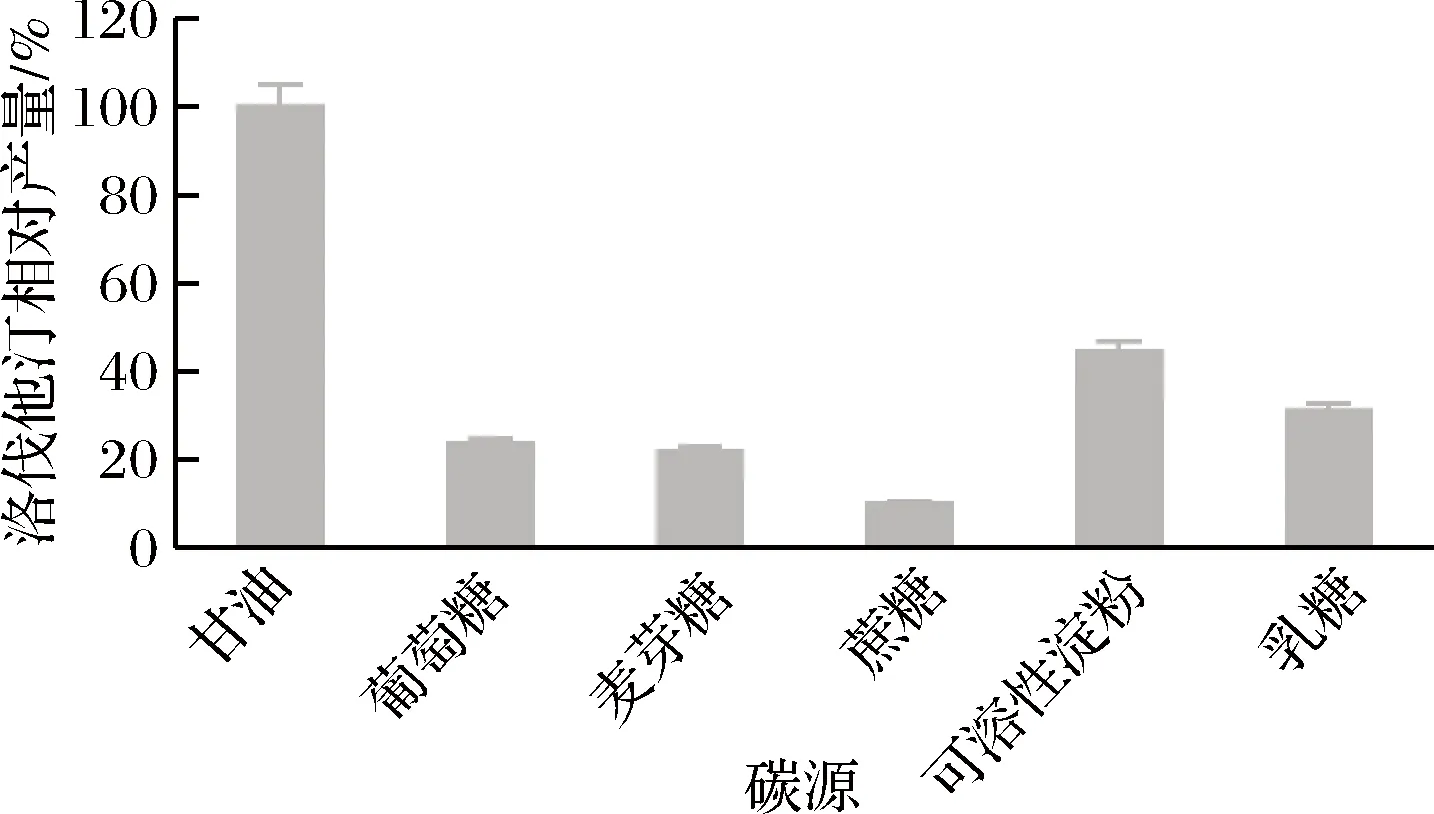
图6 碳源对洛伐他汀产量的影响Fig.6 Effect of carbon sources on lovastatin yield
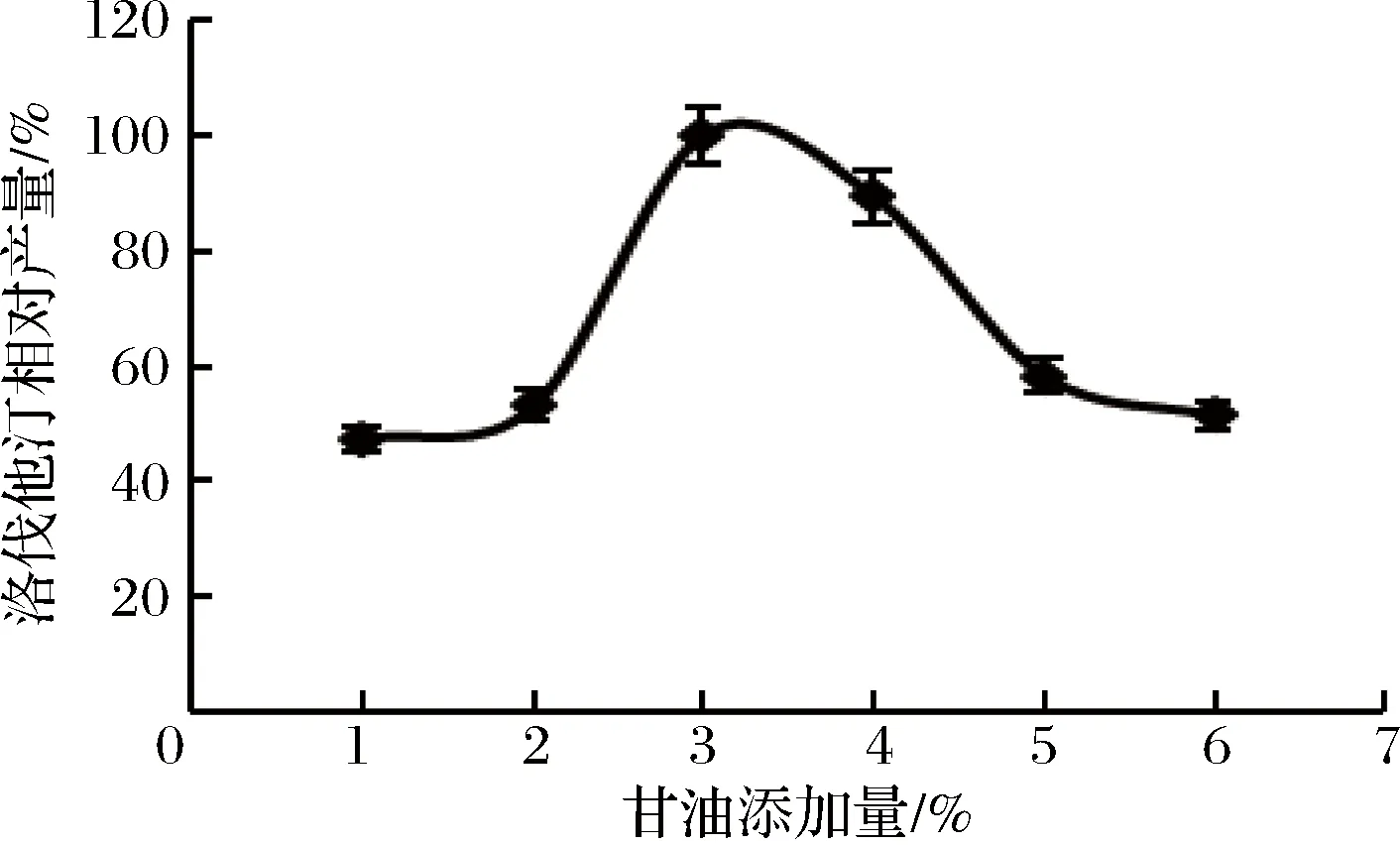
图7 甘油添加量对洛伐他汀产量的影响Fig.7 Effect of glycerol content on lovastatin yield
2.2.1.2 氮源对洛伐他汀产量的影响
不同氮源对洛伐他汀产量的影响如图8所示,黄豆粉效果最好(定义为100%),确定为最佳氮源。进一步对黄豆粉的最佳添加量进行研究,实验结果见图9,添加量为2.5%时,洛伐他汀产量达到最大(定义为100%),所以确定黄豆粉的最适添加量为2.5%。
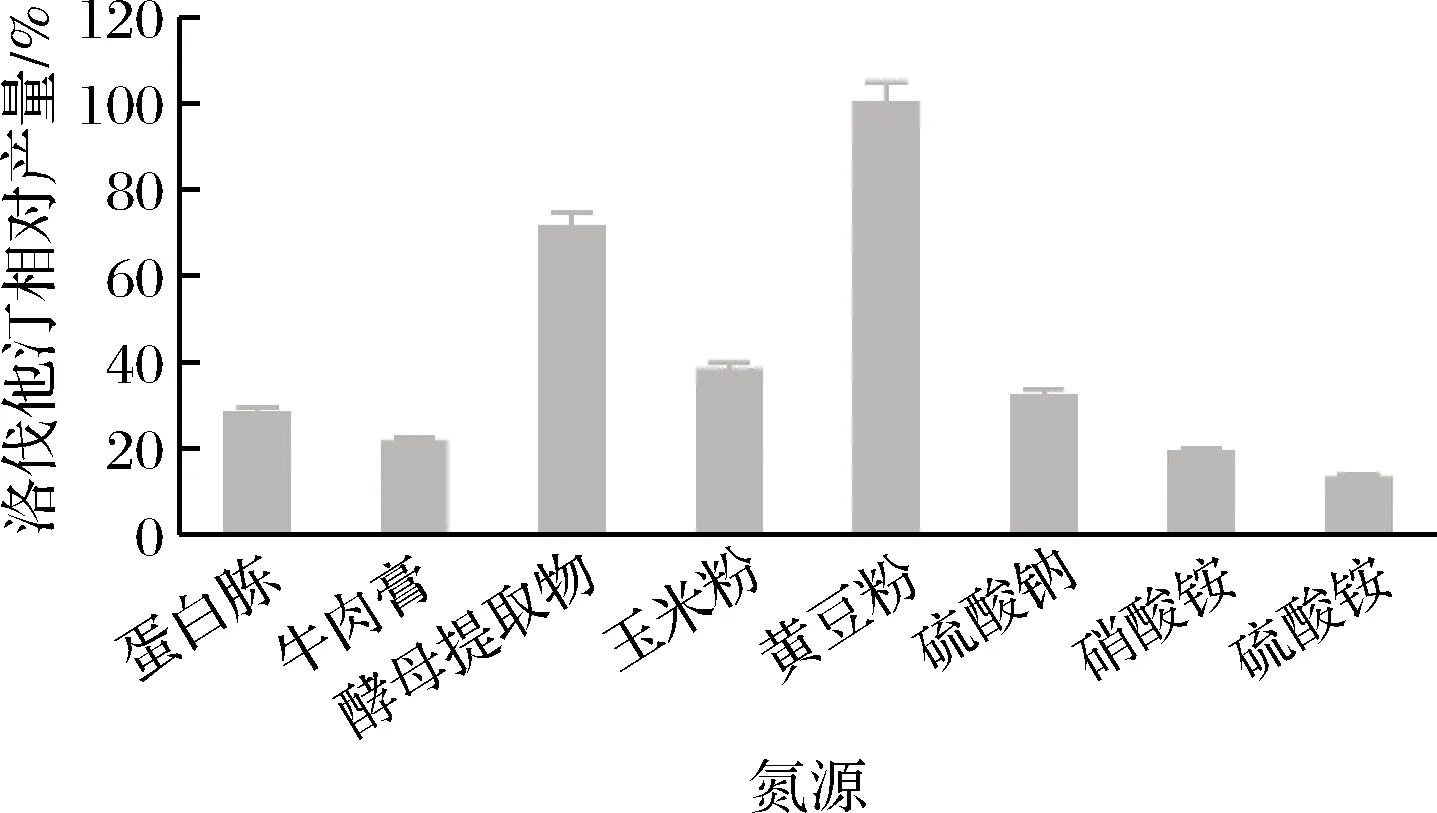
图8 氮源对洛伐他汀产量的影响Fig.8 Effect of nitrogen sources on lovastatin yield
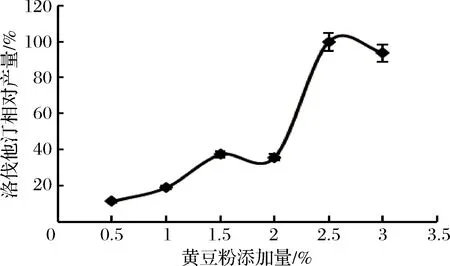
图9 黄豆粉添加量对洛伐他汀产量的影响Fig.9 Effect of soybean powder content on lovastatin yield
2.2.1.3 无机盐对洛伐他汀产量的影响
无机盐对洛伐他汀产量的影响如图10所示,其中ZnSO4·7H2O最高(定义为100%),ZnSO4·7H2O和KH2PO4的洛伐他汀产量比较接近,所以选择KH2PO4和ZnSO4·7H2O两种无机盐进行后续实验。在后续实验中,无机盐添加量为两种无机盐添加量的总和,其中ZnSO4·7H2O和KH2PO4的添加量按照2∶1的配比来添加。不同无机盐添加量时洛伐他汀产量如图11所示,当添加量为0.05%时,洛伐他汀产量达到最高(定义为100%),可推测少量的无机盐可对洛伐他汀的产量造成显著影响,量太多反而抑制洛伐他汀的合成。确定最佳无机盐添加量为0.05%。
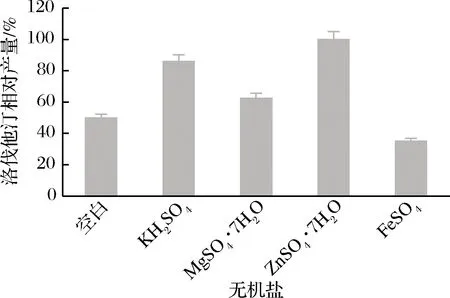
图10 无机盐对洛伐他汀产量的影响Fig.10 Effect of inorganic salts on lovastatin yield

图11 无机盐添加量对洛伐他汀产量的影响Fig.11 Effect of inorganic salt content on lovastatin yield
2.2.1.4 碳源、氮源、无机盐最佳配比的正交试验
选择甘油、黄豆粉、KH2PO4和ZnSO4·7H2O四个 因素进行L9(34)正交试验,实验结果见表2。
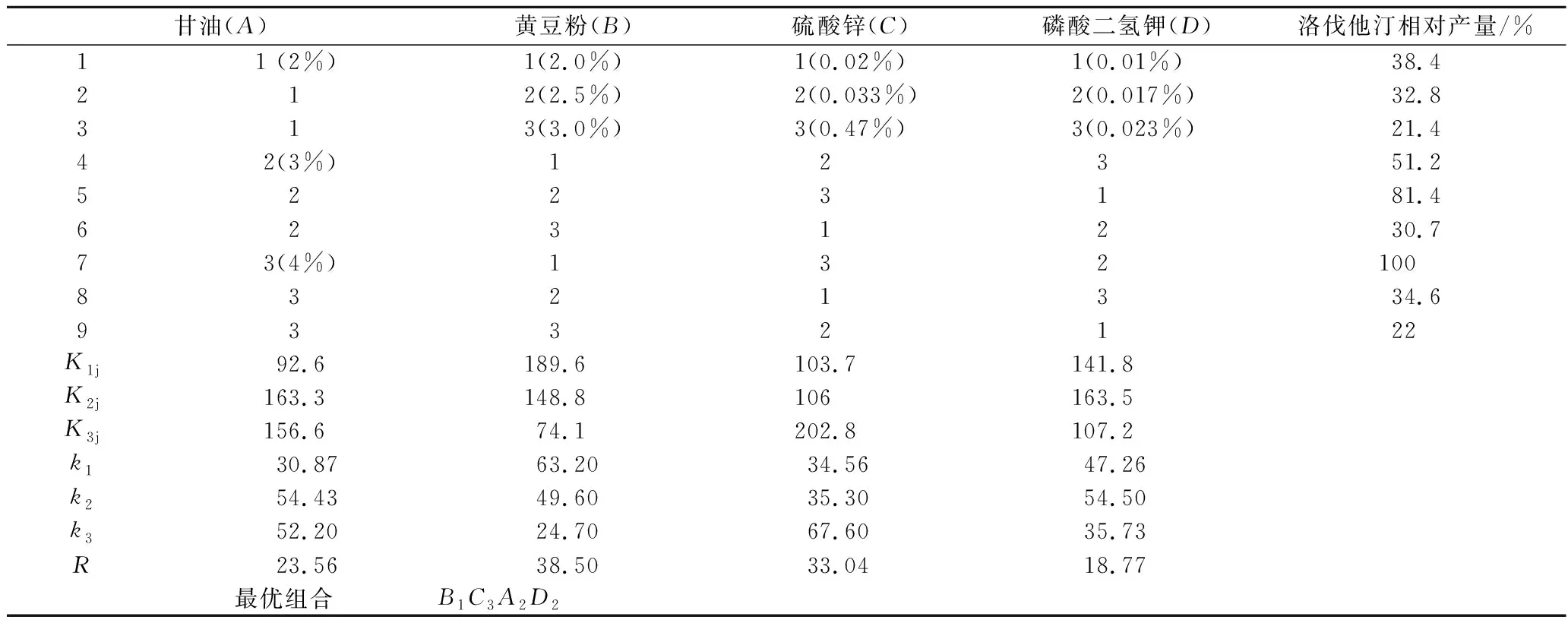
表2 L9(34)正交试验结果Table 2 Results of L9(34) orthogonal expertments
根据上表极差R可知,影响洛伐他汀产量的因素主次顺序为B>C>A>D,最优组合为B1C3A2D2,即甘油3%、黄豆粉2%、ZnSO4·7H2O 0.47%、KH2PO40.017%。
验证实验在最优组合中A、D因素添加量不变的基础上,降低因素B两个水平,升高因素C两个水平,得到4个实验组,再取最优组合B1C3A2D2和正交试验中产量最高的第7组(见表2)为参考组,组成6组组合进行验证实验。验证实验结果见表3。
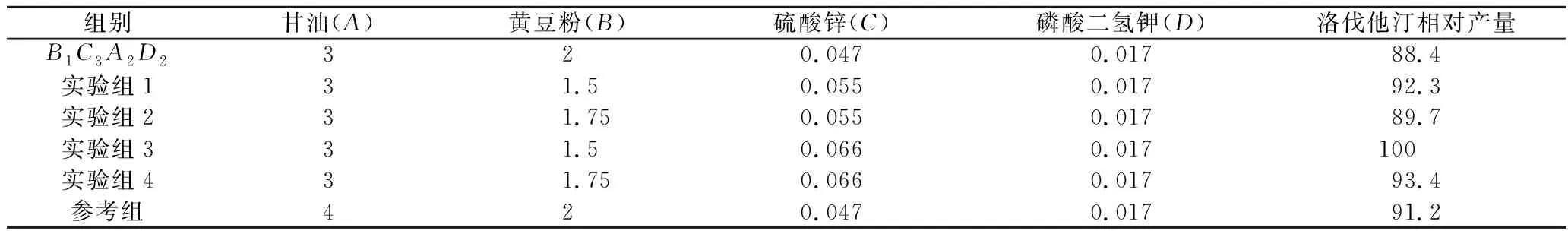
表3 验证实验结果分析表 单位:%Table 3 Analysis of test results
实验组3的洛伐他汀产量最高,但因硫酸镁对洛伐他汀合成也有一定的促进作用(见图10),故在实验组3的基础上添加不同量的硫酸镁,进一步研究其对洛伐他汀产量的影响。结果见图12。
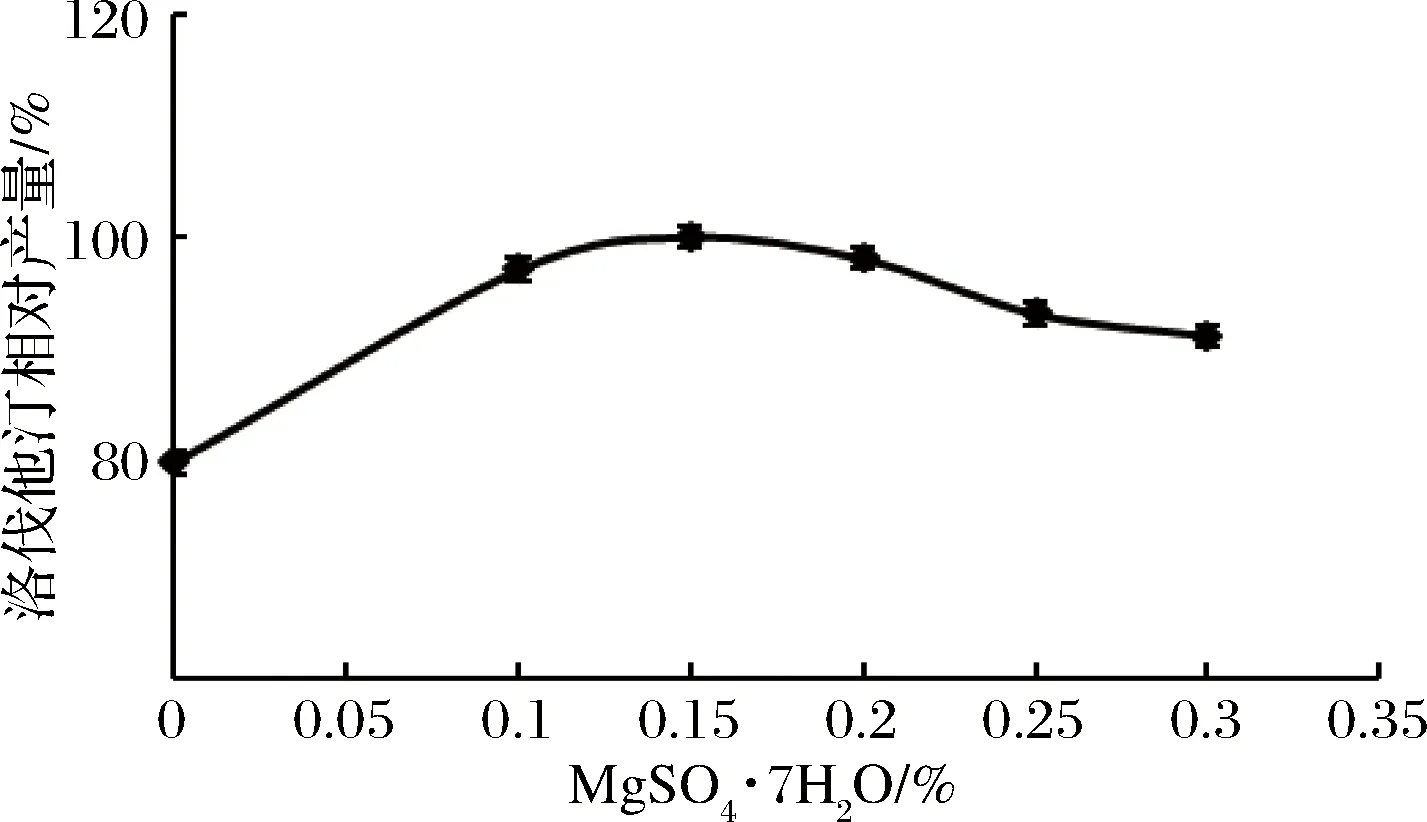
图12 硫酸镁添加量对洛伐他汀产量的影响Fig.12 Effect of MgSO4·7H2O content on lovastatin yield
由图12可知,当MgSO4·7H2O添加量为0.15%时,洛伐他汀产量最高(定义为100%),所以确定红曲霉R”-30液态发酵最佳培养基配方为:甘油3%,黄豆粉1.5%,ZnSO4·7H2O 0.66%,KH2PO40.017%,MgSO4·7H2O 0.15%。
2.2.2 液态发酵条件优化
本实验对几个主要发酵条件进行了研究。实验结果(图13)表明,发酵液最佳初始pH为5,最适接种龄为64 h,最佳接种量为8%;恒温培养的效果优于变温培养,且发现30~35 ℃洛伐他汀产量相对较高,故选择30 ℃恒温培养的方式取代变温培养;最适转速为150 r/min,最佳装液量为50 mL/250 mL。
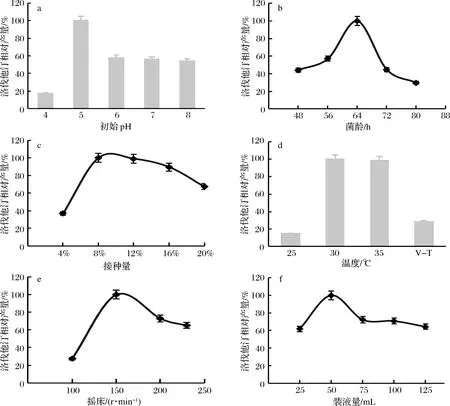
a-培养基初始pH值的影响; b-菌龄的影响; c-接种量的影响;d-温度的影响,V-T:变温; e-摇床转速的影响; f-装液量的影响图13 摇瓶发酵条件的优化Fig.13 Optimization of fermentation conditions in shake flask
2.3 红曲菌株R”-30液态发酵洛伐他汀产量测定
将菌株R”-30接种于优化后的发酵培养基中,在优化条件下培养,从第4天开始,每隔24 h取样测定发酵液中洛伐他汀产量,绘制洛伐他汀产量随发酵周期的变化曲线(图14)。
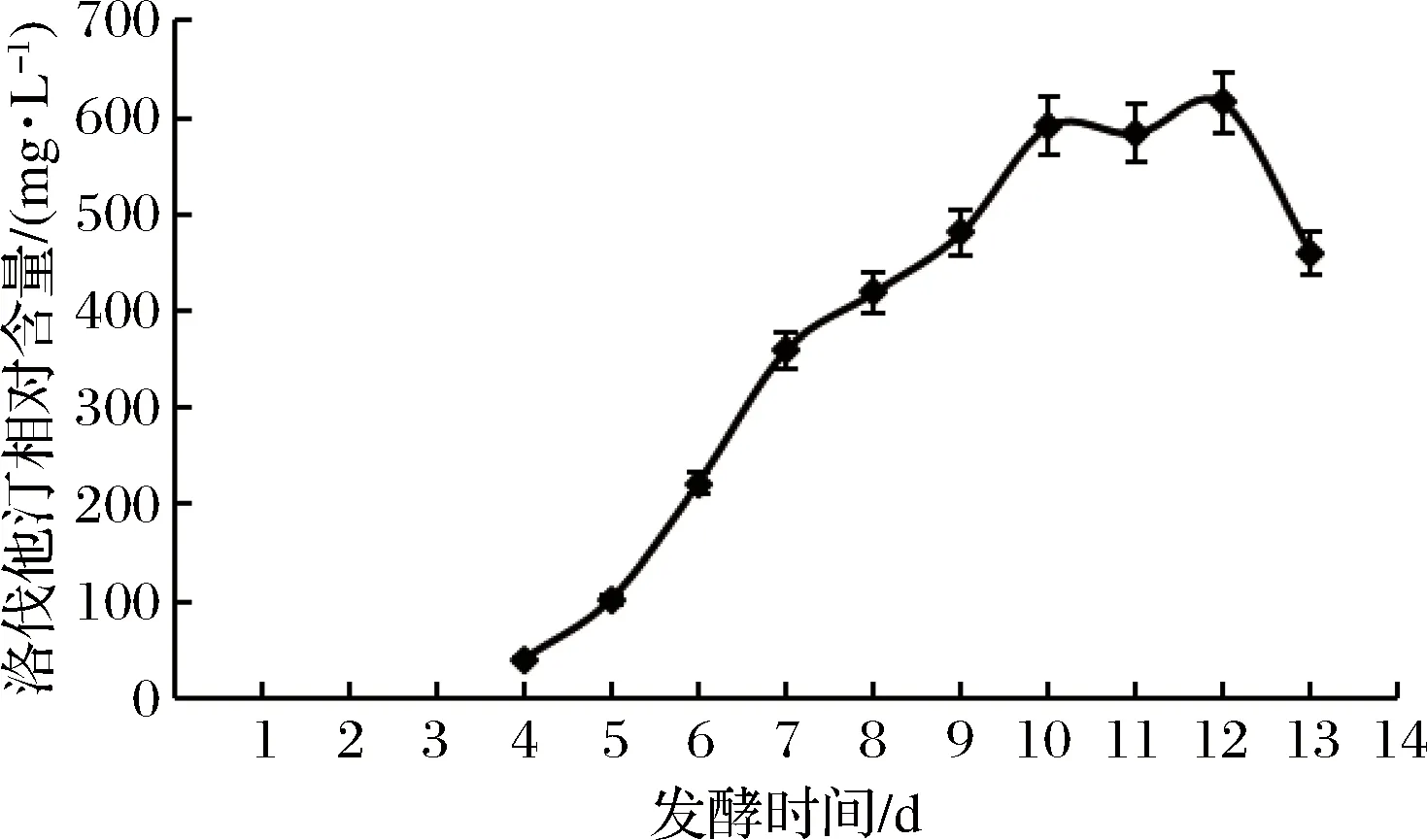
图14 菌株R”-30洛伐他汀产量与发酵周期的关系曲线Fig.14 The relationship curve of R”-30 lovastatin production and fermentation period
洛伐他汀产量于第10天开始趋于平稳,第12天达到最大值,此时洛伐他汀产量达到615.3 mg/L;与优化前相比,洛伐他汀产量由312 mg/L提高到615.3 mg/L,提高了97.2%。发酵周期没有改变,还是于第12天达到最大值。
2.4 发酵液中洛伐他汀的分离纯化
2.4.1 洛伐他汀提取工艺优化
洛伐他汀在发酵液中以洛伐他汀羧酸的形式存在,主要存在于菌丝体内。以NaOH(6 mol/L)调节发酵液的pH至碱性,将洛伐他汀转化为洛伐他汀酸钠并溶于发酵液中[19]。测定不同pH(9~12.5)对洛伐他汀溶出率的影响,以加70%乙醇,料液比1∶9,55 ℃,130 r/min萃取1 h的溶出率作对照,结果如图15所示。
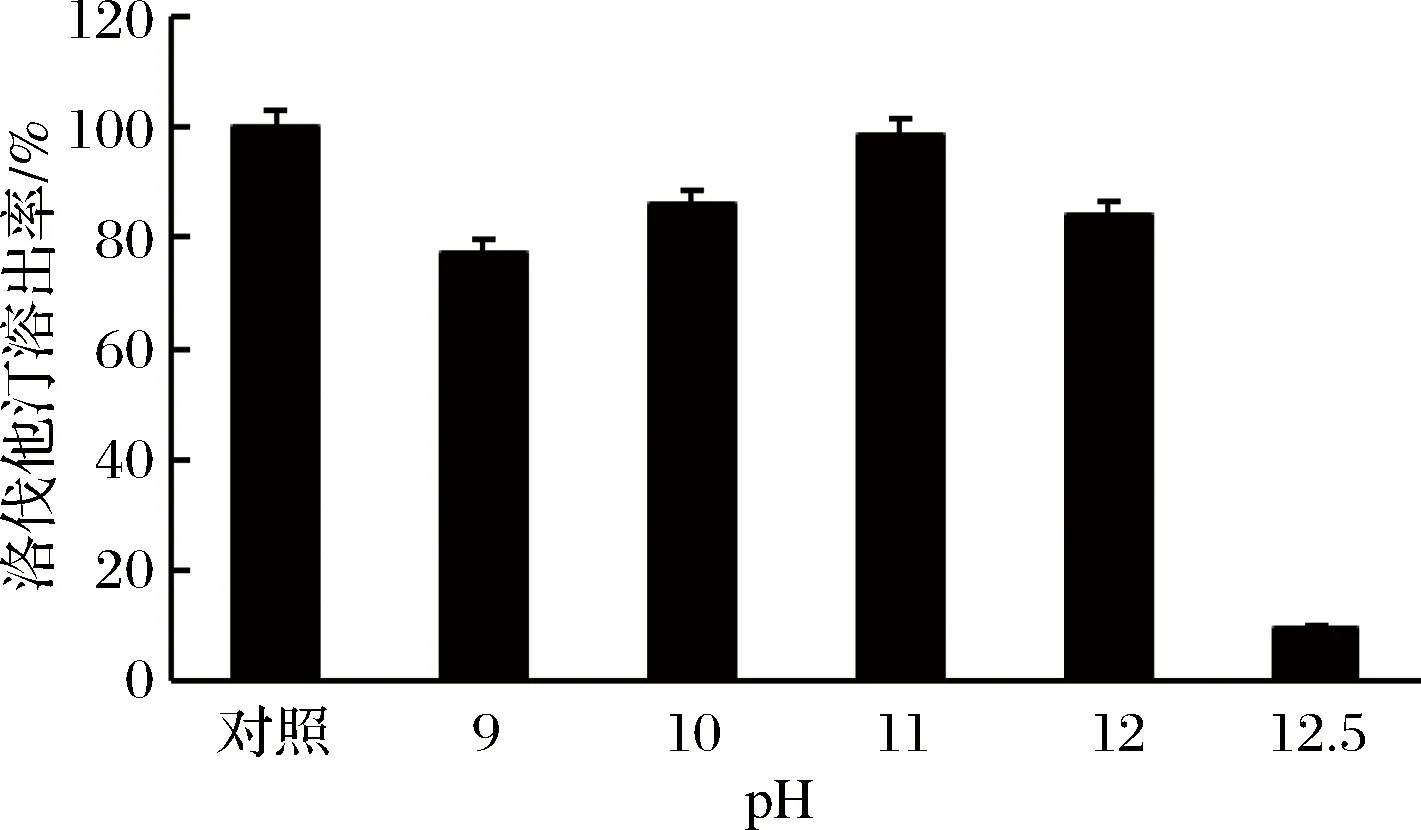
图15 不同pH下洛伐他汀的溶出率Fig.15 The dissolved quantity of lovastatin at different pH
当调发酵液pH为11时,洛伐他汀的溶出率相对较高,而pH超过12.5时,溶出率急剧下降,可能是强碱条件破坏了洛伐他汀的结构,从而检测不出。故确定pH 11为最佳溶出pH。
2.4.2 硅胶柱洗脱
取适量硅胶(200目)用A溶剂浸泡后湿法装柱,柱子直径9 mm,装柱高度约12~13 cm。上样量0.5 mL,上样后先加14~15 mL A溶剂进行洗脱,再加20 mL B溶剂洗脱,最后加8 mL C溶剂洗脱,控制流速在1~2滴/s。收集各洗脱液,检测洛伐他汀主要分布在哪种溶剂及其纯度。
选择不同极性的有机溶剂,按极性从小到大列出3种洗脱方式,结果见表4。
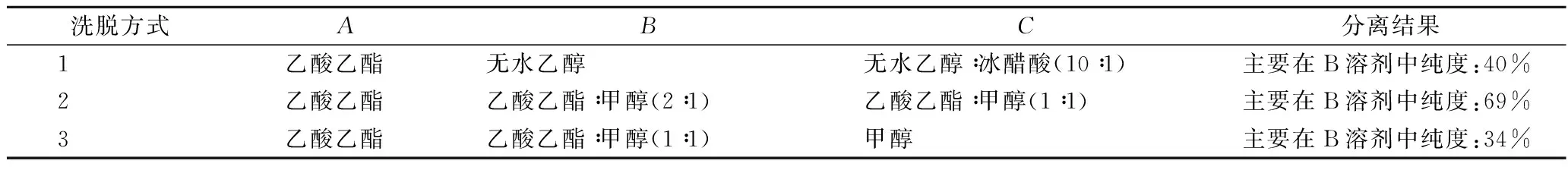
表4 不同洗脱方式及结果Table 4 Different elution methods and results
由上表可知方式2得到的洛伐他汀粗品纯度较高,故选择方式2作为硅胶柱层析的洗脱方式,收集B洗脱液浓缩。
2.4.3 LH20柱层析
取Sephadex LH20用60%乙醇浸泡后湿法装柱,柱子直径9 mm,装柱高度4~5 cm,取洛伐他汀粗品浓缩液0.5 mL上样。上样后,先加5 mL超纯水进行洗脱,再加5 mL 20%甲醇洗脱,最后加5 mL 50% 甲醇洗脱,控制流速在1~2滴/s。收集各个洗脱液,检测洛伐他汀在各个溶剂中的含量及其纯度,结果见表5。

表5 不同洗脱液中洛伐他汀含量及纯度Table 5 Lovastatin content and purity in different elution liquid
洛伐他汀主要集中在20%甲醇洗脱液中,采用HPLC检测纯度,纯度达93%,色谱图见图16。收集5 mL 20%甲醇洗脱液,适当浓缩后得到纯化的洛伐他汀溶解液。
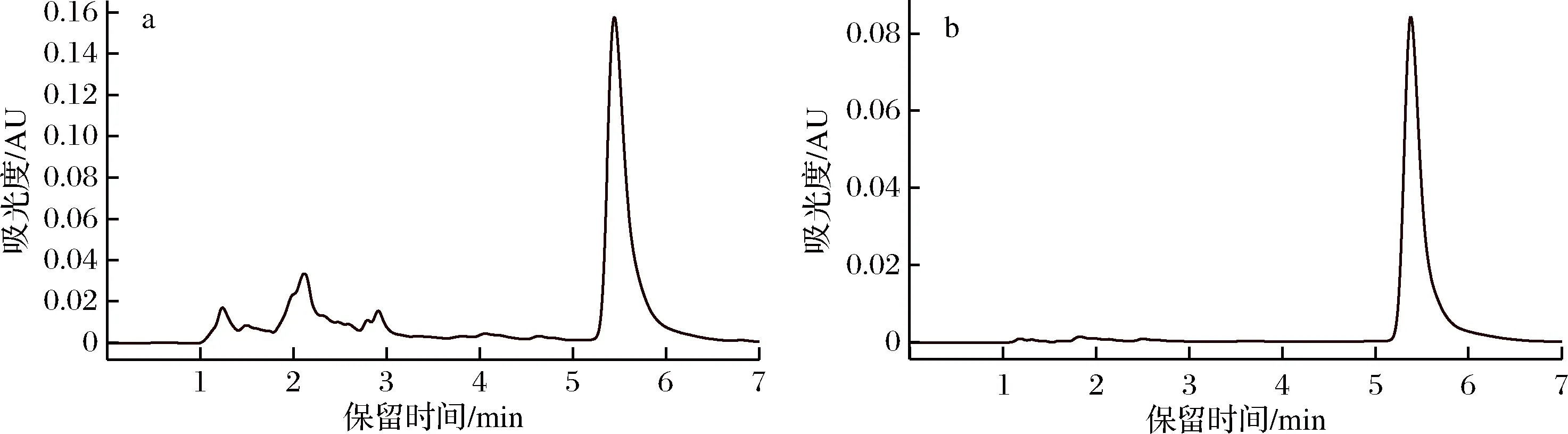
a-发酵液中洛伐他汀色谱图; b-分离纯化后洛伐他汀色谱图图16 洛伐他汀HPLC图谱Fig.16 HPLC chromatogram of lovastatin
实验结果表明,经LH20柱层析分离后,洛伐他汀纯度可达93%,得率45%;可见硅胶柱和LH20柱层析可有效去除杂质,获得高纯度的洛伐他汀。
3 结论
对红曲霉R”-30液态发酵产洛伐他汀的培养基组分和培养条件进行优化,得到最适培养基配方和发酵条件为:甘油30 g/L,黄豆粉15 g/L,ZnSO4·7H2O 6.6 g/L,KH2PO40.17 g/L,MgSO4·7H2O 1.5 g/L,pH 5.0,装液量50 mL/250 mL,摇床转速150 r/min,30 ℃恒温培养,种子液培养64 h,接种量8%(体积分数)。
对红曲霉R”-30液态发酵过程洛伐他汀产量进行测定,洛伐他汀产量于第12天达到最大值,为615.3 mg/L,比优化前(312 mg/L),提高了97.2%。红曲霉液态发酵所产的洛伐他汀主要为开环酸型。
对红曲霉R”-30液态发酵液中洛伐他汀进行分离纯化。发酵液先用6 mol/L NaOH溶液碱提,离心取上清;再通过硅胶柱和Sephadex LH20柱层析,经HPLC检测,洛伐他汀纯度达93%,得率为45%。
