姬松茸多肽对D-半乳糖致衰老小鼠的作用机制
2023-08-30冯晴霞孙艳艳孙晶波苑广信安丽萍
冯晴霞, 孙艳艳, 孙晶波, 苑广信, 安丽萍,*
(1.吉林省经济管理干部学院 食品药品工程学院,吉林 长春 130012;2.北华大学 药学院,吉林 吉林 132013)
人体的衰老是指细胞及组织结构和机能上所出现的退行性变化,如神经系统逐步发生衰退进而产生行为障碍、学习记忆能力减退等[1-2]。机体氧化应激程度加剧是衰老发生的重要原因,主要取决于氧化与抗氧化体系的平衡[3-6]。因此,提高机体的抗氧化能力,可以延缓衰老进程。天然产物含有大量的抗氧化活性物质,其所具有的预防衰老及相关疾病功能已成为食品营养研究领域的热点。
姬松茸(AgaricusblazeiMurill)又名小松菇、巴西蘑菇,是一种大型真菌,具有浓郁杏仁香味,属担子菌亚门层菌纲伞菌目蘑菇(黑伞)科蘑菇(黑伞)属[7-8]。姬松茸子实体富含蛋白质、糖类、甾醇、黄酮等多种生物活性物质,具有广泛的生物活性,如抗肿瘤、降血糖、抗炎、增强免疫力等[9-10]。姬松茸蛋白具有突出的抗氧化活性,能够提高乙酰胆碱酯酶的活性。蛋白质经蛋白酶部分水解后,可获得具有多种生物活性的多肽。与大分子蛋白相比,小分子生物多肽具有安全稳定、易溶于水、易吸收等优点。并且多肽抗氧化的能力与分子质量有关,分子质量越小,其抗氧化能力越好[10]。蒲超等[11]研究表明,姬松茸多糖可以抑制软骨细胞炎症反应和凋亡。徐天雄[12]研究发现,姬松茸水提物具有良好的肿瘤微环境免疫调节活性,并促进CD8+T细胞的肿瘤杀伤作用。而国内目前对于姬松茸多肽的研究鲜见报道,因此,本研究选择姬松茸子实体中提取的蛋白质经过蛋白酶水解后的活性物质,即姬松茸多肽(Agaricusblazeipolypeptide,ABp)。本团队前期实验也证明,ABp具有体外抗氧化作用,对羟基自由基具有较好的清除作用,但其抗衰老效果和作用机制还需要进一步研究。
本研究拟通过D-半乳糖(D-gal)注射建立小鼠衰老模型,并评价ABp的抗衰老作用,利用转录组学和蛋白免疫印迹分析ABp干预后衰老小鼠的基因及蛋白表达差异,探讨ABp抗衰老的潜在作用机制。研究旨在为姬松茸的抗衰老功能食品的开发利用提供理论依据。
1 材料与方法
1.1 材料与试剂
姬松茸子实体,江苏省苏威微生物研究有限公司,经北华大学药学院韩东教授鉴定;D-gal,西格玛奥(上海)贸易公司;SPF级雄性ICR小鼠,4~5周龄,体质量(20.0±2.0)g,52只,实验动物许可证编号为SCX(吉)-2016-0003,长春亿斯实验动物技术有限责任公司;活性氧簇(ROS)试剂盒、丙二醛(MDA)试剂盒、总抗氧化能力(T-AOC)试剂盒、过氧化氢酶(CAT)试剂盒,南京建成生物工程研究院;大鼠单克隆BrdU抗体、单克隆抗体NeuN、山羊抗大鼠IgG-Alexa Fluor 594、山羊抗兔IgG-Alexa Fluor 488,abcam公司;HOECHST 33258,ABclonal公司;反转录试剂盒,北京艾德来生物科技有限公司;其他试剂均为分析纯。
1.2 仪器与设备
AKTA Purifer TM10型蛋白质层析仪,美国通用电气公司;UV-2550型紫外可见分光光度计,岛津国际贸易有限公司;MT-200型Morris水迷宫分析仪,成都泰盟科技有限公司;BA-200型小鼠避暗仪,成都泰盟科技有限公司;TOWER2.2型荧光定量PCR仪,德国ANALYTIKJENA;scandrop型超微量核酸蛋白测定仪,德国耶拿分析仪器有限公司。
1.3 实验方法
1.3.1ABp的制备
将姬松茸的粉状子实体(约2 500 g)在5 000 mL冰水混合物中匀浆,5 000 r/min离心3 min取上清液,随后采用硫酸铵,在4 ℃下,将上清液中的可溶性蛋白质沉淀过夜。合并得到的沉淀,在去离子水中溶解,并使用截留分子质量30 kDa的透析膜,在4 ℃下,用去离子水透析24 h。透析后,冷冻干燥得到姬松茸蛋白粉,按料液比1∶20(g/mL)加入蒸馏水,用 0.1 mol/L 的盐酸调pH值至2.5,按照3 000 U/mg 的加酶量加入胃蛋白酶解液,混匀后置于37 ℃恒温水浴中酶解4 h,100 ℃条件下加热10 min使酶失活,冻干后初步提取出姬松茸粗多肽。
利用蛋白质层析仪分离多肽。将Preswollen DEAE-32柱填料装入5 mL柱体中。随后用1.5 mmol/L Tris-HCl缓冲液平衡3个柱体积,流速为0.5 mL/min。将粗蛋白质溶于Tris-HCl缓冲液中,使用0.45 μm滤膜过滤后进行上样,0~0.5 mol/L线性梯度NaCl溶液连续洗脱,并使用级分收集器收集220 nm吸收峰处的级分,冻干。使用同样的方法安装并平衡Cellulose CM-52柱,将级分进一步于CM-52柱进行分离,并用 0~0.5 mol/L的线性梯度NaCl溶液冲洗3个柱体积,流速为0.5 mL/min,收集220 nm吸收峰处的组分。将组分冻干成粉末溶于去离子水中,最终通过Hi TrapTM脱盐柱净化脱盐,使用去离子水洗脱1.5个柱体积,流速为1.0 mL/min,检测波长220 nm。
1.3.2实验动物分组及处理
选取6周龄雄性ICR小鼠52只,适应性喂养7 d,随机分为4组:空白对照(Con)组、模型(Mod)组、ABp组和吡拉西坦(Pir)组,每组13只。除Con组外,其他组小鼠按体质量每日皮下注射D-gal 300 mg/kg。Con组小鼠注射相同剂量的生理盐水,Pir组每日按体质量灌胃800 mg/kg的吡拉西坦,ABp组每日按体质量灌胃400 mg/kg ABp。Con组、Mod组每日灌胃等量蒸馏水。
1.3.3小鼠行为学实验
小鼠处理第42天进行行为学实验。小鼠放入明室中使其适应环境后,给予5 min持续电流,以2 d为训练周期,记录5 min内的小鼠错误总数和小鼠第1次被电击的错误潜伏期。
采用Morris水迷宫实验,检测小鼠的空间学习记忆能力。将各组小鼠定点放入水池,记录每只小鼠在120 s内到达隐形平台的潜伏期,共训练6 d。第7天撤去平台,以120 s内小鼠分别在中心环、中环、目标象限的游泳穿梭次数评估小鼠学习记忆的能力[12]。
1.3.4小鼠血清生化指标检测
小鼠末次处理24 h后,眼球取血,4 ℃离心(10 000 r/min)分离血清,按照试剂盒说明书检测血清总抗氧化能力及SOD、MDA、ROS水平。
1.3.5小鼠海马区转录组学分析
选取小鼠海马区进行差异基因筛选。利用Hisat软件将测序数据比对参考基因组,利用比对的结果组装转录本。采用edgeR进行差异表达分析,采用R语言对差异表达结果进行图形化展示。
采用FPKM度量基因表达的丰度值以衡量基因的表达水平。同时通过t检验阈值以及对t检验P值进行FDR校正的Q阈值初步筛选出目的基因。按照同时满足FPKM>10、Q阈值<0.05、差异倍数>1.5或差异倍数<0.6的标准筛选差异基因。
1.3.6小鼠海马区基因的表达水平检测
采用反转录试剂盒对小鼠海马区的mRNA进行反转录操作,合成的cDNA在94 ℃进行预变性5 min,35个循环扩增(94 ℃、30 s,60 ℃、30 s,72 ℃、30 s),72 ℃退火7 min,基因引物见表1。测定软件为SDS v2.2,基于Ct方法计算靶基因表达水平。

表1 基因引物序列
1.3.7小鼠海马区蛋白的表达水平检测
取小鼠海马区加入适量体积的RIPA裂解液进行裂解和蛋白抽提。利用Bradford法测定抽提液的蛋白浓度。采用聚丙烯酰胺凝胶进行蛋白的分离,随后进行转膜处理。转膜结束后,用质量分数为5%的脱脂奶粉封闭条带1 h,孵育Nrf2、HO-1、Keap1、p53、Hsph1、Apoe、Trim32一抗(体积比 1∶500稀释)过夜,于37 ℃恒温静置孵育二抗(体积比1∶200 0稀释)1 h,清洗3次,显色后用扫描仪扫描胶片。
1.4 数据处理
采用SPSS 16.0统计软件处理各组数据,结果表示为平均数±标准偏差,采用t检验判断结果的显著性,P<0.05表示差异有显著性。
2 结果与分析
2.1 ABp的制备及纯化结果
姬松茸蛋白水解物经不同柱层析纯化结果,见图1。由图1可知,DEAE-32离子交换色谱柱纯化蛋白水解物得到4个主峰。将响应值最大的DE2峰组分用于CM-52离子交换色谱纯化,得到2个主峰。采用脱盐柱纯化响应值最大的CM1组分得到ABp。ABp在蛋白电泳实验结果中呈现单一条带,分子质量为3.3 kDa。
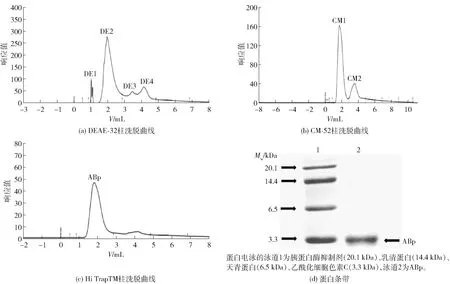
图1 ABp的纯化及鉴定
2.2 ABp对D-gal诱导的衰老小鼠记忆能力的影响
小鼠避暗实验结果见图2。由图2可知,与Con组比较,Mod组小鼠避暗错误次数增高100%(P<0.05)。与Mod组比较,ABp组错误次数减少37.5%(P<0.05),且潜伏期时间显著增加。Morris水迷宫测试,见图3。研究结果表明,与Con组比较,Mod组小鼠在第4~5 d期间到达平台的潜伏期显著增加(P<0.05)。与Mod组相比,ABp组小鼠的潜伏时间显著降低,为Mod组的56.3%(P<0.05)。第7 d的空间探索实验结果显示,相较Con组,Mod组小鼠找到平台所用的时间显著增加,穿越中心环和中环的次数显著减少(P<0.05)。而与Mod组的相比,ABp组小鼠的潜伏期更短,在中心环和中环逗留的时间及穿越次数显著增加(P<0.05)。
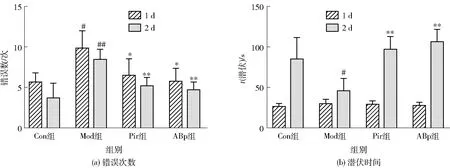
与Con组比较,#表示组间数据差异显著(P<0.05),##表示组间数据差异极显著(P<0.01)。与Mod组比较,*表示组间数据差异显著(P<0.05),**表示组间数据差异极显著(P<0.01)。
2.3 ABp对D-gal诱导的衰老小鼠血清氧化水平的影响
小鼠血清中MDA浓度、ROS水平、CAT活力及总抗氧化能力变化见图4。与Con组比较,Mod组小鼠血清中MDA浓度及ROS含量显著升高,而血清抗氧化能力及CAT活性明显降低(P<0.05)。而与Con组比较,ABp组小鼠血清中MDA浓度降低65.0%(P<0.05),CAT活性升高98.6%,总抗氧化能力升高30.2%(P<0.05)。
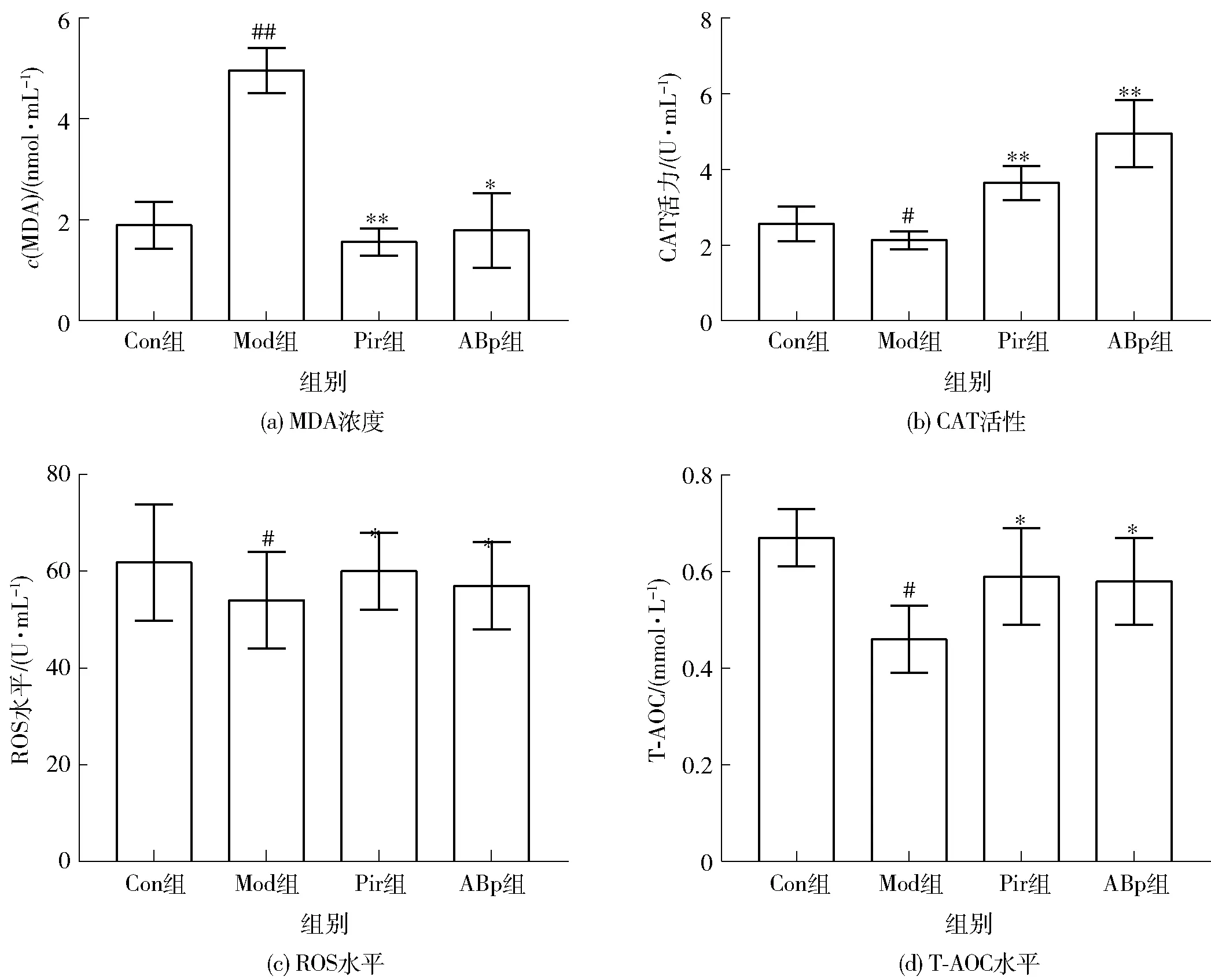
与Con组比较,#表示组间数据差异显著(P<0.05),##表示组间数据差异极显著(P<0.01)。与Mod组比较,*表示组间数据差异显著(P<0.05),**表示组间数据差异极显著(P<0.01)。
2.4 ABp对D-gal诱导的衰老小鼠海马区基因表达的影响
Mod组和ABp组小鼠海马区基因表达差异见图5。由图5可知,ABp组与Mod组相比存在大量具有显著性差异的基因。
基因聚类分析结果表明,Mod组和ABp组小鼠中共存在295个差异基因。与Mod组比较,ABp上调小鼠海马区基因79个,下调基因216个。
GO和 KEGG富集性分析结果显示,Mod组与ABp组小鼠的差异基因主要涉及细胞膜组成、蛋白质结合,如神经活性配体-受体相互作用,突触功能等。表达差异显著的基因分别是Apoe、Hsph1、Trim32、Atp1a3、Stxbp1、Mapk8ip1、Hnrnpa1、Hk1、Grik5。小鼠海马区脑组织mRNA的验证结果见图6。与Mod组相比,ABp组小鼠海马区的Hsph1、Trim32、HK1、Hnrnpa1、Grik5 mRNA表达水平增加(P<0.05),Atp1a3、Stxbp1、Apoe、Mapk8ip1 mRNA表达水平降低(P<0.05)。
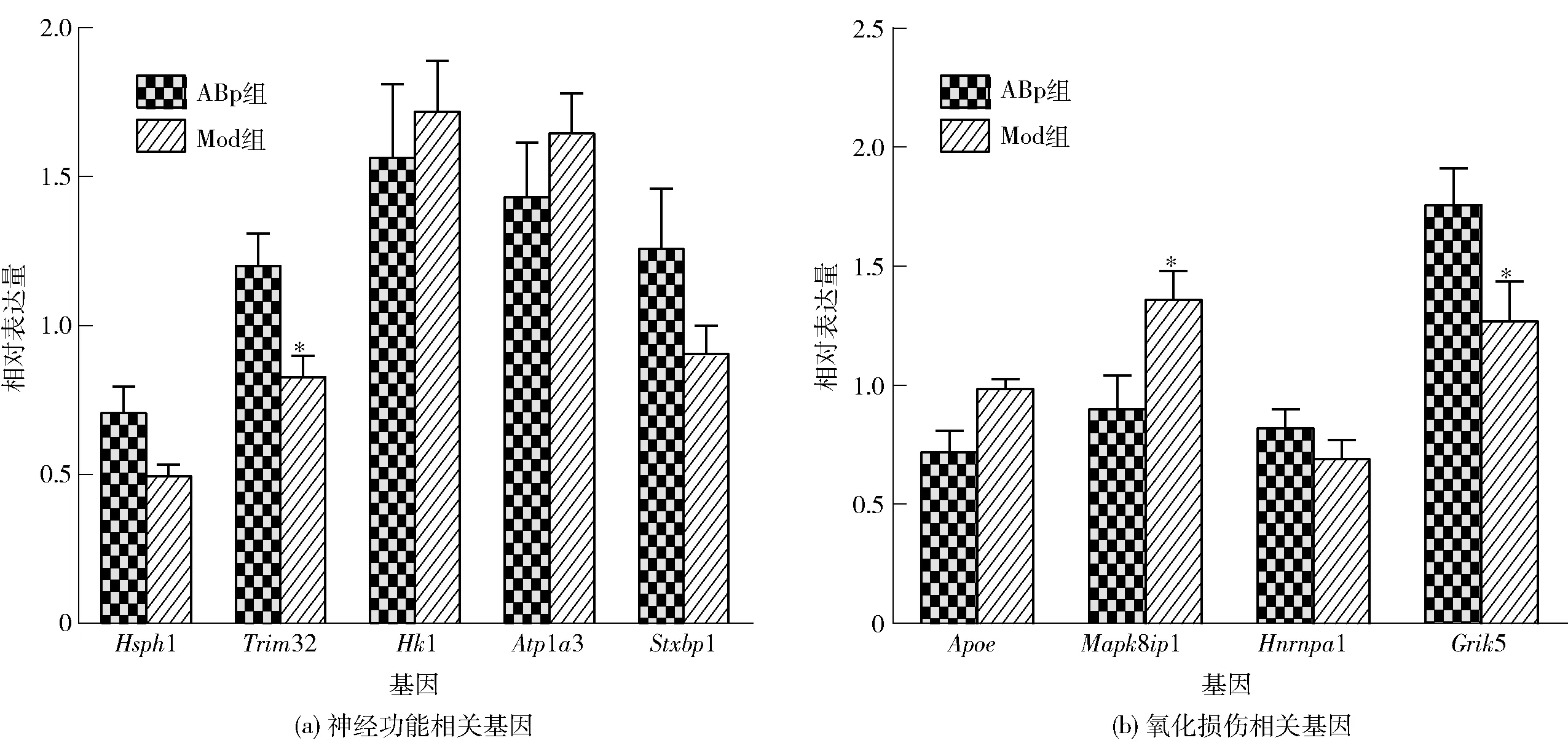
*表示同一基因组间数据差异显著(P<0.05)。
2.5 ABp对D-gal诱导的衰老小鼠海马区蛋白表达影响
小鼠海马区蛋白表达水平差异见图7。与Con组比较,Mod组小鼠海马区中Keap1、P53、Apoe蛋白水平显著升高(P<0.05),Nrf2、HO-1、Hsph1、Trim32蛋白水平显著降低(P<0.05)。与Mod组相比,ABp组小鼠海马区中Keap1、P53、Apoe蛋白水平分别降低32.6%、71.4%、25.7%(P<0.05),Nrf2、HO-1、Hsph1、Trim32蛋白水平分别显著上升20.5%、52.8%、125.4%、52.4%(P<0.05)。
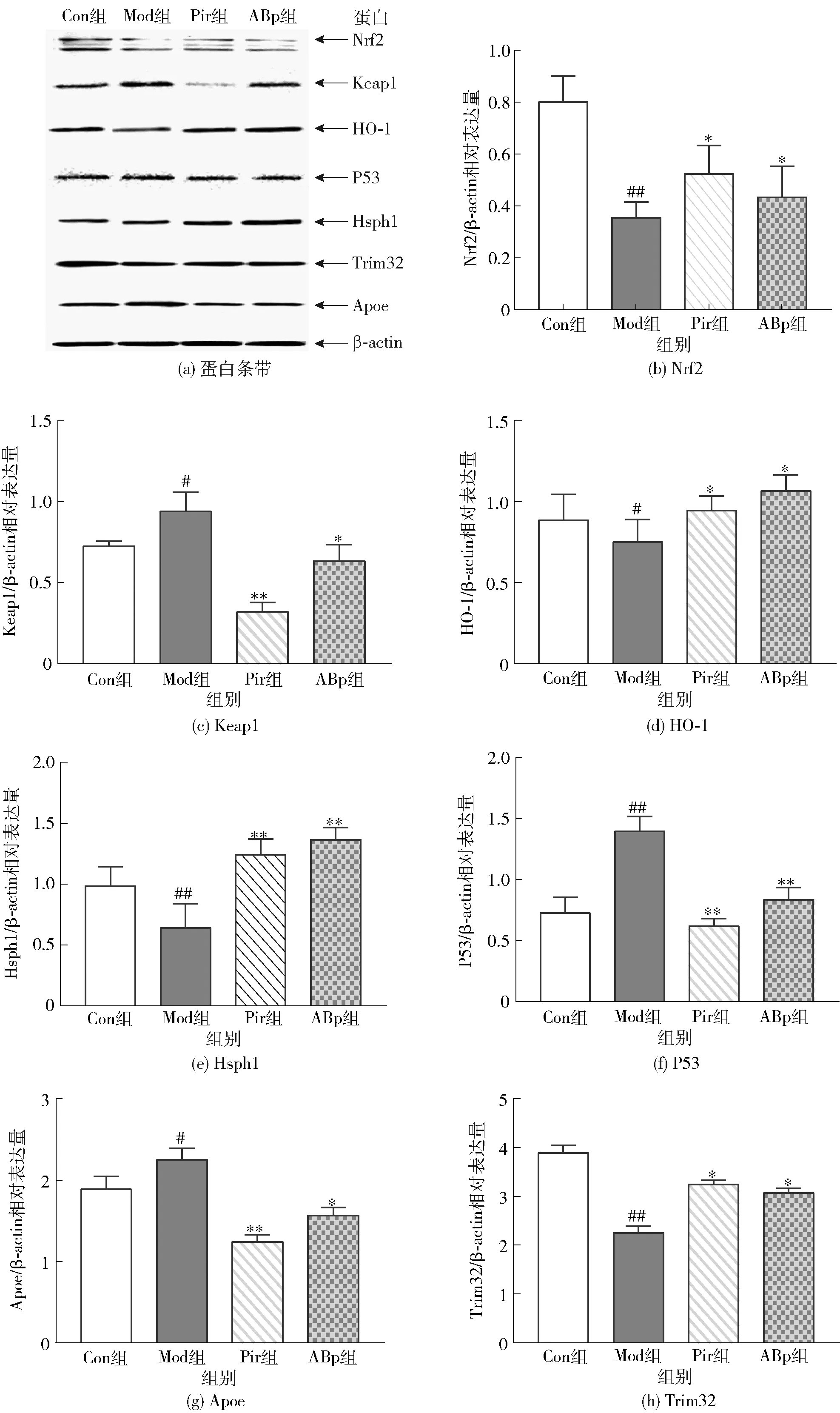
与Con组比较,#表示组间数据差异显著(P<0.05),##表示组间数据差异极显著(P<0.01)。与Mod组比较,*表示组间数据差异显著(P<0.05),**表示组间数据差异极显著(P<0.01)。
3 讨 论
衰老是机体各组织、器官功能随年龄增长而发生退行性变化的过程。衰老可降低机体面对环境胁迫维持动态平衡的能力,从而增加机体患病和死亡的可能性,其发生与氧化应激的积累密切相关[10-14]。D-gal诱导的衰老模型能够阻断大脑皮层、隔区、海马中受体的结合位点,并引发脑内氧化应激状态改变[15-16]。D-gal致衰老的机制在于可使生物体中产生大量的ROS,导致细胞线粒体系统损伤,产生大量过氧化脂质,同时过氧化产物使MDA水平升高,CAT等抗氧化酶活力下降,最终导致抗氧化水平降低及机体损伤;同时,海马区神经元细胞出现弥散、细胞核变小、排列松散等现象[17-18]。研究结果显示,Mod组小鼠出现学习记忆力衰退、行为学能力降低、反应迟缓,具有明显的衰老症状。而ABp干预后,小鼠运动和记忆力能力有所提高。小鼠避暗实验结果表明,ABp组与Mod组比较,错误次数减少37.5%。水迷宫实验中,相比Mod组,ABp组小鼠的潜伏期更短,在中心环和中环逗留的时间增加,穿越次数增加。与Mod组比较,ABp组小鼠血清MDA浓度降低65.0%、CAT活性升高98.6%、总抗氧化能力升高30.2%。研究结果表明,ABp能够显著增强抗氧化酶的活力,清除过剩的ROS,降低脂质过氧化物的产生。
转录组测序结果表明,ABp在参与转录调节、细胞膜的组成、蛋白质结合的过程中影响基因分布最广,包括神经活性配体-受体相互作用、GABA突触功能等。在中枢神经系统中,Apoe可以调控多种氧化损伤相关基因,包括Atp1a3、Mapk8ip1、Hnrnpa1等,在神经元的发育、修复和重塑中发挥重要作用。Stxbp1复合物调节发育中的神经元突触前囊泡融合,参与脑部发育与神经传递[19]。HK1为线粒体外膜蛋白(己糖激酶),是糖酵解过程中的第一个限速酶,参与细胞的糖脂代谢。Grik5为谷氨酸受体离子型,在中枢神经系统的许多突触中充当兴奋性神经递质[20]。经ABp干预的衰老小鼠海马区中Hsph1、Trime32、HK1 mRNA表达量显著增高,Atp1a3、Stxbp1 mRNA表达量显著降低。ABp的抗衰老作用可能通过调节脂蛋白代谢功能、神经传递障碍、氧化损伤、新神经元生长发育,并对Apoe、Hsph1、Trim32、Atp1a3、Stxbp1、Mapk8ip1、Hnrnpa1、Hk1、Grik5基因表达进行调控,从而发挥抗衰老作用。
Nrf2是细胞氧化应激的关键调节因子,对脑组织中氧化应激敏感;通过增强体内Nrf2的活性,可以有效地对抗氧化应激损伤,进而减轻衰老症状[21]。Apoe和Keap1是Nrf2负调控因子,其自身的泛素化、磷酸化以及核穿梭水平影响Nrf2的活力,在神经元的发育、修复和重塑中发挥重要作用。P53作为一种控制多种分子信号通路的关键性蛋白,参与细胞周期调节并受Nrf2调控,能够诱导细胞因氧化损伤而出现的生长停滞或凋亡[21-22]。研究结果显示,与Mod组相比,ABp组小鼠脑组织中Keap1蛋白水平降低32.6%、P53蛋白水平降低71.4%、Nrf2显著上升20.5%。因此,ABp可能通过调节Keap1/Nrf2/P53信号通路减轻氧化应激,发挥抗衰老作用。
4 结 论
通过胃蛋白酶水解姬松茸子实体蛋白,获得分子质量为3.3 kDa的ABp。研究结果表明,ABp可显著改善由D-gal引起的小鼠记忆功能紊乱。相比Mod组小鼠,ABp显著降低了衰老模型小鼠血清中ROS含量和MDA浓度,显著提升总抗氧化能力及CAT酶活力。转录组学分析结果表明:ABp组与Mod组小鼠基因表达水平对比,出现295个差异基因;与Mod组小鼠海马区脑组织基因表达水平相比,ABp显著上调了79个基因表达水平,显著下调216个基因表达水平。蛋白印迹结果表明,ABp抗衰老活性的潜在作用机制可能与Keap1/Nrf2/P53信号通路有关。
