561 nm与532 nm激光光凝治疗重度非增生性糖尿病视网膜病变的临床疗效比较
2023-07-11李加青陈梦平
段 娜, 李加青, 陈梦平, 廖 锐
糖尿病可引起细胞代谢和胰岛素水平改变,病变进展到一定程度时会导致眼部组织、神经和血管微循环病变,其在眼部主要表现为糖尿病视网膜病变(diabetic retinopathy,DR)、糖尿病性视神经病变、糖尿病性黄斑水肿(diabetic macular edema,DME)、糖尿病性白内障等。其中DR是最常见的糖尿病微血管的并发症之一,是青壮年工作人群的首位致盲性眼病[1],主要包括非增生性糖尿病视网膜病变(non-proliferative diabetic retinopathy,NPDR)和增生性糖尿病视网膜病变(proliferative diabetic retinopathy,PDR)。DR对视力影响较大,严重者可致失明,给患者的工作、生活带来严重的影响。因此,DR的早期治疗尤为重要,以保存更多的视功能。目前,抗血管内皮生长因子(vascular endothelial growth factor,VEGF)药物虽然越来越多地应用于重度NPDR治疗,但全视网膜激光光凝(panretinal photocoagulation,PRP)仍然是治疗中、重度NPDR的有效措施之一,其机制主要是通过激光的热效应破坏视网膜耗氧细胞,在黄斑中心凹和病变周围视网膜形成屏障,一定程度上可有效控制或减缓疾病进展,降低失明的风险[2]。但PRP是一种有创的治疗方法,治疗过程中可能会出现相关并发症,包括黄斑水肿、玻璃体积血、视网膜神经纤维层(retinal nerve fibre layer,RNFL)变薄等。本研究旨在对比观察两种不同波长激光光凝治疗DR患者的临床疗效,现报道如下。
1 对象与方法
1.1研究对象 招募2021年6月至2022年8月惠州市第三人民医院眼科收治的重度NPDR不合并黄斑水肿的患者46例(82眼),均行PRP治疗。采用随机数字表法将其分为观察组(23例,42眼)和对照组(23例,40眼)。观察组激光光凝治疗波长为561 nm,对照组激光光凝治疗波长为532 nm。两组患者年龄、性别、糖尿病病程等基线资料比较差异无统计学意义(P>0.05)。见表1。本研究获医院医学伦理委员会审批[批号:(2021)40号],患者均知情同意参与。
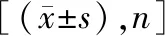
表1 两组基线资料比较
1.2纳入与排除标准 纳入标准:(1)空腹血糖≥7 mmol/L,糖化血红蛋白≥6.5%,符合糖尿病的诊断标准[3];(2)荧光素眼底血管造影(fluorescein fundus angiography,FFA)检查结果符合重度NPDR的诊断标准[4]:每一象限视网膜内出血≥20个出血点,或者至少2个象限已有明确的静脉“串珠样”改变,或者至少1个象限存在视网膜内微血管异常(intra-retinal microvascular anomaly,IRMA);(3)不合并黄斑水肿者[中央黄斑厚度(central macular thickness,CMT)<250 μm];(4)既往无其他眼部严重病变或接受过眼底病变治疗者;(5)治疗依从性较好,配合完成治疗及随访检查。排除标准:(1)合并眼部其他疾病者,如新生血管性青光眼、视网膜血管病变、视网膜脱离等;(2)既往曾行视网膜激光光凝或抗VEGF治疗;(3)对荧光素钠造影剂过敏者;(4)合并严重高血压、严重心脑血管疾病或严重肝肾功能异常者;(5)精神障碍不能配合治疗者。
1.3治疗方法 两组PRP治疗均由同一经验丰富的医师采用ZEISS多波长激光器(德国蔡司公司)单点模式完成[5-6],其中观察组采用561 nm黄激光治疗,对照组采用532 nm绿激光治疗。激光范围:视盘上、下、鼻侧各距视盘1个视盘直径(papilla disc,PD),距黄斑中心凹上下和黄斑区颞侧各2 PD处至远周边视网膜,按照下方、鼻侧、上方、颞侧的顺序完成。光斑直径200 μm,曝光时间150~200 ms,间隔1个光斑,每次光斑点数400~500点,光斑强度Ⅲ级。每次光凝1个象限,再次激光间隔至少1周,共分3~4次完成。嘱患者于术后2周、1个月、3个月、6个月返门诊进行随访复查,必要时复查FFA并补充激光光凝。
1.4观察指标 (1)最佳矫正视力(best corrected visual acuity,BCVA):于治疗前,以及治疗后2周、1个月、3个月、6个月采用5 m国际标准对数视力表进行检查,并将结果换算成log MAR视力进行分析。疗效判定标准[5]:BCVA提高≥2行为提高;下降≥2行为下降;提高或下降<2行为稳定。以治疗后BCVA较治疗前BCVA提高或不变判定为治疗有效。(2)CMT:于治疗前,以及治疗后2周、1个月、3个月、6个月,受试者充分散瞳后,采用Cirrus HD-OCT(德国蔡司公司)扫描测量,CMT<250 μm为无黄斑水肿,CMT≥250 μm为黄斑水肿。(3)RNFL厚度:于治疗前,以及治疗后2周、1个月、3个月、6个月,受试者充分散瞳后,采用Cirrus HD-OCT(德国蔡司公司)扫描视盘旁RNFL,选取最清晰的图像进行数据分析,测量3次取平均值。(4)眼底检查:于治疗前,以及治疗后2周、1个月、3个月、6个月以裂隙灯(日本株式会社拓普康SL.1E)在散瞳后通过前置镜(美国VOLK 90D)进行眼底检查。检查是否出现治疗后并发症,如玻璃体积血、视网膜新出血或虹膜新生血管等。在治疗后3~6个月的眼底检查中若发现视网膜出血加重或新生血管则行FFA检查(德国海德堡公司,Spectralis HRA),明确患眼是否存在新发新生血管及毛细血管无灌注区。
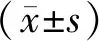
2 结果
2.1两组患眼治疗后视力改善及疗效情况比较 治疗后两组BCVA较治疗前显著提高(P<0.05),但两组各时间点BCVA比较差异无统计学意义(P>0.05)。两组治疗有效率比较差异无统计学意义(95.24% vs 90.00%,χ2=0.236,P=0.627)。见表2,3。

表2 两组患眼治疗后视力改善情况比较[n(%)]
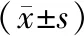
表3 两组患眼各时间点BCVA比较
2.2两组患眼不同时点CMT比较 治疗后,两组患眼CMT均呈下降趋势(P<0.05),且观察组在治疗后2周、1个月、3个月、6个月的CMT均较对照组薄,差异有统计学意义(P<0.05)。见表4,图1~2。
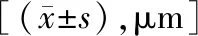
表4 两组患眼不同时点CMT比较
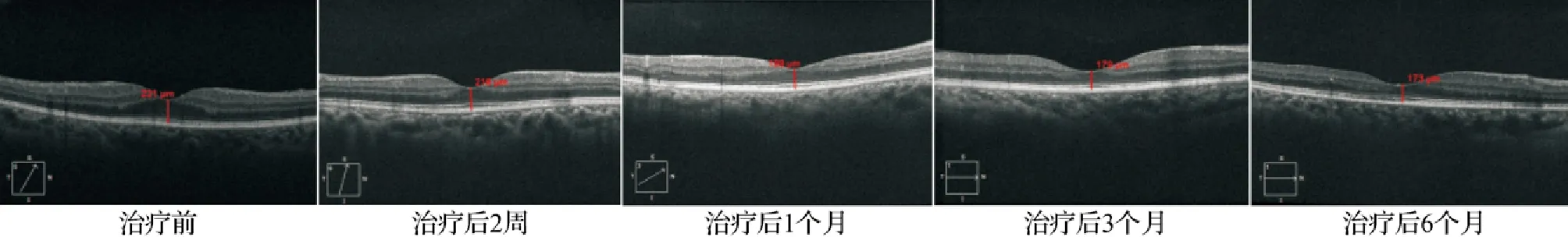
图1 观察组典型病例不同时间点CMT测量结果图
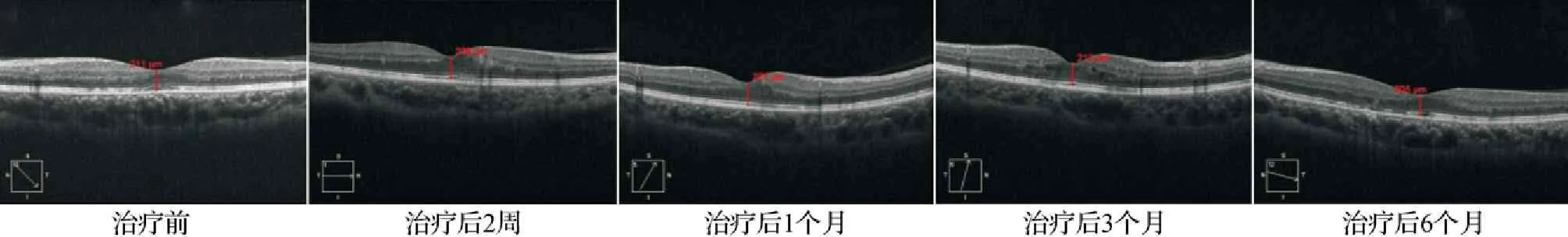
图2 对照组典型病例不同时间点CMT测量结果图
2.3两组患眼不同时间点RNFL厚度比较 治疗后,两组患眼RNFL厚度均呈下降趋势(P<0.05),且观察组在治疗后2周、1个月、3个月、6个月的RNFL厚度均较对照组厚,差异有统计学意义(P<0.05)。见表5。
表5 两组患眼不同时间点RNFL厚度比较
2.4两组不良反应发生情况比较 在治疗后3个月,对照组有1例患者发生新生血管性青光眼,予局部应用降眼压药物、玻璃体腔注射抗VEGF药物后眼压控制在正常范围(10~21 mmHg),虹膜新生血管消退,后根据FFA复查结果补充视网膜激光光凝,后续随访期内未再发生眼压升高情况,视网膜病变稳定。在治疗后6个月,观察组继发黄斑水肿2例,对照组有3例,两组发生率比较差异无统计学意义(P>0.05),予玻璃体腔注射抗VEGF药物治疗后黄斑水肿均消退。在治疗后6个月,观察组发生玻璃体积血1例,对照组有2例,两组发生率比较差异无统计学意义(P>0.05),予严格控制血糖干预处理,2例玻璃体腔注射抗VEGF药物后积血吸收,1例对照组患者在予玻璃体腔注射抗VEGF药物4周后积血仍未吸收,最终行玻璃体切除术(pars plana vitrectomy,PPV)治疗。两组随访期间均未发生渗出性视网膜脱离、脉络膜脱离或严重葡萄膜炎等并发症。见表6。

表6 两组不良反应发生情况比较[n(%)]
3 讨论
3.1DR是糖尿病严重微血管并发症之一,约占视网膜病变总数的60%[7]。糖尿病导致视网膜组织缺血、缺氧,VEGF释放,产生异常的新生血管,这类异常的血管极易引起出血、渗漏,引起严重的视网膜病变及视功能损害。有研究显示,重度NPDR及PDR若不予以干预,约50%的患眼在5年内可出现严重的视力缺失[8]。
3.2目前,DR的治疗方法包括全身系统的慢性病管理和眼部的局部治疗。全身系统的慢性病管理对于DR患者来说至关重要,具体措施包括科学控制血糖、血压和血脂;眼部的局部治疗包括PRP、抗VEGF药物治疗和手术治疗。应根据DR所处的疾病阶段,并结合DME合并情况来选择合适的治疗方案。根据《我国糖尿病视网膜病变临床诊疗指南(2022年)》[9],PRP被认为是有效降低重度NPDR和PDR患者严重视力损伤的主要治疗方法,尤其对于极重度NPDR和非高危PDR患者,更需要及时进行PRP治疗。但针对视力下降的重度NPDR及不合并玻璃体积血和牵拉性视网膜脱离的PDR患者,与PRP治疗比较,推荐使用抗VEGF药物治疗或抗VEGF药物治疗联合PRP治疗。既往研究也表明,抗VEGF药物治疗可有效降低眼内VEGF浓度,减少血管渗漏,减轻组织水肿。DR患者在注射抗VEGF药物后,可通过更低能量、更有效的激光光凝治疗视网膜病变,降低黄斑水肿复发率和再治疗率,降低高能量光凝对视网膜造成的损伤[3,10]。因此,有学者提倡PRP联合抗VEGF药物治疗,两者起到有效的协同作用,在改善视网膜水肿的同时能更顺利地完成PRP[11-12]。虽然抗VEGF药物治疗可在一定程度上减轻出血点、微动脉瘤、渗出等病变,但无法逆转毛细血管无灌注区扩大的自然病程,而且玻璃体腔注射抗VEGF药物治疗费用相对较高,并需要长期随访,要求患者的依从性好。因此,PRP在重度NPDR和PDR进展的控制方面及减少致盲上仍具有非常重要的作用,是DR临床治疗中的首要方法[13]。
3.3PRP治疗DR的机制:(1)通过激光破坏病灶周围的异常组织及视网膜耗氧细胞,改善视网膜缺血、缺氧,消退视网膜水肿及渗出,抑制血管生成因子的产生。(2)通过激光减少耗氧高的外层光感受器组织,使有重要功能的视网膜组织供氧得到改善,减少血管渗漏。PRP治疗光斑反应Ⅱ~Ⅲ级,总光斑数最少1 500~2 000点,可达到较好的治疗效果,但在光凝过程中需避开视盘新生血管及突起的视网膜新生血管丛,以免血管收缩引起严重的玻璃体积血。目前,临床上最常用的视网膜激光光谱仍然是倍频532 nm绿激光,它具有固体激光的优点和自身波长的优势,光激射介质可靠,在视网膜色素上皮层吸收率高于脉络膜,在临床上得到广泛应用。但是,黄斑区含大量叶黄素,其吸收峰值是460 nm,激光治疗时是吸收能量的主要组织,因此在靠近黄斑区光凝或行黄斑病变光凝时,532 nm激光对黄斑区会造成一定的损伤。相比于532 nm单一波长绿激光,561 nm的多波长激光机具有红、黄、绿3种不同波长激光联合应用的优点,对病灶部位的治疗更精确,对正常组织的损伤更小,具有更高的安全性[14-15]。目前,公认的561 nm黄激光的优势:(1)穿透力位于视网膜色素上皮(retinal pigment epithelium,RPE)-Bruch膜之间,RPE可有效吸收,而视网膜叶黄素无吸收,在治疗伴轻度黄斑水肿的患者或黄斑病变时可更靠近黄斑区进行有效光凝,对黄斑影响较小[16];(2)穿透力强,光散射小,可更有效穿过散射的介质,对屈光介质不清者也能有效光凝[17];(3)因其波长特性,视网膜血红蛋白可达到最佳吸收,最适用于视网膜血管性疾病,包括视网膜血管瘤等。因此,对于DR的PRP治疗,561 nm黄激光效果较绿激光更好,能最大限度地减少对视网膜功能的损伤,尤其是靠近黄斑区光凝及治疗黄斑病变方面更有优势。但由于多波长激光机的仪器费用较单波长激光机高,其在多数医院并未得到推广应用。
3.4PRP作为一种有创治疗,破坏了视网膜内、外屏障,毛细血管渗漏及液体透过RPE层可引起水肿[18-19],甚至导致视功能损害、玻璃体积血等并发症。本研究两组中共有5例患者继发黄斑水肿,给予玻璃体腔注射抗VEGF药物治疗后水肿均消退。既往研究也表明,视网膜激光光凝在治疗过程中可发生玻璃体积血[19],主要是由于激光能量较高、光斑周围能量突然增加致新生血管破裂引起出血,此时应稍压迫眼球以减少出血,治疗后应给予对症处理。光凝治疗后发生玻璃体积血,考虑主要因为激光点数偏少或光斑反应不足,新生血管未完全消退所致,在给予相应治疗后若积血仍难以吸收则需行PPV治疗。本研究两组患者在治疗过程中并未出现玻璃体积血,而治疗后6个月时有3例患者出现玻璃体积血,均行玻璃体腔注射抗VEGF药物治疗,2例患者玻璃体积血吸收。对照组1例患者干预4周后积血仍不吸收,予PPV进行治疗。有研究显示,激光光凝的高温造成视网膜神经节细胞功能受损,发生退行性神经病变,可使RNFL变薄[20]。本研究两组治疗后的RNFL厚度均呈下降趋势,但观察组患者RNFL厚度的损害较对照组小,这与相关研究[21]结果相似。除上述几种常见并发症外,有文献还报道了在行激光治疗时可能会发生视网膜脱离的情况,发生率为0.01%~12.20%[22]。考虑主要为过度光凝破坏了RPE之间的紧密连接,导致液体渗漏,出现渗出性视网膜脱离,通过应用糖皮质激素药物及双眼制动等处理,大多数患者脱离的视网膜均可复位。在本研究开展过程中,医师严谨控制每次激光总点数及光斑反应强度,所有患者未出现严重葡萄膜炎或渗出性视网膜脱离。
综上所述,561 nm黄激光治疗重度NPDR时穿透力强,RPE可有效吸收,而叶黄素吸收率低,能更靠近黄斑区病变光凝,对黄斑区、RNFL损害小,有利于保存视功能,值得在临床治疗中推广。但本研究样本量较小,有待更大样本量、更长随访时间的双盲、随机、多中心临床研究进行验证。
