载药栓塞微球经肝动脉化疗栓塞术联合阿帕替尼治疗不可切除肝癌后二线追加卡瑞利珠单抗的安全性和有效性分析
2023-04-29张延藏王满周韩新巍段旭华任建庄李浩王文辉许文泽
张延藏 王满周 韩新巍 段旭华 任建庄 李浩 王文辉 许文泽

摘要:目的 分析在載药栓塞微球经肝动脉化疗栓塞术(DTACE)联合阿帕替尼治疗不可切除肝癌后,二线追加卡瑞利珠单抗的安全性和有效性。方法 回顾性分析2019年12月—2020年12月于郑州大学第一附属医院就诊的89例二线追加卡瑞利珠单抗的肝癌患者资料。主要观察终点是使用卡瑞利珠单抗后总生存期(OS)和无进展生存期(PFS),次要终点包括客观缓解率(ORR)、疾病控制率(DCR)和治疗相关不良事件(TRAE)。采用Kaplan-Meier法估算生存曲线,基线特征亚组分层分析采用Log-rank检验进行比较,分析影响患者预后的相关因素。结果 本研究共筛选并随访了89例患者。随访至2021年12月,中位随访时间为16个月,中位OS为17.0(95%CI:15.3~18.7)个月,中位PFS为7.0(95%CI:6.2~7.8)个月。不同ECOG-PS、肝功能Child-Pugh分级、门静脉侵犯、进展模式、DTACE次数、口服阿帕替尼时长和应用卡瑞利珠单抗时长的患者OS及PFS之间差异具有统计学意义(P值均<0.05)。应用卡瑞利珠单抗后3个月与6个月ORR分别为39.3%和22.4%,DCR分别为80.9%和54.1%。Log-rank检验单因素分析结果表明:DTACE次数为3~4、1~2比0次的患者显著改善中位OS [22.0 (95%CI:21.1~22.9)个月 vs 17.0 (95%CI:15.8~18.2)个月 vs 10.0 (95%CI:7.0~13.0)个月,χ2=31.423,P<0.001]与PFS [10.0 (95%CI:7.0~13.0)个月 vs 7.0(95%CI:6.2~7.8)个月 vs 3.0 (95%CI:1.9~4.1)个月,χ2=20.741,P<0.001]; 阿帕替尼应用时长>4个月比≤4个月的患者显著改善中位OS [21.0 (95%CI:19.1~22.9) 个月vs 14.0(95%CI:10.4~17.6)个月, χ2=19.399,P<0.001]与PFS [9.0 (95%CI:7.3~10.7)个月 vs 5.0 (95%CI:4.0~6.0)个月,χ2=27.733,P<0.001]; 卡瑞利珠单抗应用时长>5个月比≤5个月的患者显著改善中位OS [22.0(95%CI:20.2~23.8)个月 vs 13.0(95%CI:9.3~16.7)个月, χ2=22.336,P<0.001]与PFS [9.0 (95%CI:7.0~11.0)个月 vs 5.0 (95%CI:4.1~5.9)个月, χ2=26.141,P<0.001]。DTACE术后不良事件为栓塞后综合征,给予对症处理后缓解。靶向药物和免疫治疗相关不良反应经对症支持治疗后均缓解,无4级及以上不良反应,无患者因TRAE而停用靶免治疗。结论 DTACE联合阿帕替尼治疗不可切除肝癌进展后追加卡瑞利珠单抗疗效确切,TRAE总体安全可控。
关键词:肝肿瘤; 化学栓塞, 治疗性; 阿帕替尼; 卡瑞利珠单抗
基金项目:2021年河南省医学科技攻关省部共建重大项目(SBGJ202102100)
Safety and efficacy of camrelizumab added to second-line therapy after drug-eluting bead transarterial chemoembolization combined with apatinib for unresectable hepatocellular carcinoma
ZHANG Yancang, WANG Manzhou, HAN Xinwei, DUAN Xuhua, REN Jianzhuang, LI Hao, WANG Wenhui, XU Wenze. (Department of Interventional Radiology, The First Affiliated Hospital of Zhengzhou University, Zhengzhou 450052, China)
Corresponding author:
WANG Manzhou, manzhouwang@126.com (ORCID:0000-0003-3685-4801)
Abstract:
Objective To investigate the safety and efficacy of camrelizumab added to second-line therapy after drug-eluting bead transarterial chemoembolization (DTACE) combined with apatinib for unresectable hepatocellular carcinoma(HCC). Methods A retrospective analysis was performed for 89 HCC patients with camrelizumab added to second-line therapy who attended The First Affiliated Hospital of Zhengzhou University from December 2019 to December 2020. The primary endpoints were overall survival (OS) and progression-free survival (PFS) after the application of camrelizumab, and the secondary endpoints were objective remission rate (ORR), disease control rate (DCR), and treatment-related adverse events (TRAEs). The Kaplan-Meier method was used to plot survival curves, the Log-rank test was used for stratified analysis of subgroups based on baseline characteristics, and the influencing factors for prognosis were analyzed. Results A total of 89 patients were screened and followed up in this study. The patients were followed up to December 2021, with a median follow-up time of 16 months, a median OS time of 17.0 (95% confidence interval [CI]: 15.3-18.7) months, and a median PFS time of 7.0 (95% CI: 6.2-7.8) months. There were significant differences in OS and PFS between the patients with different ECOG-PS scores, liver function Child-Pugh classes, portal vein invasion, patterns of progression, times of DTACE treatment, durations of oral administration of apatinib, and durations of application of camrelizumab (all P<0.05). At 3 and 6 months after the application of camrelizumab, ORR was 39.3% and 22.4%, respectively, and DCR was 80.9% and 54.1%, respectively. The univariate analysis using the Log-rank test showed that compared with the patients receiving 0 time of DTACE treatment, the patients receiving 3-4 or 1-2 times of DTACE treatment had significant improvements in median OS [22.0 (95% CI: 21.1-22.9) months and 17.0 (95% CI: 15.8-18.2) months vs 10.0 (95% CI: 7.0-13.0) months, χ2=31.423, P<0.001] and PFS [10.0 (95% CI: 7.0-13.0) months and 7.0 (95% CI: 6.2-7.8) months vs 3.0 (95% CI: 1.9-4.1) months, χ2=20.741, P<0.001]; compared with the patients using apatinib for ≤4 months, the patients using apatinib for >4 months had significant improvements in median OS [21.0 (95% CI: 19.1-22.9) months vs 14.0 (95% CI: 10.4-17.6) months, χ2=19.399, P<0.001] and PFS [9.0 (95% CI: 7.3-10.7) months vs 5.0 (95% CI: 4.0-6.0) months, χ2=27.733, P<0.001]; compared with the patients using camrelizumab for ≤5 months, the patients using camrelizumab for >5 months had significant improvements in median OS [22.0 (95% CI: 20.2-23.8) months vs 13.0 (95% CI: 9.3-16.7) months, χ2=22.336, P<0.001] and PFS [9.0 (95% CI: 7.0-11.0) months vs 5.0 (95% CI: 4.1-5.9) months, χ2=26.141, P<0.001]. Post-embolization syndrome was the adverse event after DTACE and resolved after symptomatic treatment. Adverse reactions related to targeted drugs and immunotherapy all resolved after symptomatic supportive treatment, with no grade ≥4 adverse reactions, and no patients withdrew from target-free therapy due to TRAEs. Conclusion As for DTACE combined with apatinib in the treatment of unresectable HCC, camrelizumab added after progression has a marked therapeutic efficacy with safe and controllable TRAEs.
Key words:
Liver Neoplasms; Chemoembolization, Therapeutic; Apatinib; Camrelizumab
Research funding:
The Co-operation Research Plan of Medical Science and Technology in Henan Province (SBGJ202102100)
經肝动脉化疗栓塞术(TACE)是治疗中晚期肝细胞癌(HCC)的一线治疗方法[1-2]。目前有两种TACE技术,传统的TACE (conventional TACE,cTACE )和载药栓塞微球TACE (drug-eluting bead TACE,DTACE)。载药微球(drug-eluting beads,DEB)作为新型的可载药栓塞剂,具有加载大剂量化疗药物、缓慢释放药物和提高局部药物浓度等优势,已在临床大量应用并取得了良好的临床疗效[3-5]。相比于cTACE,DTACE对中国肝癌患者具有很好的耐受性,更好的肿瘤治疗反应和更长的生存期[6-8]。
TACE作为一种姑息治疗方法对于肿瘤体积大、合并门静脉癌栓的中晚期肝癌患者,一次治疗很难彻底栓塞肿瘤,不完全栓塞易导致残瘤肝癌细胞内缺氧诱导因子1α表达,缺氧诱导因子1α/血管内皮生长因子(vascular endothelial growth factor,VEGF)通路开放,VEGF过度表达促进残留肿瘤组织的血管生成,进而加速残瘤的进展导致复发和转移[9]。阿帕替尼高度选择性地抑制血管内皮生长因子受体-2(vascular endothelial growth factor receptor 2,VEGFR-2),减少肿瘤新血管生成,一线治疗晚期HCC的临床试验[10]显示,其能显著改善患者的生存期,且不良事件可控。一项荟萃分析[11]显示相比于单纯TACE,阿帕替尼联合TACE治疗中晚期肝癌也得到了更好的生存获益。值得注意的是,TACE联合靶向药物治疗肝癌,在肿瘤进展后的治疗策略目前仍尚无定论。
以程序性死亡受体-1(programmed cell death protein 1,PD-1)/程序性死亡受体配体-1(programmed cell death-ligand 1,PD-L1)抗体途径为代表的免疫检查抑制剂治疗,现已成为改善肝癌患者肿瘤反应和生存期的联合方案的重要选择[12-14]。卡瑞利珠单抗联合阿帕替尼可以提高晚期HCC患者的临床获益,优于单一用药[15]。DTACE联合阿帕替尼治疗中晚期肝癌疗效确切,然而仍有很多患者存在复发风险[16]。研究[17]发现TACE可以诱导免疫性肿瘤细胞死亡,TACE联合免疫治疗可以提高疗效。DTACE联合阿帕替尼治疗进展后,追加使用卡瑞利珠单抗治疗不可切除的HCC虽罕于报道,但理论基础明确。因此笔者回顾性分析该种方法治疗不可切除肝癌患者的安全性及有效性。
1 资料与方法
1.1 研究对象 回顾性分析本院2019年12月—2020年12月既往接受DTACE联合阿帕替尼治疗进展后应用卡瑞利珠单抗的HCC患者资料。纳入标准:(1)严格符合《原发性肝癌诊疗规范(2019年版)》[18]临床诊断标准,根据影像学和/或活检,诊断为不可切除肝癌;(2)至少有1个可测量病灶,单个或2~3个肿瘤直径之和≥5 cm;(3)应用DTACE联合阿帕替尼作为一线治疗方案,应用阿帕替尼不少于1个月;(4)一线治疗期间疾病出现进展后,应用卡瑞利珠单抗作为二线追加治疗手段,二线治疗期间继续联合DTACE和阿帕替尼治疗;(5)年龄18~75岁;(6)入组前1周内东部肿瘤学协作组体力状态评分(ECOG-PS):0~2分;(7)预期寿命超过3个月;(8)肝功能应达到Child-Pugh分级A或B级,肾功能正常,凝血功能正常或经治疗后得以纠正。
排除标准:(1)弥漫性HCC;(2)严重凝血功能异常,且无法纠正;严重肾功能衰竭、心肺功能衰竭;(3)肝功能Child-Pugh分级为C级;(4)门静脉主干完全由癌栓阻塞,侧支循环减少或门静脉高压伴逆向血流;(5)合并其他原发性恶性肿瘤;(6)妊娠;(7)因严重靶免药物不良反应而停止治疗;(8)数据不完整。符合以上一项或几项的患者不可参与本研究。
1.2 治疗过程
1.2.1 TACE过程 患者由具有10年以上经验的介入放射科医生进行DTACE治疗。常规消毒铺巾后,在局部麻醉下使用Seldinger穿刺法穿刺股动脉,放置5F血管鞘及5F RH导管,将导管在导丝配合下分别插管至腹腔干动脉、肠系膜上动脉、脾动脉等高压造影,明确肝肿瘤病灶位置及肿瘤责任血管后,采用微导管超选择至肿瘤责任血管。经微导管注入加载40~60 mg阿霉素载药栓塞微球(CalliSpheres;苏州恒瑞迦俐生生物医药科技有限公司),栓塞直至肿瘤染色消失,若DEB用完后复查造影仍然有肿瘤染色,则继续追加300~500 μm栓塞微球(Embospheres, Merit Medical, South Jordan, USA),直至造影显示肿瘤责任血管血流接近停滞。拔出鞘管,加压包扎。介入手术后给予保肝、护胃、止痛、止吐等药物对症支持。术后4~6周复查上腹部增强CT或MRI,由两名10~15年工作经验的放射科医生评估患者图像,明确肿瘤是否仍有动脉血供。若仍有动脉供血,肝功能评估Child-Pugh分级为A或B级时,重复TACE过程。
1.2.2 阿帕替尼和卡瑞利珠单抗应用方案 DTACE术后3~5天给予阿帕替尼口服,在第二次DTACE术前3天停药,直至肿瘤进展、患者死亡或不可耐受药物不良事件,起始剂量为250 mg/d。期间出现≥3级不良事件(adverse event, AE)则调整药物剂量至125 mg/d 或暂停给药,停药时间不超过2周,停药次数不超过2次。DTACE联合阿帕替尼治疗一直随访至患者肿瘤进展,加用卡瑞利珠单抗(每3周1次,200 mg/次)。持续给药直至出现无法忍受的毒性或再次疾病进展。允许剂量中断不超过12周。
1.3 隨访及疗效评估 以患者接受DTACE联合阿帕替尼治疗进展后肿瘤特征为基线,根据Llovet等[19]对肿瘤进展模式的描述,出现靶区病变、非靶区病变、新病灶视为肿瘤进展。采用门诊复查、微信、电话或相结合的方式,询问患者本人或者家属TACE术后、应用靶向药物和PD-1抑制剂期间的不良反应、生存状况和死亡原因等。观察并记录有无严重并发症发生,由美国国家癌症研究所(NCI)制定的“不良事件通用术语标准(CTCAE)”4.03版评估患者AE。根据患者术前及治疗后影像学检查(增强CT或MRI)结果,采用改良版实体肿瘤疗效评价标准(mRECIST)评估疗效。
主要终点是总生存期(OS)和无进展生存期(PFS)。OS的定义是第一次使用卡瑞利珠单抗到因任何原因引起的死亡日期或最后随访日期。PFS的定义是从第一次应用卡瑞利珠单抗到疾病进展或死亡时间。次要终点为应用卡瑞利珠单抗首次治疗后3个月及6个月的客观反应率(ORR)、 疾病控制率(DCR)和治疗相关不良事件(TRAE)。随访终点为患者死亡或2021年12月31日。
1.4 统计学方法 所有数据均使用SPSS 26.0统计软件(IBM公司,Armonk, NY, USA)进行分析。符合正态分布的计量资料以x±s表示,非正态分布以M(P25~P75)表示;计数资料以例数及百分比表示。生存曲线用Kaplan-Meier方法估计,计算OS和PFS的中位数,亚组分析采用Log-rank检验进行比较。P<0.05为差异具有统计学意义。
2 结果
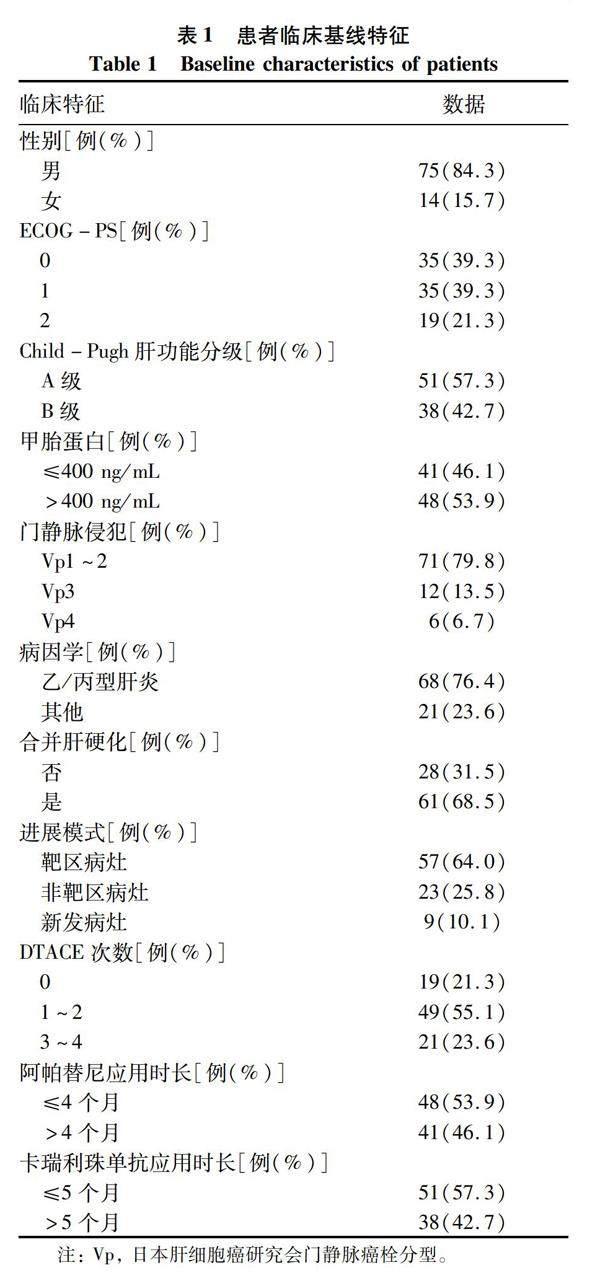
2.1 临床基线特征 2019年12月—2020年12月共计纳入患者115例。因严重的凝血功能异常、严重肾功能不全、合并其他肿瘤、入组其他临床试验、资料不完整排除26例。最终共筛选出符合条件的89例患者并完成随访,截止日期为2021年12月31日,中位随访时间为16.0(95%CI:4.3~24.0)个月。患者的基线特征资料如表1所示。
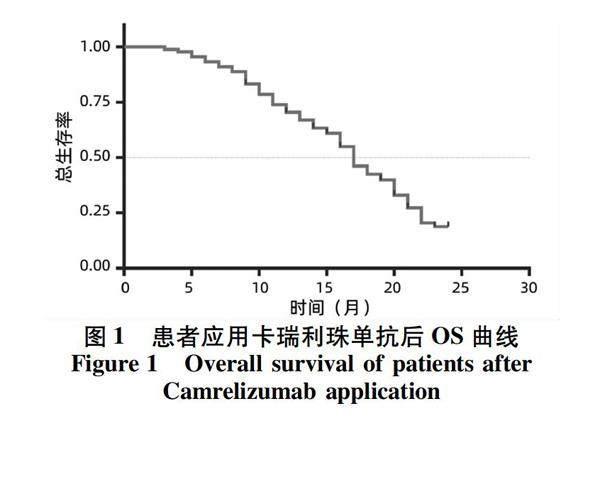
2.2 OS分析 所纳入患者的中位OS为17.0(95%CI:15.3~18.7)个月(图1)。将患者基线特征数据作为单变量对是否影响OS进行单因素分析(表2),其中不同ECOG-PS、肝功能Child-Pugh分级、门静脉侵犯、进展模式、DTACE次数、口服阿帕替尼时长和应用卡瑞利珠单抗时长的患者OS之间差异有统计学意义(P值均<0.05)。
2.3 PFS分析 所纳入患者的中位PFS为7.0(95%CI:6.2~7.8)个月(图2)。将患者基线特征数据作为单变量对是否影响PFS进行单因素分析(表3),其中不同ECOG-PS、肝功能Child-Pugh分级、门静脉侵犯、进展模式、DTACE次数、口服阿帕替尼时长和应用卡瑞利珠单抗时长的患者PFS之间差异有统计学意义(P值均<0.05)。
2.4 治疗应答 患者首次输注卡瑞利珠单抗后3个月和6个月的治疗应答见表4。
2.5 TRAE 常见的TRAE为发热36例(40.4%)、疼痛19例(21.3%)及胃肠道反应26例(29.2%),大多数被分类为1~2级,可耐受且经对症治疗后能够缓解,3级AE有疼痛3例(3.4%)及肝脓肿2例(2.2%),无4级以上不良事件。本研究中发现的靶免治疗相关AE,以乏力23例(25.8%)、手足综合征17例(19.1%)、高血压16例(18.0%)、肝性脑病15例(16.9%)、反应性皮肤毛细血管增生症14例(15.7%)、发热11例(12.4%)以及疼痛10例(11.2%)较为常见。除此之外还出现了蛋白尿5例(5.6%)、上消化道出血7例(7.9%)等。根据CTCAE 4.03,多数为1~2级,而3级AE有肝性脑病4例(4.5%)、免疫相关性肺炎1例(1.1%)以及上消化道出血3例(3.4%),无4级以上不良事件。患者均可耐受且经对症治疗后能够缓解(表5)。
3 讨论
目前TACE常联合使用抗血管生成靶向药物控制TACE术后中晚期HCC的复发和转移。TACTICS试验对比cTACE 联合索拉非尼与cTACE治疗中期肝癌,发现联合组 mPFS 明显长于cTACE 组(25.2个月vs 13.5个月),联合组较cTACE组明显延长1年和2年的总生存率[20]。一项多中心回顾性研究[21]发现治疗BCLC C期HCC患者时,虽然cTACE联合阿帕替尼取得的PFS短于TACE联合索拉非尼(5.0个月 vs 6.0个月, P=0.002),但最终二者取得了类似的OS疗效(13.0个月 vs 13.0个月)。
阿帕替尼是一种比索拉非尼选择性和亲和力更高的酪氨酸激酶抑制剂,能够抑制肿瘤血管内皮细胞增殖、迁移,降低肿瘤微血管密度,促进细胞凋亡[22]。同样治疗BCLC C期HCC患者,Ju等[16]采用DTACE联合阿帕替尼,中位OS和PFS分别为16.9个月和6.3个月,而Kan等[23]采用cTACE联合阿帕替尼,中位OS和疾病进展时间为13个月和7个月。以上研究可推测同样联合阿帕替尼,相比cTACE,DTACE能更好地延长生存期。然而TACE联合阿帕替尼治疗肝癌进展之后,如何选择进一步治疗方案,有诸多争议。
TACE术后肿瘤细胞碎片、促炎细胞因子和危险相关分子模式的释放对适应性免疫具有启动作用[24]。抗血管生成靶向药物减少了VEGF介导的肿瘤及其微环境中的免疫抑制,并可能通过逆转VEGF介导的免疫抑制和促进T淋巴细胞在肿瘤中的浸润来提高抗PD-1和PD-L1的疗效[25-26]。根据以上理论基础,本研究加用卡瑞利珠单抗控制TACE联合阿帕替尼治疗后肿瘤复发。RESORCE试验[27]在索拉非尼治疗晚期肝癌进展后,仅用二线治疗药物瑞戈替尼控制肿瘤发展,发现瑞戈替尼较安慰剂能明显改善OS(10.6个月 vs 7.8个月)和ORR(10.6% vs 4.1%)。本研究中OS为17.0个月,3个月与6个月ORR为39.3%和22.4%,较二线单药应用瑞戈替尼更为有效。
一項单中心回顾性对比研究[28]发现,DTACE或cTACE联合阿帕替尼与卡瑞利珠单抗一线治疗较与单独阿帕替尼与卡瑞利珠单抗更有利于提高中晚期HCC肿瘤反应率[ORR(42.9% vs 17.3%)、DCR(85.7% vs 57.7%)]和OS(24.8个月 vs 13.1个月)。本研究中DTACE与阿帕替尼联合治疗进展后追加卡瑞利珠单抗的OS为17.0个月,结合本研究前期应用阿帕替尼与DTACE联合治疗期间的PFS为8.0(95%CI: 6.9~9.1)个月。本研究患者DTACE与阿帕替尼联合治疗进展后序贯卡瑞利珠单抗的队列OS约为25.0个月,该结果与Ju等[28]研究类似。证实TACE联合阿帕替尼治疗肝癌进展后追加卡瑞利珠单抗,与直接应用TACE联合阿帕替尼及卡瑞利珠单抗一样在晚期肝癌治疗中能够使患者OS获益。
本研究单因素分析表明,ECOG-PS为2分是影响患者死亡的危险因素,针对此类患者应充分结合患者肝功能状态制定治疗策略。肿瘤以新病灶模式进展是影响患者死亡的保护因素,根据mRECIST,肝硬化过程固有的病理变化(再生结节或纤维间隔)导致在慢性肝病中,诊断新发现的局灶性肝脏病变成为一个具有挑战性的问题,因为可能无法与小肿瘤区分开来[19],这可能是新病灶进展相比于靶区病灶/非靶区病灶进展成为保护因素的原因。而进展后TACE重复次数3~4次、应用阿帕替尼时长>4个月以及进展后卡瑞利珠单抗应用时长>5个月可能是影响患者死亡的保护因素。这表明在一定限度内,合理根据肿瘤负荷精细化制定治疗策略,可使得患者获益。
研究中与DTACE相关不良反应均为栓塞后综合征,经对症处理安全可控。靶免联合治疗相关的TRAE主要为1~2级,处理后均能缓解,未出现因TRAE而停用阿帕替尼或卡瑞利珠单抗。Grade3级TRAE较为特殊的是肝性脑病、上消化道出血。有研究[29]提出预先存在肝功能异常的情况下,应用酪氨酸激酶抑制剂(tyrosine kinase inhibitors,TKI)有诱发肝性脑病的风险。在本研究中Grade3级肝性脑病比例达到了4.5%,原因可能是DTACE和PD-1增加了TKI诱发肝性脑病的风险,因此在追加卡瑞利珠单抗前,应充分评估肝功能及血氨水平。本研究中Grade3级的上消化道出血为3.4%,进行积极保守治疗得到了缓解,考虑为免疫相关的腹泻/肠炎[30]可能诱发了上消化道出血。因此,早期干预性治疗可改善AE预后。
本研究的局限性:第一,本研究为单中心回顾性研究,所选患者DTACE术后的一线系统治疗未选择索拉非尼和仑法替尼。第二,没有采用病例对照设计,在与其他类似研究进行比较时需谨慎。随访时间较短,大部分患者OS未观察到终点事件,延长随访时间,中位OS可能会进一步延长。第三,对于免疫检查点抑制剂治疗后的疗效评估,并未考虑实体瘤的免疫治疗疗效评价标准[31]。因此,需要进一步进行多中心、前瞻性、大样本的随机对照临床试验来合理验证TACE联合多激酶抑制剂序贯免疫检查点抑制剂的疗效。
总之,DTACE联合阿帕替尼治疗不可切除肝癌进展后追加卡瑞利珠单抗疗效确切,TRAE总体安全可控。
伦理学声明:本研究方案于2020年11月24日经郑州大学第一附属医院伦理委员会审批,批号:SS-2020-017。
利益冲突声明:本研究不存在研究者、伦理委员会成员、受试者监护人以及与公开研究成果有关的利益冲突。
作者贡献声明:张延藏、王满周、段旭华对研究的思路有关键贡献;王满周负责课题设计,资料分析,撰写论文;张延藏负责撰写、修改论文;李浩、王文辉、许文泽负责数据收集和整理分析;韩新巍、段旭华、任建庄负责拟定写作思路,指导撰写文章并最后定稿。
参考文献:
[1]
SUNG H, FERLAY J, SIEGEL RL, et al. Global Cancer Statistics 2020: GLOBOCAN Estimates of incidence and mortality worldwide for 36 cancers in 185 countries[J]. CA Cancer J Clin, 2021, 71(3): 209-249. DOI: 10.3322/caac.21660.
[2]VILLANUEVA A. Hepatocellular carcinoma[J]. N Engl J Med, 2019, 380(15): 1450-1462. DOI: 10.1056/NEJMra1713263.
[3]VESSELLE G, QUIRIER-LELEU C, VELASCO S, et al. Predictive factors for complete response of chemoembolization with drug-eluting beads (DEB-TACE) for hepatocellular carcinoma[J]. Eur Radiol, 2016, 26(6): 1640-1648. DOI: 10.1007/s00330-015-3982-y.
[4]SONG MJ, CHUN HJ, SONG DS, et al. Comparative study between doxorubicin-eluting beads and conventional transarterial chemoembolization for treatment of hepatocellular carcinoma[J]. J Hepatol, 2012, 57(6): 1244-1250. DOI: 10.1016/j.jhep.2012.07.017.
[5]CAO B, ZHANG GW. Meta analysis of efficacy and safety of drug-eluting beads transarterial chemoembolization and conventional transarterial chemoembolization in the treatment of advanced hepatocellular carcinoma[J]. China Med Herald, 2021, 18(26): 95-99.
曹博, 張光文. 载药微球经动脉化疗栓塞术与常规经动脉化疗栓塞术治疗中晚期肝癌效果及安全性的meta分析[J]. 中国医药导报, 2021, 18(26): 95-99.
[6]SCARTOZZI M, BARONI GS, FALOPPI L, et al. Trans-arterial chemo-embolization (TACE), with either lipiodol (traditional TACE) or drug-eluting microspheres (precision TACE, pTACE) in the treatment of hepatocellular carcinoma: efficacy and safety results from a large mono-institutional analysis[J]. J Exp Clin Cancer Res, 2010, 29(1): 164. DOI: 10.1186/1756-9966-29-164.
[7]ZHOU GH, HAN J, SUN JH, et al. Efficacy and safety profile of drug-eluting beads transarterial chemoembolization by CalliSpheres beads in Chinese hepatocellular carcinoma patients[J]. BMC Cancer, 2018, 18(1): 644. DOI: 10.1186/s12885-018-4566-4.
[8]SUN J, ZHOU G, XIE X, et al. Efficacy and safety of drug-eluting beads transarterial chemoembolization by callispheres in 275 hepatocellular carcinoma patients: Results from the Chinese CalliSpheres Transarterial Chemoembolization in Liver Cancer (CTILC) Study[J]. Oncol Res, 2020, 28(1): 75-94. DOI: 10.3727/096504019X15662966719585.
[9]KONG J, KONG J, PAN B, et al. Insufficient radiofrequency ablation promotes angiogenesis of residual hepatocellular carcinoma via HIF-1α/VEGFA[J]. PLoS One, 2012, 7(5): e37266. DOI: 10.1371/journal.pone.0037266.
[10]QIN S, LI Q, GU S, et al. Apatinib as second-line or later therapy in patients with advanced hepatocellular carcinoma (AHELP): a multicentre, double-blind, randomised, placebo-controlled, phase 3 trial[J]. Lancet Gastroenterol Hepatol, 2021, 6(7): 559-568. DOI: 10.1016/S2468-1253(21)00109-6.
[11]ZHAO S, ZHANG T, DOU W, et al. A comparison of transcatheter arterial chemoembolization used with and without apatinib for intermediate- to advanced-stage hepatocellular carcinoma: a systematic review and meta-analysis[J]. Ann Transl Med, 2020, 8(8): 542. DOI: 10.21037/atm.2020.02.125.
[12]RIMASSA L, PRESSIANI T, MERLE P. Systemic treatment options in hepatocellular carcinoma[J]. Liver Cancer, 2019, 8(6): 427-446. DOI: 10.1159/000499765.
[13]FINN RS, ZHU AX. Evolution of systemic therapy for hepatocellular carcinoma[J]. Hepatology, 2021, 73(Suppl 1): 150-157. DOI: 10.1002/hep.31306.
[14]LIANG J, LI L.Progress and consideration of immunotherapy strategy for hepatocellular carcinoma[J]. Chin J Dig Surg, 2021, 20(2): 184-190. DOI: 10.3760/cma.j.cn115610-20201228-00809.
梁军, 李丽. 肝癌免疫治疗策略的进展与思考[J]. 中华消化外科杂志, 2021, 20(2): 184-190. DOI: 10.3760/cma.j.cn115610-20201228-00809.
[15]XU J, SHEN J, GU S, et al. Camrelizumab in combination with apatinib in patients with advanced hepatocellular carcinoma (RESCUE): A nonrandomized, open-label, phase II trial[J]. Clin Cancer Res, 2021, 27(4): 1003-1011. DOI: 10.1158/1078-0432.CCR-20-2571.
[16]JU S, WANG W, CHEN P, et al. Drug-eluting bead transarterial chemoembolization followed by apatinib is effective and safe in treating hepatocellular carcinoma patients with BCLC stage C[J]. Clin Res Hepatol Gastroenterol, 2022, 46(3): 101859. DOI: 10.1016/j.clinre.2022.101859.
[17]GRETEN TF, MAUDA-HAVAKUK M, HEINRICH B, et al. Combined locoregional-immunotherapy for liver cancer[J]. J Hepatol, 2019, 70(5): 999-1007. DOI: 10.1016/j.jhep.2019.01.027.
[18]
Bureau of Medical Administration, National Health Commission of the Peoples Republic of China. Guidelines for diagnosis and treatment of primary liver cancer in China (2019 edition)[J]. J Clin Hepatol, 2020, 36(2): 277-292. DOI: 10.3969/j.issn.1001-5256.2020.02.007.
中華人民共和国国家卫生健康委员会医政医管局. 原发性肝癌诊疗规范(2019年版)[J]. 临床肝胆病杂志, 2020, 36(2): 277-292. DOI: 10.3969/j.issn.1001-5256.2020.02.007.
[19]LLOVET JM, LENCIONI R. mRECIST for HCC: Performance and novel refinements[J]. J Hepatol, 2020, 72(2): 288-306. DOI: 10.1016/j.jhep.2019.09.026.
[20]KUDO M, UESHIMA K, IKEDA M, et al. Randomised, multicentre prospective trial of transarterial chemoembolisation (TACE) plus sorafenib as compared with TACE alone in patients with hepatocellular carcinoma: TACTICS trial[J]. Gut, 2020, 69(8): 1492-1501. DOI: 10.1136/gutjnl-2019-318934.
[21]QIU Z, SHEN L, JIANG Y, et al. Transarterial chemoembolization (TACE) combined with apatinib versus TACE combined with sorafenib in advanced hepatocellular carcinoma patients: a multicenter retrospective study[J]. Ann Transl Med, 2021, 9(4): 283. DOI: 10.21037/atm-20-5360.
[22]PENG S, ZHANG Y, PENG H, et al. Intracellular autocrine VEGF signaling promotes EBDC cell proliferation, which can be inhibited by Apatinib[J]. Cancer Lett, 2016, 373(2): 193-202. DOI: 10.1016/j.canlet.2016.01.015.
[23]KAN X, LIANG B, ZHOU G, et al. Transarterial chemoembolization combined with apatinib for advanced hepatocellular carcinoma: A propensity score matching analysis[J]. Front Oncol, 2020, 10: 970. DOI: 10.3389/fonc.2020.00970.
[24]POL J, VACCHELLI E, ARANDA F, et al. Trial watch: Immunogenic cell death inducers for anticancer chemotherapy[J]. Oncoimmunology, 2015, 4(4): e1008866. DOI: 10.1080/2162402X.2015.1008866.
[25]MOTZ GT, SANTORO SP, WANG LP, et al. Tumor endothelium FasL establishes a selective immune barrier promoting tolerance in tumors[J]. Nat Med, 2014, 20(6): 607-615. DOI: 10.1038/nm.3541.
[26]VORON T, COLUSSI O, MARCHETEAU E, et al. VEGF-A modulates expression of inhibitory checkpoints on CD8+ T cells in tumors[J]. J Exp Med, 2015, 212(2): 139-148. DOI: 10.1084/jem.20140559.
[27]BRUIX J, QIN S, MERLE P, et al. Regorafenib for patients with hepatocellular carcinoma who progressed on sorafenib treatment (RESORCE): a randomised, double-blind, placebo-controlled, phase 3 trial[J]. Lancet, 2017, 389(10064): 56-66. DOI: 10.1016/S0140-6736(16)32453-9.
[28]JU S, ZHOU C, YANG C, et al. Apatinib plus camrelizumab with/without chemoembolization for hepatocellular carcinoma: A real-world experience of a single center[J]. Front Oncol, 2021, 11: 835889. DOI: 10.3389/fonc.2021.835889.
[29]LIU Y, CHEN X, GAO X, et al. Apatinib-induced hyperammonemic encephalopathy[J]. J Oncol Pharm Pract, 2020, 26(2): 465-470. DOI: 10.1177/1078155219846253.
[30]LARKIN J, HODI FS, WOLCHOK JD. Combined nivolumab and ipilimumab or monotherapy in untreated melanoma[J]. N Engl J Med, 2015, 373(13): 1270-1271. DOI: 10.1056/NEJMc1509660.
[31]HODI FS, BALLINGER M, LYONS B, et al. Immune-Modified Response Evaluation Criteria In Solid Tumors (imRECIST): Refining guidelines to assess the clinical benefit of cancer immunotherapy[J]. J Clin Oncol, 2018, 36(9): 850-858. DOI: 10.1200/JCO.2017.75.1644.
收稿日期:
2022-08-19;錄用日期:2022-09-20
本文编辑:王亚南
