颈椎管内外沟通性肿瘤一期全切的手术治疗策略
2023-04-29李洋邹福建邓雷薛军蒋登志徐忠烨晏怡
李洋 邹福建 邓雷 薛军 蒋登志 徐忠烨 晏怡


【摘要】 目的 建立新的頸椎管内外沟通性肿瘤临床分型,并根据术前分型选择不同的手术方式,制定一期全切颈椎管内外沟通性肿瘤的最佳手术治疗策略。方法 回顾性分析重庆医科大学附属第一医院神经外科2016年1月—2021年1月收治的84例颈椎管内外沟通性肿瘤患者的临床资料,所有患者术前依据新的“三分型”系统进行临床分型。Ⅰ型:肿瘤主体位于椎管内及椎间孔区,采取后入路半椎板术式;Ⅱ型:肿瘤涉及椎间孔内外,生长范围广,采取后入路个体化椎板切除+内固定术式;Ⅲ型:肿瘤主体位于椎间孔外及肿瘤位于C1-2水平,采取侧方入路术式。不同分型采用相应的手术方式达到一期全切肿瘤的手术目标。术后评估神经功能损害症状有无改善、有无肿瘤复发及内固定相关并发症等临床疗效,分析此分型在临床实践中的指导价值。结果 84例患者中,Ⅰ型10例,Ⅱ型40例,Ⅲ型34例,均达到一期全切目标,术中未发生椎动脉的损伤。术后病理诊断以神经鞘瘤最为常见,共70例(83.3%)。术前McCormick脊髓功能评分Ⅰ级33例,Ⅱ级43例,Ⅲ级7例,Ⅳ级1例。随访时间6~40个月,平均18 个月,随访期间43例患者疼痛及无力等神经功能损害症状均不同程度缓解;29例患者临床症状较术前无变化;12例无症状患者无新发神经功能损害症状。末次随访时,所有患者的McCormick脊髓功能评分Ⅰ级69例,Ⅱ级13例,Ⅲ级2例,Ⅳ级0例,优于术前,差异有统计学意义(P<0.001)。随访期间所有患者无肿瘤复发,未见颈椎不稳或畸形,其中Ⅱ型患者也未发生固定材料松动、脱落或断裂等并发症。结论 新的“三分型”有助于指导手术方案的制定,在一期全切肿瘤的同时兼顾了脊柱稳定性,更加简单实用。
【关键词】 颈椎管内外沟通性肿瘤;肿瘤分型;一期全切;手术方式
【中图分类号】 R739.42 【文献标志码】 A 【文章编号】 1672-7770(2023)01-0028-08
Abstract: Objective To establish a new clinical classification of cervical intraspinal and extraspinal communicating tumors, for surgical methods selection, and formulate the best surgical treatment strategy for one-stage total resection of cervical intraspinal and extraspinal communicating tumors. Method The clinical data of 84 patients with cervical intraspinal and extraspinal communicating tumors admitted to Department of Neurosurgery, the First Affiliated Hospital of Chongqing Medical University from January 2016 to January 2021 were analyzed retrospectively. All patients were clinically classified according to the new “three-classification” system before operation. Type Ⅰ: The main part of the tumor was located in the spinal canal and the intervertebral foramen, and the posterior approach with hemilaminectomy was adopted. Type Ⅱ: The tumor involved both inside and outside the intervertebral foramen, with a wide range of growth. The posterior approach of individualized laminectomy+internal fixation was adopted. Type Ⅲ: The main part of the tumor was located outside the intervertebral foramen or the tumor was located at the C1-2 level. The lateral approach was adopted. Different types were treated with corresponding surgical methods to achieve the goal of one-stage total tumor resection. After operation, the clinical effects of neurological impairment symptom improvement, tumor recurrence and internal fixation related complications were evaluated, then the guiding value of this classification in clinical practice was analyzed. Results Among the 84 patients, 10 were type Ⅰ, 40 were type Ⅱ, and 34 were type Ⅲ. All achieved the goal of one-stage total resection, no intraoperative vertebral artery injury. Schwannoma was the most common postoperative pathological diagnosis in 70 cases(83.3%). Preoperative McCormick spinal cord function score was performed in 33 patients with grade Ⅰ, 43 with grade Ⅱ, 7 with grade Ⅲ, and 1 with grade Ⅳ. The follow-up time was from 6 to 40 months, with an average of 18 months. During the follow-up period, the symptoms of neurological impairment such as pain and weakness were relieved to varying degrees in 43 patients. The clinical symptoms of 29 patients did not change compared with those before operation. Twelve asymptomatic patients showed no new neurological impairment. At the last follow-up, the McCormick spinal cord function score of all patients was better than that before operation(69 cases with grade Ⅰ, 13 cases with grade Ⅱ, 2 cases with grade Ⅲ and 0 case with grade Ⅳ) (P<0.001). During the follow-up period, there was no tumor recurrence, no cervical instability or deformity, and no complications such as loosening, shedding or breaking of fixation materials occurred in type Ⅱ patients. Conclusions The new “three-classification” system is helpful to guide the formulation of surgical plan. It takes into account the stability of the spine while performing one-stage total tumor resection, which is more simple and practical.
Key words: cervical intraspinal and extraspinal communicating tumor; tumor classification; one-stage complete cut; surgical method
作者单位:400016 重庆,重庆医科大学附属第一医院神经外科(李洋,晏怡);重庆医科大学附属璧山医院(重庆市璧山区人民医院)神经外科(李洋,邹福建,邓雷,薛军,蒋登志,徐忠烨)
通信作者:晏怡
椎管内外沟通性肿瘤是椎管肿瘤的一种特殊且常见的类型,肿瘤通过椎间孔生长至椎管内外,多为良性,手术全切是该疾病唯一有效的治疗方法;其中发生于颈段的椎管内外沟通性肿瘤,因其涉及颈部大血管、颈脊髓、臂丛神经、颈椎侧方小关节等重要结构,手术需要面临全切率和脊柱稳定性两个难题,一期全切有一定难度和风险[1]。多入路分期手术或肿瘤切除后常规行颈椎后路固定融合可以部分解决上述难题,但将会增加患者手术创伤和费用[1-2]。一直以来,很多学者提出了各种不同的分型系统来协助指导椎管内外沟通性肿瘤的手术治疗,但至今在这一领域尚未达成共识,既无统一的分型标准,手术入路及方式的选择依据也各有主张[2-6]。结合自身临床实践,本研究提出了新的颈椎管内外沟通性肿瘤分型,并将其应用于临床,对不同分型的肿瘤病例采用不同的手术策略,从而可在关注全切率和脊柱稳定性的前提下,达到一期全切除肿瘤的目的。本研究对重庆医科大学附属第一医院神经外科2016年1月—2021年1月收治的84例依据新的颈椎管内外沟通性肿瘤分型进行手术治疗的患者的诊疗过程进行回顾性分析,为此类肿瘤患者的一期手术全切提供了个性化解决方案。
1 资料与方法
1.1 一般资料 共纳入84例进行一期手术治疗的颈椎管内外沟通性肿瘤患者,其中男39例,女45例;年龄15~76岁,平均年龄约47岁。主要临床症状以感觉障碍最常见,30例表现为不同程度肢体麻木,上肢为主;其次为疼痛,27例存在颈肩疼痛,部分伴患侧上肢放射痛;也有运动障碍表现,15例出现不同程度肢体乏力感,其中11例出现患侧上肢肌力下降,4例出现步态不稳;还有12例因无症状包块或检查发现病变入院;无大小便功能障碍患者。所有患者术前常规行颈椎MRI增强、颈部CTA及颈椎CT三维重建。肿瘤位于颅颈交界区3例,C1-2 28例,C2-316例,C3-412例,C4-56例,C5-65例,C6-74例,累及2~4个椎体节段10例,包括颈胸交界区5例。纳入标准:(1)术前诊断颈椎管内外沟通性肿瘤明确;(2)依据新的“三分型”制定手术治疗策略;(3)术前及随访影像学资料完整。排除标准:(1)术前合并脊柱不稳或畸形;(2)二次或多次手术。所有患者或家属均签署知情同意书。
1.2 肿瘤分型 在Toyama分型基础上,本研究根据肿瘤大小、位置及生长范围,将颈椎管内外沟通性肿瘤分成 3型 4类。(1)Ⅰ型:肿瘤主体位于椎管内及椎间孔区,包括Toyama分型中的Ⅰ型、Ⅱa型、Ⅲa型、Ⅳ型及Ⅴ型;(2)Ⅱ型:肿瘤涉及椎间孔内外,生长范围广,包括Toyama分型中的Ⅱb型、Ⅲb型及Ⅵ型;(3)Ⅲ型:肿瘤主体位于椎间孔外,定义为Ⅲa型,与Toyama分型中的Ⅱc型类似;同时考虑到C1、C2水平解剖结构的特殊性,定义肿瘤位于C1-2水平此特殊位置为Ⅲb型,此类肿瘤在Toyama分型中被遗漏。
1.3 手术方式 根据肿瘤分型采用相应的手术方式。Ⅰ型:采取经后入路切除患侧半椎板,不破坏关节突,不行内固定;Ⅱ型:采取经后入路个体化椎板切除,关节突关节切除打开椎间孔,同期行颈椎内固定;Ⅲ型:采取侧方入路术式。见表1。
1.4 手术过程 所有手术均行气管内插管全麻。(1)Ⅰ型:患者取俯卧位,根据C臂定位作肿瘤对应节段后正中直切口,剥离并推开患侧椎旁肌,显露椎板、关节突,用超骨刀配合咬骨钳去除患侧半椎板显露肿瘤(必要时可咬除少许关节突),肿瘤通常有包膜,切开肿瘤包膜,包膜内分块切除椎间孔内及椎管内肿瘤,注意保护硬脊膜和神经根,若椎管内部分腫瘤位于硬脊膜下,应打开硬脊膜,切除肿瘤后严密缝合或修补硬膜,防止脑脊液漏。术区彻底止血,置入引流管,逐层缝合切口。打开硬脊膜的患者必须严密缝合肌肉,以防止脑脊液漏。(2)Ⅱ型:手术入路同Ⅰ型,先处理椎管内及椎间孔内肿瘤,部分患者若无法完全显露肿瘤,可通过咬除棘突根部的骨质甚至部分棘突及对侧椎板,切除黄韧带,适当倾斜手术床等方法以便暴露肿瘤。关节突关节切除打开患侧椎间孔,再沿椎间孔内肿瘤向椎旁追踪,严格包膜下切除肿瘤,避免损伤静脉丛引起出血,更有利于避免损伤椎动脉。包膜内切除肿瘤过程中,肿瘤体积缩小后肿瘤边界将逐渐显露,小心分离肿瘤包膜与周围组织粘连,直至全切除肿瘤,特别注意保护椎动脉。因对后柱稳定性破坏较大,同期行后路钉棒内固定术。术区彻底止血,置入引流管,逐层缝合切口。(3)Ⅲ型:患者取侧卧位,行患侧乳突下颈部肿瘤水平侧方纵行切口,分离胸锁乳突肌、颈夹肌、颈脊肌、斜角肌等颈部肌群。对Ⅲa型,在肌间隙中即可显露并切除肿瘤,如有需要再经扩大的椎间孔显微切除椎间孔内部分;对Ⅲb型,通过寰椎后弓与枢椎之间宽大的椎板间隙进入,必要时暴露并去除部分寰椎后弓、C2半椎板,注意保护椎动脉。显露肿瘤后切开包膜,包膜内分块切除肿瘤,缩小瘤体后分离肿瘤边界;若发现明确载瘤神经无法分离则予以切断,显微镜下小心分离肿瘤与脊髓和神经根粘连,完整切除肿瘤,修补硬脊膜破损,术区确切止血后逐层关闭切口。所有手术均在神经电生理监测下进行;术后使用头孢曲松预防感染治疗3 d,术后1~2 d内视引流量情况拔除引流管;术后建议患者佩戴颈托2~3个月。
1.5 评价方法 采用McCormick脊髓功能评分来评估患者神经功能损害情况。McCormick脊髓功能评分共分为4级[7-8]。(1)Ⅰ级:神经功能正常,轻度局灶功能缺损,但不影响肢体的功能,轻度痉挛或反射异常,步态正常;(2)Ⅱ级:感觉运动缺损影响肢体功能,轻度到重度步态困难,严重的疼痛影响患者生活质量,但仍能独立行走;(3)Ⅲ级:稍严重的神经功能缺损,需要轮椅或拐杖/支具行走或双上肢功能损害,能够或不能够独立活动;(4)Ⅳ级:严重的神经功能缺损,需要轮椅或拐杖/支具行走,伴双上肢功能损害,不能独立活动。术前McCormick脊髓功能评分通过收集分析患者住院病历资料来获得,采用微信、电话联系等方式获得患者随访McCormick脊髓功能评分。
肿瘤完全切除的标准为术中显微镜下达到肿瘤全切及术后1周内复查增强MRI检查提示肿瘤无残留,通过住院及门诊复诊所行MRI影像资料来评估患者有无肿瘤复发。脊柱畸形和稳定性评价方法是收集住院及门诊复诊所进行影像学检查资料,从而评估患者脊柱稳定性及有无内固定相关并发症情况。通过手术前后颈椎正侧位或过伸、过屈侧位X线片分析,将颈椎不稳[9]定义为相邻节段成角>10°,或椎体动态滑移≥3 mm。
1.6 统计学分析 采用SPSS 22.0软件分析处理数据,计数资料以例数和百分比表示。对术前及随访McCormick脊髓功能评分进行配对样本比较的Wilcoxon符号秩和检验,以P<0.05认为差异有统计学意义。
2 结 果
2.1 McCormick脊髓功能评分 84例患者术前的McCormick脊髓功能评分Ⅰ级33例,Ⅱ级43例,Ⅲ级7例,Ⅳ级1例。随访时间6~40个月,平均18 个月,末次随访时所有患者的McCormick脊髓功能评分Ⅰ级69例,Ⅱ级13例,Ⅲ级2例,Ⅳ级0例,优于术前,差异有统计学意义(P<0.001)。见图1。
2.2 临床疗效 84例患者中,Ⅰ型患者10例均采取后入路半椎板术式,Ⅱ型患者40例均采取后入路个体化椎板切除+内固定术式,Ⅲ型患者34例均采取侧方入路术式,术中均未发生椎动脉的损伤。依据术中显微镜下所见及术后1周内复查增强MRI检查判断肿瘤切除情况,84例患者均完成一期全切手术治疗目标。病理诊断结果显示,70例神经鞘瘤,7例脊膜瘤,2例神经纤维瘤,1例节细胞神经瘤,1例脂肪瘤,1例上皮样恶性外周神经鞘瘤,1例血管瘤及1例侵袭性B细胞非霍奇金淋巴瘤。
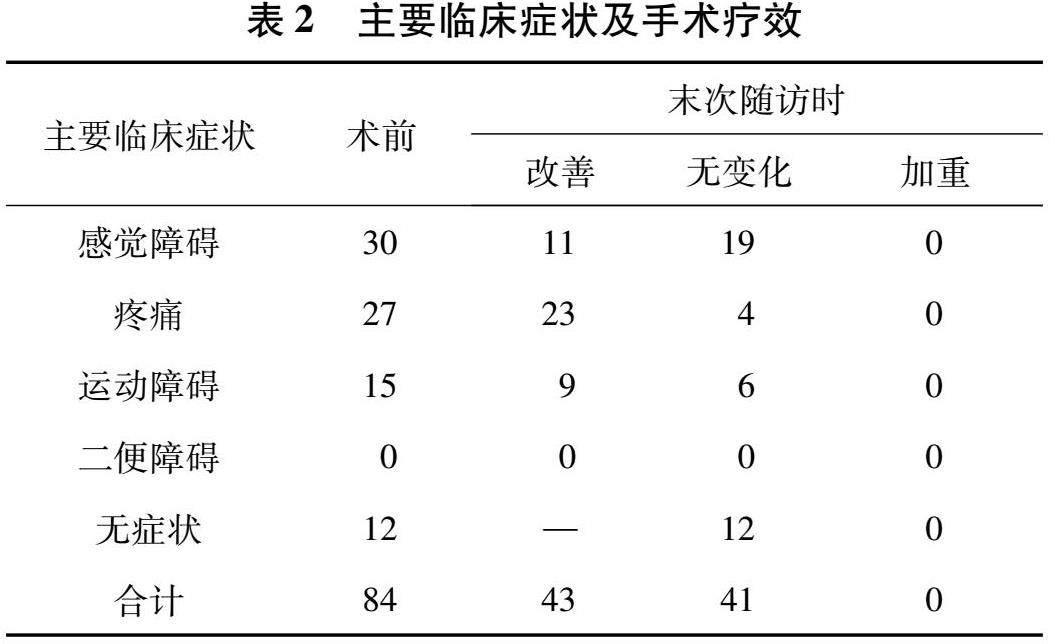
随访时间6~40个月,平均18 个月,随访期间未见肿瘤复发患者。43例患者麻木、疼痛及无力等神经功能损害症状均不同程度缓解,29例患者临床症状较术前无变化,12例无症状患者无新发神经功能损害症状(表2)。
2.3 脊柱稳定性 术后随访期间,84例患者均未出现颈椎不稳或畸形情况,其中Ⅱ型40例同期行颈椎后路内固定的患者,均未发生内固定材料松动、脱落或断裂等并发症。
2.4 典型病例
2.4.1 22号病例 患者男,46岁,因“右上肢疼痛麻木2个月”入院。术前颈椎MRI示,颈6-7椎管内及右侧椎间孔区占位性病变。分型为Ⅰ型,采取经后正中入路,颈6-7右侧半椎板切除,术中见肿瘤累及硬膜下,完整切除肿瘤。术后病理诊断为神经鞘瘤。术前McCormick评分为Ⅱ级,随访评分为Ⅰ级,右上肢疼痛麻木症状完全消失。术后随访未见颈椎不稳或畸形,复查MRI未见肿瘤复发(图2)。
2.4.2 14号病例 患者女,38岁,因“左上肢麻木3个月,加重伴乏力1个月”入院。术前颈椎MRI示,颈4-5左侧椎间孔区占位性病变,沟通椎管内外生长。分型为Ⅱ型,采取经后正中入路,颈4-5左侧半椎板及关节突关节切除,完整切除肿瘤后行颈4-6融合内固定术。术后病理诊断为神经鞘瘤。术前McCormick评分为Ⅱ级,随访评分为Ⅰ级,左上肢麻木、乏力症状完全消失。术后复查CT及X片,未见颈椎不稳或畸形,也未发生固定材料松动、脱落或断裂等;复查MRI未见肿瘤复发(图3)。
2.4.3 23号病例 患者男,56岁,因“反复颈部疼痛1+年”入院。术前颈椎MRI示,C2-3右侧椎间孔区及椎管外占位性病变。分型为Ⅲa型,采取侧方入路术式。术后病理诊断为神经鞘瘤。术前McCormick评分为Ⅱ级,随访评分为Ⅱ级,颈痛症状无明显变化。术后复查MRI未见肿瘤复发(图4)。
2.4.4 33号病例 患者女,65岁,因“发现左侧颈部包块6+年,双下肢麻木感1+月”入院。术前颈椎MRI示,C1-2椎体水平椎管内外沟通占位性病变,相应节段脊髓受压。分型为Ⅲb型,采取侧方入路术式。术后病理诊断为神经鞘瘤。术前McCormick评分为Ⅰ级,随访评分为Ⅰ级,麻木症状明显缓解。术后复查MRI未见肿瘤复发(图5)。
3 讨 论
颈椎管内外沟通性肿瘤因涉及頸部大血管、颈脊髓、臂丛神经、颈椎侧方小关节等重要结构,手术需要面临全切率和脊柱稳定性两个难题,一期全切有一定难度和风险[1]。本研究在手术治疗中需在关注全切率和脊柱稳定性的前提下,达到一期全切除肿瘤的目的,因此对颈椎管内外沟通性肿瘤进行分型具有非常重要的临床意义,这有利于制定最佳的手术治疗策略[2-3]。
目前颈椎管内外沟通性肿瘤的手术治疗方式多种多样,仍存在许多争议。很多研究提出了不同的分型系统来协助指导此类肿瘤的手术方式[2-6],其中2004年提出的Toyama分型是一种基于影像学(CT及MRI)和术中所见的三维分型方法,临床影响最广泛[3]。Toyama分型根据肿瘤横断面生长范围分为9种类型。(1)Ⅰ型:联系硬膜内、外的肿瘤,仅位于椎管内;(2)Ⅱ型:位于硬膜外,沿椎间孔生长沟通椎管内外,根据椎间孔外扩散程度分为a、b和c三种亚型:①Ⅱa型肿瘤不超出椎间孔,②Ⅱb型肿瘤超出椎间孔到达椎旁,③Ⅱc肿瘤位于椎间孔内及椎旁;(3)Ⅲ型,肿瘤存在于硬膜内、外,并沿椎间孔生长沟通椎管内外,若位于硬膜内、外及椎间孔内即为Ⅲa型,若位于硬膜内、外且超出椎间孔达椎旁即为Ⅲb型;(4)Ⅳ型,肿瘤位于硬膜外并向前侵入椎体内;(5)V型,肿瘤位于硬膜外并侵犯椎板到达椎板外;(6)Ⅵ型,肿瘤呈多方向骨侵蚀性生长。同时为显示肿瘤的纵向生长范围,根据累及椎间和横突孔的数目进行分期,根据累及椎间孔数量定义的IF分期:(1)Ⅰ期:累及1个椎间孔;(2)Ⅱ期:累及2个椎间孔;(3)Ⅲ期:累及3个或更多。根据累及横突孔数量定义的TF分期:(1)Ⅰ期:未累及横突孔;(2)Ⅱ期:累及1个横突孔;(3)Ⅲ期:累及2个及以上的横突孔。
Toyama分型比较关注硬脊膜、椎间孔等解剖标志,而C1、C2之间无椎间孔,因此更适用于确定位于C2水平以下的颈椎管内外沟通性肿瘤的手术策略。同时,本研究在临床实践中发现该分型过于繁琐细致,对手术方式的指导意义较模糊,不便于直观指导手术方案的制定。至今未能确定一个“金标准”式的分型系统指导临床手术决策,但基本的治疗原则是一致的,术前准确评估肿瘤大小、位置及生长范围有利于制定个体化的一期全切除手术方案。基于此理念,结合自身临床实践体会,本研究在Toyama分型基础上,提出将颈椎管内外沟通性肿瘤分成3型4类,并根据术前肿瘤分型选取相应的手术方式。
本研究提出的新分型重点关注椎间孔这一解剖结构,模糊了Toyama分型中对硬脊膜的关注,因为大多数情况下仅仅依据术前增强MRI等检查无法准确判断肿瘤是否生长至硬膜下。本研究以椎间孔为界限, 将颈椎管内外沟通性肿瘤主体分为椎间孔内、椎间孔外及跨过椎间孔内外生长三大类型,这样在术前更容易进行临床分型。从指导手术方案方面考虑,为达到全切肿瘤的目的,椎间孔内、外肿瘤大小是选择手术入路的首要考虑因素,而韧带、椎板及关节突关节等结构的破坏程度决定了脊柱稳定性的保护与重建方案,新分型在一期手术完全切除肿瘤的同时,兼顾了脊柱稳定性,可为最佳手术方案提供直接参考。本研究注意到寰椎后弓与枢椎之间存在宽大的椎板间隙,可以充分利用此生理间隙来切除肿瘤,同时C2棘突肌肉附着点对上颈椎稳定性有重要意义[9],因此新分型单独将C1-2水平此特殊位置的颈椎管内外沟通性肿瘤归为一种类型。总的来说,本研究的新分型更简洁,易于理解也更具手术方案指导价值,很方便临床决策。
颈椎管内外沟通性肿瘤的手术治疗首要目标为肿瘤全切除,在制定手术方案时需考虑达到较高的全切率。同时本研究也注意到,以往神经外科医师由于缺乏脊柱生物力学相关理论知识,在切除肿瘤时不注意保护脊柱的骨性结构,导致患者术后出现脊柱后凸或侧凸畸形,甚至造成脊髓二次压迫,不得不再次接受手术。即便患者肿瘤被完全切除,但由于脊柱稳定性未能重建,其神经症状依然无法解除,这大大影响了患者手术效果及生活质量。另一方面,并非所有肿瘤切除后都需要进行稳定性重建,过度的稳定性重建及内固定可使得手术过程中损伤椎动脉和神经根的风险增加,手术固定后颈椎运动功能受限,还可能加速邻近节段的退变。手术后患者也有可能出现断钉断棒、内固定脱位等严重并发症,需再次进行手术翻修,加重患者的痛苦和经济负担。目前对颈椎管内外沟通性肿瘤切除术后脊柱稳定性的重建与否以及方式缺乏统一的共识。虽然脊柱稳定性相关问题争议尚存,但是基本手术原则相同,需要在保证较高全切率的同时,注意脊柱稳定性的保护与重建。
首先注重脊柱稳定性的保护。根据著名的“Denis三柱”理论,对患者的生理解剖结构(包括肌肉软组织、韧带、骨性结构等)破坏越少就越有利于保护脊柱稳定性。半椎板技术十分符合此理念,该方式只分离患侧的肌肉和棘突,保留了棘突韧带复合体及对侧肌肉附着点,同时也保护对侧椎板、黄韧带及关节突关节的完整,显著减少了对生理解剖结构的损伤,保护了后柱稳定性。有报道表明,半椎板切除可以降低脊柱畸形的发生率,还能有效地降低脑脊液漏和术后感染的发生率,具有手术创伤小、术后恢复快、脊柱稳定性好、远期疗效好等显著优点,但暴露的操作空间有限,肿瘤切除不完整可能大,需要娴熟的显微外科技术[10]。本研究对Ⅰ型患者采用單纯半椎板切除,不行内固定,如果肿瘤少许延伸至椎间孔区域,可通过适当倾斜手术床等方法即可做到良好暴露肿瘤的同时保护颈椎稳定性;10例患者均达到全切,术后随访未见肿瘤残留及复发,脊柱稳定性良好。对肿瘤主体位于椎间孔外及C1-2水平肿瘤的34例Ⅲ型患者,采取侧方入路,通过颈部自然肌间隙,术中可以充分显露椎管外肿瘤,再经扩大的椎间孔显微切除椎间孔内部分,所有患者均达到全切目标;其中有部分Ⅲb型患者为了切除椎管内病变从侧方行半椎板切除,未破坏脊柱稳定性。
其次关注脊柱稳定性重建的问题。椎管内外沟通性肿瘤总是沿椎间孔生长,为了更好地暴露肿瘤达到全切,往往需要打开椎间孔,较大程度地破坏了关节突关节。有时半椎板切除无法完全显露肿瘤,可采取咬除棘突根部骨质甚至部分棘突及对侧椎板、切除黄韧带,适当倾斜手术床等方法适当扩大手术视野,必要时需行全椎板切除。Asazuma等[3]认为,对于Toyama分型中Ⅳ、Ⅵ型及IF 2期和3期的患者需要进行脊柱重建。既往有研究采用半椎板+单侧小关节切除未行内固定,随访未见颈椎畸形[11]。McCormick认为双侧椎板切除+单侧小关节切除术后应考虑内固定,单侧椎板+单侧小关节切除术不稳定的风险较小[12-13]。Huang等[14]建议当关节突关节切除超过50%时,应进行脊柱重建。Zdeblick等[15]的研究中,在切除超过50%的关节突关节后观察到不稳定。张科等[16]认为,术前脊柱稳定性已破坏、术前影像学检查显示椎体侵蚀过半或病变节段≥3个、手术过程中切开患侧小关节等情况下需同期行内固定。另一方面,长期以来常有椎管内外肿瘤切除后未行内固定重建脊柱稳定性,随访期间发生脊柱不稳甚至后凸畸形的病例报道[11,17-18]。尽管影响颈椎管内外沟通性肿瘤切除术后脊柱稳定性的因素较多,但目前绝大多数学者都支持在关节突关节完全破坏时,需要同期进行脊柱稳定性重建这一观点。本研究中,Ⅱ型患者肿瘤常常延伸到椎间孔外区域,需要小关节完全切除以实现肿瘤的可视化。因此对Ⅱ型患者采用的方式是全切除患侧关节突关节,打开椎间孔,切除部分或全部椎板,手术过程中获得了很好的手术视野,肿瘤暴露充分;40例患者均达到全切肿瘤的目标,全切率100%;同时Ⅱ型患者术中同期行颈椎后路内固定以重建脊柱稳定性,术后随访未见脊柱畸形,也未发生内固定材料松动、脱落或断裂情况。
后入路是最为经典的手术入路,大多数神经外科医师都已熟练掌握此入路。它具有创伤小、出血少及对周围邻近组织干扰小等优点,非常有利于处理椎管内肿瘤及硬脊膜。但存在较大椎动脉损伤风险,常不能完全暴露椎管外的肿瘤。Ⅰ型、Ⅱ型患者均需处理椎管内肿瘤,有时甚至需要处理硬膜下肿瘤;同时Ⅱ型患者需采用脊柱后路内固定系统重建脊柱稳定性,因此本研究对于Ⅰ型、Ⅱ型均采取后正中入路,共50例患者均达到肿瘤全切,所有手术中都未发生椎动脉的损伤。Asazuma等[3]认为,对于肿瘤局限于椎管和椎间孔的Toyama Ⅰ型、Ⅱa型和Ⅲa型患者,甚至肿瘤局限于椎体或椎板的Ⅳ型和V型患者,仅通过后路手术即可实现全切除。但有研究认为,单纯后路只能切除距离硬脊膜4 cm以内的椎管外肿瘤[4];也有研究报告,切除的最大距离可以超过4 cm[13]。本研究中,部分病例椎管外肿瘤超过4 cm,经后入路成功完成一期手术全切,因此,椎管外肿瘤可切除的最大范围取决于主刀医师的经验技巧及手术器械的运用,如包膜内分块切除、适当旋转患者体位、超声吸引器的使用等。
颈侧入路有利于椎间孔外肿瘤的切除,可以通过正常的肌肉间隙进入,开阔的视野便于辨识周围解剖结构,椎动脉损伤风险较低,有术式简单易行、损伤小、切口关闭时简单、伤口愈合快、术后恢复快等优点,且不需切除椎板,不影响术后稳定性,椎管打开范围小,术后较少出现脑脊液漏和皮下积液,但对椎管内肿瘤的切除十分不便[8]。本研究中对于Ⅲ型患者均采取侧方入路,可以充分利用组织间隙以达到显露并全切除肿瘤的目的[5,8-9],保证全切率的同时也保护了脊柱稳定性。尤其对于Ⅲb型,即C1-2水平椎管内外沟通性肿瘤,可以充分利用寰椎后弓与枢椎之间宽大的椎板间隙来切除肿瘤。林国中等[9]在研究中针对C1-2水平椎管内外沟通性肿瘤建议采取后入路,同样张科等[16]对7例C1-2哑铃型肿瘤患者均采取后正中入路,通过一侧 C1-2椎间隙或切除部分椎板骨质达到肿瘤全切除。但后入路在一定程度上会破坏对上颈椎稳定性有重要意义的C2棘突肌肉附着点,而采取侧方入路可以完全做到对C2棘突肌肉附着点的保护,更加有利于脊柱稳定性。
多方联合入路有利于全切巨大、生长范围广泛的肿瘤,但手术时间较长,将会造成更多创伤,术后并发症增多,住院时间及花费增加[1,3]。张杨等[19]对肿瘤生长范围涉及椎管内外且椎间孔外直径≥6 cm的肿瘤采取联合入路。Asazuma等[3]认为当肿瘤在椎动脉以外的椎间孔广泛生长时,如Toyama Ⅱb、Ⅱc、Ⅲb和Ⅵ型,需要前后联合入路。本研究依据“三分型”选取适合的手术入路,个体化椎板切除,必要时破坏小关节完全打开椎间孔可以达到全切肿瘤的目的,单一术式较前后联合入路大大减少了手术创伤、并发症及患者住院费用。
综上所述,本研究认为新的“三分型”可以用来指导手术方案的制定,在一期全切肿瘤的同时兼顾了脊柱稳定性,易于理解也更具实用价值,值得在临床上推广运用。
[参 考 文 献]
[1] Ozawa H,Kokubun S,Aizawa T,et al.Spinal dumbbell tumors:an analysis of a series of 118 cases[J].J Neurosurg Spine,2007,7(6):587-593.
[2] Sridhar K,Ramamurthi R,Vasudevan MC,et al.Giant invasive spinal schwannomas:definition and surgical management[J].J Neurosurg,2001,94(2 Suppl):210-215.
[3] Asazuma T,Toyama Y,Maruiwa H,et al.Surgical strategy for cervical dumbbell tumors based on a three-dimensional classification[J].Spine(Phila Pa 1976),2004,29(1):E10-E14.
[4] Liu T,Liu H,Zhang JN,et al.Surgical strategy for spinal dumbbell tumors:a new classification and surgical outcomes[J].Spine(Phila Pa 1976),2017,42(12):E748-E754.
[5] 陈海锋,李丹,王跃龙,等.颈椎哑铃型肿瘤的临床分型及手术入路的选择[J].中华医学杂志,2014,94(19):1444-1447.
[6] 范涛,赵新岗,孙鹏,等.显微手术结合脊柱内固定技术治疗椎管内外沟通性肿瘤(附129例报告)[J].中华神经外科杂志,2013,29(9):871-875.
[7] 李德志,王贵怀.McCormick脊髓肿瘤患者脊髓功能分级[J].中华神经外科杂志,2012,28(6):645.
[8] 钱海鹏,万经海,李学记,等.颈侧入路切除颈部椎管内外哑铃形神经源性肿瘤[J].中华外科杂志,2012,50(12):1091-1095.
[9] 林国中,马长城,王振宇,等.颈1-2硬膜外神经鞘瘤的显微微创治疗[J].北京大学学报(医学版),2021,53(3):586-589.
[10]Lei DQ,Zhou YC,Yao DX,et al.Efficacy of unilateral hemilaminectomy for intraspinal tumor resection:a systematic review and meta-analysis[J].Ann Palliat Med,2021,10(2):984-999.
[11]Nakamura M,Iwanami A,Tsuji O,et al.Long-term surgical outcomes of cervical dumbbell neurinomas[J].J Orthop Sci,2013,18(1):8-13.
[12]McCormick PC.Surgical management of dumbbell tumors of the cervical spine[J].Neurosurgery,1996,38(2):294-300.
[13]谢京城,王振宇,马长城,等.半椎板-小关节突切除术后颈椎稳定性的研究[J].中华神经外科杂志,2011,27(9):885-889.
[14]Huang Y,Wang ZW,Chen Z,et al.Posterior hemi-/laminectomy and facetectomy approach for the treatment of dumbbell-shaped schwannomas in the subaxial cervical spine:a retrospective study of 26 cases[J].Eur Neurol,2017,78(3-4):188-195.
[15]Zdeblick TA,Abitbol JJ,Kunz DN,et al.Cervical stability after sequential capsule resection[J].Spine(Phila Pa 1976),1993,18(14):2005-2008.
[16]張科,王先祥,张义泉,等.颈椎管哑铃型肿瘤个体化手术策略分析[J].中国现代神经疾病杂志,2022,22(8):680-686.
[17]Wang PB,Ma K,Chen TN,et al.Risk factor analysis for progressive spinal deformity after resection of intracanal tumors─a retrospective study of 272 cases[J].BMC Neurol,2020,20(1):34.
[18]Tatter C,Fletcher-Sandersj A,Persson O,et al.Incidence and predictors of kyphotic deformity following resection of cervical intradural tumors in adults:a population-based cohort study[J].Acta Neurochir(Wien),2020,162(11):2905-2913.
[19]张杨,薛兴森,何光建,等.基于一期全切除策略的椎管内外沟通性肿瘤手术新分型(附133例临床分析)[J].临床神经外科杂志,2020,17(4):361-365.
(收稿2022-10-04 修回2022-10-30)
