伊马替尼减轻大鼠蛛网膜下腔出血后早期脑损伤的作用研究
2023-04-29韩雨薇王晨辰梁国标李晓明
韩雨薇 王晨辰 梁国标 李晓明
【摘要】 目的 探讨伊马替尼对大鼠蛛网膜下腔出血(SAH)后早期脑损伤(EBI)的影响及其可能的作用机制。方法 采用颈内动脉穿刺法构建SAH模型,Sprague-Dawley雄性大鼠分为假手术组、模型组和伊马替尼给药组。SAH模型制作30 min后,腹腔注射一次给予伊马替尼50 mg/kg。24 h后对出血情况,神经功能评分,平衡木评分,脑水肿和伊文思蓝渗出进行考察;Western blot考察过氧化物酶体增殖物激活受体γ(PPARγ),Toll样受体4(TLR4),白细胞介素-1β(IL-1β)和肿瘤坏死因子α(TNF-α)的表达量;TUNEL染色考察凋亡的情况。结果 实验结果表明伊马替尼能够显著减轻SAH后的神经损伤和脑损伤。在SAH大鼠模型中,伊马替尼给药显著增加PPARγ表达,抑制TLR4及炎症因子TNF-α,IL-1β的表达从而抑制细胞凋亡的发生。结论 伊马替尼能够激活PPARγ,从而抑制炎症反应减轻SAH后的EBI。
【关键词】 伊马替尼;蛛网膜下腔出血;PPARγ;炎症
【中图分类号】 R965;R651 【文献标志码】 A 【文章编号】 1672-7770(2023)01-0057-05
Abstract: Objective To explore the effect of imatinib on early brain injury(EBI) after subarachnoid hemorrhage(SAH) in rats. Methods The SAH model was established by internal carotid artery puncture. Sprague-Dawley male rats were divided into sham operation group, model group and imatinib administration group. After the SAH model was made for 30 minutes 50 mg/kg of imatinib was given by intraperitoneal injection. After 24 hours, hemorrhage, neurological function score, balance beam score, cerebral edema and Evans blue exudation were investigated. Western blot examined the peroxisome proliferator activated receptors γ(PPARγ), toll-like receptor 4(TLR4), interleukin-1 beta(IL-1β) and tumor necrosis factor(TNF-α). TUNEL staining was used to investigate apoptosis. Results The results showed that imatinib can significantly reduce nerve injury and brain injury after SAH. In the SAH rat model, imatinib administration significantly increased the expression of PPARγ and inhibited the expressions of TLR4 and inflammatory factors TNF-α and IL-1β, thereby inhibiting the occurrence of apoptosis. Conclusion Imatinib can activate PPARγ to inhibit inflammatory reaction and alleviate EBI after SAH.
Key words: imatinib; subarachnoid hemorrhage; PPARγ; inflammation
基金項目:国家自然科学基金面上项目(81971133);沈阳市科技计划项目(20-205-4-098);中国博士后面上基金(2020M673679)
作者单位:110016 沈阳,北部战区总医院神经外科
通信作者:李晓明
蛛网膜下腔出血(subarachnoid hemorrhage,SAH)是一种病死率高、致残率高的危重疾病,并且SAH患者的预后很差[1-2]。早期脑损伤(early brain injury,EBI)被认为是SAH患者预后不良的主要原因之一。在EBI过程中,动脉瘤破裂可导致颅内压升高、脑血流量减少和全脑缺血,这些生理变化导致血脑屏障破坏、神经炎症、氧化反应和随后的细胞死亡[3]。其中,炎症和细胞凋亡被认为是SAH后EBI的主要原因[4]。
过氧化物酶体增殖物激活受体γ(PPARγ)属于核激素受体超家族,在中枢神经系统发挥抗炎作用[5]。已有报道表明,PPARγ在调节炎症和免疫反应以及保护细胞凋亡和氧化应激方面具有重要作用[5-7]。PPAR-γ激动剂在中风、阿尔茨海默病、感染、脊髓损伤和创伤性脑损伤等神经炎症性疾病中的治疗潜力受到特别关注[8-12]。 PPARγ激活剂伊马替尼(imatinib),一种被批准用于治疗慢性粒细胞白血病和其他恶性肿瘤的抗肿瘤药物[13]。有报道称,PPARγ激活剂伊马替尼抑制Tenascin-C表达预防大鼠SAH后脑血管痉挛[14],但伊马替尼在SAH后EBI中仍未见报道。因此,本研究将讨论PPARγ激动剂伊马替尼是否对大鼠SAH后的EBI有保护作用。此外,本研究将讨论伊马替尼可能的保护机制。
1 材料与方法
1.1 材料 伊马替尼(北京诺华公司),二甲基亚砜(DMSO,美国Sigma公司),PPARγ,NF-κB,IL-β,TNF-α(美国Cell Signaling Technology公司),TLR4,β-actin(美国Santa Cruz Biotechnology公司),BCA蛋白定量试剂盒,蛋白酶磷酸酶抑制剂,RIPA裂解液,SDS-PAGE凝胶配制试剂盒,ECL化学发光试剂盒,5×loading buffer(碧云天生物技术公司)。IL-β和TNF-α ELISA试剂盒(南京建成生物技术有限公司)。
1.2 实验动物及分组给药 实驗动物符合美国国立卫生研究院于1996年出版的《National Institutes of Health Guide for the Care and Use of Laboratory Animals》。Sprague Dawley雄性大鼠,8周,购自北部战区总医院实验动物中心(中国沈阳),实验动物合格证号0005095。恒温,给予充足食物和水。大鼠随机分为3组,每组30只:假手术组(Sham),模型组(SAH),模型+伊马替尼(imatinib)。SAH模型制作30 min后,腹腔注射给予伊马替尼50 mg/kg[14]。
1.3 模型制作 每只动物腹腔注射戊巴比妥钠40 mg/kg麻醉。从颈外动脉残端向左侧颈内动脉插入一条锐化的4-0单丝尼龙线,穿透左侧大脑前动脉和大脑中动脉的分叉处。假手术大鼠接受相同的手术,只是在没有穿刺的情况下拔除缝线。
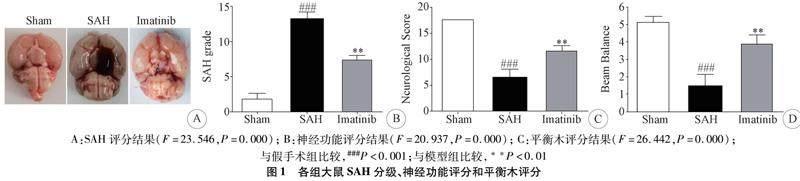
1.4 SAH严重程度评分 如前所述,将基底池分为6个节段,根据蛛网膜下腔出血量将每个节段划分为0~3级。通过将分数相加,得到的总分从0~18不等[15]。
1.5 神经功能评分 采用两种方法对神经功能缺损进行盲法评估。评估由六个测试组成,分数可以是0~3或1~3。这六项测试包括:自发活动,0分:不活动;1分:仅可移动;2分:能触壁,不到3面;3分:自由运动,触到笼子至少3面;四肢运动的对称性,0分:肢体不能运动;1分:肢体极度无力,仅有轻微活动;2分:肢体无力,运动迟缓;3分:四肢对称,与正常无差异;前爪伸展,0分:无动作;1分:仅有轻度伸展;2分:较正常差;3分:同SAH前;攀登,1分:不能攀爬,滚下;2分:攀爬困难;3分:爬行容易,抓笼有力;身体本体感觉,1分:无反应;2分:仅有轻微反应;3分:迅速转头,对侧对称;对胡须刺激的反应,1分:无反应;2分:轻微反应;3分:双侧对称反应。最高分为18分,最低分为3分。分数越高,功能越强[15]。平衡木测试研究了动物在狭窄的木梁(2.25)上行走60秒的能力:四分,行走≥20 cm;三分,20 cm≥行走≥10 cm;两分,行走≥10 cm但坠落;一分,行走10 cm;零分,行走10 cm以内坠落。计算5分钟内连续三次试验的最高得分[16]。分数越高,表明这两种方法的功能都更强。
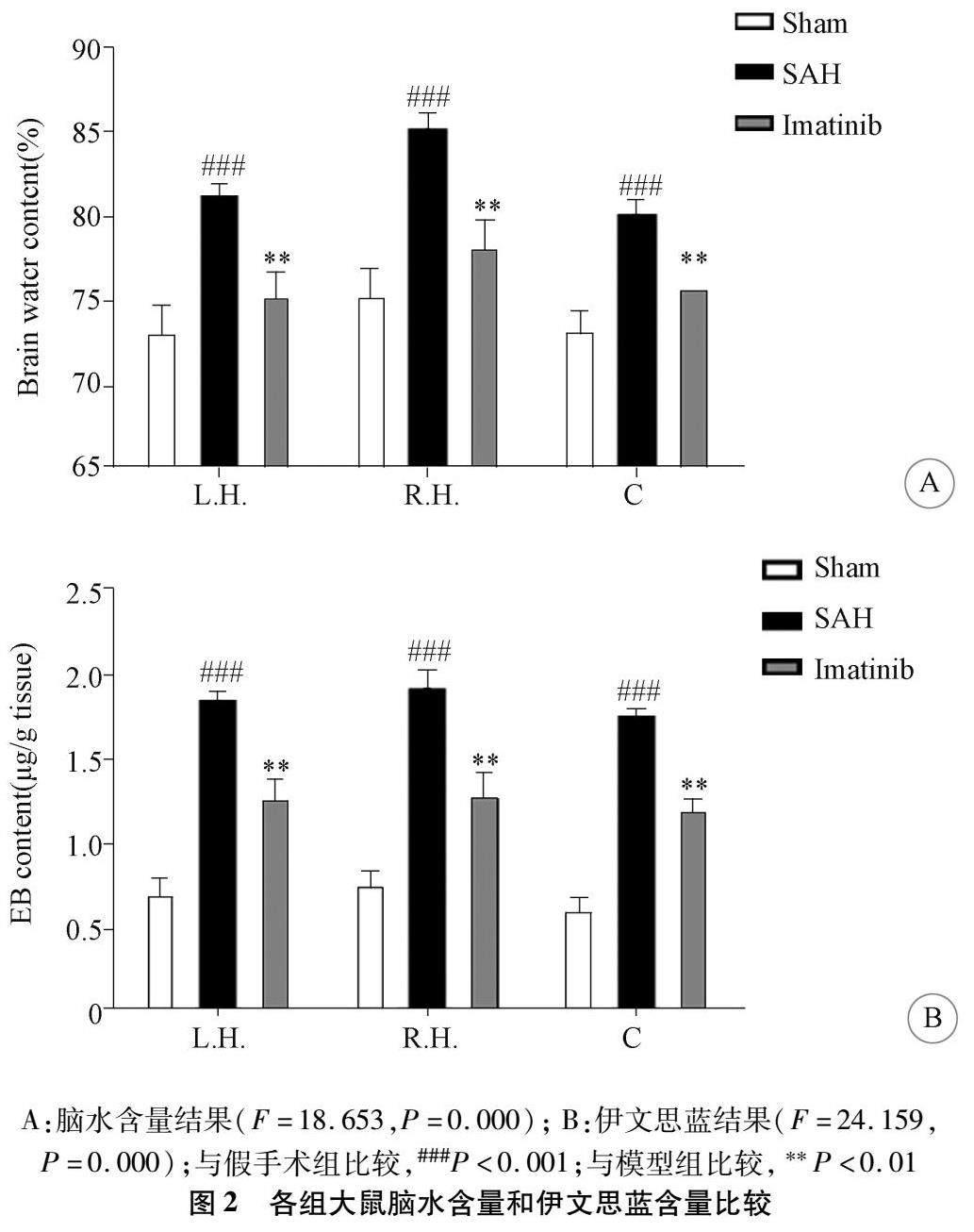
1.6 脑水含量 脑水含量通过湿重/干重方法进行评估[17]。迅速收集大脑并将其分为左右半球及小脑。所有样品立即称量以获得湿重,并在105 ℃下脱水72 h后再次称重以获得干重。计算每个标本的脑含水量为(湿重-干重)/湿重×100%。
1.7 伊文思蓝检测 通过伊文思蓝外渗试验评估血脑屏障的血脑屏障渗透性[18]。在SAH后23 h,麻醉大鼠左侧股静脉注射伊文思蓝染料(2%;5 mL/kg)。取脑左右半球及小脑。称重后浸泡在甲酰胺中(10 mL/g),60 ℃孵育,用分光光度计测量渗出物在620 nm处的吸光度。
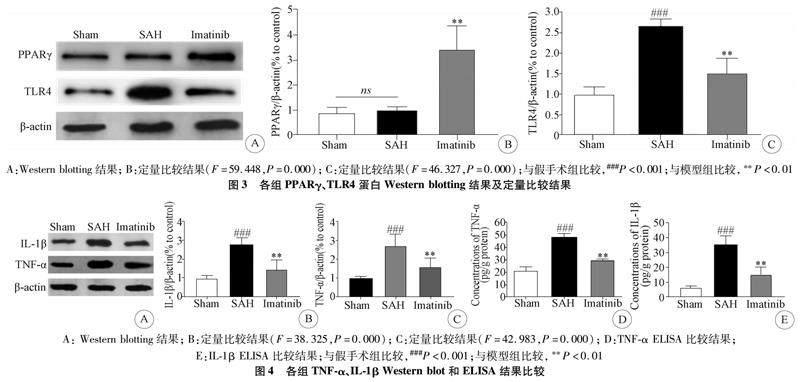
1.8 Western blot检测 脑组织用RIPA裂解液裂解提取蛋白,并用BCA试剂盒检测蛋白浓度。等量的蛋白质(60 μg)在SDS-聚丙烯胺上电泳并转移到PVDF膜上,5%BSA封闭,然后与一抗在4 ℃下孵育过夜PPARγ(1∶400),TLR4(1∶200),NF-κB(1∶400),β-actin(1∶200)。在室温下与对应的二抗兔抗和鼠抗孵育1 h,用ECL化学发光试剂盒显影,并用Image J定量分析。
1.9 TUNEL染色 在SAH后24 h将大鼠深度麻醉,并向心内灌注60 mL冰冷的PBS和60 mL 10%的多聚甲醛。收集全脑,然后在10%多聚甲醛中固定24 h,然后在30%蔗糖溶液中固定72 h。在-80 ℃下冷冻后,将大脑切成4 μm厚的冠状切片。将脑切片PBS洗3次每次10 min,含0.3%TritonX-100的5%BSA封闭1 h。加入对应的TUNEL检测液37 ℃避光孵育1 h。抗体荧光显微镜(尼康)拍照。
1.10 统计学分析 所有数据以Mean±S.E.M.表示,使用SPSS 19.0对数据进行统计分析。对所有数据进行单因素方差分析,然后进行Tukey检验进行多重比较。以P<0.05认为差异具有统计学意义。
2 结 果
2.1 伊马替尼对SAH评分和神经功能评分的影响SAH 24 h后,对SAH出血程度进行评分。评分结果显示,模型组评分显著增加出血严重,伊马替尼给药后能够明显减轻SAH的出血情况,降低SAH评分(图1B)。与假手术组相比,SAH后神经功能评分和平衡木评分明显受损,而伊马替尼给药可显著改善SAH后神经学评分(图1C-D)。
2.2 伊马替尼对SAH后脑水肿和血脑屏障的影响与假手术组相比,SAH后脑含水量增加,伊马替尼能够降低脑含水量(图2A)。为了评估血脑屏障的完整性,静脉注射伊文思蓝,并对渗出量进行检测。结果表明伊马替尼能够降低SAH后伊文思蓝的渗出量(图2B),改善血脑屏障。
2.3 伊马替尼对SAH后PPARγ和TLR4表达量的影响 Western blot结果显示,与假手术组相比,SAH后PPARγ表达量无显著变化,而伊马替尼给药能够显著增加PPARγ的表达(P<0.05)。SAH后TLR4表达显著上调,而伊马替尼给药能够降低TLR4的表达量。
2.4 伊马替尼对SAH后炎症因子TNF-α和IL-1β的表达影响 本研究采用Western blot和ELISA方法检测炎症因子TNF-α和IL-1β的表达情况,Western blot和ELISA均显示SAH后,炎症因子TNF-α和IL-1β的表达量增加,而伊马替尼给药能够抑制SAH诱导的TNF-α和IL-1β的表达(图4)。
2.5 伊马替尼对SAH后细胞凋亡的影响 本研究利用TUNEL染色考察了伊马替尼对SAH后细胞凋亡的影响。SAH后TUNEL阳性细胞数目增加,伊 马替尼给药减少了TUNEL阳性细胞数目,抑制了细胞凋亡的发生(图5)。
3 讨 论
伊马替尼是一种被批准用于治疗慢性粒细胞白血病和其他恶性肿瘤的抗肿瘤药物[13]。它抑制几种酪氨酸激酶,包括PDGFR-α,并且已经被证明可以减轻缺血性中风和纤溶酶原激活剂治疗后的脑水肿[19]。此外,伊马替尼联合抑制PDGFR-α在脑出血小鼠模型中改善了血脑屏障的完整性[20]。然而,伊马替尼在SAH中的作用及作用机制尚未阐明。因此,本研究将讨论伊马替尼在SAH中的作用以及其可能的作用机制。
本研究中,为了检测伊马替尼对SAH后EBI的影响,对神经功能评分、脑水肿和伊文思蓝渗出率进行考察。结果发现,伊马替尼给药能够显著改善脑含水量和血脑屏障功能,并且提高神经功能评分。说明伊马替尼对SAH后EBI具有保护作用。另外,为了检测伊马替尼保护SAH后EBI的作用机制,本研究对PPARγ、TLR4、TNF-α和IL-1β的表达进行了考察。观察到伊马替尼给药后PPARγ表达增加,TLR4表达减少,抑制炎症因子TNF-α和IL-1β的表达。此外,采用了ELISA方法检测了TNF-α和IL-1β的表達量,伊马替尼抑制炎症因子TNF-α和IL-1β的表达。为了进一步阐明伊马替尼对SAH后细胞凋亡的影响,进行了TUNEL染色。染色结果说明,伊马替尼能够抑制SAH后的细胞凋亡。以上实验结果表明,PPARγ激活对SAH后EBI具有保护作用,伊马替尼可能通过上调PPARγ减少TLR4的表达从而抑制炎症反应发挥抗凋亡作用。
目前的研究有几个局限性。首先,没有考察SAH后72 h的脑水肿和神经功能缺损情况,这个时间点的变化情况有待被研究。其次,SAH后的血脑屏障通透性和脑水肿程度可以用更具创新性的方法来评估,例如磁共振成像。
综上所述,伊马替尼通过激活PPARγ减少TLR4的表达抑制SAH后炎症和凋亡的发生,维持血脑屏障的完整性。虽然伊马替尼保护SAH后EBI的作用机制仍需进一步阐明,但本研究认为靶向PPARγ可能是改善SAH后EBI的关键策略。
[参 考 文 献]
[1]Muehlschlegel S.Subarachnoid hemorrhage[J].Continuum(Minneap Minn),2018,24(6):1623-1657.
[2]余志强,赵金兵,周新建,等.蛛网膜下腔出血后早期脑损伤的研究进展[J].临床神经外科杂志,2022,19(1):117-120.
[3]He RY,Du YW,Ling LB,et al.Nanoformulation of dual bexarotene-tailed phospholipid conjugate with high drug loading[J].Eur J Pharm Sci,2017,100(1):197-204.
[4]Mo J,Enkhjargal B,Travis ZD,et al.AVE 0991 attenuates oxidative stress and neuronal apoptosis via Mas/PKA/CREB/UCP-2 pathway after subarachnoid hemorrhage in rats[J].Redox Biol,2019,20(1):75-86.
[5]Christofides A,Konstantinidou E,Jani C,et al.The role of Peroxisome Proliferator-Activated Receptors(PPAR) in immune responses[J].Metabolism,2021,114(1):154338.
[6]Cheng F,Si XM,Yang GL,et al.Relationship between PPAR-γ gene polymorphisms and ischemic stroke risk:a meta-analysis[J].Brain Behav,2021,11(12):e2434.
[7]Zhang GF,Wang H,Zhang QX,et al.Bergenin alleviates H2O2-induced oxidative stress and apoptosis in nucleus pulposus cells:involvement of the PPAR-γ/NF-κB pathway[J].Environ Toxicol,2021,36(12):2541-2550.
[8]Shehata AHF,Ahmed ASF,Abdelrehim AB,et al.The impact of single and combined PPAR-α and PPAR-γ activation on the neurological outcomes following cerebral ischemia reperfusion[J].Life Sci,2020,252(7):117679.
[9]Wójtowicz S,Strosznajder AK,Jez·yna M,et al.The novel role of PPAR alpha in the brain:promising target in therapy of Alzheimer's disease and other neurodegenerative disorders[J].Neurochem Res,2020,45(5):972-988.
[10]Huang W,Eum SY,András IE,et al.PPARalpha and PPARgamma attenuate HIV-induced dysregulation of tight junction proteins by modulations of matrix metalloproteinase and proteasome activities[J].FASEB J,2009,23(5):1596-1606.
[11]Chen YM,Wang BL,Zhao H.Thymoquinone reduces spinal cord injury by inhibiting inflammatory response,oxidative stress and apoptosis via PPAR-γ and PI3K/Akt pathways[J].Exp Ther Med,2018,15(6):4987-4994.
[12]Yi JH,Park SW,Brooks N,et al.PPARgamma agonist rosiglitazone is neuroprotective after traumatic brain injury via anti-inflammatory and anti-oxidative mechanisms[J].Brain Res,2008,1244(9):164-172.
[13]Peggs K,Mackinnon S.Imatinib mesylate—the new gold standard for treatment of chronic myeloid leukemia[J].N Engl J Med,2003,348(11):1048-1050.
[14]Shiba M,Suzuki H,Fujimoto M,et al.Imatinib mesylate prevents cerebral vasospasm after subarachnoid hemorrhage via inhibiting tenascin-C expression in rats[J].Neurobiol Dis,2012,46(1):172-179.
[15]Sugawara T,Ayer R,Jadhav V,et al.A new grading system evaluating bleeding scale in filament perforation subarachnoid hemorrhage rat model[J].J Neurosci Methods,2008,167(2):327-334.
[16]Wang YP,Wang JK,Zuo YC,et al.Elevation of CSF sortilin following subarachnoid hemorrhage in patients and experimental model rats[J].Neuroscience,2021,470(7):23-36.
[17]Han YW,Tong ZH,Wang CC,et al.Oleanolic acid exerts neuroprotective effects in subarachnoid hemorrhage rats through SIRT1-mediated HMGB1 deacetylation[J].Eur J Pharmacol,2021,893(2):173811.
[18]Han YW,Liu XJ,Zhao Y,et al.Role of oleanolic acid in maintaining BBB integrity by targeting p38MAPK/VEGF/Src signaling pathway in rat model of subarachnoid hemorrhage[J].Eur J Pharmacol,2018,839(11):12-20.
[19]Su EJ,Fredriksson L,Geyer M,et al.Activation of PDGF-CC by tissue plasminogen activator impairs blood-brain barrier integrity during ischemic stroke[J].Nat Med,2008,14(7):731-737.
[20]Ma QY,Huang B,Khatibi N,et al.PDGFR-α inhibition preserves blood-brain barrier after intracerebral hemorrhage[J].Ann Neurol,2011,70(6):920-931.
(收稿2021-07-15 修回2022-02-26)
