miR-433通过JAK2/STAT3信号通路调控氧化应激在大鼠术后认知障碍中的作用研究
2023-04-29许琼冠欧阳一彬谢镇明
许琼冠 欧阳一彬 谢镇明
【摘要】 目的 探討miR-433对术后认知障碍(POCD)大鼠海马氧化应激和认知功能的影响及其作用机制。方法 将大鼠随机分为4组,Control组、POCD组、POCD+NC mimic组、POCD+miR-433 mimic组。构建大鼠POCD模型,实时荧光定量PCR实验(RT-qPCR)检测miR-433在POCD大鼠海马组织中的表达;Morris水迷宫试验评价大鼠认知功能;苏木精-伊红(HE)染色检测海马组织病理学变化;TUNEL染色检测细胞凋亡情况;采用酶联免疫吸附法(ELISA)检测氧化应激水平;双荧光素酶报告基因系统检测miR-433和JAK2的靶向关系;Western blotting检测海马组织中cleaved caspase-3、Bad、Bcl-2、JAK2、p-JAK2、STAT3、p-STAT3蛋白的表达。结果 与Control组比较,POCD组大鼠海马组织中miRNA-433表达显著降低,逃避潜伏期延长,穿越目标平台次数减少,POCD组神经细胞紊乱,细胞数量明显减少,神经元细胞凋亡率显著升高,cleaved caspase-3和Bad蛋白表达显著升高,Bcl-2蛋白表达显著降低,超氧化物歧化酶(SOD)水平显著降低,丙二醛(MDA)水平显著升高,差异均有统计学意义(P<0.05)。与POCD+NC mimic组比较,POCD+miR-433 mimic组大鼠海马组织中miRNA-433表达显著升高,逃避潜伏期缩短,穿越目标平台次数增加,海马内细胞排列较规则,坏死神经细胞数量明显减少,神经元细胞凋亡率显著降低,cleaved caspase-3和Bad蛋白表达显著降低,Bcl-2蛋白表达显著升高,SOD水平显著升高,MDA水平显著降低。双荧光素酶报告基因实验结果JAK2是miRNA-433的靶基因,与POCD+miR-433 mimic+Vector组比较,POCD+miR-433 mimic+pcDNA-JAK2组大鼠海马组织中JAK2、p-JAK2、p-STAT3、cleaved caspase-3、Bad蛋白以及MDA水平显著升高,而Bcl-2蛋白、SOD水平显著降低,差异均有统计学意义(P<0.05)。结论 miR-433通过JAK2/STAT3信号通路抑制氧化应激从而预防大鼠术后认知障碍。
【关键词】 miR-433;术后认知障碍;氧化应激;凋亡;JAK2/STAT3通路
【中图分类号】 R651 【文献标志码】 A 【文章编号】 1672-7770(2023)01-0067-07
Abstract: Objective To explore the effect of miR-433 on oxidative stress and cognitive function in the hippocampus of rats with postoperative cognitive impairment(POCD)and its mechanism of action. Methods Rats were randomly divided into 4 groups, control group, POCD group, POCD+NC mimic group, and POCD+miR-433 mimic group. A rat POCD model was constructed, and the expression of miR-433 in hippocampal tissue of POCD rats was detected by real-time fluorescence quantitative PCR assay(RT-qPCR). Morris Water Maze test was used to evaluate the cognitive function of rats. Hematoxylin and Eosin(HE) staining was used to detect histopathological changes in hippocampus. TUNEL staining was used to detect cell apoptosis. The level of oxidative stress was detected by enzyme-linked immunosorbent assay(ELISA). Dual luciferase reporter gene system was used to detect the targeting relationship between miR-433 and JAK2. Western blotting was used to detect the expression of cleaved caspase-3, Bad, Bcl-2, JAK2, p-JAK2, STAT3, and p-STAT3 proteins in the hippocampus tissues. Results Compared with the control group, miR-433 expression in hippocampus tissues of rats in the POCD group was significantly reduced. The evasion latency was prolonged. The number of crossing the target platform was reduced. Neuronal cells in the POCD group were disordered. The number of cells was significantly reduced. The apoptosis rate of neuronal cells was significantly increased. Cleaved caspase-3 and Bad protein expression was significantly increased. Bcl-2 protein expression and superoxide dismutase(SOD) level significantly decreased. Malondialdehyde(MDA) level increased significantly. The difference was statistically significant(P<0.05). Compared with the POCD+NC mimic group, the expression of miR-433 in hippocampus tissues of rats in the POCD+miR-433 mimic group was significantly higher, the escape latency was shortened, the number of crossing the target platform was increased, the arrangement of cells in the hippocampus was more regular. The apoptosis rate of neuronal cells was significantly lower, and the rate of neuronal cell apoptosis was significantly reduced. The expression of cleaved caspase-3 and Bad protein expression was significantly decreased. Bcl-2 protein expression was significantly increased, SOD level was significantly increased, and MDA level was significantly decreased. The results of dual luciferase reporter gene assay showed that JAK2 was the target gene of miRNA-433, and compared with POCD+miR-433 mimic+Vector group, the hippocampal tissues of rats in POCD+miR-433 mimic+pcDNA-JAK2 group showed significantly lower expression of JAK2, p-JAK2, p-STAT3, cleaved caspase-3, Bad protein, and MDA levels were significantly increased, while Bcl-2 protein and SOD levels were significantly decreased. The difference was statistically significant(P<0.05). Conclusion MiR-433 inhibits oxidative stress through JAK2/STAT3 signaling pathway to prevent postoperative cognitive impairment in rats.
Key words: miR-433; postoperative cognitive impairment; oxidative stress; apoptosis; JAK2/STAT3 pathway
基金项目:海南省卫生健康行业科研项目(20A200093)
作者单位:571103 海口,海南医学院第二附属医院神经外科二区
术后认知功能障碍(postoperative cognitive dysfunction,POCD)是全身麻醉后影响中枢神经系统最常见的并发症之一。POCD可延长术后的恢复时间,并长期损害患者的生活质量。对于60岁以上的患者,术后POCD的比例较高,严重影响了老年患者的社会生活能力和生活质量[1]。以往研究表明,年龄增加、大手术、心肌梗死史、酒精依赖史、既往存在认知障碍已被确定为POCD的独立危险因素[2]。虽然POCD发病机制尚不清楚,但先前研究表明炎症反应、氧化应激、蛋白表达变化、细胞凋亡和中枢胆碱能系统的退化可能是导致POCD发病的因素[3-4]。迫切需要了解导致POCD的潜在机制,并找出有效的方法来保护术后认知功能。JAK2/STAT3通路参与许多生理过程,包括炎症、增殖、分化和发育[5],它可能有助于驱动暴露于细胞因子后的神经元的存活反应。大量研究证实,JAK2/STAT3通路参与了短暂性局灶性脑缺血后的抗凋亡过程[6]。此外,有研究表明,STAT3信号通路被激活会导致淀粉样前体蛋白水平异常和认知功能障碍[7]。MicroRNA(miRNA)是一类短链非编码RNA,通过mRNA降解或翻译抑制在抑制靶基因表达中起关键作用。目前在哺乳动物的脑组织中发现了大量的miRNA。它们与脑组织发育、神经元分化和高级神经功能(如学习和记忆)有关[8]。此外,它们还与神经退行性疾病、精神障碍和脑肿瘤等疾病有关[9]。最近的研究发现,在阿尔茨海默病和帕金森病中,miRNA也参与调节神经元细胞周期控制和凋亡[10]。此外,它们还参与调节缺血后脑损伤的病理过程[11]。miR-433位于12号染色体上。张等研究发现miR-433在缺氧条件下对神经元的增殖和迁移具有调节作用[12],表明miR-433在调节神经细胞生物学功能中具有重要作用。然而,miR-433在POCD的神经发病机制中的作用尚不清楚。因此,本研究将探讨miR-433和JAK2/STAT3信號通路在大鼠术后认知障碍中的确切作用和机制。
1 材料与方法
1.1 材料 SYBR Premix Ex Taq试剂盒(北京优尼康生物科技有限公司);PrimeScript RT Reagent Kit试剂盒、miRcute miRNA cDNA第一链合成试剂盒[宝日医生物技术(北京)有限公司];TUNEL染色试剂盒(Roche公司);ABI 7500 qPCR系统(Applied Biosystems公司);BX51显微镜(奥林巴斯公司)。8周龄雄性SD大鼠(500~600 g)饲养于动物房中(由海南医学院实验动物中心提供),温度为22~24 ℃,湿度为55%~65%,光照/黑暗周期为12 h,并提供食物和水。所有实验方案和程序均获得海南医学院第二附属医院伦理委员会的批准。
1.2 方法
1.2.1 POCD大鼠模型的建立和实验分组 将大鼠随机分为4组,Control组、POCD组、POCD+NC mimic组、POCD+miR-433 mimic组。术前禁食12 h,大鼠吸入异氟醚(1.5%~2.0%)麻醉。大鼠进行气管插管和机械通气。大鼠在整个手术过程中暴露在(21% O2, 79% N2)和1.5%~2.0%异氟醚的混合物中进行麻醉。消毒后,在剑突下缘垂直切开3 cm,解剖左肝叶。探查左肝叶并与根部结扎,随后切除。使用0.25%布比卡因浸润切口,3-0缝线缝合。待大鼠恢复意识后,将其送回到动物房。一旦建立大鼠POCD模型,POCD+NC mimic组、POCD+miR-433 mimic组、POCD+miR-433 mimic+Vector组和POCD+miR-433 mimic+pcDNA-JAK2组大鼠分别通过脑室注射将总体积为 2 μL的NC mimic、miR-433 mimic以及Vector、pcDNA-JAK2慢病毒注射到海马中。Control组和POCD组大鼠未接受病毒载体。
1.2.2 Morris水迷宫实验 使用Morris水迷宫实验评估认知功能。试验于损伤后5~8 d进行,训练持续4 d,每天5次试验。迷宫由一个不锈钢圆形水池(直径120 cm,高50 cm)组成。将水池分成四个象限,在西南象限的中央放置一个透明的有机玻璃平台。将大鼠从4个象限中的一个放入水中自由游泳,探索迷宫,直到他们找到平台。若大鼠在60 s内找不到平台,则将其放置在平台上休息10 s。第5天,移除平台,将大鼠从东北象限放入水中,让其游泳60 s,记录大鼠逃避潜伏期及穿越平台次数。
1.2.3 HE染色 使用35 mg/kg戊巴比妥钠麻醉大鼠,解剖大鼠分离脑组织样本。将脑组织放入4%多聚甲醛中固定24 h,进行常规石蜡包埋。将组织切成厚度为5 μm的连续冠状切片,然后脱蜡再水合。最后使用HE染色试剂盒对脑组织进行染色,在光学显微镜下观察脑组织的病理变化。
1.2.4 TUNEL染色 按照制造商说明书,使用TUNEL染色试剂盒进行染色。简而言之,将切片与包括TdT酶和TMRred标记的dUTP在内的TUNEL反应混合物在37 ℃下避光孵育1 h,然后最后洗涤15 min,并通过使用具有0.03% 3,3′-二氨基联苯胺(diaminobenzidine,DAB)的转化过氧化物酶可视化。最后在BX51显微镜下观察和计数每个切片的五个视野下的TUNEL阳性细胞总数。
1.2.5 实时荧光定量PCR(RT-qPCR) 使用Trizol试剂从海马组织中提取总RNA。随后用PrimeScript RT Reagent Kit试剂盒和miRcute miRNA cDNA第一链合成试剂盒分别从mRNA和miRNA中反转录合成cDNA。使用SYBR Premix Ex Taq试剂盒在ABI 7500 qPCR系统上进行PCR反应。反应条件为:50 ℃ 2 min, 95 ℃ 10 min,第三步变性,95 ℃ 15 s,60 ℃ 1 min,重复40个循环。用2-ΔΔCt法计算miRNA和mRNA基因的相对表达,U6和GAPDH分别作为miRNA和mRNA的内部对照。
1.2.6 酶联免疫吸附实验(enzyme linked immunosorbent assay,ELISA) 收集海马组织,采用RIPA法分离蛋白,采用BCA试剂盒测定蛋白浓度。根据ELISA试剂盒说明书检测超氧化物歧化酶(superoxide dismutase,SOD)和丙二醛(malonaldehyde,MDA)水平,使用酶标仪测量450 nm波长各孔的吸光度值。
1.2.7 Western blotting 使用RIPA裂解液对处理后的海马组织进行分裂,并用BCA试剂盒检测蛋白浓度。将50 g蛋白样品通过8%~12% SDS-PAGE分离并转移到PVDF膜上。将膜在含5%脱脂牛奶的PBST缓冲液中于37 ℃封闭1 h,并与一抗在 4 ℃下孵育过夜。然后将膜与相应的辣根过氧化物酶结合的二抗在37 ℃下孵育1 h。使用ECL试剂盒测量蛋白质水平,并使用Image J软件进行定量。
1.2.8 双荧光素酶报告基因实验 简而言之,将293 T细胞接种在24孔板中,并与携带野生型JAK2(JAK2-WT)或突变型JAK2(JAK2-MUT)的荧光素酶质粒和miR-433 mimic或NC mimic共转染。孵育48 h后,根据说明书使用双荧光素酶报告基因检测试剂盒检测荧光强度。
1.3 统计学分析 所有数据均表示为均数±标准差(x-±s),并使用SPSS 20.0软件和GraphPad Prism 7.0软件进行分析。组间表达的比较使用Student's t检验或单因素方差分析,P<0.05被认为差异具有统计学意义。
2 结 果
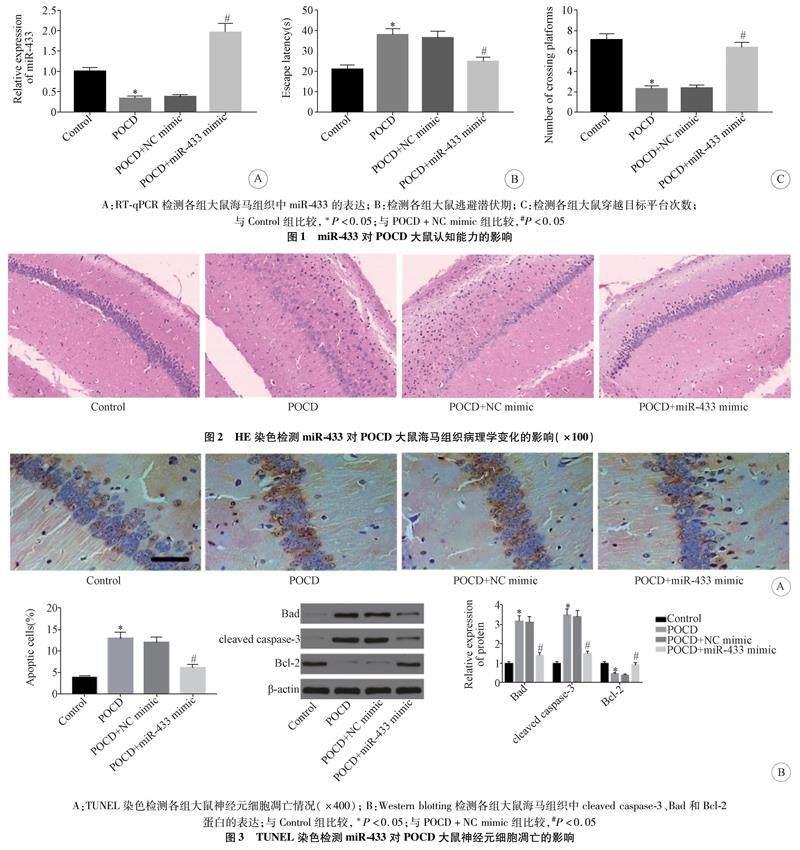
2.1 miR-433对POCD大鼠认知能力的影响 结果显示,与Control组比较,POCD组大鼠海马组织中miR-433表达显著降低,逃避潜伏期延长,穿越目标平台次数减少;与POCD+NC mimic组比较,POCD+miR-433 mimic组大鼠海马组织中miRNA-433表达显著升高,逃避潜伏期缩短,穿越目标平台次数增加,差异均有统计学意义(P<0.05,n=12),见图1。
2.2 miR-433对POCD大鼠海马组织病理学变化的影响 HE染色结果显示,Sham组海马区神经细胞排列规则紧密,细胞边界清晰,细胞核呈圆形或椭圆形。POCD组神经细胞紊乱,细胞核溶解,海馬神经元细胞和锥体细胞死亡,细胞数量明显减少。POCD+miR-433 mimic组大鼠海马内细胞排列较POCD+NC mimic组更规则,坏死神经细胞数量明显减少,差异均有统计学意义(P<0.05,n=5),见图2。
2.3 miRNA-433过表达对神经元细胞凋亡的影响与Control组比较,POCD组大鼠神经元细胞凋亡率显著升高,cleaved caspase-3和Bad蛋白表达显著升高,Bcl-2蛋白表达显著降低;与POCD+NC mimic组比较,POCD+miR-433 mimic组大鼠神经元细胞凋亡率显著降低,cleaved caspase-3和Bad蛋白表达显著降低,Bcl-2蛋白表达显著升高,差异均有统计学意义(P<0.05,n=5),见图3。
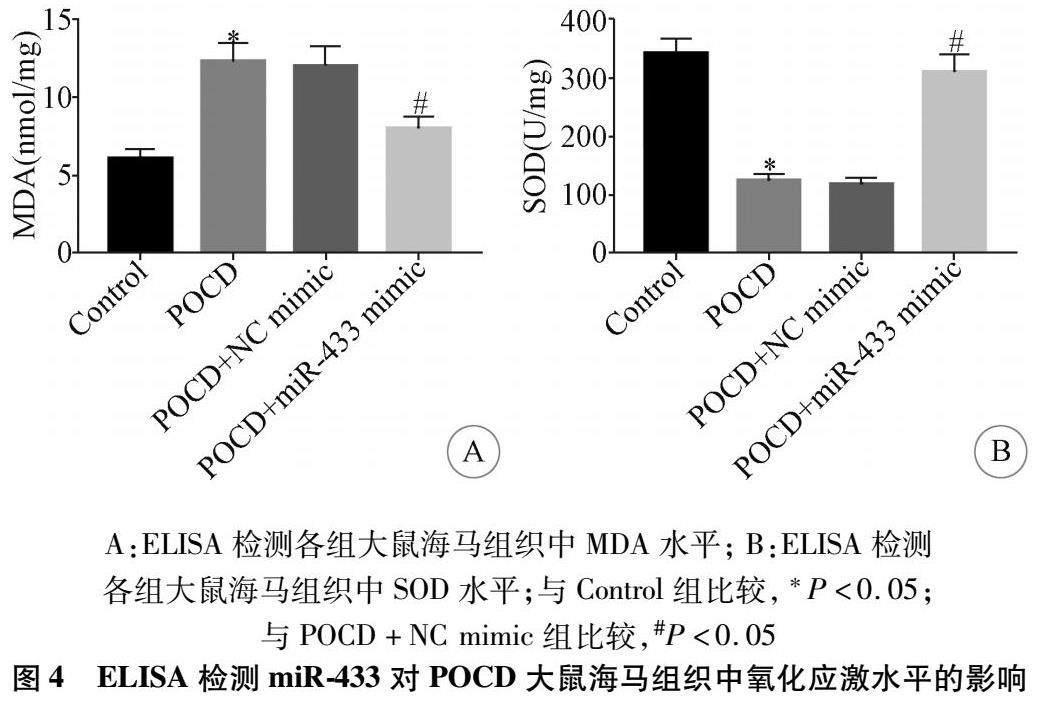
2.4 miRNA-433过表达对POCD大鼠海马组织中氧化应激水平的影响 与Control组比较,POCD组大鼠海马组织中SOD水平显著降低,MDA水平显著升高;与POCD+NC mimic组比较,POCD+miR-433 mimic组大鼠海马组织中SOD水平显著升高,MDA水平显著降低,差异均有统计学意义(P<0.05,n=5),见图4。
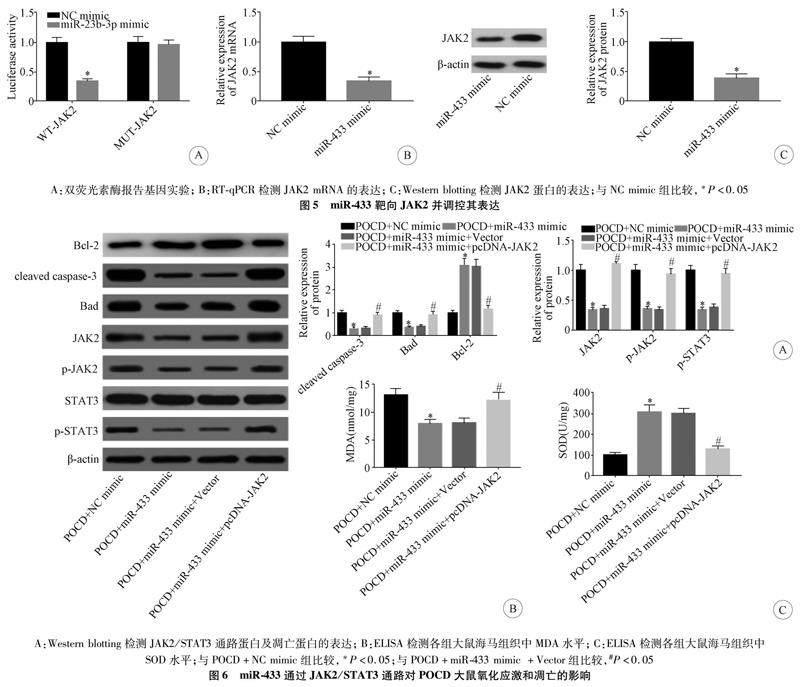
2.5 miR-433靶向JAK2并调控其表达 双荧光素酶报告基因实验结果显示,与NC mimic组比较,miR-433 mimic和WT-JAK2 3′UTR共转染组细胞的荧光素酶活性明显降低;RT-qPCR实验结果显示,与NC mimic组比较,miR-433 mimic组JAK2 mRNA和蛋白水平明显下降,差异均有统计学意义(P<0.05,n=3),见图5。
2.6 miR-433通过JAK2/STAT3通路对POCD大鼠氧化应激和凋亡的影响 与POCD+NC mimic组比较,POCD+miR-433 mimic组大鼠海马组织中JAK2、p-JAK2、p-STAT3、cleaved caspase-3、Bad蛋白以及MDA水平显著降低,而Bcl-2蛋白、SOD水平显著升高;与POCD+miR-433 mimic+Vector组比较,POCD+miR-433 mimic+pcDNA-JAK2组大鼠海马组织中JAK2、p-JAK2、p-STAT3、cleaved caspase-3、Bad蛋白以及MDA水平显著升高,而Bcl-2蛋白、SOD水平显著降低,差异均有统计学意义(P<0.05,n=5),见图6。
3 讨 论
POCD是老年人术后出现的认知功能障碍,主要表现为注意力、记忆、语言等认知功能减退。POCD的病理机制复杂而不明确,因此,迫切需要了解预防POCD的机制。已有研究报道了几种miRNAs与POCD显著相关,这为miRNAs在POCD中发挥重要作用提供了支持性证据。例如,敲低miR-448抑制神经元凋亡,并进一步参与调节异氟醚诱导的认知功能障碍[13]。miR-96通过抑制IGF1R加重了七氟醚对大鼠海马神经元和认知功能的影响[14]。有研究报道,miR-433在帕金森病患者中低表达,提示miR-433可能是帕金森病的潜在生物标志物[15]。本研究结果发现,miR-433在POCD大鼠海马组织中的表达水平显著降低,提示miR-433可能在POCD中发挥作用。
在具有学习和记忆功能的大脑海马体中,信号通路的改变被认为是全身麻醉导致POCD认知障碍的上游机制。据报道,异氟醚是一种常见的吸入麻醉剂,通过NF-κB和缺氧诱导因子-1等多种途径诱导老年大鼠海马神经炎症和认知损伤[16]。此外,氧化应激也可能参与POCD的发病机制,有研究证明手术创伤可诱导POCD模型鼠海马的氧化应激[17]。这些机制为POCD提供了潜在的预防或治疗靶点。研究已经证实,在POCD大鼠模型中,抑制氧化应激可以改善认知障碍[18]。本研究采用异氟醚诱导的大鼠POCD模型,通过检测氧化应激因子、细胞凋亡和JAK2/STAT3信号通路相关蛋白,以研究miR-433在大鼠POCD发生和进展中的作用。本研究将提供一种新的POCD治疗方法,并探讨其作用机制。
Morris水迷宫实验用于评估大鼠的认知功能,主要是实验动物空间位置和方向的学习记忆能力,广泛应用于学习记忆、老年痴呆、海马研究、智力与衰老、新药研发等方面的研究[19]。逃逸潜伏期用于评估大鼠的学习能力,逃逸潜伏期越短,表现越好。穿越平台次数用于评估空间记忆能力,穿越平台次数越多表示性能水平越高。本研究通过将miR-433过表达腺病毒注射至大鼠体内,结果发现miR-433过表达显著改善了POCD大鼠的学习和空间记忆能力。
在本研究中,miR-433过表达与海马MDA降低和SOD水平升高有关,表明miR-433过表达抑制了老年POCD大鼠海马的氧化应激。氧化应激是指抗氧化防御系统功能障碍,导致活性氧和活性氮过量产生,从而导致组织和细胞损伤[20]。SOD是抗氧化系统中重要的酶,它的活性可以直接反应线粒体抗氧化系统的功能水平[21]。研究表明,氧化应激参与了POCD诱导的神经元损伤[1]。据报道,手术创伤可诱导POCD鼠海马氧化应激,从而参与POCD发病机制。年龄也是POCD的危险因素,年老的海马表现出多种神经生物学变化,包括氧化应激增加[22]。因此,氧化应激可能是治疗POCD的潜在治疗靶点。近期研究表明miR-7684参与调控POCD氧化应激的表达[23]。在本研究中,miR-433过表达可以降低POCD大鼠氧化应激,抑制神经元凋亡,改善术后认知障碍的发生和发展,发挥神经保护作用。
JAK2/STAT3信号通路是胆碱能抗炎通路(cholinergic anti-inflammatory pathway,CAP)的重要通路。随着对CAP研究的不断深入,其对大脑的保护作用越来越受到人们的关注。已有研究报道JAK2/STAT3信号通路参与了脑缺血神经元的凋亡过程[24]。Chen等[25]报道了脑缺血后通过RNA干扰降低STAT3磷酸化具有显著的神经保护作用。也有研究发现电针刺激大鼠局灶性脑缺血,通过降低JAK2表达,防止JAK2异常激活,下调STAT3磷酸化,从而缓解神经功能缺损[26]。JAK2/STAT3通路的下调也与miRNA的上调相关。例如,miR-17通过靶向JAK2/STAT3信号通路减少胶原诱导关节炎小鼠的炎症和骨侵蚀[27]。近期有研究发现,miR-433在帕金森病和阿尔茨海默症患者中下调,miR-433过表达可能通过JAK2/STAT3降低Aβ诱导的神经元活性抑制[28]。然而,miR-433通过JAK2/STAT3通路在术后认知障碍中的作用尚不清楚。本研究发现,miR-433通过靶向JAK2/STAT3通路能降低POCD大鼠的氧化应激水平,抑制神经元凋亡,表明miR-433过表达可能通过JAK2/STAT3通路来改善大鼠POCD。
本研究结果表明,miR-433通过抑制JAK2/STAT3通路降低氧化应激水平和抑制海马组织的神经元凋亡,改善大鼠的认知功能,为治疗POCD提供了新的方法。
[参 考 文 献]
[1]Lin XY,Chen YR,Zhang P,et al.The potential mechanism of postoperative cognitive dysfunction in older people[J].Exp Gerontol,2020,130(2):110791.
[2]Luo AL,Yan J,Tang XL,et al.Postoperative cognitive dysfunction in the aged:the collision of neuroinflammaging with perioperative neuroinflammation[J].Inflammopharmacology,2019,27(1):27-37.
[3]Ho YS,Zhao FY,Yeung WF,et al.Application of acupuncture to attenuate immune responses and oxidative stress in postoperative cognitive dysfunction:what do we know so far?[J].Oxid Med Cell Longev,2020,2020(2):9641904.
[4]孫啸云,邱丽丽,徐建国,等.金刚烷胺减轻海马炎症反应和细胞凋亡在小鼠术后认知功能障碍中的治疗作用[J].临床麻醉学杂志,2019,35(10):1006-1010.
[5]Zhu JL,Yang T,Tang MH,et al.Studies on the anti-psoriasis effects and its mechanism of a dual JAK2/FLT3 inhibitor flonoltinib maleate[J].Biomed Pharmacother,2021,137(5):111373.
[6]Xiang JY,Zhang XJ,Fu JL,et al.USP18 overexpression protects against focal cerebral ischemia injury in mice by suppressing microglial activation[J].Neuroscience,2019,419(9):121-128.
[7]Hu Y,Zhang X,Zhang J,et al.Activated STAT3 signaling pathway by ligature-induced periodontitis could contribute to neuroinflammation and cognitive impairment in rats[J].J Neuroinflammation,2021,18(1):80.
[8]Konovalova J,Gerasymchuk D,Parkkinen I,et al.Interplay between microRNAs and oxidative stress in neurodegenerative diseases[J].Int J Mol Sci,2019,20(23):6055.
[9]Juz'wik CA,S Drake S,Zhang Y,et al.microRNA dysregulation in neurodegenerative diseases:a systematic review[J].Prog Neurobiol,2019,182(11):101664.
[10]Swarbrick S,Wragg N,Ghosh S,et al.Systematic review of miRNA as biomarkers in Alzheimer's disease[J].Mol Neurobiol,2019,56(9):6156-6167.
[11]阎雯,齐薛浩.MicroRNA-181b及Toll样受体4在新生大鼠神经元缺氧缺血损伤中的作用机制研究[J].中国现代医学杂志,2018,28(21):21-27.
[12]Zhang L,Zhang YX,Zhang XH,et al.MicroRNA-433 inhibits the proliferation and migration of HUVECs and neurons by targeting hypoxia-inducible factor 1 alpha[J].J Mol Neurosci,2017,61(2):135-143.
[13]Wu Q,Dai QX,Jiang LM,et al.Downregulation of microRNA-448 improves isoflurane-induced learning and memory impairment in rats[J].Mol Med Rep,2017,16(2):1578-1583.
[14]Xu C,Niu JJ,Zhou JF,et al.MicroRNA-96 is responsible for sevoflurane-induced cognitive dysfunction in neonatal rats via inhibiting IGF1R[J].Brain Res Bull,2019,144(1):140-148.
[15]Zhang X,Yang R,Hu BL,et al.Reduced circulating levels of miR-433 and miR-133b are potential biomarkers for Parkinson's disease[J].Front Cell Neurosci,2017,11(6):170.
[16]Jiang T,Xu SC,Shen YY,et al.Genistein attenuates isoflurane-induced neuroinflammation by inhibiting TLR4-mediated microglial-polarization in vivo and in vitro[J].J Inflamm Res,2021,14(6):2587-2600.
[17]Jiang Y,Gao H,Yuan HB,et al.Amelioration of postoperative cognitive dysfunction in mice by mesenchymal stem cell-conditioned medium treatments is associated with reduced inflammation,oxidative stress and increased BDNF expression in brain tissues[J].Neurosci Lett,2019,709(9):134372.
[18]黎娜,洪素云,李俊,等.電针预处理对术后认知功能障碍老龄小鼠海马氧化应激的影响[J].中国针灸,2021,41(6):645-650.
[19]Tian HL,Ding N,Guo MW,et al.Analysis of learning and memory ability in an Alzheimer's disease mouse model using the Morris water maze[J].J Vis Exp,2019,29(152):e60055.
[20]Simunkova M,Alwasel SH,Alhazza IM,et al.Management of oxidative stress and other pathologies in Alzheimer's disease[J].Arch Toxicol,2019,93(9):2491-2513.
[21]Taysi S,Tascan AS,Ugur MG,et al.Radicals,oxidative/nitrosative stress and preeclampsia[J].Mini Rev Med Chem,2019,19(3):178-193.
[22]Kotekar N,Shenkar A,Nagaraj R.Postoperative cognitive dysfunction-current preventive strategies[J].Clin Interv Aging,2018,13(11):2267-2273.
[23]Wei CW,Sun Y,Wang J,et al.LncRNA NONMMUT055714 acts as the sponge of microRNA-7684-5p to protect against postoperative cognitive dysfunction[J].Aging(Albany NY),2021,13(9):12552-12564.
[24]Hu GQ,Du X,Li YJ,et al.Inhibition of cerebral ischemia/reperfusion injury-induced apoptosis:nicotiflorin and JAK2/STAT3 pathway[J].Neural Regen Res,2017,12(1):96-102.
[25]Chen S,Dong ZP,Cheng M,et al.Homocysteine exaggerates microglia activation and neuroinflammation through microglia localized STAT3 overactivation following ischemic stroke[J].J Neuroinflammation,2017,14(1):187.
[26]Xu H,Zhang YM,Sun H,et al.Electroacupuncture at GV20 and ST36 exerts neuroprotective effects via the EPO-mediated JAK2/STAT3 pathway in cerebral ischemic rats[J].Evid Based Complement Alternat Med,2017,2017(8):6027421.
[27]Najm A,Masson FM,Preuss P,et al.MicroRNA-17-5p reduces inflammation and bone erosions in mice with collagen-induced arthritis and directly targets the JAK/STAT pathway in rheumatoid arthritis fibroblast-like synoviocytes[J].Arthritis Rheumatol,2020,72(12):2030-2039.
[28]Wang R,Zhang JJ.Clinical significance of miR-433 in the diagnosis of Alzheimer's disease and its effect on Aβ-induced neurotoxicity by regulating JAK2[J].Exp Gerontol,2020,141(11):111080.
(收稿2021-09-28 修回2021-12-13)
