荧光定量PCR方法检测头孢类产品中的残留DNA
2023-03-14蒋惠源张培培仇雅静王琰
蒋惠源 张培培 仇雅静 王琰


摘要:目的 熒光实时定量PCR(real-time fluorescence quantitative PCR,RTFQ-PCR)检测头孢类产品中残留DNA方法开发、验证及应用。方法 采用柱式游离DNA抽提试剂盒(离心柱法)提取供试品中残留DNA;将已知浓度的产黄枝顶孢霉基因组DNA标准溶液系列稀释后,根据DNA标准溶液的循环阈值与浓度之间的线性关系,对5种头孢类产品中的残留DNA进行定量分析;对方法进行专属性、线性和范围、准确度、精密度验证,并使用该方法对5种头孢类产品进行残留DNA检测。结果 DNA标准溶液的线性范围为10 fg/μL~1 ng/μL、相关系数R2>0.99、扩增效率为90%~110%、LOD相当于83 pg/g,质控样品回收率为 50%~150%,供试品相对标准偏差(RSD)均小于30%,方法学验证的各项参数均符合规定。结论 离心柱法结合qPCR探针法能够简便、快速、准确地对5种头孢类抗生素中的残留DNA进行定量测定,方法的专属性、线性、准确度、精密度等各项指标均可达到方法验证的要求,适用于头孢类产品中残留DNA的检测,对其他发酵或半合成抗生素的质量控制具有借鉴意义。
关键词:荧光定量PCR;头孢类产品;发酵和半合成类抗生素;残留DNA
中图分类号:R978.1文献标志码:A
Detection of residual DNA in cephalosporin products by real-time fluorescence quantitative PCR
Jiang Huiyuan1, Zhang Peipei2, Qiu Yajing1, and Wang Yan2
(1 Taizhou Institute for Drug Control, Taizhou 225300; 2 National Institutes for Food and Drug Control, Beijing 102629)
Abstract Objective To develop, verify and apply the detection of residual DNA in cephalosporin products by real-time fluorescence quantitative PCR (RTFQ-PCR). Methods The residual DNA was extracted by the Ezup column-free DNA extraction kit (centrifugal column method). After diluting the known concentration of the Acremonium chrysogenum genomic DNA standard solution series, the residual DNA in 5 cephalosporin products was quantitatively analyzed according to the linear relationship between the circulation threshold of the DNA standard solution and the concentration. The specificity, linearity, range, accuracy and precision of the method were verified, and the method was used to detect residual DNA in 5 cephalosporin products. Results The linear range of the DNA standard solution was 10 fg/μL~1 ng/μL, the correlation coefficient R2>0.99, the amplification efficiency was 90%~110%, and the LOD equivalent was 83 pg/g. The recovery rate of quality control samples was 50%~150%, and the relative standard deviation (RSD) was less than 30%. The parameters of methodological verification met the requirements. Conclusion The centrifugal column method combined with the qPCR probe method can be used to quantitatively determine residual DNA in cephalosporin antibiotics simply, quickly and accurately. The specificity, linearity, accuracy and precision of the method can meet the requirements of method verification. It is suitable for the detection of residual DNA in cephalosporin products and has reference significance for the quality control of other fermented and semi-synthetic antibiotics.
Key words Fluorescence quantitative PCR; Cephalosporin products; Fermented or semi-synthetic antibiotics; Residual DNA
头孢类抗生素是临床中最重要的抗菌药物,目前绝大部分头孢类抗生素都以产黄枝顶孢霉(顶头孢霉Acremonium chrysogenum)发酵产生的头孢菌素C为原料,通过青霉素G酰基转移酶(penicillin G acylase, PGA)半合成或化学修饰改造而成[1-5],因此终产品中可能会残留有工业微生物来源的DNA。宿主残留DNA是一种潜在的风险,主要是具有感染性和致瘤性[6-8]。因此,有必要建立专属性强、灵敏度高和精密度好的分析方法,对抗生素药品中发酵残留物进行有效控制,以保证产品质量安全。
欧洲药品局(European Medicines Agency, EMA)对进口欧盟国家及欧洲市场的发酵类产品,要求企业在进口申报资料中提供对残留大分子物质的检测结果,美国食品药品监督管理局(Food and Drug Administration, FDA) 和欧洲药品质量与健康管理局(European Directorate for The Quality of Medicines& HealthCare, EDQM) 也对于发酵类产品中的残留物也做了相应规定[9]。我国现行版药典并未要求检测抗生素发酵残留,但国家药品监督管理局(Nation Medical Products Administration, NMPA)要求抗生素一致性评价申报资料中必须提供残留大分子检测数据。
虽然多国都对抗生素中残留大分子提出检测的要求,但目前国际上尚无统一的检验方法及标准,王琰等[9-10]采用高效液相荧光色谱法和蛋白芯片电泳技术建立了发酵类抗生素中残留蛋白通用性测定方法,许明哲等[11]采用凝胶过滤色谱和Bradford法测定抗生素中蛋白残留量,但抗生素中残留DNA的检测还处于研究初期,目前常用DNA荧光检测法药物中残留DNA,但该法的灵敏度较低,且不能特异性检测宿主残留的DNA,专属性较差[12-13];相比于已有方法,荧光实时定量PCR(real-time fluorescence quantitative PCR,RTFQ-PCR)检测方法具有专属性强和灵敏度高的特点,对目标宿主细胞残留DNA的检测准确性更强。因此采用qPCR方法进行抗生素中残留DNA检测的研究意义重大。
本方法根据头孢类抗生素半合成生产工艺的特点,采用柱式游离DNA抽提试剂盒(离心柱法)提取供试品中残留DNA。采用qPCR探针法检测供试品中残留DNA,以产黄枝顶孢霉基因组DNA为定量参考品,对供试品中残留产黄枝顶孢霉菌DNA进行定量。
1 材料与方法
1.1 主要试剂及仪器
真菌基因组DNA提取试剂盒(批号:D3195010000I06V009),购自美国Omega公司;细菌基因组DNA提取试剂盒(批号:AL11991A)、Premix Ex TaqTM(Probe qPCR)(批号:AL13174A),购自日本Takara公司;Ezup柱式游離DNA抽提试剂盒(批号:H701KA0602)、Carrier RNA溶液(批号:IA11KA6632)、pH8.0 Tris缓冲液、DNA分子量标准Marker(500~15000 bp)(批号:I815KA7297)、DNA分子量标准Marker(50-1031bp:I805KA5783),购自上海生工生物工程有限公司;无菌带滤芯低吸附枪头,购自中国LABSELECT公司;无菌低吸附离心管和PCR八联管,购自美国AXYGEN公司;分析纯的氯仿、异戊醇、无水乙醇和氢氧化钠,购自国药集团化学试剂有限公司。马铃薯葡萄糖液体培养基(批号:1101412)、马铃薯葡萄糖琼脂培养基(批号:1101411)、营养肉汤培养基(批号:1105551)、营养琼脂(批号:1090401),购自广东环凯微生物科技有限公司;超纯水由Millipore 纯水仪制备。
CFX96 Touch荧光定量PCR仪(美国BIO-RAD公司);移液枪(德国Eppendorf公司);BY-G16型高速医用离心机(北京白洋医疗器械有限公司);NTC200干式恒温器(上海皓庄仪器有限公司);BSC-1304II A2生物安全柜(苏州安泰空气技术有限公司);Mettler Toledo XS105DU十万分之一电子天平(美国Mettler Toledo公司);Nanodrop One超微量可见分光光度计(美国Thermo公司)。
1.2 菌种
产黄枝顶孢霉(菌种编号:CGMCC3.2853,等同于ATCC11550),购自中国普通微生物菌种保藏中心;产黄青霉(Penicillium chrysogenum)(菌种编号:CICC40654,等同于ATCC10106),购自中国工业微生物菌种保藏中心;大肠埃希菌(Escherichia coli)(菌种编号:CMCC(B)44102)、枯草芽胞杆菌(Bacillus subtilis) (菌种编号:CMCC(B)63501),购自中国微生物菌种保藏中心。
1.3 供试品
7-ACA原料、注射用头孢呋辛钠、注射用头孢唑林钠、注射用头孢尼西钠和注射用头孢唑肟钠等5种头孢菌素类供试品由泰州市药品检验院提供。
1.4 菌种基因组DNA提取
1.4.1 产黄枝顶孢霉DNA提取
按菌种说明书要求进行菌种复苏、传代,在马铃薯琼脂平板上划线得到单菌落,挑取单菌落加入马铃薯葡萄糖液体培养基,28 ℃振荡培养5~7 d,取约20 mL菌悬液,用无菌滤纸过滤得到约200 mg的菌体,加液氮研磨至粉末状,用接种铲转移至1.5 mL无菌离心管中,按照真菌DNA提取试剂盒说明书提取基因组DNA。
1.4.2 其他菌种DNA提取
产黄青霉DNA提取同“1.4.1”;大肠埃希菌和枯草芽胞杆菌的DNA提取按菌种说明书要求进行菌种复苏,在营养琼脂平板上划线得到单菌落,挑取单菌落加入营养肉汤培养基,37 ℃振荡培养24 h,取1 mL菌悬液至1.5 mL离心管中,12000 g离心得到菌体,按照细菌DNA提取试剂盒说明提取基因组DNA。
1.4.3 菌种基因组DNA浓度测定
参考现有的qPCR方法建立的相关文献[14-16],使用Nanodrop One超微量可见分光光度计测定上述4种菌种基因组DNA的浓度,产黄枝顶孢霉基因组DNA浓度在10~30 ng/μL之间, A260/A280为1.7~2.0,基因组DNA纯度较好。
1.5 引物和探针的设计与合成
根据NCBI检索得到的产黄枝顶孢霉18S rRNA核酸序列(NG_062810.1)保守区域设计荧光引物和探针,通过NCBI检索引物和探针的特异性,在NCBI中选择与产黄枝顶孢霉同属及近源种属的交织顶孢霉(Acremonium implicatum)、产黄青霉(Penicillium chrysogenum)、墙支顶孢(Acremonium murorum)、分枝枝顶孢(Acremonium furcatum)、弯曲枝顶孢(Acremonium curvulum)、镰状枝顶孢(Acremonium kiliense)、互生枝顶孢(Acremonium alternatum)、顶青霉(Penicillium corylophilium)、网孢青霉(Penicillium reticulisporum)、平山青霉(Penicillium hirayamae)、产红青霉(Penicillium rubens)、桔青霉(Penicillium citrinum)、波兰青霉(Penicillium polonicum)、宛氏拟青霉(Paecilomyces variotii)、灰黄青霉(Penicillium griseofulvum)、宛氏拟青霉(Paecilomyces variotii)、炭黑曲霉(Aspergillus carbonarius)、黑曲霉(Aspergillus niger)、米曲霉(Aspergillus oryzae)、臭曲霉(Aspergillus foetidus)等20種霉菌的基因进行比对,NCBI-Blast 结果显示引物和探针均具有较高特异性,只特异性扩增产黄枝顶孢霉的18S rRNA核酸序列。引物及探针序列如表1所示,由生工生物工程(上海)公司合成。
1.6 溶液的制备
1.6.1 标准DNA溶液的制备
取已知浓度产黄枝顶孢霉基因组DNA提取液适量,用pH 8.0的Tris缓冲液(稀释液)稀释成10 ng/μL的溶液,作为标准DNA储备液,用pH 8.0的Tris缓冲液逐步稀释为稀释成浓度分别为1000 pg/μL(ST1)、100 pg/μL(ST2)、10 pg/μL(ST3)、1pg/μL(ST4)、100 fg/μL(ST5)、10 fg/μL(ST6)的溶液,作为标准DNA溶液,以制备标准曲线及加样回收用。
1.6.2 供试品溶液的制备
每个供试品称取200 mg,溶于10 mL稀释液中,制备成20 mg/mL溶液,作为供试品溶液,如供试品不能完全溶解,可加入适量2 mol/L的氢氧化钠溶液助溶,精密量取200 μL至干净的1.5 mL离心管中备用。
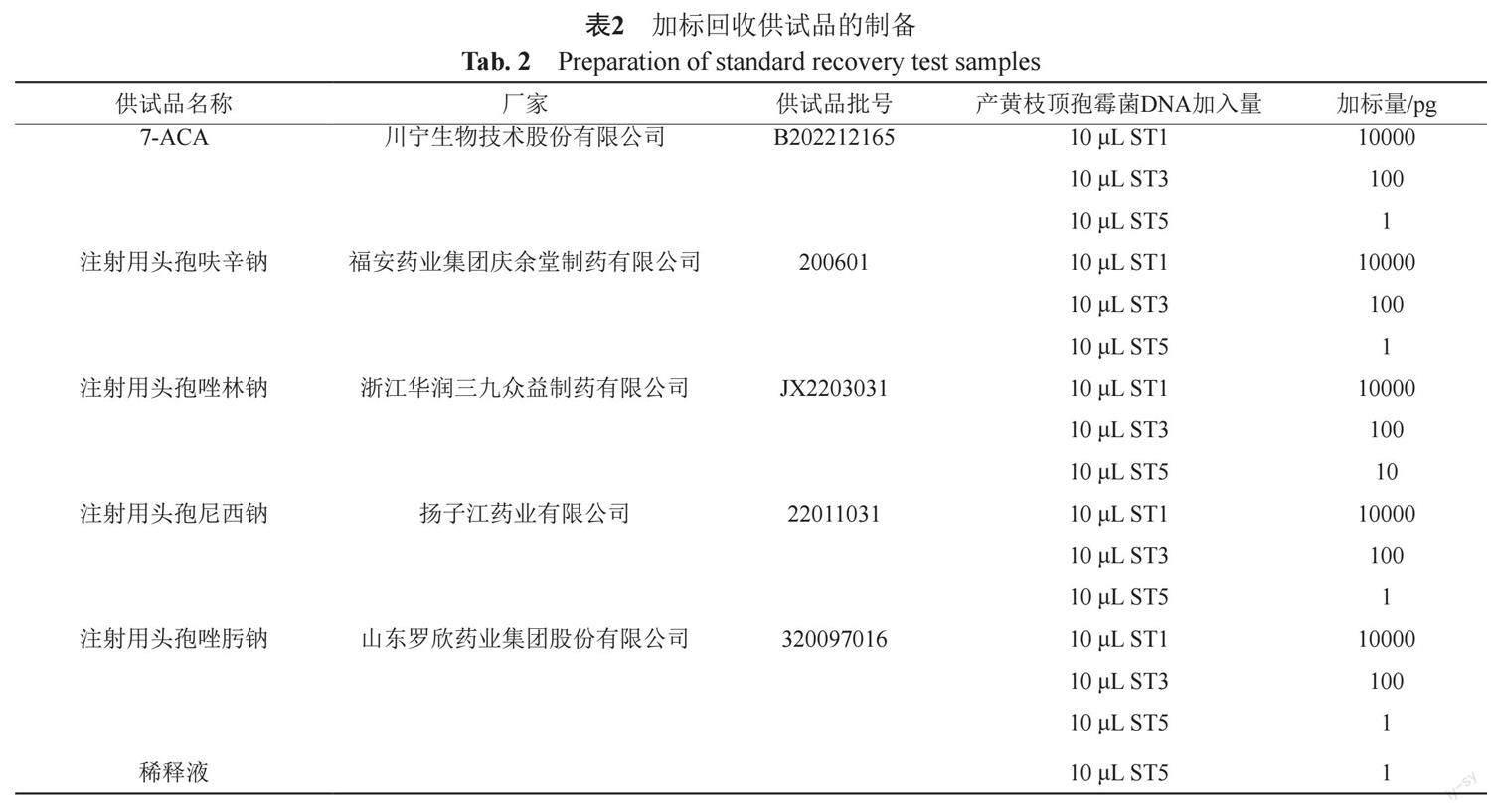
1.6.3 加标回收供试品溶液的制备
分别精密量取200 μL供试品溶液及稀释液至干净的1.5 mL离心管,按表2加入标准DNA溶液,作为加标回收供试品溶液和阳性质控PCS溶液。
1.6.4 阴性质控溶液的制备
取稀释液200 μL,作为阴性质控NCS。
1.7 供试品溶液前处理
按照柱式游离DNA抽提试剂盒说明书的要求对供试品溶液、加标回收溶液和阴性质控溶液进行前处理,按照以下公式添加适量体积的Carrier RNA溶液,A=10(-0.5lgB)(A为Carrier RNA溶液添加的体积,单位:μL;B为加标量,单位:pg;添加量小于0.1 μL时忽略不计)以提高DNA回收效率,得到终体积为100 μL的供试品纯化液。
1.8 qPCR测定方法
1.8.1 qPCR反应体系的制备
将qPCR引物、探针、Premix Ex TaqTM (Probe qPCR)试剂提前半小时取出融化,轻微震荡混匀,按表3配制qPCR反应体系,每个供试品检测3个重复;
1.8.2 qPCR程序
选择探针方法,选择报告荧光基团为FAM,猝灭荧光基团为none。设置两步法反应程序:95 ℃预变性3 min;95 ℃ 15 s,60 ℃ 1 min,40个循环;反应体积25 μL。
1.8.3 数据分析
qPCR 运行结束后,在结果分析窗口自动设置阈值,用标准DNA溶液扩增达到荧光阈值的循环数,即循环阈值(cycle threshold,Ct)对DNA浓度绘制标准曲线,将待测供试品的Ct值代入方程,计算其初始浓度。参考2020年版《中国药典》3407外源性DNA残留量测定法的相关规定,设定系统适用性及可接受标准为:标准曲线决定系数(R2)≥ 0.990;PCR扩增效率90%~110%,质控供试品回收率:50%~150%,供试品3个重复的相对标准偏差(RSD)≤30%。
残留量(pg/g)=(供试品检测值(pg/μL)×100/供试品浓度/0.2×1000
其中,供试品检测值单位为pg/μL,100为供试品溶液前处理终体积(μL),0.2为供试品溶液取用体积(mL),供试品溶液浓度单位为mg/mL,1000为mg与g之间的单位换算。
回收率(%)=(加标供试品检测值-供试品检测值)×100/理论加标量×100%,其中,100为供试品溶液前处理终体积(μL)。
1.9 方法学研究
1.9.1 线性和范围
取“1.6.1”标准DNA溶液各10 μL,采用“1.8”方法进行qPCR,做线性和范围的分析,根据标准DNA溶液线性考察结果确定检测限(LOD)和定量限(LOQ)。
1.9.2 专属性
在“1.5”引物和探针设计中已充分考虑引物特异性,NCBI-Blast结果显示二者均具有较高特异性,在此仅对实验室常用的产黄青霉、大肠埃希菌、枯草芽胞杆菌3种微生物基因组DNA进行检测,取产黄枝顶孢霉及产黄青霉、大肠埃希菌、枯草芽胞杆菌基因组DNA,分别稀释至1 ng/μL,并设立阴性对照(NCS),按照“1.8”方法检测,补充评估该方法的专属性。
1.9.3 准确度
取5种头孢类产品,按照“1.6.3”方法分别制备高、中、低3种浓度的加样回收溶液和阳性质控,按照“1.7”方法处理得到加样回收纯化液,采用“1.8”方法检测加样回收溶液中DNA含量,并计算回收率。
1.9.4 重复性和精密度
以B202212165批7-ACA原料为代表供试品,考察日内和日间精密度,在3个不同日期分别按“1.6.2”方法制备供试品溶液,按“1.6.3”方法加入10 μL ST5,加标量为1 pg ,按照“1.7”方法处理得到加样回收纯化液,采用“1.8”方法检测,分别重复3次检测,计算其RSD。
1.10 方法的应用
应用建立的方法对5种头孢类产品中产黄枝顶孢霉残留DNA进行检测,按照“1.6.2”方法制备供试品溶液,“1.7”方法处理得到供试品纯化液,采用“1.8”方法检测供试品溶液中DNA含量。
2 结果
2.1 方法学验证结果
2.1.1 线性与范围
线性结果显示在DNA含量为10 fg/μL~1 ng/μL的范围内,线性关系良好,建立标准曲线,得到方程 Y=27.671-3.196×logX(Y为标准DNA溶液的Ct值,X 为标准DNA溶液的浓度),相关系数R2=0.997,扩增效率为105.5%(图1)。根据标准DNA溶液线性考察结果分析,标准DNA溶液终浓度为10 fg/μL时,以供试品浓度20 mg/mL计,相当于250 pg/g,以此浓度作为标准DNA溶液在供试品溶液中的LOQ,以LOQ的三分之一作为LOD,以供试品浓度20 mg/mL计,相当于83 pg/g。根据2020年版《中国药典》及《人用重组DNA制品质量控制要点》的相关规定,生物制品残留DNA的检出限一般为10 ng/剂~100 pg/剂[17-18],参考生物制品的残留DNA检出限,本方法的检出限可满足检测需求。
2.1.2 专属性
取产黄枝顶孢霉及产黄青霉、大肠埃希菌和枯草芽胞杆菌基因组DNA,进行qPCR扩增,结果显示,产黄枝顶孢霉扩增情况良好,产黄青霉、大肠埃希菌、枯草芽胞杆菌基因组DNA均未能扩增,NCS未检出(图2)。综上所述,建立的qPCR方法专属性良好。
2.1.3 准确度
按照“1.9.3”验证准确度,各品种的3个不同浓度的加样回收结果均符合要求,在50%~150%之间;PCS的回收率在50%~150%之间(表4),准确度结果良好。
2.1.4 重复性和精密度
以B202212165批7-ACA原料为代表供试品,考察日内和日间精密度,按照“1.9.4”方案,由实验员不同日期对低浓度供试品进行回收提取并检测,考察日内和日间实验浓度RSD值,结果见表5,结果显示,供试品日内和日间RSD值在30%以下,符合重复性和精密度要求。
2.2 供试品测定结果
头孢类产品中产黄枝顶孢霉残留DNA检测结果见表6,结果显示,5批供试品中的产黄枝顶孢霉菌残留DNA均在检测限以下。
3 讨论
发酵类和半合成类抗生素会面临类似宿主细胞来源DNA残留所带来的潜在风险,因此,需严格控制残留DNA含量。近年来,由于qPCR检测残留DNA更加快速、灵敏,该方法逐渐应用于残留DNA含量的检测,2020年版《中国药典》将qPCR法加入残留DNA含量的检测,并规定不同品种的生物制品中残留DNA的限度要求为10 ng/剂~100 pg/劑,基于CHO细胞基质的疫苗在原液阶段的残留DNA含量不高于10 pg/剂[17]。《人用重组DNA制品质量控制要点》中要求必须用敏感的方法测定来源于宿主细胞的残余 DNA含量,这对于用哺乳动物传代细胞( 转化的细胞系) 生产的制品尤为重要,一般认为残余DNA含量小于100 pg/剂是安全的[18]。目前尚无针对发酵类和半合成类抗生素的残留DNA规定。考虑头孢类产品一般使用工程菌发酵,与连续传代的肿瘤细胞株相比,其安全性相对较高,因此可参考非肿瘤细胞株的宿主残留DNA的规定[17],将其残留安全剂量制定为10 ng/剂。
本研究开发了离心柱法结合qPCR探针法对5种头孢类产品中残留DNA含量进行检测,并进行了方法学验证,结果显示,方法的专属性、线性、准确度、重复性、精密度等各项指标均可达到方法验证的要求,方法检测限低至83 pg/g,远低于10 ng/剂的安全剂量,可以满足头孢类产品宿主残留DNA的检测需求。由于产黄枝顶孢霉基因组DNA尚无法定标准品,本研究所用的标准品DNA为实验室提取的产黄枝顶孢霉基因组DNA,采用Nanodrop One超微量可见分光光度计测定其浓度,可能存在标准DNA浓度测定不准确的问题,因此本文建立的qPCR仅能相对定量,下一步需要采取更加准确的浓度方法测定产黄枝顶孢霉基因组DNA浓度,并做进一步研究;另外,本文仅采用5种头孢类产品进行方法学验证和检测,下一步将扩大引物设计选择和验证规模,选取不同厂家的多种头孢类产品、半成品和发酵原液,检测其残留DNA水平,为头孢类抗生素中残留DNA检测提供合理且客观的质量标准数据。
参 考 文 献
刘钢. 头孢菌素C的生物合成及其调控[J]. 四川师范大学学报, 2020, 43(5): 569-579.
牛李杰, 张婷, 张宝新, 等. 头孢菌素C产生菌的诱变育种及发酵应用[J]. 化学与生物工程, 2021, 38(10): 57-61.
吴耀辉, 刘丹君, 王永红, 等. 酶法合成头孢羟氨苄工艺研究[J]. 中国抗生素杂志, 2016, 41(4): 255-260.
沈星, 肖东北. 新型头孢菌素类抗生素合成路线及合成材料[J]. 医药化工, 2022, 48(12): 209-211.
张宏, 王艳戎, 罗兰. 固定化酶解法合成7-ACA的方法研究[J]. 化学试剂, 2019, 41(2): 194-198.
Varnamkhasti F A, Kia V, Shokri R, et al. Design and development of a simple method for the detection and quantification of residual host cell DNA in recombinant rotavirus vaccine [J]. Mol Cell Probes, 2021, 55: 101674-101677.
Zheng W, Jiang L, Lei Q, et al. Development and validation of quantitative real-time PCR for the detection of residual CHO host cell DNA and optimization of sample pretreatment method in biopharmaceutical products[J]. Biol Proced Online, 2019, 21: 17-23.
Knezevic I, Stacey G, Petricciani J. Evaluation of cell substrates for the production of biologicals: Revision of WHO recommendations[J]. Biologicals, 2010, 38(1): 162-169.
王琰, 姚尚辰, 常艳, 等. 发酵类抗生素中残留蛋白通用性测定方法的探讨[J]. 中国新药杂志, 2015, 24(10): 1178-1186.
Wang Y, Zhang P, Yao S, et al. Integrative strategy to determine residual proteins in cefaclor produced by immobilized penicillin G acylase[J]. J Pharmaceut Biomed, 2020, 185: 113229-113236.
Xu M, Ma S, Hu C. Gel filtration chromatography combined with bradford method for determination of total residual protein in ferment antibiotics[J]. J Chin Pharmaceut Sci, 2004, 13(4): 262-266.
國家药典委员会. 中华人民共和国药典[S]. (三部). 北京: 中国医药科技出版社, 2020: 555-558.
王琰, 张培培, 崔生辉, 等. 发酵类脂溶性药物中残留DNA检测关键影响因素——溶剂的筛选与确定[J]. 药物分析杂志, 2020, 40(4): 651-658.
姜睿姣, 周丽军, 邬旭龙, 等. 副猪嗜血杆菌及巴氏杆菌双重荧光定量PCR检测方法的建立[J]. 中国预防兽医学报, 2019, 41(5): 489-494.
韩学贞. 荧光定量聚合酶链反应检测常见致病真菌方法的建立[J]. 检验医学与临床, 2012, 9(24): 3112-3114.
杨萍, 张艳, 李微, 等. 重组人肠道病毒71型病毒样颗粒疫苗外源DNA残留量检测方法的建立[J]. 中国生物制品学杂志, 2020, 33(3): 308-315.
国家药典委员会. 中华人民共和国药典[S]. (三部). 北京: 中国医药科技出版社, 2020: 151-168.
卫生部. 人用重组DNA制品质量控制要点[S]. 北京: 卫生部, 1990: 1-5.
