弗氏柠檬酸杆菌SYBRGreenⅠ荧光定量PCR诊断方法的建立及耐药性分析
2017-03-21王芳康超李永霞
王芳+康超+李永霞

摘要:根据GenBank中弗氏柠檬酸杆菌ompA基因序列,设计1对特异性引物,PCR扩增弗氏柠檬酸杆菌ompA基因片段,T克隆到pMD-18T载体上构建标准阳性质粒。通过SYBR Green Ⅰ荧光定量PCR反应条件优化,建立弗氏柠檬酸杆菌SYBR Green Ⅰ荧光定量PCR诊断方法,结果显示重复性好、特异性高,灵敏度可达1.0×101拷贝/μL,说明建立的弗氏柠檬酸杆菌SYBR Green Ⅰ荧光定量PCR方法适合于弗氏柠檬酸杆菌病临床疑似病料样品的快速诊断。对分离得到的83株弗氏柠檬酸杆菌进行药敏试验,结果表明冷水鱼养殖中耐药性问题日益严重。
关键词:弗氏柠檬酸杆菌;荧光定量PCR;快速诊断;耐药性
中图分类号: S855.1+2 文献标志码: A
文章编号:1002-1302(2016)11-0286-04
弗氏柠檬酸杆菌(Citrobacter freundii)是革兰氏阴性菌、短杆菌,该菌在水体、土壤中广泛存在,是一种条件致病菌,可引起人、畜、鱼类的败血症[1-3]。近几年,贵州省冷水鱼的养殖发展迅速,主要品种有虹鳟、金鳟、斑点鳟鲑、鲟鱼、大鲵。随着冷水鱼养殖场(户)集约化程度不断提高,苗种流通交换量不断加大,病害逐渐增多,病情不断愈趋复杂。目前,弗氏柠檬酸杆菌感染的病害报道主要集中在鲟鱼、虾、中华鳖,而鳟鲑鱼、大鲵报道较少。感染该菌的鲟鱼、虾、中华鳖、鳟鲑鱼和大鲵出现消化不良或拒食,头部、腹部肿大,轻度腹水,皮下有出血点等症状[4-7]。传统的细菌分离鉴定耗时较长,不能快速、准确地得到鉴定结果。荧光定量PCR技术进行疾病病原菌的鉴定和诊断,较普通PCR反应程序快、特异性强、灵敏度高、重复性好、结果简单可视。本研究根据GenBank中弗氏柠檬酸杆菌ompA序列,设计1对特异性引物,PCR扩增出ompA基因片段,克隆到pMD-18T载体上,构建阳性标准品。通过对荧光定量PCR反应条件的优化,建立弗氏柠檬酸杆菌的SYBR Green Ⅰ荧光定量PCR诊断方法,以期对弗氏柠檬酸杆菌临床疑似病样进行快速检测和诊断。同时,对冷水鱼养殖场分离得到的弗氏柠檬酸杆菌进行耐药性分析,为探讨防治弗氏柠檬酸杆菌病提供科学依据。
1 材料与方法
1.1 试验材料
试验菌株包括弗氏柠檬酸杆菌、致病性嗜水气单胞菌、荧光假单胞菌、黄杆菌、迟缓爱德华菌,由贵州重大疫病监测防制重点实验室保存。
主要试剂包括普通PCR酶、SYBR Green Ⅰ荧光定量PCR酶、核酸染料Goldview、1×TAE电泳缓冲液、DL2000、DH5α感受态细胞、细菌基因组DNA提取试剂盒、PBS缓冲液等、pMD-18T连接载体,均购自生工生物工程(上海)股份有限公司;药敏试纸片,购自杭州微生物试剂有限公司;其他为国产分析纯试剂。
1.2 试验方法
1.2.1 引物设计 根据GenBank中弗氏柠檬酸杆菌ompA序列,设计1对引物,上游引物为5′-CTTGCTCCTTGGGTGACGAGTGG-3′,下游引物为5′-TCTGGGGTCTCCTTCGTAAATGC-3′,预计扩增产物大小为117 bp,引物为生工生物工程(上海)股份有限公司合成。
1.2.2 核酸的提取
1.2.2.1 组织样品 取患病冷水鱼肝脏组织约2.0 g,加入0.1 mol/L PBS缓冲液5 mL进行研磨,然后置于-70 ℃低温冰箱中反复冻融3次,5 000 r/min离心5 min,取上清液 970 μL 加入10% SDS 20 μL,20 mg/mL蛋白酶K 10 μL,55 ℃ 孵育30 min,5 000 r/min离心5 min,取上清液200 μL,用细菌基因组DNA试剂盒提取基因组。
1.2.2.2 细菌样品 细菌样品DNA的提取参照细菌基因组DNA提取试剂盒说明书进行。
1.2.3 pMD-18T- fre阳性标准品的制备 通过PCR扩增获得弗氏柠檬酸杆菌ompA基因片段,PCR反应程序为:94 ℃ 5 min;94 ℃ 30 s,退火温度55 ℃ 30 s,72 ℃ 1 min,30个循环;72 ℃延伸10 min。将扩增的PCR产物用琼脂糖凝胶DNA回收试剂盒回收DNA片段,与pMD-18T克隆载体连接,转化感受态细胞DH5α,重组体命名为pMD-18T-fre,同时送往生工生物工程(上海)股份有限公司测序。用紫外分光光度计测定测序正确的重组质粒pMD-18T-fre在260、280 nm处的吸光度,得到重组质粒的浓度和纯度,进行10倍梯度倍比稀释。
1.2.4 荧光定量PCR反应条件的优化 荧光定量PCR反应体系为25 μL,对退火温度在50、55、60 ℃等3個温度上进行优化,引物浓度在5、10、20 μmol/L等3个浓度上进行优化,以确定最佳反应条件。反应体系为:上下游引物各1 μL,Premix Ex Taq 12.5 μL,ROX Reference Dye 0.5 μL,模板 1 μL,用超纯水补足至25 μL,同时以超纯水作为空白对照。反应条件为:94 ℃ 10 s;94 ℃ 10 s,退火温度(50、55、60 ℃)10 s,72 ℃ 10 s,40个循环。
1.2.5 荧光定量PCR反应标准曲线的构建 用紫外分光光度计测定pMD-18T-fre质粒,计算出浓度、纯度和DNA拷贝数,将标准阳性质粒进行10倍倍比稀释,以“1.2.4”节下优化好的条件进行扩增,每个稀释倍数进行3次重复,以核酸拷贝数为横坐标,以Ct值为纵坐标建立标准曲线。
1.2.6 敏感性试验 将10倍倍比稀释后的pMD-18T-fre质粒分别进行荧光定量PCR反应,每个稀释倍数3次重复,以研究建立的荧光定量PCR诊断的敏感性。
1.2.7 特异性试验 分别以弗氏柠檬酸杆菌、致病性嗜水气单胞菌、荧光假单胞菌、黄杆菌、迟缓爱德华菌DNA进行荧光定量PCR反应,每种细菌DNA 3次重复,以研究建立的荧光定量PCR诊断方法的特异性。
1.2.8 重复性试验 应用建立的荧光定量PCR方法重复检测弗氏柠檬酸杆菌DNA标准阳性样品3次,以研究检验结果的可靠性。
1.2.9 建立的荧光定量PCR对临床样品的检测 对2013年1月至2015年5月贵州省贵阳市、黔西南、铜仁地区几个规模化鳟鲑鱼、大鲵养殖场以及散养户采集的356份疑似鳟鲑鱼、大鲵病料(肝脏),135份大鲵饵料鱼病料,184份发病鳟鲑鱼、大鲵养殖场水样,应用建立的荧光定量PCR方法进行检测,同时应用传统的细菌分离鉴定进行检测比对。
1.2.10 弗氏柠檬酸杆菌的耐药性分析 对2013年1月至2015年5月贵州省贵阳市、黔西南、铜仁地区几个规模化冷水鱼养殖场分离得到的弗氏柠檬酸杆菌运用药敏纸片法检测分离菌对18种抗生素药物的敏感性,药敏试纸片包括青霉素、氨苄西林、头孢噻吩、头孢拉定、头孢唑林、链霉素、庆大霉素、诺氟沙星、恩诺沙星、氟苯尼考、强力霉素、红霉素、利福平、呋喃唑酮、卡那霉素、土霉素、林可霉素、磺胺二甲嘧啶钠。
2 结果与分析
2.1 pMD-18T-fre阳性标准品的制备
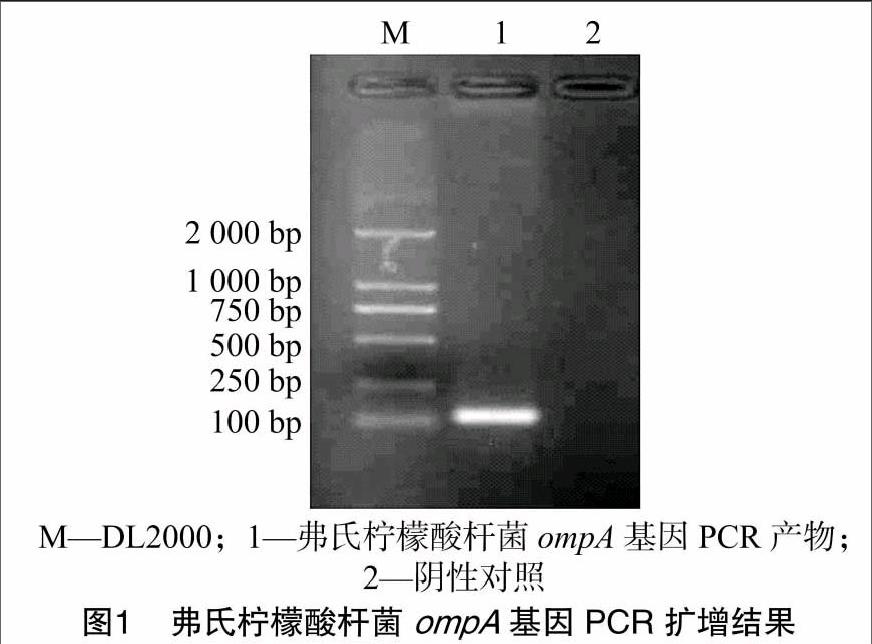
扩增的弗氏柠檬酸杆菌ompA片段大小为117 bp,无非特异性片段产生(图1)。将生工生物工程(上海)股份有限公司测序结果与GenBank中的ompA基因序列进行比对,核苷酸相似度为98.9%~100.0%。
2.2 荧光定量PCR反应条件的优化
通过荧光定量PCR反应条件的优化,在25 μL反应体系中,最佳反应条件为Premix Ex Taq 12.5 μL、ROX Reference Dye 0.5 μL、10 μmol/L上下游引物各1 μL、模板2 μL、超纯水8 μL,反应条件为:94 ℃ 10 s;94 ℃ 10 s,退火温度55 ℃ 10 s,72 ℃ 10 s,40个循环。
2.3 荧光定量PCR反应标准曲线的构建
将标准样品进行10倍倍比稀释,分别取1.0×101、1.0×102、1.0×103、1.0×104、1.0×105拷贝/μL的重组质粒为模板,进行荧光定量PCR扩增反应,得到扩增反应的标准曲线(图2),线性回归方程为Ct=-2.980×lg(核酸拷贝数)+9.27(r2=0.999)。
2.4 熔解曲线分析
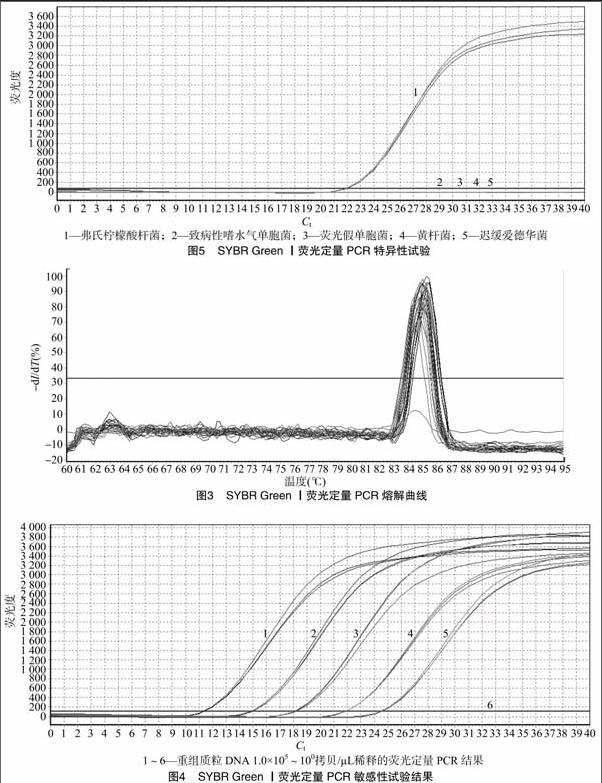
扩增产物的熔解温度Tm为84.6~85.4 ℃,无引物二聚体和非特异性产物等峰值出现(图3)。
2.5 敏感性试验
将标准样品进行10倍倍比稀释,分别取1.0×100、1.0×101、1.0×102、1.0×103、1.0×104、1.0×105拷贝/μL重组质粒作为模板,进行荧光定量PCR扩增,结果(图4)显示其灵敏度为1.0×101拷贝/μL。
2.6 特异性试验
以弗氏柠檬酸杆菌、致病性嗜水气单胞菌、荧光假单胞菌、黄杆菌、迟缓爱德华菌DNA进行荧光定量PCR反应,每个菌株进行3次重复,结果显示弗氏柠檬酸杆菌为阳性,而致病性嗜水气单胞菌、荧光假单胞菌、黄杆菌、迟缓爱德华菌为阴性(图5)。
2.7 重复性试验
应用建立的荧光定量PCR方法检测弗氏柠檬酸杆菌DNA,样品重复3次,以检验结果的重复性,结果均一致。
2.8 临床样品的检测结果
应用建立的荧光定量PCR方法进行检测采集的356份鳟鲑鱼、大鲵病料(肝脏)弗氏柠檬酸杆菌阳性率为26.4%(94/356),135份大鲵饵料鱼病料阳性率为 11.1%(15/135),64份发病鳟鲑鱼、大鲵养殖场水样阳性率20.3%(13/64)。传统的细菌分离鉴定356份鳟鲑鱼、大鲵病料(肝脏)弗氏柠檬酸杆菌阳性率为19.1%(68/356),135份大鲵饵料鱼病料阳性率为7.4%(10/135),64份发病鳟鲑鱼、大鲵养殖场水样阳性率7.8%(5/64)。荧光定量PCR方法敏感性均高于传统的细菌分离鉴定。
2.9 弗氏柠檬酸杆菌的耐药性分析
将2013年1月至2015年5月贵州省贵阳市、黔西南、铜仁地区几个规模化冷水鱼养殖场分离得到83株弗氏柠檬酸杆菌进行药敏试验,结果见表1。
3 结论与讨论
目前,临床常用的病原菌鉴定方法主要有传统平板分离培养及生化鉴定。随着生物技术的快速发展,与传统鉴定方法相比,基于SYBR GreenⅠ的实时荧光定量PCR技术具有快速、准确的优势,适合于临床样品的快速诊断。余波等利用传统鉴定方法结合PCR測序对大鲵细菌性败血症病原进行分离鉴定,从对病原菌分离、培养、纯化,到生化鉴定整个过程最快需要1周[8]。胡秀彩等采用弗氏柠檬酸杆菌16S rDNA V3区的PCR-SSCP图谱进行菌株鉴别效果良好[9]。余波等研制的致病性嗜水气单胞菌 SYBR Green Ⅰ实时荧光定量 PCR试剂盒具有特异、灵敏、快速等特点,敏感度达到1.0×101拷贝/μL[10]。本研究根据GenBank中弗氏柠檬酸杆菌ompA基因序列,设计1对引物,PCR扩增获得ompA基因片段,将其克隆到pMD-18T载体上构建标准品阳性质粒。通过SYBR Green Ⅰ荧光定量PCR反应条件的优化,建立弗氏柠檬酸杆菌SYBR Green Ⅰ荧光定量PCR诊断方法,灵敏度可达1.0×101拷贝/μL。传统细菌分离和荧光定量均能检测到养殖用水和饵料鱼中存在弗氏柠檬酸杆菌,表明该菌是在冷水鱼养殖中广泛存在的,当养殖密度提高以及鳟鲑鱼、大鲵大鲵免疫力下降时就容易发病。因此,控制好水质、饵料,提高冷水鱼自身的免疫力,对弗氏柠檬酸杆菌的防治至关重要。
目前,弗氏柠檬酸杆菌的耐药性报道较少,Chuang等报道了弗氏柠檬酸杆菌对头孢噻肟耐药性[11],Nawaz等报道了耐四环素的弗氏柠檬酸杆菌的分离鉴定[12]。本研究药敏试验结果表明,分离得到的83株弗氏柠檬酸杆菌对目前应用较为广泛的青霉素、链霉素、土霉素等产生了较强的耐药性,仅头孢类和氟苯尼考敏感,说明目前在冷水鱼养殖中耐药性问题也较严重,抗生素的滥用在冷水鱼上要引起重视。
参考文献:
[1]何晓青. 柠檬酸杆菌属的分类与鉴定[J]. 中国卫生检验杂志,2005,15(12):1535-1536.
[2]周 联,张希圣,刘添发,等. 一起弗氏柠檬酸杆菌引起的食物中毒[J]. 现代预防医学,2002,29(5):678-678, 680.
[3]陈红莲,宋光同,何吉祥,等. 克氏原螯虾弗氏柠檬酸杆菌的分离鉴定与药敏试验[J]. 淡水渔业,2014,43(1):73-77.
[4]杨移斌,夏永涛,赵 蕾,等. 鲟源弗氏柠檬酸杆菌分离鉴定及药敏特性研究[J]. 水生生物学报,2013,37(4):766-771.
[5]杨移斌,曹海鹏,夏永涛,等. 41种中草药对3种鲟源病原茵的体外抑菌效果[J]. 淡水渔业,2013,43(4):80-84.
[6]田飞焱,欧阳敏,张晓燕,等. 中华鳖弗氏柠檬酸杆菌的分离、鉴定及药物敏感性试验[J]. 水产学杂志,2013,26(4):42-46.
[7]高正勇,曾令兵,孟 彦,等. 患病大鲵中弗氏柠檬酸杆菌的分离与鉴定[J]. 微生物学报,2012,52(2):169-176.
[8]余 波,徐景峨,谭诗文,等. 大鲵细菌性败血症病原的分离鉴定与药敏特性[J]. 中国兽医杂志,2011,47(1):30-31.
[9]胡秀彩,王 艺,吕爱军. 弗氏柠檬酸杆菌的分离鉴定与PCR-SSCP分析[J]. 微生物学杂志,2011,31(4):12-18.
[10]余 波,羅永成,马永兵,等. 大鲵致病性嗜水气单胞菌SYBR Green Ⅰ 荧光定量PCR诊断试剂盒的研制[J]. 基因组学与应用生物学,2014,33(5):1098-1103.
[11]Chuang Y M, Tseng S P, Teng L J, et al. Emergence of cefotaxime resistance in Citrobacter freundii causing necrotizing fasciitis and osteomyelitis[J]. The Journal of Infection, 2006, 53(3):e161-e163.
[12]Nawaz M, Khan A A, Khan S, et al. Isolation and characterization of tetracycline-resistant Citrobacter spp. from catfish[J]. Food Microbiology,2008,25(1):85-91.
