光敏抗菌药物及光敏抗菌材料研究进展
2023-03-14袁露平洪阁刘天军
袁露平 洪阁 刘天军

摘要:细菌广义上是一类个体微小、结构简单、生命力顽强的原核生物。它与人类的生活息息相关,是许多疾病的病原体。随着抗生素的滥用,越来越多的细菌产生了耐药性,甚至有的细菌获得了多重耐药性,导致临床上出现了用药困难的世界性难题,因此发展新型的抗菌剂已经迫在眉睫。光动力抗菌是一种新型抗菌疗法,其不仅不易产生耐药性,而且抗菌效果更好,是目前最有希望的一种替代疗法。故本文主要对抗菌光敏药物(卟啉及其衍生物、酞菁及其衍生物、吩噻嗪类光敏剂、其他类光敏剂)以及光敏抗菌材料(光催化抗菌材料、光动力抗菌材料、光热抗菌材料)的开发现状进行综述。
关键词:细菌感染;光动力疗法;光敏剂;光敏抗菌材料
中图分类号:R978文献标志码:A
Research progress of photosensitive antibacterial drugs and photosensitive antibacterial materials
Yuan Luping1, Hong Ge2, and Liu Tianjun2
(1 Tianjin University of Traditional Chinese Medicine, Tianjin 301617; 2 Tianjin Key Laboratory of Biomedical materials, Institute of Biomedical Engineering, Chinese Academy of Medical Sciences and Peking Union Medical College, Tianjin 300192)
Abstract Bacteria are, in a broad sense, a class of prokaryotes with small individuals, simple structures and tenacious vitality. They are closely related to human life and are the pathogens of many diseases. With the abuse of antibiotics, more and more bacteria have developed drug resistance, and some bacteria have even acquired multiple drug resistances. As a result, there is a worldwide problem of clinical difficulty in drug use, so the development of new antimicrobial agents is imminent. The photodynamic antibacterial method is a new type of antibacterial therapy. It is not only hard to produce drug resistance but also has a better antibacterial effect. It is the most promising alternative therapy at present. Therefore, this article mainly briefly reviews the development of photosensitive antibacterial drugs (porphyrin and its derivatives, phthation and its derivatives, phenothiazide photosensitive agents, and other photosensitive agents) and photosensitive antibacterial materials (photosynthetic antibacterial materials, photodynamic antibacterial materials, and photothermal antibacterial materials).
Key words Bacterial infection; Photodynamic therapy; Photosensitizer; Photosensitive antibacterial material
细菌感染一直以来都困扰着人类,20世纪初抗生素的发现解决了当时的感染困境,拯救了无数生命。然而,随着抗生素的长期使用以及滥用导致了细菌耐药性(antimicrobial resistance, AMR)产生。近年随着AMR持续的上升,世界卫生组织预测到2050年,这种由耐药产生的流行病每年将导致1000万人死亡,经济负担将达到100万亿美元[1]。
光动力疗法(photodynamic therapy, PDT)是光敏劑(photosensitizer, PS)在一定波长的光照下,会产生对靶细胞有毒的单线态氧(1O2)从而杀死特定靶细胞的一种新型治疗方法[2]。抗菌光动力疗法(photodynamic antimicrobial therapy, PACT)是PDT的衍生疗法,其能杀灭敏感细菌和耐药细菌,且不会出现耐药性[3]。其作用机制主要为光敏剂在一定波长的可见光照射下,由基态(单重态)跃迁至激发单重态,寿命较短的激发单重态通过快速的极间跃迁生成激发三重态,然后与环境中的分子氧发生电子转移或能量传递反应,产生具有细胞毒性的活性氧(reactive oxygen species, ROS),ROS能够以非特异性方式有效杀灭对药物敏感和有耐受的病原体[4],并且不会导致细菌产生耐药性[5]。因此在本篇综述中,分别对抗菌药物(卟啉及其衍生物、酞菁及其衍生物、吩噻嗪类光敏剂、其他类光敏剂)以及光敏抗菌材料(光催化抗菌材料、光动力抗菌材料、光热抗菌材料)的研发现状进行简单的综述
1 光敏抗菌药物
自从20世纪初发现具有光敏作用的染料后,大量的学者便开始对其进行了研究。虽然目前不管是天然提取还是实验室合成都得到了许多种光敏剂,但由于各种原因被临床批准作为药物治疗的光敏剂却非常少[6]。
1.1 卟啉及其衍生物
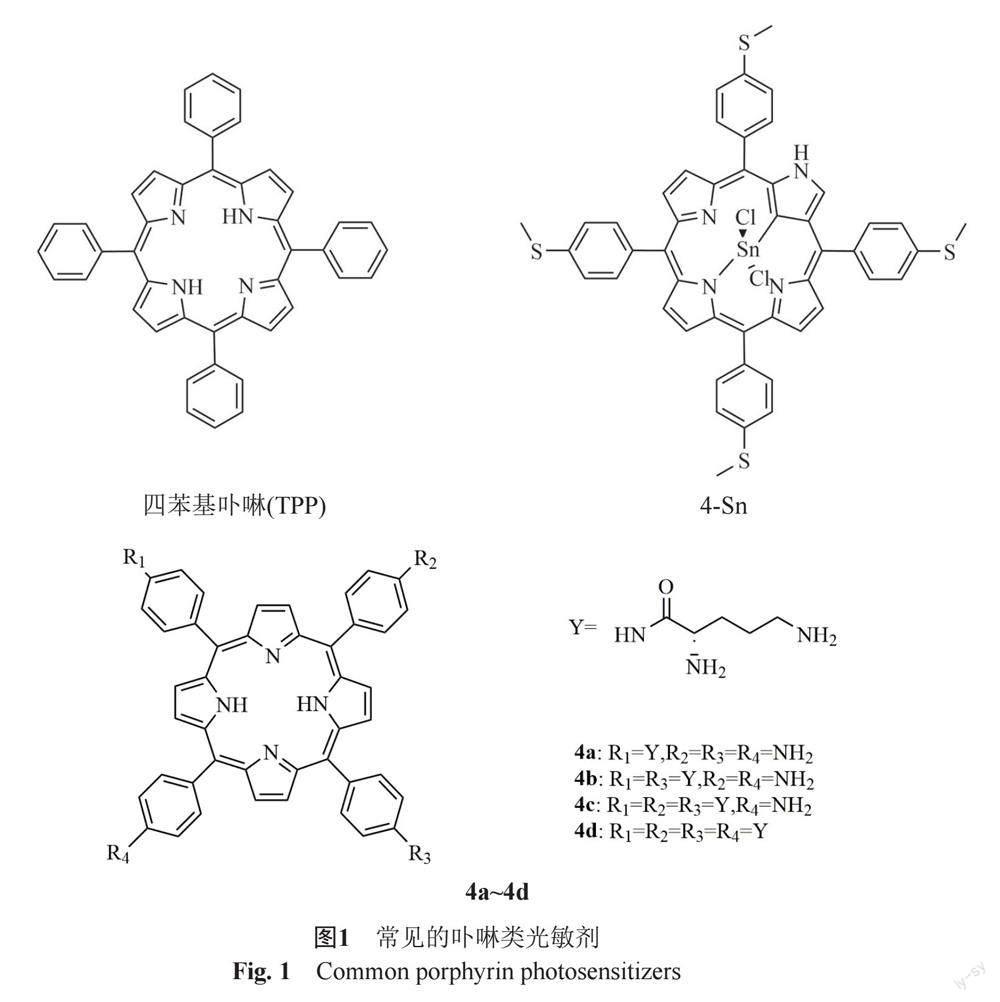
卟啉(porphyrin)是由一个取代的芳香大环(其中4个次甲基桥(=CH-)连接4个吡咯型残基)组成(图1)。卟啉光动力灭活细菌的机制非常复杂且不具有特异性[7]。许多研究者[8]认为是由I型和II型反应产生的ROS通过功能损伤、形态学变化、细胞膜损伤这3种主要机制引起细菌死亡。1981年Ito[9]第一次发表论文提出卟啉化合物可用于光动力抗菌,其研究发现,在光照条件下,血卟啉会通过改变酵母菌菌体细胞膜的通透性,破坏菌体正常代谢而杀灭酵母菌。Ito又对其进行进一步研究,发现其抗菌性与卟啉环的带电性有关,阳离子卟啉类化合物比阴离子和中性卟啉类化合物抗菌能力强。后续学者对阳离子卟啉类化合物进行了大量研究,发现阳离子卟啉抗菌能力强的主要原因,是其带正电的基团可以与细菌细胞壁上带负电的脂多糖或肽聚糖相互作用,提高与细菌的结合能力,从而能更有效杀灭细菌[10-12]。Meng等[13]设计并合成了抗多重耐药奇异变形杆菌(MRPM)的新型阳离子光敏剂(4a~4d)(图1),发现含有4个鸟氨酸基团的卟啉光敏剂4d表现出较高的MRPM光灭活能力,其可以通过PACT破坏细菌膜的完整性并改变其渗透性。Dingiswayo等[14]制备Sn(IV)中四(4-甲基噻吩基)N-络合卟啉配合物,并评价了它们的光物理化学性质和单线态氧产率,发现4-Sn(图1)对革兰阳性菌(金黄色葡萄球菌)和革兰阴性菌(大肠埃希菌)都具有较强的杀灭作用。
1.2 酞菁及其衍生物
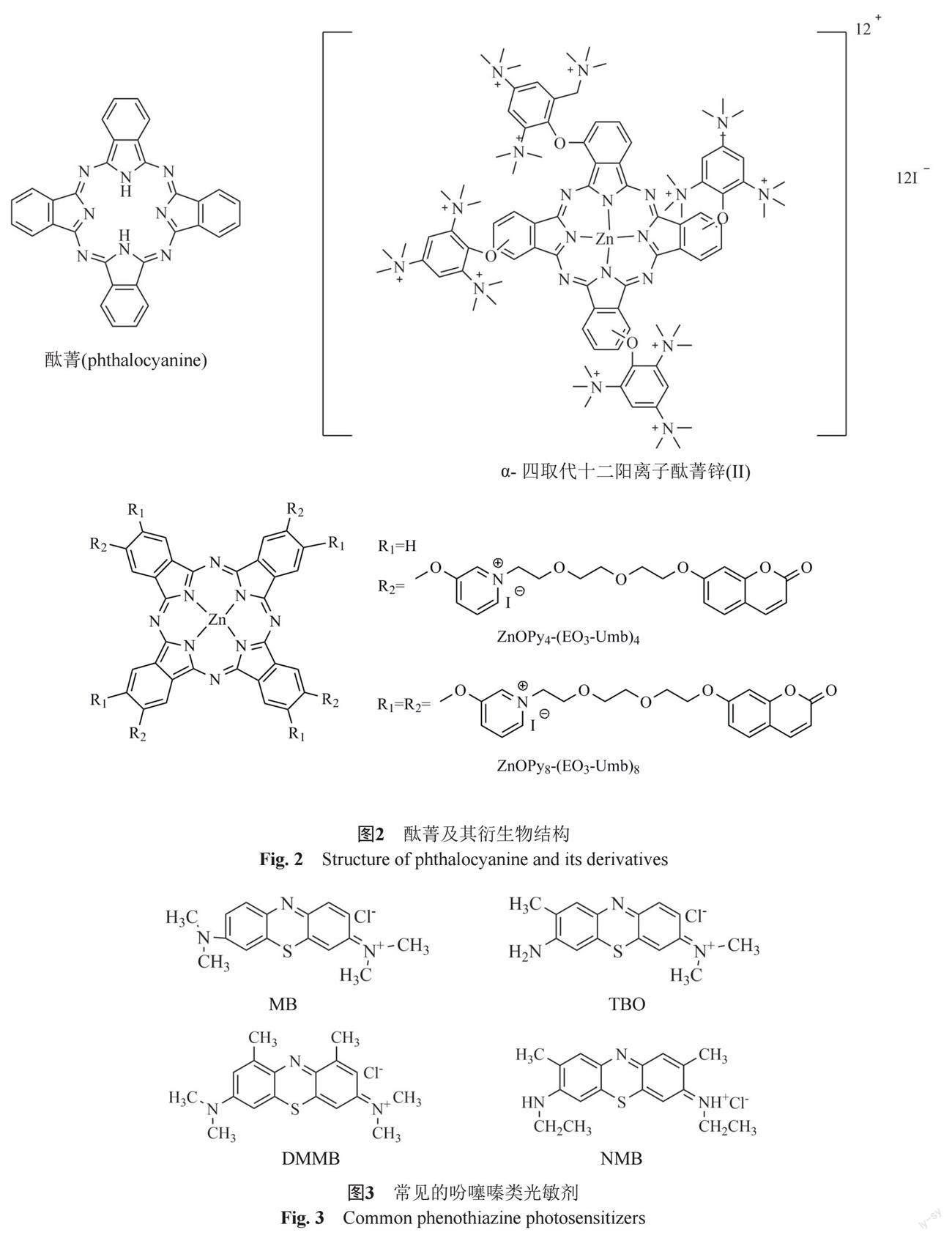
酞菁(phthalocyanine, Pc)被认为是PDT中的第二代光敏剂[15],它由4个氮原子连接4个异吲哚形成的一个内16元环(图2),具有长的三重态寿命,且单重态氧量子产率高。酞菁是一种很有前途的光敏剂,具有很强的共轭π键,其在650~800 nm有很强的光吸收[16]。强共轭π键的光敏剂可以产生更多的ROS,同时高共轭的Pc也会在水介质中聚集,降低其ROS效率和PDT效率[17]。为了克服这一缺点,在Pc分子中引入亲水基团来增加溶解度从而防止π-π键的叠加。Zhao等[18]对其进行了大量研究,发现带有大量正电荷的阳离子聚合物可以破坏细菌表面带负电的磷脂层,Pc的阳离子聚合物可以通过静电相互作用促进Pc在细菌膜上的吸附。光照后,产生的活性氧将直接与细菌细胞相互作用,从而扩散到细菌膜中,增强抗菌性能。赵阳等[19]合成了一种新型水溶性α-四取代十二阳离子酞菁锌(II)(图2),研究发现,其对白色念珠菌、红色毛癣菌、须癣毛癣菌的IC90分别为1.9、44和42.5 μmol/L,并且对真菌细胞有一定的选择性。Hu等[20]成功地合成了2种水溶性锌(II)酞菁:四香豆素取代[ZnOPy4-(EO3-Umb)4]和八香豆素取代[ZnOPy8-(EO3-Umb)8](图2),研究发现这2种化合物在光照射下具有极强的抗菌活性,能快速杀灭革兰 阳性和革兰阴性细菌,此外低浓度和极少量的光剂量已经足以杀死大多数细胞或细菌,在光敏抗菌领域有非常大的应用前景。
1.3 吩噻嗪类光敏剂
自19世纪以来,吩噻嗪类光敏剂广泛应用于生物医学研究和临床治疗,是目前临床上应用广泛的光敏剂之一。常见的吩噻嗪类光敏剂有亚甲蓝(methylene blue, MB)、甲苯胺蓝O(toluidine blueO, TBO)、新亚甲蓝(newmethylene blue, NMB)和二甲基蓝(dimethylmethylene blue, DMMB)等(图3)。其中MB和TBO是亲水性光敏剂,主要用于肿瘤方面的研究,抗菌方面研究较少。而最近研发的亲脂性吩噻嗪类光敏剂NMB和DMMB主要致力于抗微生物方面的研究[18]。国外已有相关研究[21]表明吩噻嗪类光敏剂对真菌的杀伤作用。国内学者李庆妮[22]通过实验发现发现吩噻嗪类光敏剂中DMMB對白色念珠菌的体外杀伤作用最强,同时发现DMMB介导的PACT对艾滋病(acquired immune deficiency syndrome, AIDS)患者合并的口腔白色念珠菌感染也具有杀伤作用。此研究为筛选出能应用临床的PACT吩噻嗪类光敏剂提供了可靠依据。
1.4 天然光敏剂及其衍生物
核黄素(RF,即VB2)、金丝桃素(HY)和姜黄素(E100)等天然光敏剂是PACT的良好候选品种(图4)。核黄素是一种水溶性维生素,呈黄绿色荧光,研究发现核黄素及其衍生物作为光敏剂能有效抑制引起角膜炎的微生物[23],并能杀灭大肠埃希菌、粪肠杆菌等。Khan等[23]通过使用大肠埃希菌作为研究模型,证明了核黄素的光动力抗菌潜力,而且发现光活化核黄素的机制并不针对任何蛋白质或序列,而是利用核黄素的基本化学特性来产生ROS。Maisch等[24]合成了一种核黄素衍生物,1O2量子产率为75%,该分子表面额外的正电荷使其能够附着在革兰阴性病原体带负电荷的表面,使其具有快速和高效的抗菌活性。金丝桃素(HY)是从天然中草药贯叶连翘中发现的,一种新型光敏剂,具有抗炎、抗肿瘤、增强免疫力等生物学活性[25]。此外还发现金丝桃素在体外可以利用光动力杀灭铜绿假单胞菌。肖冬梅等[26]采用96孔培养板和细菌涂板法进行实验,结果表明金丝桃素介导的体外光动力治疗最佳杀灭铜绿假单胞菌的条件为孵化时间是60 min、适宜的光照时间是30 min,但由于金丝桃素不溶于水,极大地限制了其在水相体系的应用,后续还需对其结构进行改造。姜黄素(curcumins)是在姜黄块根中发现的具有光学活性的化合物,是一种黄色的多酚类色素,激发波长420~460 nm,不易溶于水。姜黄素粗提物在民族药理学中具有抗炎、抗氧化、抗菌和降糖等作用[27]。多项研究表明[28]姜黄素的光激发可降低粪肠球菌、大肠埃希菌和金黄色葡萄球菌的生长。但也有一些研究表明[29],姜黄素作为光敏剂对变形链球菌、血链球菌和白色念珠菌的效率低于其他许多常见的光敏剂,如孟加拉玫瑰红或亚甲基蓝等。
2 光敏抗菌材料
常见的抗菌材料有金属离子、季铵盐和肽等[30]。这些材料的抗菌速度快、效果好,但安全性无法保证,抗菌过程不可控[31]。因此我们就需要外源性抗菌剂使用外部刺激物刺激材料产生活性氧(ROS)或热量来对抗细菌从而杀死细菌。目前,外界刺激主要包括光、电、磁、微波、超声等。光敏抗菌材料主要包括光催化抗菌材料、光动力抗菌材料和光热抗菌材料等,见表1。
对光敏抗菌材料的研究现状进行简单文献汇总,见表2。
2.1 光催化抗菌材料
光催化抗菌材料通常包括①无机半导体:金属氧化物、金属硫化物、氮化碳、异质结复合物等;②有机物:有机聚合物、有机小分子-聚集诱导发射[32]。光催化抗菌的作用机制就是细菌和活性氧(ROS)发生作用的过程,ROS主要是在光催化反应过程中由光激发的电子或者空穴与氧气(O2)或水之间发生不完全还原反应产生的,其具有很高的活性。ROS主要包括单线态氧(1O2)、超氧阴离子(-O2-)、羟基自由基(-OH)等[33]。光催化抗菌作用原理具体为特定波长的激光辐射激发细菌感染部位的光敏剂,产生的电子或空穴与周围的氧气或水反应,生成高活性的ROS[34]。ROS会与细胞膜反应或者进入细菌中,从而破坏细菌细胞膜,诱发内部物质的泄漏,进一步灭活细菌DNA和蛋白质,从而杀死细菌[35]。
2.1.1 无机半导体材料
常见的光催化抗菌无机半导体材料有金属氧化物、金属硫化物和氮化碳等。有研究发现金属氧化可以改变带隙宽度,从而改善光吸收增加对分子的吸附,提高光催化效率,在光催化抗菌领域显示出巨大的潜力,其中氧化锌、二氧化钛是常见的光催化抗菌金属氧化物[36]。氧化锌的相关研究发现其具有良好的热稳定性和生物相容性,对不同菌株的细菌均具有良好的抗菌活性[37]。二氧化钛纳米材料的宽带隙约为3.0至3.2 eV,其只能被波长小于385 nm的光激发,光激发产生的电子和空穴可以迅速重组,导致光催化效率低[38]。Venieri等[39]通过共沉淀法制备了钴(Co)和锰(Mn)掺杂的TiO2材料。在可见光照射下,Mn/Co掺杂的TiO2会产生电子和空穴,TiO2界面上的掺杂物作为电子陷阱捕获电子,从而促进界面电荷转移,延迟光诱导的电子和空穴的重新结合,提高了光催化效率。Mn/Co掺杂的TiO2可以使大肠埃希菌(抗菌活性>90%)和肺炎克雷伯菌(K. pneumoniae)(抗菌活性>90%)等致病菌失活。研究发现过渡金属硫化物比金属氧化物有更小的带隙,可以在可见光下通过氧化还原反应,产生更好的杀菌效果[40]。Hu等[41]以半乳糖和岩藻糖基配体为原料,采用自组装方法在二维二硫化钼(MoS2)表面制备了一种构筑块,通过多价碳水化合物-凝集素相互作用选择性地定位铜绿假单胞菌。结果表明,在白光下杂化材料对多重耐药铜绿假单胞菌(>80%的抗菌活性)具有高效的抗菌活性。
石墨氮化碳(g-C3N4)是一种特殊的光催化材料,可以通过简单的热煅烧过程合成。原始的石墨氮化碳受到光激发电荷高重组率的影响,其光催化活性低。近年来,人们提出了许多策略来提高g-C3N4的催化效率。Li等[42]合成了由g-C3N4、Zn2+和氧化石墨烯(GO)组成的复合材料,通过掺入Zn2+帮助减少光生电子和空穴的重新结合,GO具有良好的导电性,它可以吸收大量的光电子,以减少电子空穴对的重新结合,它们都能提高光催化的活性。此复合材料在光照射下,对金黄色葡萄球菌和大肠埃希菌的杀伤力都超过99.1%。
2.1.2 有机物
有机物光催化抗菌材料[43]主要有有机聚合物和有机小分子-聚集诱导发射。有机聚合物由于其光吸收能力和高效的能量传递,在生物医学和光催化应用方面引起了广泛关注。聚合物的抗菌作用是由于其在光的照射下,原始的共轭聚合物可以直接与O2反应产生ROS,从而杀灭细菌。Zhu等[44-45]合成了具有聚乙二醇(PEG)和季铵侧链的阳离子(对苯基乙烯基)聚合物[cationic poly(p-phenylene vinylene)s, PPVs](图5)。对其研究发现在可见光照射下,具有较高季铵比例的聚合物会产生大量的ROS并破坏细菌,对耐氨苄青霉素大肠埃希菌有70%的抗菌效果。许多研究[32]发现光敏剂是疏水性的,在水溶液中会聚集,导致聚集淬灭(ACQ)的现象,无法进行熒光引导的抗菌治疗。为了解决这一问题,Luo等[32]的研究小组提出了一个叫作聚集诱导发射的概念。其光催化机制主要是荧光素的电子被光子从基态激发到激发态,当电子通过辐射衰变回到基态时,会产生荧光。此外,衰变发出的能量也通过非辐射耗散产生热量,这些热量可用于光疗法,包括光催化抗菌。Wang等[46]合成一种季胺官能化聚集诱导发射(AIE),AIE通过产生单线态氧(1O2)和热来消除细菌。通过在AIE中引入正电荷,AIE纳米颗粒(AIE NPs)可以选择性地靶向作用于细菌。其研究发现AIE NPs对大多数细菌都有明显的抗菌性能,AIE NPs对金黄色葡萄球菌和大肠埃希菌的杀伤力分别高达99.9%和99.8%。
2.2 光动力抗菌材料
此类抗菌材料的抗菌机制也是通过产生ROS从而杀灭细菌的[47]。此方法不易产生耐药性,是一种非常有前景的治疗方法[48]。研究发现目前该类材料主要有两类,第一类是利用一些纳米载体包裹光敏剂而形成的材料;第二类是本身就具有光敏效应的纳米材料。第一类材料可促进光敏剂渗透进细菌内,从而杀灭细菌[49]。Wang等[50]通过各种方法合成了负载光敏剂的MnO2纳米粒子,其不仅可以在光照下直接杀灭细菌,还可以有效的治疗金黄色葡萄球菌感染导致的皮肤脓肿。Wang等[51]研制了一种新型的pH响应超多孔光敏剂(SiO2-PCe6-IL)。由于光敏剂的质子化和聚离子液体的高结合能,在生物膜感染的酸性微环境中,SiO2-PCe6-IL转变为正的SiO2-PIL+,SiO2-PIL+可以与带负电荷的胞外聚合物(EPS)结合,形成孔洞,消除生物膜屏障。SiO2-PCe6-IL能有效降低伤口炎症反应,加速伤口愈合,其还能有效、安全的控制MRSA生物膜感染。董建成等[52]针针对医院获得性感染细菌耐药性的问题,在细菌纤维素(BC)表面接枝卟啉制备了一种光敏抗菌材料,其纤维膜对金黄色葡萄球菌的初次抗菌率可达到98%。王婷婷[53]对合成的细菌纤维素/壳聚糖(BC/CH)复合抗菌材料进行研究发现光敏剂竹红菌素与壳聚糖的协同抗菌作用使得纤维膜对金黄色葡萄球菌的杀伤力提高到99.99%,对大肠埃希菌的杀伤力也达到了理想的99.49%。
第二类抗菌材料在近些年也应用得比较多。Nie等[54]采用一锅法将柠檬酸和1,5-二氨基萘在乙醇溶剂中合成光敏劑碳量子点(carbon quantum dots, CQDs)(图6),研究发现CQDs光照后,氧会发生能量传递从而生成1O2,1O2能破坏大肠埃希菌和金黄色葡萄球菌的细胞膜,从而杀灭细菌。一些学者[55]将光敏剂(亚甲基蓝)与碳量子点偶联,该复合材料不仅能产生大量的单线态氧来杀灭金黄色葡萄球菌和大肠埃希菌,此外还具有良好的生物相容性。Mei等[56]对二维石墨烯基纳米材料进行了综述,发现石墨烯(2D NBG)的二维纳米材料可以作为新型抗菌剂,其具有独特的物理化学性质和良好的生物相容性,2D NBG通过接触破坏、氧化应激、光诱导抗菌、控制药物/金属离子释放、多模式协同进行抗菌。Qiu等[57]为了解决皮肤烧伤后的耐药菌感染问题,合成了抗菌光动力金纳米颗粒(AP-AuNPs),这是光动力抗菌肽、聚乙二醇(PEG)和AuNPs的自组装纳米复合材料。AP-AuNPs表现出良好的光和水稳定性,ROS的产率高,并且在光照射下对革兰阳性金黄色葡萄球菌和革兰阴性大肠埃希菌均具有显著的抗菌效果。此外,合成的纳米复合材料在体外显著抑制细菌生长和生物膜形成。碳点(CDs)是一类尺寸小于10 nm的碳基荧光纳米材料[58]。由于其水溶性好、易于合成、具备优异的光学性能、生物相容性和抗光漂白效应,在生物医学中的应用受到了极大关注[59]。例如,一些抗生素(如盐酸环丙沙星和甲硝唑)已被合成为CDs,显示出良好的杀菌活性,并降低其耐药性[60-61]。Liang等[61]通过溶剂热法合成了来自有机杀菌剂或中间体的具有宽光谱吸收范围(350~700 nm)的红碳点(R-CDs)。此R-CDs不仅具有良好的抗菌活性,而且可以通过产生活性氧,有效地杀死多重耐药菌[多重耐药鲍曼不动杆菌(MRAB)和多重耐药金黄色葡萄球菌(MRSA)]。此外,R-CDs还可以消除和抑制MRAB生物膜的形成,同时对正常细胞几乎没有副作用。
2.3 光热抗菌材料
光热抗菌材料的抗菌机制主要是利用自身能在光照下局部产生高热,其热量可以破坏细菌膜通透性和代谢信号,从而使蛋白质或者酶发生变性诱导细菌死亡[62]。主要包括各种金属纳米材料和碳纳米材料等[63]。Qing等[62]采用经典的纳米沉淀法制备了温度响应型纳米结构(TRN)。其对致病性细菌感染非常有效,并且可以防止局部感染发展成败血症。与抗生素的抗菌机理不同,金纳米棒(AuNRs)通过近红外(NIR)光照射诱导的局部加热对微生物进行消毒,其是一种潜在的消毒剂。Qiao等[64]为了增加AuNRs对浮游和生物膜表型中生物体的生物相容性和抗菌活性,在AuNRs上装饰了具有侧链羧基甜菜碱基团的聚甲基丙烯酸酯(PCB),研究发现PCB-AuNRs对成熟生物膜的渗透率更高,并且比非表面电荷可转化的对应物具有更好的生物膜消除活性,其对革兰阳性菌、革兰阴性菌、耐药菌株都有杀灭作用。Ma等[65]用水热法合成PEG-MoS2纳米片和CeO2NPs,通过PEG-MoS2纳米片与CeO2NPs之间的静电作用得到MoS2-CeO2纳米复合材料。研究发现MoS2-CeO2纳米复合材料对慢性创面特别是糖尿病性溃疡创面具有广谱杀菌和抗氧化活性,具有良好的抗菌活性,未来具有很大的临床应用潜力。近年来一类叫MXene(过渡金属碳化物和氮化物)的二维纳米材料,在生物医学领域显示出了巨大的潜力[66]。MXENE在光热转换方面具有特殊优势,因其固有的大吸收表面、丰富的自由电子分布以及宽带太阳光谱中的强吸收等[67]在光照射下,MXene将有效地吸收光能并将光能转化为热量,导致其表面温度急剧上升,这一过程将加速周围细菌的死亡[66-68]。
3 展望
PACT是近年来治疗细菌感染最有希望的一种替代疗法。但目前临床应用及开发较少,并且在研究中发现经典的光敏剂中存在许多缺点,如低的水溶性和分散性;不理想的光物理性质;需要复杂的合成路线或难以提纯;缺乏生物相容性、生物降解性低等,这些缺点都限制了其在医学中的应用。光敏抗菌材料种类众多可以很好地解决传统光敏剂的缺点,提高其光敏抗菌能力,在光动力抗菌领域有很好的应用前景。但是其也存在一些问题,如ROS对细菌的耐受性以及其浓度对正常组织和细胞可能有毒性;材料自身的生物安全性;以及可见光甚至近红外光对深层组织感染的穿透能力差等。但我们相信随着物理、化学和生物等交叉学科的发展,这些问题会逐一解决,光敏抗菌药物及光敏抗菌材料可能是未来抗菌的发展方向,应给予重视和持续研究。
参 考 文 献
Zaman S B, Hussain M A, Nye R, et al. A review on antibiotic resistance: Alarm bells are ringing[J]. Cureus, 2017, 9(6): e1403.
雷万华, 王雪松. 光动力抗菌光敏剂的研究进展[J]. 影像科学与光化学, 2013, 31(5): 321-334.
de Paula Zago L H, de Annunzio S R, de Oliveira K T, et al. Antimicrobial photodynamic therapy against metronidazole-resistant dental plaque bactéria[J]. J Photochem, 2020,
209: 111903.
Souza D M, Alves P M, Silva M L, et al. 5-ALA-mediated photodynamic therapy reduces the parasite load in mice infected with Leishmania braziliensis[J]. Parasite Immunol, 2017, 39(3): e12403.
Tavares A, Carvalho C M B, Faustino M A, et al. Antimicrobial photodynamic therapy: Study of bacterial recovery viability and potential development of resistance after treatment[J]. Mar Drugs, 2010, 8(1): 91-105.
Vaz G M, Paszko E, Davies A M, et al. High content screening as high quality assay for biological evaluation of photosensitizers in vitro[J]. PloS One, 2013, 8(7): e70653.
朱子薇, 張健, 王倩, 等. 卟啉代谢途径高价值产物及其微生物合成研究进展[J]. 中国科学: 生命科学, 2020, 50(12): 1405-1417.
Ragàs X, He X, Agut M, et al. Singlet oxygen in antimicrobial photodynamic therapy: Photosensitizer-dependent production and decay in E. coli[J]. Molecules, 2013, 18(3): 2712-2725.
Ito T. Photodynamic action of hematoporphyrin on yeast cells--a kinetic approach[J]. Photochem Photobiol, 1981, 34(4): 521-524.
Alves E, Faustino M A, Neves M G, et al. An insight on bacterial cellular targets of photodynamic inactivation[J]. Future Med Chem, 2014, 6(2): 141-164.
Li J, Sun W, Yang Z, et al. Rational design of self-assembled cationic porphyrin-based nanoparticles for efficient photodynamic inactivation of bacteria[J]. ACS Appl Mater Interfaces, 2020, 12(49): 54378-54386
Hu H, Wang H, Yang Y, et al. A bacteria-responsive porphyrin for adaptable photodynamic/photothermal therapy[J]. Angew Chem Int Ed, 2022, 61(23): e202200799.
Meng S, Xu Z, Wang X, et al. Synthesis and photodynamic antimicrobial chemotherapy against multi-drug resistant Proteus mirabilis of ornithine-porphyrin conjugates in vitro and in vivo[J]. Front Microbiol, 2023, 14: 1196072.
Dingiswayo S, Burgess K, Babu B, et al. Photodynamic antitumor and antimicrobial activities of free-base tetra(4-methylthiolphenyl)chlorin and its tin(IV) complex[J]. Chempluschem, 2022, 87(5): e202200115.
Pereira J B, Carvalho E F A, Faustino M A F, et al. Phthalocyanine thio-pyridinium derivatives as antibacterial photosensitizers[J]. Photochem Photobiol, 2012, 88(3): 537-547.
Liu Y, Liu Y, Bu W, et al. Hypoxia induced by upconversion-based photodynamic therapy: Towards highly effective synergistic bioreductive therapy in tumors[J]. Angew Chem Int Ed, 2015, 54(28): 8105-8109.
Xiao J, Cong H, Wang S, et al. Recent research progress in the construction of active free radical nanoreactors and their applications in photodynamic therapy[J]. Biomater Sci, 2021, 9(7): 2384-2412.
Zhao M H, Zhen J B, Yang K W, et al. Quaternized polymer-based nanostructures confer antimicrobial efficacy against multidrug-resistant bacteria[J]. New J Chem, 2020, 44(10): 3874-3881.
赵阳, 李洪才, 李兴淑, 等. 新型十二阳离子酞菁锌(Ⅱ)的合成及光动力抗菌活性研究[C]. 中国化学会光化学专业委员会. 第十五届全国光化学学术讨论会会议论文集, 2017: 1.
Sowa A, H?ing A, Dobrindt U, et al. Umbelliferone decorated water-soluble zinc(II) phthalocyanines - in vitro phototoxic antimicrobial anti-cancer agents[J]. Chem Eur J, 2021, 27(59): 14672-14680.
Machado-de-Sena R M, Corrêa L, Kato I T, et al. Photodynamic therapy has antifungal effect and reduces inflammatory signals in Candida albicans-induced murine vaginitis[J]. Photodiagnosis Photodyn Ther, 2014, 11(3): 275-282.
李庆妮. 吩噻嗪类光敏剂介导的光动力抗菌疗法对白色念珠菌的杀伤作用研究[D]. 广西医科大学, 2016.
Khan S, Rayis M, Rizvi A, et al. ROS mediated antibacterial activity of photoilluminated riboflavin: A photodynamic mechanism against nosocomial infections[J]. Toxicol Rep, 2019, 6: 136-142.
Maisch T, Eichner A, Sp?th A, et al. Fast and effective photodynamic inactivation of multiresistant bacteria by cationic riboflavin derivatives[J]. PLoS One, 2014, 9(12): e111792.
Qian J, Wu J, Yao B, et al. Preparation of a polyclonal antibody against hypericin synthase and localization of the enzyme in red-pigmented Hypericum perforatum L. plantlets[J]. Acta Biochim Pol, 2012, 59(4): 639-645.
肖冬梅, 周倩, 黃春妮, 等. 金丝桃素对铜绿假单胞菌的体外光动力杀菌研究[J]. 广西大学学报(自然科学版), 2018, 43(3): 1267-1276.
Wang D, Hu J, Lv L, et al. Enhanced inhibitory effect of curcumin via reactive oxygen species generation in human nasopharyngeal carcinoma cells following purple-light irradiation[J]. Oncol Lett, 2013, 6(1): 81-85.
Bhavya M L, Umesh Hebbar H. Efficacy of blue LED in microbial inactivation: Effect of photosensitization and process parameters[J]. Int J Food Microbiol, 2019, 290: 296-304.
Anas A, Sobhanan J, Sulfiya K M, et al. Advances in photodynamic antimicrobial chemotherapy[J]. J Photochem Photobiol C, 2021, 49: 100452.
焦阳, 陈吉华. 季铵盐化合物在生物医学材料中的应用进展[J]. 口腔疾病防治, 2019, 27(5): 280-286.
赵婷, 戴红, 许伟, 等. 纳米抗菌材料及其在制革领域的应用[J]. 中国皮革, 2005, (17): 31-35.
Luo J, Tang B Z, Xie Z, et al. Aggregation-induced emission of 1-methyl-1, 2, 3, 4, 5-pentaphenylsilole[J]. Chem commun, 2001 (18): 1740-1741.
Wang L, Wu J, Hu Y, et al. Using porous magnetic iron oxide nanomaterials as a facile photoporation nanoplatform for macromolecular delivery[J]. J Mater Chem B, 2018, 6(27): 4427-4436.
Sun J, Song L, Fan Y, et al. Synergistic photodynamic and photothermal antibacterial nanocomposite membrane triggered by single NIR light source[J]. ACS Appl Mater Interfaces, 2019, 11(30): 26581-26589.
Kim S, Ahn S M, Lee J S, et al. Functional manganese dioxide nanosheet for targeted photodynamic therapy and bioimaging in vitro and in vivo[J]. 2D Mater, 2017, 4(2): 025069.
佳豪, 李家成, 许锴, 等. 光催化材料去除水中病毒的研究进展[J]. 化工进展, 2020, 39(10): 4248-4255.
Sirelkhatim A, Mahmud S, Seeni A, et al. Review on zinc oxide nanoparticles: Antibacterial activity and toxicity mechanism[J]. Nanomicro Lett, 2015, 7(3): 219-242.
王佳赫, 刘大勇, 刘伟, 等. 纳米 TiO2光催化抗菌应用的研究进展[J]. 应用化学, 2022, 39(4): 629.
Cheng Y, Chang Y, Feng Y, et al. Simulated sunlight-mediated photodynamic therapy for melanoma skin cancer by titanium-dioxide-nanoparticle-gold-nanocluster-graphene heterogeneous nanocomposites[J]. Small, 2017, 13(20): 1603935.
韓世同, 习海玲, 史瑞雪, 等. 半导体光催化研究进展与展望[J]. 化学物理学报, 2003, (5): 339-349.
Hu X L, Chu L, Dong X, et al. Multivalent glycosheets for double light-driven therapy of multidrug-resistant bacteria on wounds[J]. Adv Funct Mater, 2019, 29(14): 1806986.
Li Y, Liu X, Tan L, et al. Rapid sterilization and accelerated wound healing using Zn2+ and graphene oxide modified g‐C3N4 under dual light irradiation[J]. Adv Funct Mater, 2018, 28(30): 1800299.
莫尊理, 胡惹惹, 王雅雯, 等. 抗菌材料及其抗菌机理[J]. 材料导报, 2014, 28(1): 50-52, 90.
Zhu C, Yang Q, Liu L, et al. Multifunctional cationic poly(p-phenylene vinylene) polyelectrolytes for selective recognition, imaging, and killing of bacteria over mammalian cells[J]. Adv Mater, 2011, 23(41): 4805-4810.
Xing C, Xu Q, Tang H, et al. Conjugated polymer/porphyrin complexes for efficient energy transfer and improving light-activated antibacterial activity[J]. J Am Chem Soc, 2009, 131(36): 13117-13124.
Wang W, Wu F, Zhang Q, et al. Aggregation-induced emission nanoparticles for single near-infrared light-triggered photodynamic and photothermal antibacterial therapy[J]. ACS nano, 2022,16(5): 7961-7970.
孔秋晨, 佘慧明, 杨粤军. 纳米抗菌材料的研究进展[J]. 生物化工, 2022, 8(1): 158-163.
Chen Z, Yuan H, Liang H. Synthesis of multifunctional cationic poly(p-phenylenevinylene) for selectively killing bacteria and lysosome-specific imaging[J]. ACS Appl Mater Interfaces, 2017, 9(11): 9260-9264.
张昌, 任恩, 庞鑫, 等. 光动力抗菌纳米制剂研究进展[J]. 中国激光, 2020, 47(2): 163-170.
Wang C, Xiao Y, Zhu W, et al. Photosensitizer-modified MnO2 nanoparticles to enhance photodynamic treatment of abscesses and boost immune protection for treated mice[J]. Small, 2020, 16(28): 2000589.
Wang C, Chen P, Qiao Y, et al. pH responsive superporogen combined with PDT based on poly Ce6 ionic liquid grafted on SiO2 for combating MRSA biofilm infection[J]. Theranostics, 2020, 10(11): 4795-4808.
董建成, 葛孝棟, 王清清, 等. 卟啉接枝细菌纤维素的制备及其光敏抗菌性能[J]. 纺织学报, 2018, 39(11): 20-26.
王婷婷. 细菌纤维素基光敏抗菌材料的制备及其性能研究[D]. 江南大学, 2021.
Nie X, Jiang C, Wu S, et al. Carbon quantum dots: A bright future as photosensitizers for in vitro antibacterial photodynamic inactivation[J]. J Photochem Photobiol B Biol, 2020, 206: 111864.
Lv Y, Li P, Su R, et al. Methylene Blue/Carbon Dots Composite with photothermal and photodynamic properties: Synthesis, characterization, and antibacterial application[J]. Photochem Photobiol, 2023, 99(1): 92-100.
Mei L, Zhu S, Yin W, et al. Two-dimensional nanomaterials beyond graphene for antibacterial applications: Current progress and future perspectives[J]. Theranostics, 2020, 10(2): 757-781.
Qiu L, Wang C, Lan M, et al. Antibacterial photodynamic gold nanoparticles for skin infection[J]. ACS Appl Bio Mater, 2021, 4(4): 3124-3132.
Wu X, Abbas K, Yang Y, et al. Photodynamic anti-bacteria by carbon dots and their nano-composites[J]. Pharmaceuticals, 2022, 15(4): 487.
Yang W, Ling B, Hu B, et al. Synergistic N‐heterocyclic carbene/palladium‐catalyzed umpolung 1, 4‐addition of aryl iodides to enals[J]. Angew Chem Int Ed, 2020, 59(1): 161-166.
Liu J, Lu S, Tang Q, et al. One-step hydrothermal synthesis of photoluminescent carbon nanodots with selective antibacterial activity against Porphyromonas gingivalis[J]. Nanoscale, 2017, 9(21): 7135-7142.
Liang G, Shi H, Qi Y, et al. Specific anti-biofilm activity of carbon quantum dots by destroying P. gingivalis biofilm related genes[J]. Int J Nanomedicine, 2020, 15: 5473-5489.
Qing G, Zhao X, Gong N, et al. Thermo-responsive triple-function nanotransporter for efficient chemo-photothermal therapy of multidrug-resistant bacterial infection[J]. Nat Commun, 2019, 10(1): 4336.
Chang M, Wang M, Shu M, et al. Enhanced photoconversion performance of NdVO4/Au nanocrystals for photothermal/photoacoustic imaging guided and near infrared light-triggered anticancer phototherapy[J]. Acta Biomater, 2019, 99: 295-306.
Qiao Z, Yao Y, Song S, et al. Gold nanorods with surface charge-switchable activities for enhanced photothermal killing of bacteria and eradication of biofilm[J]. J Mater Chem B, 2020, 8(15): 3138-3149.
Ma T, Zhai X, Huang Y, et al. A smart nanoplatform with photothermal antibacterial capability and antioxidant activity for chronic wound healing[J]. Adv Healthc Mater, 2021, 10(13): 2100033.
Hao S, Han H, Yang Z, et al. Recent advancements on photothermal conversion and antibacterial applications over mxenes-based materials[J]. Nanomicro Lett, 2022, 14(1): 178.
Xu D, Li Z, Li L, et al. Insights into the photothermal conversion of 2D MXene nanomaterials: Synthesis, mechanism, and applications[J]. Adv Funct Mater, 2020, 30(47): 2000712.
Wu F, Zheng H, Wang W, et al. Rapid eradication of antibiotic-resistant bacteria and biofilms by MXene and near-infrared light through photothermal ablation[J]. Sci China Mater, 2021, 64(3): 748-758.
