乳杆菌耐药风险及其药敏检测标准
2023-03-14宋可王俊豪万晓宝郝海红
宋可 王俊豪 万晓宝 郝海红
摘要:本文简述了乳杆菌作为益生菌的商业应用情况和作为致病菌造成临床感染的致病情况及乳杆菌耐药传播风险,总结了与乳杆菌相关的4个国际权威机构对其制定的抗菌药敏试验(antimicrobial susceptibility test, AST)标准程序方法,对近15年内研究发现的乳杆菌耐药表型、基因型进行了汇总。发现在我国,对嗜酸乳杆菌、鼠李糖乳杆菌、罗伊乳杆菌和植物乳杆菌的应用最多,乳杆菌可能联合其他致病菌对免疫低下者造成合并感染,但总体而言乳杆菌的致病风险较低,乳杆菌的可转移耐药问题更值得关注,目前发现的乳杆菌的耐药基因包括tet、van、erm、mef、gyr、par、aad、aph、ant、aac、sul、dfr、cat、fex、rpo、mef和lnu等。值得关注的是,乳杆菌存在与四环素、红霉素和氯霉素相关的抗性基因(tet、erm和cat)的转移的风险,4个组织机构制定的抗菌药敏试验方法在药敏肉汤和选择測试药物上存在主要差异。
关键词:乳杆菌抗菌药敏试验;国际乳品联合会;益生菌
中图分类号:S859文献标志码:A
Risk of Lactobacillus drug resistance and standards for its antibiotic susceptibility test
Song Ke1,2, Wang Junhao1,2, Wan Xiaobao1,2, and Hao Haihong1,2,3,4
(1 State Key Laboratory of Agricultural Microbiology, Huazhong Agricultural University, Wuhan 430070;
2 MOA Laboratory for Risk Assessment of Quality and Safety of Livestock and Poultry Products, Huazhong Agricultural University, Wuhan 430070; 3 Huazhong Agricultural University, Shenzhen Institute of Nutrition and Health, Shenzhen 518000;
4 Shihezi University, Shihezi 832000)
Abstract This paper briefly describes the commercial application of Lactobacillus as a probiotic, the pathogenic situation of clinical infections caused by Lactobacillus as a pathogenic bacteria, and the risk of Lactobacillus drug resistance transmission. It also summarizes the standard procedure methods of the antimicrobial susceptibility test (AST) developed by four international authorities related to Lactobacillus and collects the Lactobacillus resistance phenotypes and genotypes from research in the last 15 years. It was found that in China, Lactobacillus rhamnosus, Lactobacillus acidophilus, Lactobacillus reuteri and Lactobacillus plantarum are most used. Lactobacillus may combine with other pathogenic bacteria to cause co-infection in immunocompromised people, but overall, Lactobacillus has a low risk of causing disease. The transferable drug resistance of Lactobacillus is more worthy of attention, and the drug resistance genes of Lactobacillus found so far include tet, van, erm, mef, gyr, par, aad, aph, ant, aac, sul, dfr, cat, fex, rpo, mef, lnu, etc. It is concerned that the risk of transfer of resistance genes associated with tetracycline, erythromycin, and chloramphenicol in Lactobacillus (tet, erm, cat), and the main differences in antimicrobial susceptibility testing methods developed by the four organizing institutes are in the drug-sensitive broth and the selection of the test drug.
Key words Lactobacillus antimicrobial susceptibility test; International dairy federation; Probiotics
乳杆菌属在分类学上十分复杂,包括260多个物种,是乳酸菌中最大的群体,这些物种在表型上不容易区分,常需进行分子鉴定[1]。一部分乳杆菌是人类正常菌群的组成部分,传统意义上乳杆菌在人体肠道菌群中通常扮演着有益菌的角色,对维持健康人体肠道平衡起到重要作用,因此乳杆菌被广泛用于各种商业产品中,如益生菌保健品、发酵食品等[2]。在现代医学领域,一方面,乳杆菌作为益生菌与抗生素联合使用,可用于预防抗生素相关性腹泻(antibiotic-associated diarrhea, AAD)、艰难梭菌感染(Clostridium difficile infection, CDI)等胃肠道疾病;另一方面,临床上,特别是重症加强护理病房(intensive care unit, ICU)里,近年发现的多起乳杆菌感染情况,使得乳杆菌菌属“安全”的地位动摇[3]。
相对于传统致病菌而言,关于乳杆菌耐药和耐药转移的研究较少且标准分散[4],本文阐述并比较了美国临床和实验室标准协会(Clinical and Laboratory Standards Institute, CLSI)、欧盟药敏试验标准委员会(European Committee on Antimicrobial Susceptibility Testing, EUCAST)、欧洲食品安全局(European Food Safety Authority, EFSA)[5]、国际乳品联合会(International Dairy Federation, IDF)4个机构根据不同分类标准,对乳杆菌提出的抗菌药敏试验(antimicrobial susceptibility test, AST)标准程序方法,另外对我国常用几种益生乳杆菌的商业应用状况、国内外乳杆菌临床发生的感染情况、耐药风险情况作出了整理汇总,以期为更好地了解乳杆菌的耐药现状,更规范的进行乳杆菌的抗菌药敏试验,更安全的应用乳杆菌提供科学参考依据。
1 常用乳杆菌分类
乳杆菌不仅存在于环境和各种食品(主要是乳制品、发酵食品)中,在人类胃肠道中也广泛分布。目前已从肠道中分离出了發酵乳杆菌、植物乳杆菌、干酪乳杆菌和鼠李糖乳杆菌等[6],从胃黏膜中分离出了安特里乳杆菌、胃乳杆菌和罗伊乳杆菌等[7],从阴道中分离出了卷曲杆菌、詹氏乳杆菌、阴道乳杆菌和惰性乳杆菌等[8],嗜酸乳杆菌天然存在于人和动物的胃肠道和口腔中,一般来说,最常见的人类临床分离株是鼠李糖乳杆菌和干酪乳杆菌[9]。
由于乳杆菌属种类繁多,对其抗生素耐药的研究一直较为困难,2020年国际上基于全基因组测序技术对乳杆菌属进行了拆分,将原乳杆菌属的260多个物种重新划分归为25个属[10-11],并在相关的国际食品和贸易领域中开始使用,这有利于开展对乳杆菌系统的耐药研究。我国对新划分的已经修改名称的菌种,基于其拉丁文名称的原始词根、结合国际上对该词根的注解进行中文翻译,给出了新规范的菌属和菌种的中文名[12]。
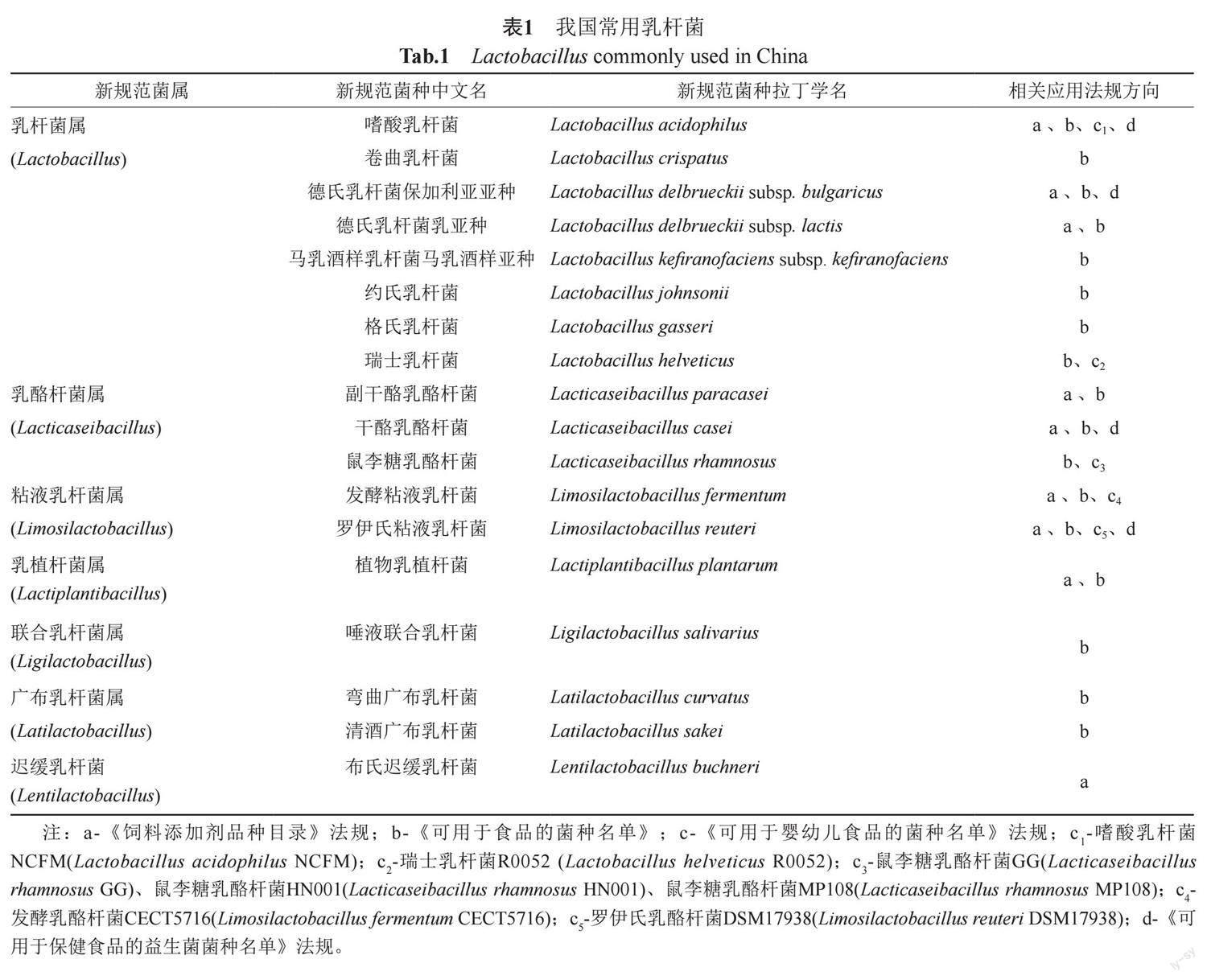
基于我国乳杆菌的应用情况,综合参考《饲料添加剂品种目录》[13]、《可用于食品的菌种名单》&《可用于婴幼儿食品的菌种名单》[14]、《可用于保健食品的益生菌菌种名单》[15]3个法规文件,并结合当前的研究热点,总结了18种常用乳杆菌的新规范拉丁学名、中文名及法规允许的应用方向,如表1所示。其中婴幼儿食品允许添加的益生菌明确到具体菌株,这种带编号的菌株是获得了国际多个监督机构认证安全的,如美国食品药品监督管理局(Food and Drug Administration, FDA)认证的“公认安全”(Generally Recognized as Safe, GRAS)资格,在表中进行相关标注。
由表1可以看出我国法律规范中,嗜酸乳杆菌、罗伊乳杆菌、德氏乳杆菌保加利亚亚种和干酪乳杆菌被允许在饲料添加(兽用)、食品(人用)和保健品中使用,应用面最广,鼠李糖乳杆菌是研究最深入的益生菌种类之一,在明确规定可用于婴幼儿食品的7株乳杆菌中,鼠李糖乳杆菌占据了3/7。我国为菌株的名称更替设置了2年的过渡期,过渡期内新旧菌种名称均可以使用,在本文之后的讨论中,为了便捷,依然使用旧命名进行叙述。
2 乳杆菌的商业应用情况
乳杆菌是具有益生潜力的菌种储存库,作为一种优质添加剂,在食品和医疗领域具有广泛的应用前景。
在发酵食品中:长期应用于风味发酵食品的开发和制作,包括乳制品(酸奶、奶酪、黄油)、鱼/肉制品(香肠、火腿、腊肉)、腌菜制品(酸黄瓜、泡菜、橄榄)以及特殊食品(咖啡豆、发酵调味品、发酵酒)等[16]。在中国,乳杆菌还应用在一些大豆制品,如臭豆腐、腐乳、毛豆腐中,也参与一些发酵面包食品的制作,如米糕和馒头等[17]。
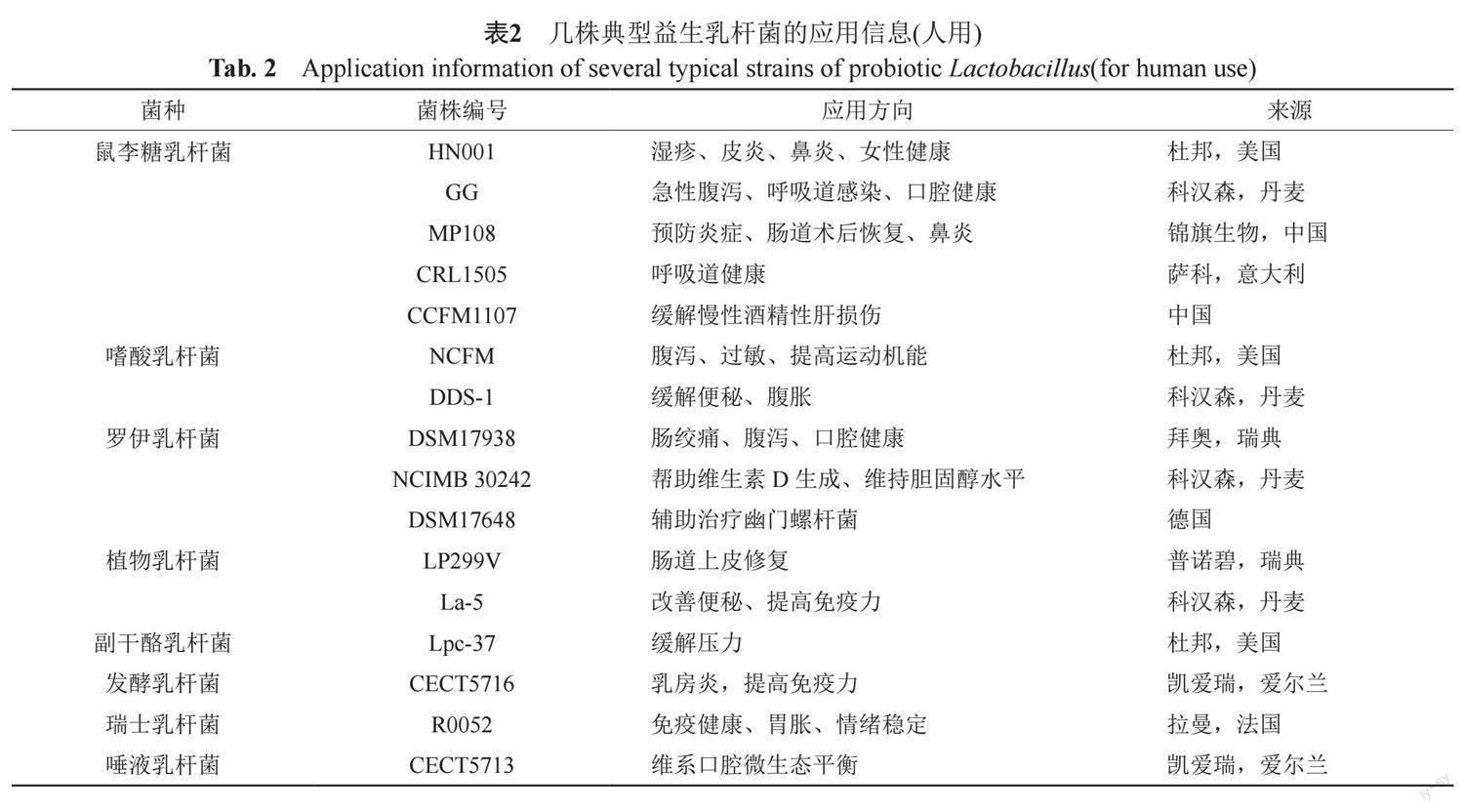
在医疗、保健品领域:国际范围内益生菌对宿主健康的影响已在预防/治疗各种不同病症方面得到了证实,例如肠道感染和幽门螺杆菌胃感染等[18]。得益于筛选菌株的优秀抗逆性和固有耐药性,在美国、欧洲等发达国家和地区,常将益生菌与抗菌药物联合应用降低AAD和CDI的发病率[19],一项针对儿童的大型Meta分析也指出益生乳杆菌对预防AAD有长久作用[20]。参考FDA的乳杆菌菌株GRAS认证名录,查询全球食用益生菌原料龙头企业信息,筛选出有相关实验性文献报告在30篇以上,应用方向不同的典型益生乳杆菌菌株[21-23],列举如下:由表2可以看出国际上典型乳杆菌的益生效应综合体现在对口腔、鼻腔黏膜,皮肤炎症、湿疹,呼吸道疾病,消化道疾病,免疫系统和神经系统的调节上。
对国内乳杆菌相关药物、保健品和饲料添加剂进行查询:在中国国家药品监督管理局查询到9款含有乳杆菌的药物,其中明确标注包含嗜酸乳杆菌的有6款,包含德氏乳杆菌的有1款,还有1款含有乳酸乳杆菌,在国家市场监督管理总局-特殊食品信息查询平台中查询发现了98款益生菌保健品,其中68款明确标注包含嗜酸乳杆菌,8款包含鼠李糖乳杆菌,3款包含干酪乳杆菌,3款包含植物乳杆菌,2款包含罗伊乳杆菌,2款包含瑞士乳杆菌,2款包含副干酪乳杆菌,2款包含罗伊乳杆菌,1款包含发酵乳杆菌,1款包含德氏乳杆菌,在农业农村厅(湖北)查询2018年上下半年对饲料添加剂产品的审批共341个,包含38个乳酸菌产品,其中有13个产品添加了植物乳杆菌,1个产品添加了干酪乳杆菌,其余产品未知。综合而言,我国审批和应用较多的益生乳杆菌是嗜酸乳杆菌、鼠李糖乳杆菌、罗伊乳杆菌和植物乳杆菌。
3 乳杆菌的致病与耐药潜在风险
根据世界卫生组织(World Health Organization, WHO)和联合国粮食及农业组织(Food and Agriculture Organization of the United Nations, FAO)联合发布的2002年报告[24],乳杆菌可能通过造成全身感染、进行有害的代谢活动、使敏感个体的受到过度免疫刺激等途径对人体健康造成威胁。
虽然乳杆菌是正常人类共生菌群的一部分,致病潜力极低,但仍有研究从人类感染中分离出了乳杆菌。大多数乳杆菌感染被归类为内源性感染,但其中一些也与使用含有乳杆菌的益生菌产品有关[25],例如2022年一份报告指出一例乳杆菌菌血感染的病例,患者在给予鼠李糖乳杆菌治疗后出现了菌血感染[26]。
乳酸杆菌病原体很少感染免疫功能正常的人类,但在免疫功能低下的患者中容易引起临床侵袭性感染,2018年阿根廷举行了一项调查临床感染乳杆菌的研究[27],从菌血症(占比67%)等炎症疾病和糖尿病等慢性疾病患者的患处中分离出了乳杆菌,其中鼠李糖乳杆菌的分离率最高,其次是发酵乳杆菌、副干酪乳杆菌、加塞里乳杆菌和内氏乳杆菌[27]。由乳杆菌单独引起严重感染的报道较少,通常是伴随其他菌种的合并感染情况,主要引起心内膜炎、菌血症和胸膜肺炎等局部感染[28],由乳杆菌单独(无论是内源或是外源益生菌补剂)引起的严重感染的情况尚无临床报告,因此我们认为乳杆菌的致病风险较低,只需对免疫功能低下的患者考虑乳杆菌致病问题。
乳杆菌对人类健康的最大威胁不在于其本身引起的疾病问题,而在于其耐药转移的风险[29]:耐药基因可能会传递给致病菌,造成致病菌的多重耐药,发酵食品或其他乳杆菌添加产品可能成为抗生素耐药性从非致病菌传播给消费者的关键传播渠道[30]。基因组中可移动组分是细菌获得性耐药性的主要来源,也被称作是抗生素耐药基因(antibiotic resistance genes, ARGs)[31],通常,水平基因转移是ARGs转移的主要方式,由移动基因元件(MGEs)介导[32]。理论上含有ARGs的益生菌可能成为潜在致病菌抗生素抗性基因的来源。
2022年一项针对分析126个完整的益生菌细菌基因组的抗生素抗性基因分析的研究,使用了全基因组序列分析来测定全部细菌的抗生素抗性基因[33],测出的有关乳杆菌的ARGs为:Lactobacillus: vat(E), tet(L), tetW, dfrG和dfrK。
用生物信息法分析乳杆菌耐药基因:在NCBI数据库中以Lactobacillus, Lacticaseibacillus, Limosilactobacillus, Lactiplantibacillus, Ligilactobacillus, Latilactobacillus和Lentilactobacillus为关键词进行检索(截止至2022年12月8日),得到175株乳杆菌的全基因测序结果,下载FASTA格式的基因组并上传至CARD数据库进行相关耐药基因分析。发现这175株公开信息的乳杆菌中有13株含有耐药基因,在这13株有2株值得关注。根据我国法规适用于人/兽的乳杆菌菌株,分别是卷曲乳杆菌DC21.1(被预测含有ErmB、InuC和tet(W/N/W)耐药基因)和约氏乳杆菌GHZ10a(被预测含有ErmB、fexA、tet(W/N/W)耐药基因),其他11株乳杆菌菌株还被预测含有vanI、tetM和tetO等耐药基因。
由此可见乳杆菌确实存在耐药现象,为评估商用乳杆菌的耐药风险及转移可能性,对乳杆菌进行抗生素敏感性试验(AST)是非常必要的。
4 乳杆菌的抗生素敏感性试验(AST)
相对于其他细菌,进行乳杆菌的AST有3个问题:①药敏肉汤的选择:乳杆菌属于苛养菌,常规的药敏肉汤(MH肉汤)无法提供给乳杆菌适宜的生长环境,但乳杆菌培养通用的MRS肉汤却对多种药物的活性有影响;②药物的选择:考虑到乳杆菌耐药基因转移风险的问题,需要对更多种类的药物进行试验;③耐药折点标准:乳杆菌属所包含菌种种类多,基因差距大,个体之间耐药差异大,其耐药折点标准的选择是一个复杂的问题。
因此关于乳杆菌的AST,除了参考目前全球公认的两大折点制定权威机构——CLSI和EUCAST外,还可以参考其他两个国际食品组织:一是EFSA属下的动物饲料添加剂和产品或物质小组(The Panel on Additives and Products or Substances used in Animal Feed, FEEDAP)給出的EFSA-FEEDAP指南[34];第二个是IDF,IDF成立了专门的委员会制定乳品的分析方法和其他方面的标准,直接参与国际标准化组织(International Organization for Standardization, ISO)、国际食品法典委员会 (Codex Alimentarius Commission, CAC)的国际标准制定工作,在乳杆菌抗菌药敏方面,IDF联合ISO推出了ISO10932/IDF233标准,用于规范对奶和奶制品中双歧杆菌和乳酸菌的MIC测定。下面分别进行叙述。
4.1 CLSI对乳杆菌AST的标准
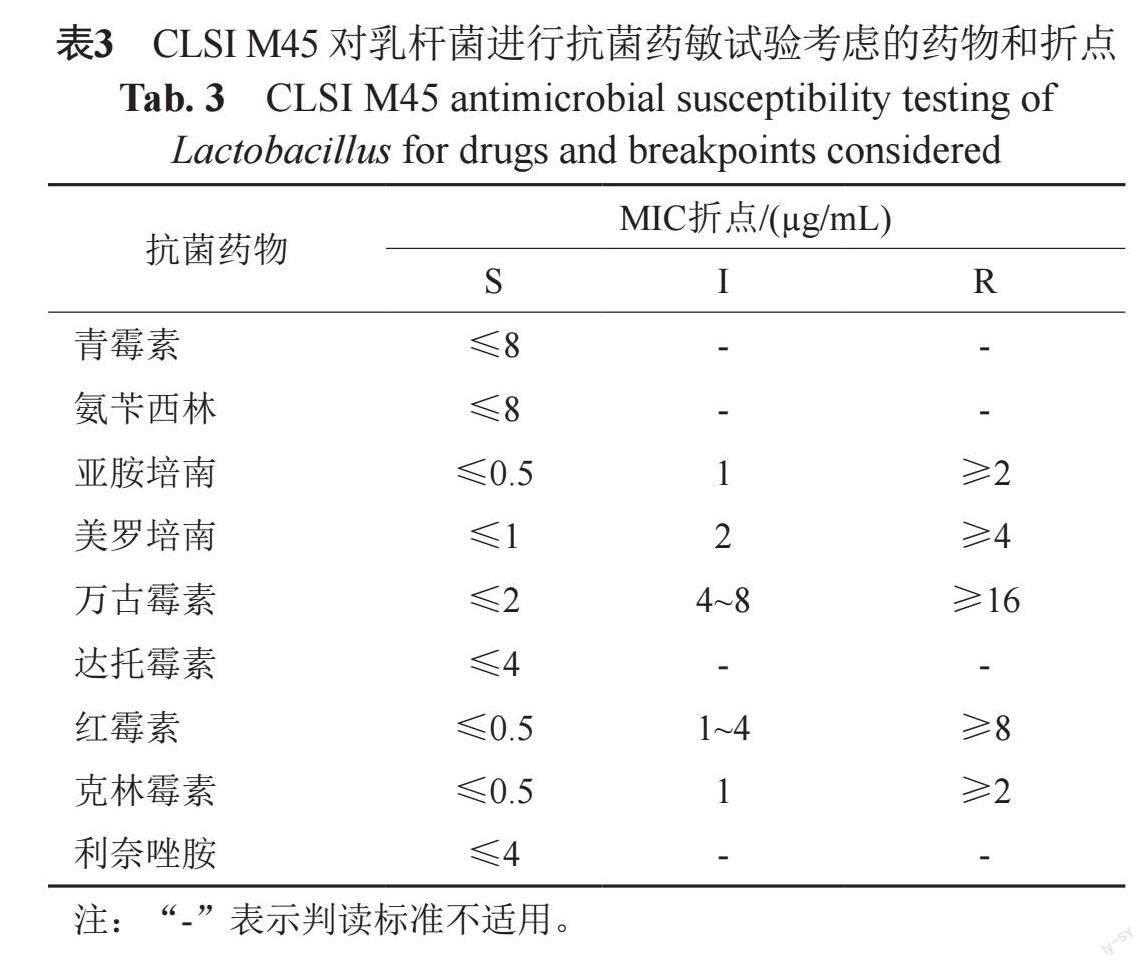
CLSI推出文件标准CLSI M45(更新于2016年8月15日)[35],对多种少见细菌/苛养菌给出了药敏纸片法和肉汤稀释法所考虑的测试药物和相关折点,在M45文件中,CLSI重点考虑从人类感染临床中分离的乳杆菌株,关注机会致病乳杆菌引起的免疫力低下患者的感染情况,对这种临床致病乳杆菌,给出了9种药物建议进行AST,并给出折点,如下表3所示。
CLSI M45建议,针对乳杆菌感染首选药物为青霉素或氨苄西林,制定的利奈唑胺和万古霉素折点参照葡萄球菌,其他药物(除外克林霉素、亚胺培南、美罗培南)参照肠球菌。虽然乳杆菌属于厌氧菌,但鼠李糖乳杆菌、干酪乳杆菌和发酵乳杆菌等在有氧环境下依然可以生存,M45指出在有氧环境下生长良好的乳杆菌菌种对万古霉素是天然耐药,而严格厌氧的乳杆菌往往对万古霉素敏感,如约氏乳杆菌、卷曲乳杆菌等。
4.2 EUCAST对乳杆菌AST的标准
EUCAST对所有细菌进行药敏试验的标准都汇总在其官方网址https://www.eucast.org/上[36],将乳杆菌归为革兰阳性厌氧菌范畴进行考虑,如表4所示,是EUCAST提出的对于革兰阳性厌氧菌进行AST试验推荐的药物和折点。
可以看出EUCAST相对于CLSI,考虑了更多的青霉素类抗生素和氯霉素,没有考虑达托霉素和利奈唑胺。对耐青霉素的折点判定是两个组织意见相差最大的地方,EUCAST给出的MIC值更低。
4.3 EFSA对乳杆菌AST的标准
EFSA属下的EEDAP小组给出了两个相关指南[29],EFSA-FEEDAP指南[37-38]:①Guidance on the Characterisation of Microorganisms Used as Feed Additives or as Production Organisms(用作饲料添加剂或生产用生物体的微生物的特征定性指南),用于指导和审核含有活菌成分的动物饲料添加剂或生产用微生物;②Guidance on the Assessment of Bacterial Susceptibility to Antimicrobials of Human and Veterinary Importance(细菌对人类和兽医重要抗菌药物的敏感性评估指南),用于对故意引入食物链(人/动物)的细菌进行安全性审核。
根据EFSA-FEEDAP指南,乳杆菌的固有耐药不被视为安全问题,重点应该关注的是其获得性耐药性的情况。EFSA-FEEDAP建议使用全基因组序列法(genome-wide sequencing , WGS),以确定乳杆菌是否存在抗生素抗性基因。用WGS寻找抗生素抗性基因还可以识别出与耐药基因相似的易突变基因,发现沉默的耐药基因,这些基因在乳杆菌中的表达可能受到了抑制,但如果转移到其他物种,或许会被激活。
EFSA-FEEDAP小组重点关注菌株是否有获得性耐药,定义了乳杆菌对9种药物的“微生物临界值”(microbiological cut-off values),如表5所示,此临界值可用于区分敏感菌种和获得性耐药菌株[37],
对于应用乳杆菌,要求提供WGS数据,并进行AST,测定乳酸菌的MIC值,与微生物临界值进行对比,以判断菌株是否有获得性耐药风险。
由表5可知,相对于CLSI和EUCAST两个组织,EFSA-FEEDAP小组多考虑了四环素和3种氨基糖苷类药物(庆大霉素、卡那霉素、链霉素),并且对氨基糖苷类药物给出的微生物临界值较高。
4.4 IDF对乳杆菌AST的标准
IDF推出ISO 10932/IDF 233标准[39]:Milk and milk products - Determination of the minimal inhibitory concentration (MIC) of antibiotics applicable to bifidobacteria and non-enterococcal lactic acid bacteria (LAB),以对乳制品中乳酸菌进行药敏试验。IDF提出 “流行病学临界值”(epidemiological cut-off value)概念,用于区分野生型(敏感)和非野生型菌株(有获得性耐药),这个概念与EFSA-FEEDAP小组的“微生物临界值”相似。
ISO 10932/IDF 233标准主要针对乳和乳制品中的乳酸菌,包括短乳杆菌、植物乳杆菌、戊糖乳杆菌、德氏乳杆菌、清酒乳杆菌、其他乳杆菌和双歧杆菌、嗜热链球菌、乳酸乳球菌等。测试药物选择了庆大霉素、卡那霉素、链霉素、新霉素、四环素、红霉素、克林霉素、氯霉素、氨苄西林、万古霉素、利奈唑胺、甲氧苄啶、环丙沙星、利福平和奎奴普丁/达福普汀。用IDF标准程序可以测定乳杆菌MIC值,但IDF并未给出不同乳杆菌的MIC折点解释标准,而是建议将结果提交给EUCAST进行处理。
相比其他3个机构,IDF对乳杆菌进行AST考虑的药物种类最多,但缺乏判定标准。
4.5 对4个国际组织对乳杆菌进行AST的比较
CLSI和EUCASTA重点关注导致临床感染情况的致病乳桿菌,建议进行试验的抗生素药物以青霉素和碳青霉素类为主,给出MIC值意在指导临床感染上对致病菌株用药,而EFSA和IDF关注的是食品/饲料中添加的乳杆菌,对多种抗生素都给出考虑,测定MIC值意在与微生物临界值/流行病学临界值进行对比,以判断所测试的菌株含有获得性耐药的可能性,保障乳杆菌的应用安全性。
在进行AST试验的具体过程中,细节方面4个组织各有不同,总结如表6所示。
在2013年,Mayrhofer等[40]根据CLSI和IDF标准,对22种乳杆菌进行了16种抗生素的AST试验,发现两种标准之间的关键差异主要是由于不同的药敏培养基(CAMHB vs. LSM)导致,一半的测试菌株在CAMHB培养基中无法生长,而所有菌株在LSM培养基中均可生长,但是,一些抗生素受到LSM培养基成分的影响:包括甲氧苄啶、庆大霉素、卡那霉素、新霉素和链霉素等几种药物,在两种培养基下对同株乳杆菌的MIC值差异很大,因此,两种肉汤下必须使用不同的解释标准来区分耐药菌株和易感菌株。
LSM肉汤包含10%的MRS肉汤成分,MRS培养基含有一些针对甲氧苄啶的拮抗剂,其低pH值也可能会降低氨基糖苷类抗生素的活性,而相反,可能使β-内酰胺类抗生素活性更高,因此LSM肉汤不够规范。但对于一些特殊的乳杆菌种类,即使添加了裂解马血/β-NAD,CAMHB肉汤仍不足以支持生长。
除此以外,在培养环境方面EUCAST建议药敏试验非必要不在CO2环境下进行,因为CO2对某些药物有影响,如红霉素等在CO2环境下活性会降低[40]。但同时另两个组织考虑到大部分乳杆菌在厌氧环境下生存能力更好,依然建议统一在厌氧环境中培育。
5 乳杆菌的耐药表型和基因型
乳杆菌属对不同类别的抗生素表现出很大的耐药差异。CLSI建议临床首选药物为青霉素或氨苄西林,然而,虽然乳杆菌通常对青霉素敏感,但它们对同为β-内酰胺类的头孢类药物却不一定敏感[41]。
大多数乳杆菌对氨基糖苷类(新霉素、卡那霉素、链霉素和庆大霉素)、糖肽(万古霉素和替考拉宁)、核酸合成抑制剂(环丙沙星、依诺沙星、培氟沙星、诺氟沙星、萘啶酸和甲硝唑)和葉酸合成抑制剂(磺胺甲恶唑、甲氧苄啶和复方磺胺甲恶唑)具有内在耐药性[42]。
大多数乳杆菌对糖肽类药物(万古霉素和替考拉宁)表现出高水平的耐药,对万古霉素的耐药性可能是乳杆菌最好的内在耐药性[43-44]。万古霉素通过结合细胞壁前体肽聚糖五肽D-丙氨酸末端的D-丙氨酸残基,阻断细菌细胞壁中的肽聚糖的聚合,从而发挥杀菌作用[45]。而多种乳杆菌在其胞壁五肽中,D-丙氨酸末端的D-丙氨酸残基被胞壁中的D-乳酸或D-丝氨酸取代,万古霉素缺乏作用靶点,因此失效[46]。需要注意的是并不是所有的乳杆菌都对万古霉素有固有耐药:大部分在有氧环境下能很好生存的乳杆菌如干酪乳杆菌、发酵乳杆菌、植物乳杆菌、鼠李糖乳杆菌等对万古霉素有固有耐药,但嗜酸乳杆菌、卷曲乳杆菌詹氏乳杆菌、约氏乳杆菌等严格厌氧乳杆菌对万古霉素敏感[47]。CLSI、EFSA等组织都明确指出固有耐药并不是问题,反而因为此特性,乳杆菌可以与药物同时给药,达到更好的治疗效果[48],值得关注的是乳杆菌可转移耐药风险。
乳杆菌对氯霉素、链霉素、克林霉素、四环素、红霉素、利奈唑胺和奎奴普丁/达福普汀敏感[42]。但根据Gueimonde等[46]报道,尽管乳杆菌通常对大环内酯类药物敏感,但乳杆菌中的染色体突变(例如鼠李糖乳杆菌)可以降低红霉素对核糖体的亲和力,通过这样的机制,使得红霉素(杀菌机制为与细菌核糖体50S亚单位结合)失效。另一项研究也观察到乳杆菌中的染色体突变,鼠李糖乳杆菌E41发生了 23S rRNA基因的单个突变,该突变降低了红霉素对核糖体的亲和力,使菌株获得了大环内酯类耐药特性[47]。
表7总结了近15年来,乳杆菌药敏领域研究者们分离得到的乳杆菌耐药情况,这些乳杆菌大部分来源于发酵食品,对于菌株耐药表型、耐药基因、耐药基因位置进行了汇总,需要注意的是一些研究没有考虑耐药基因或基因位置,但菌株本身的耐药表型仍然很重要。
由表7可见,目前对乳杆菌获得性耐药的研究,主要集中在四环素、氯霉素和红霉素等相关耐药基因上。在副干酪乳杆菌、罗伊乳杆菌、唾液乳杆菌和发酵乳杆菌中检测到位于质粒或转座子上的四环素抗性基因tet,在发酵乳杆菌、唾液乳杆菌中检测到位于质粒上的红霉素抗性基因erm,在嗜酸乳杆菌、德氏乳杆菌中检测到位于质粒上的氯霉素抗性基因cat,一研究还检测到某株植物乳杆菌转座子上含有对氨基糖苷类抗生素的抗性基因aac(6)-aph(2″)、ant(6)和aph(3) -III等。
6 结论
作为益生菌的潜在菌库,一些被筛选出的乳杆菌菌株已被证明对多种疾病有效,并被FDA认定“GRAS”,因此广泛参与到人与动物的生活中,本文对我国乳杆菌的使用情况和致病耐药风险进行了相关总结,发现以下几点。
(1)典型的乳杆菌益生菌的益生效应综合体现在对口腔、鼻腔黏膜,皮肤炎症、湿疹,呼吸道疾病,消化道疾病,免疫系统以及神经系统的调节作用上,我国审批和应用较多的益生乳杆菌是鼠李糖乳杆菌、嗜酸乳杆菌、罗伊乳杆菌和植物乳杆菌。
(2)作为条件致病菌,乳杆菌可能引起菌血症,心内膜炎,脑膜炎等疾病[37],但乳杆菌引起疾病的风险很低,通常并非主要致病菌,而是伴随其他细菌的合并感染,只对免疫低下的患者造成威胁。相比而言,更值得注意的是,益生菌广泛使用可能造成的耐药风险[69]。
(3)总结近年来对乳杆菌耐药风险相关研究报告,发现多种乳杆菌携带有抗生素耐药性基因,包括四环素类(tet)、糖肽类(van)、大环内酯类(erm、mef)、酰胺醇类(cat,fex)、喹诺酮类(gyr,par)、氨基糖苷类(aac(6)-aph(2″)、ant(6)、aph(3') -III)、磺胺类(sul,dfr)、利福平类(rpo)、大环内酯类(mef)、林可酰胺类(lnu),在多种乳杆菌中发现了位于可移动元件上的四环素抗性基因tet,红霉素抗性基因erm,氯霉素抗性基因cat基因,乳杆菌有耐药转移风险。
7 讨论与展望
本文对CLSI、EUCAST、EFSA和IDF等4个权威国际机构给出的乳杆菌AST标准进行了综合比较分析,认为规范化进行乳杆菌的抗生素敏感性试验(AST)迫在眉睫,建议可从以下方面进行。
(1)推进对乳杆菌新分类的研究,从进化方向和亲缘关系上对乳杆菌的固有耐药和获得性耐药进行深入研究。
(2)研究出更适合乳杆菌使用的药敏肉汤,既能满足菌株生长,又不影响药物活性。
(3)各标准机构可以根据关注点的不同,给出更体系化的对某种用途乳杆菌的具体药敏实验方法和结果评定标准,而不能采用不同的体系进行药敏试验又采取相同的标准进行判定。
(4)对于临床感染的乳杆菌耐药快速检测,在有质控菌株的情况下,纸片法药敏试验也许更加方便快捷,有报道称纸片扩散法和 E-test 法得到的嗜酸乳杆菌MIC结果与标准的微量肉汤稀释法结果具有一致性[70]。
(5)乳杆菌在进行商业投产前,除了进行表型检测外,还应进行全基因组序列(genome-wide sequencing, WGS)以确定乳杆菌是否存在抗生素抗性基因,用WGS寻找抗生素抗性基因可以识别出相似但不相同的基因,发现更多沉默的耐药基因,避免这些基因转移到其他物种中被激活。
最后,呼吁國家制定法规在规范乳杆菌应用的过程中更应谨慎行事[71],需要进一步的研究来表征它们,综合考虑其作为商业产品应用的有效性和安全性。
参 考 文 献
王阶平, 刘波, 刘欣, 等. 乳酸菌的系统分类概况[J]. 生物资源, 2019, 41(6): 471-485.
魏长浩, 邓泽元. 益生菌及其应用研究进展[J]. 乳业科学与技术, 2018, 41(1): 26-32.
Fine R L, Mubiru D L, Kriegel M A. Friend or foe? Lactobacillus in the context of autoimmune disease[J]. Adv Immunol, 2020, 146: 29-56.
Campedelli I, Mathur H, Salvetti E, et al. Genus-wide assessment of antibiotic resistance in Lactobacillus spp.[J]. Appl Environ Microb, 2019, 85(1): e01738-18.
房诗薇, 黄玲利, 谢书宇, 等. 兽用抗菌药耐药判定标准的研究进展[J]. 中国抗生素杂志, 2019, 44(6): 667-673.
赵岩. 中国人群肠道中发酵乳杆菌的基因差异及其对肠道的生理调节作用[D]. 无锡: 江南大学, 2021.
陆静. 中国人群肠道菌群分布特征及影响因素解析[D]. 无锡: 江南大学, 2022.
张晓宇, 孙茜, 冯旸子, 等. 阴道内乳杆菌与粪肠球菌共培养生长状态及其上清液对阴道加德纳菌抑制作用的体外研究[J]. 现代妇产科进展, 2023, 32(4): 1-6.
Jespers V, Menten J, Smet H, et al. Quantification of bacterial species of the vaginal microbiome in different groups of women, using nucleic acid amplification tests[J]. BMC Microbiol, 2012, 12: 83.
Zheng J, Wittouck S, Salvetti E, et al. A taxonomic note on the genus Lactobacillus: Description of 23 novel genera, emended description of the genus Lactobacillus Beijerinck 1901, and union of Lactobacillaceae and Leuconostocaceae[J]. Int J Syst Evol Micr, 2020, 70(4): 2782-2858.
Qiao N, Wittouck S, Mattarelli P, et al. After the storm-Perspectives on the taxonomy of Lactobacillaceae[J]. JDS Commun, 2022, 3(3): 222-227.
于学健, 胡海蓉, 曹艳花, 等. 乳杆菌属分类学地位变迁后菌种名称英解汉译检索表(三)[J]. 食品与发酵工业, 2020, 46(17): 296-300.
中华人民共和国农业部畜牧业司. 饲料添加剂品种目录(2013)[S]. (2013年). 北京: 中华人民共和国农业部, 2013 公告第2045号: 附录一.
食品安全标准与监测评估司. 可用于食品的菌种名单&可用于婴幼儿食品的菌种名单[S]. (2022年). 北京: 中华人民共和国国家卫生健康委员会, 2022第4号: 附件1-2.
食品安全标准与监测评估司. 可用于保健食品的益生菌菌种名单[S]. (2004年). 北京: 中华人民共和国国家卫生健康委员会, 2004 卫法监发[2001]84号: 附件5.
Grujovi? M, Mladenovi? K G, Semedo-Lemsaddek T, et al. Advantages and disadvantages of non-starter lactic acid bacteria from traditional fermented foods: Potential use as starters or probiotics[J]. Compr Rev Food Sci F, 2022, 21(2): 1537-1567.
Azam M, Mohsin M, Ijaz H, et al. Review - Lactic acid bacteria in traditional fermented Asian foods[J]. Pak J Pharm Sci, 2017, 30(5): 1803-1814.
Mantegazza C, Molinari P, D'Auria E, et al. Probiotics and antibiotic-associated diarrhea in children: A review and new evidence on Lactobacillus rhamnosus GG during and after antibiotic treatment[J]. Pharmacol Res, 2018, 128: 63-72.
Floch M H, Walker W A, Madsen K, et al. Recommendations for probiotic use-2011 update[J]. J Clin Gastroenterol, 2011, 45 Suppl: S168-S171.
Hayes S R, Vargas A J. Probiotics for the prevention of pediatric antibiotic-associated diarrhea[J]. Explore-Ny, 2016, 12(6): 463-466.
Moal L L, Servin A L. Anti-infective activities of lactobacillus strains in the human intestinal microbiota: From probiotics to gastrointestinal anti-infectious biothera-peutic agents[J]. Clin Microbiol Rev, 2014, 27(2): 167-199.
Auclair J, Frappier M, Millette M. Lactobacillus acidophilus CL1285, Lactobacillus casei LBC80R, and Lactobacillus rhamnosus CLR2 (Bio-K+): Characterization, manufacture, mechanisms of action, and quality control of a specific probiotic combination for primary prevention of clostridium difficile infection[J]. Clin Infect Dis, 2015, 60(Suppl 2): S135-S143.
唐京, 陳明, 柯文灿, 等. 乳酸菌在疾病防治和人体保健中的应用研究进展[J]. 微生物学杂志, 2017, 37(4): 98-107.
Ganguly N K, Bhattacharya S K, Sesikeran B, et al. ICMR-DBT guidelines for evaluation of probiotics in food[J]. Indian J Med Res, 2011, 134(1): 22-25.
Mikucka A, Deptu?a A, Bogiel T, et al. Bacteraemia caused by probiotic strains of Lacticaseibacillus rhamnosus-Case studies highlighting the need for careful thought before using microbes for health benefits[J]. Pathogens, 2022, 11(9): 977.
Rubin I M C, Stevnsborg L, Mollerup S, et al. Bacteraemia caused by Lactobacillus rhamnosus given as a probiotic in a patient with a central venous catheter: a WGS case report[J]. Infect Prev Pract, 2022, 4(1): 100200.
Rocca F, Aguerre L, Cipolla L, et al. Lactobacillus spp. invasive infections in Argentina[M]. Int J Infect Dis, 2018, 73 Suppl: S163.
Rossi F, Amadoro C, Colavita G. Members of the Lactobacillus Genus Complex (LGC) as opportunistic pathogens: A review[J]. Microorganisms, 2019, 7(5): 126.
吉星, 李俊, 王冉, 等. 常见益生菌耐药性研究进展[J]. 江苏农业学报, 2022, 38(6): 1722-1728.
Wang K, Zhang H, Feng J, et al. Antibiotic resistance of lactic acid bacteria isolated from dairy products in Tianjin, China[J]. J Agr Food Res, 2019, 1: 100006.
Van den Nieuwboer M, Brummer R J, Guarner F, et al. Safety of probiotics and synbiotics in children under 18 years of age[J]. Benef Microbes, 2015, 6(5): 615-630.
Oladeinde A, Cook K, Lakin S M, et al. Horizontal gene transfer and acquired antibiotic resistance in Salmonella enterica Serovar Heidelberg following in vitro incubation in broiler ceca[J]. Appl Environ Microb, 2019, 85(22): e01903-19.
Fatahi-Bafghi M, Naseri S, Alizehi A. Genome analysis of probiotic bacteria for antibiotic resistance genes[J]. Anton Leeuw Int J G, 2022, 115(3): 375-389.
More S, Bampidis V, Benford D, et al. Evaluation of existing guidelines for their adequacy for the food and feed risk assessment of microorganisms obtained through synthetic biology[J]. EFSA J, 2022, 20(8): e07479.
CLSI. Methods for antimicrobial dilution and disk susceptibility testing of infrequently isolated or fastidious bacteria[S]. (2015, 3rd ed). Wayne, PA: Clinical and Laboratory Standards Institute; 2015, 1-21.
Giske C G, Turnidge J, Cantón R, et al. Update from the European Committee on Antimicrobial Susceptibility Testing (EUCAST)[J]. J Clin Microbiol, 2022, 60(3): e0027621.
Rychen G, Aquilina G, Azimonti G, et al. Guidance on the characterisation of microorganisms used as feed additives or as production organisms[J]. EFSA J, 2018, 16(3): e05206.
Efsa. Guidance on the assessment of bacterial susceptibility to antimicrobials of human and veterinary importance[J]. EFSA J, 2012, 10(6): 2740.
ISO/IDF. Milk and milk products-determination of the minimal inhibitory concentration (MIC) of antibiotics applicable to bifidobacteria and non-enterococcal lactic acid bacteria (LAB)[S]. (2010, 1rd ed). Switzerland: ISO and IDF Institute, 2015: 1-31.
Mayrhofer S, Zitz U, Birru F H, et al. Comparison of the CLSI guideline and ISO/IDF standard for antimicrobial susceptibility testing of lactobacilli[J]. Microb Drug Resist, 2014, 20(6): 591-603.
宋曉敏, 李少英, 马春艳, 等. 发酵食品中乳酸菌的耐药性现状分析[J]. 微生物学通报, 2015, 42(1): 207-213.
Abriouel H, Casado-Mu?oz M D, Lavilla-Lerma L, et al. New insights in antibiotic resistance of Lactobacillus species from fermented foods[J]. Food Res Int, 2015, 78: 465-481.
Goldstein E J, Tyrrell K L, Citron D M. Lactobacillus species: Taxonomic complexity and controversial susceptibilities[J]. Clin Infect Dis, 2015, 60 (Suppl 2): S98-S107.
Colautti A, Arnoldi M, Comi G, et al. Antibiotic resistance and virulence factors in lactobacilli: Something to carefully consider[J]. Food Microbiol, 2022, 103: 103934.
王炜哲, 翟征远, 郝彦玲. 市售酸奶中发酵剂乳酸菌的耐药性及耐药基因研究进展[J]. 中国乳品工业, 2022, 50(2): 34-37.
Gueimonde M, Sánchez B, Reyes-Gavilán C G L, et al. Antibiotic resistance in probiotic bacteria[J]. Front Microbiol, 2013, 4: 202.
Flórez A B, Ladero V, Alvarez-Martín P, et al. Acquired macrolide resistance in the human intestinal strain Lactobacillus rhamnosus E41 associated with a transition mutation in 23S rRNA genes[J]. Int J Antimicrob Agents, 2007, 30(4): 341-344.
Das D J, Shankar A, Johnson J B, et al. Critical insights into antibiotic resistance transferability in probiotic Lactobacillus[J]. Nutrition, 2020, 69: 110567.
Nawaz M, Wang J, Zhou A, et al. Characterization and transfer of antibiotic resistance in lactic acid bacteria from fermented food products[J]. Curr Microbiol, 2011, 62(3): 1081-1089.
Guo H, Pan L, Li L, et al. Characterization of antibiotic resistance genes from Lactobacillus isolated from traditional dairy products[J]. J Food Sci, 2017, 82(3): 724-730.
Ouoba L I, Lei V, Jensen L B. Resistance of potential probiotic lactic acid bacteria and bifidobacteria of African and European origin to antimicrobials: determination and transferability of the resistance genes to other bacteria[J]. Int J Food Microbiol, 2008, 121(2): 217-224.
Yang C, Yu T. Characterization and transfer of antimicrobial resistance in lactic acid bacteria from fermented dairy products in China[J]. J Infect Dev Countr, 2019, 13(2): 137-148.
Zhou N, Zhang J X, Fan M T, et al. Antibiotic resistance of lactic acid bacteria isolated from Chinese yogurts[J]. J Dairy Sci, 2012, 95(9): 4775-4783.
Thumu S C, Halami P M. Presence of erythromycin and tetracycline resistance genes in lactic acid bacteria from fermented foods of Indian origin[J]. Anton Leeuw Int J G, 2012, 102(4): 541-551.
Pan L, Hu X, Wang X. Assessment of antibiotic resistance of lactic acid bacteria in Chinese fermented foods[J]. Food Control, 2011, 22(8): 1316-1321.
Cho G S, Cappello C, Schrader K, et al. Isolation and characterization of lactic acid bacteria from fermented goat milk in Tajikistan[J]. J Microbiol Biotechnol, 2018, 28(11): 1834-1845.
Comunian R, Daga E, Dupré I, et al. Susceptibility to tetracycline and erythromycin of Lactobacillus paracasei strains isolated from traditional Italian fermented foods[J]. Int J Food Microbiol, 2010, 138(1-2): 151-156.
Devirgiliis C, Coppola D, Barile S, et al. Characterization of the Tn916 conjugative transposon in a food-borne strain of Lactobacillus paracasei[J]. Appl Environ Microb, 2009, 75(12): 3866-3871.
Zonenschain D, Rebecchi A, Morelli L. Erythromycin-and tetracycline-resistant Lactobacilli in Italian fermented dry sausages[J]. J Appl Microbiol, 2009, 107(5): 1559-1568.
Anisimova E A, Yarullina D R. Antibiotic resistance of Lactobacillus strains[J]. Curr Microbiol, 2019, 76(12): 1407-1416.
Jaimee G, Halami P M. High level aminoglycoside resistance in Enterococcus, Pediococcus and Lactobacillus species from farm animals and commercial meat products[J]. Ann Microb, 2016, 66(1): 101-110.
Liu C, Zhang Z Y, Dong K, et al. Antibiotic resistance of probiotic strains of lactic acid bacteria isolated from marketed foods and drugs[J]. Biomed Environ Sci (BES), 2009, 22(5): 401-412.
Hoek A V, Margolles A, Domig K J, et al. Molecular assessment of erythromycin and tetracycline resistance genes in lactic acid bacteria and Bifidobacteria and their relation to the phenotypic resistance[C]. Int J Probiotics Prebiotics, 2008, 3(4): 271-280.
Chang Y C, Tsai C Y, Lin C F, et al. Characterization of tetracycline resistance Lactobacilli isolated from swine intestines at western area of Taiwan[J]. Anaerobe, 2011, 17(5): 239-245.
Egerv?rn M, Lindmark H, Olsson J, et al. Transferability of a tetracycline resistance gene from probiotic Lactobacillus reuteri to bacteria in the gastrointestinal tract of humans[J]. Anton Leeuw Int J G, 2010, 97(2): 189-200.
Egerv?rn M, Roos S, Lindmark H. Identification and characterization of antibiotic resistance genes in Lactobacillus reuteri and Lactobacillus plantarum[J]. J Appl Microbiol, 2009, 107(5): 1658-1668.
Zhang S, Oh J H, Alexander L M, et al. d-Alanyl-d-Alanine ligase as a broad-host-range counterselection marker in vancomycin-resistant lactic acid bacteria[J]. J Bacteriol, 2018, 200(13): e00607-17.
Coton M, Lebreton M, Leyva Salas M, et al. Biogenic amine and antibiotic resistance profiles determined for lactic acid bacteria and a propionibacterium prior to use as antifungal bioprotective cultures[J]. Int Dairy J, 2018, 85: 21-26.
Zheng M, Zhang R, Tian X, et al. Assessing the risk of probiotic dietary supplements in the context of antibiotic resistance[J]. Front Microbiol, 2017, 8: 908.
Mayrhofer S, Domig K J, Mair C, et al. Comparison of broth microdilution, E-test, and agar disk diffusion methods for antimicrobial susceptibility testing of Lactobacillus acidophilus group members[J]. Appl Environ Microbiol, 2008, 74(12): 3745-3748.
Ojha A K, Shah N P, Mishra V. Conjugal transfer of antibiotic resistances in Lactobacillus spp.[J]. Curr Microbiol, 2021, 78(8): 2839-2849.
