基于线粒体DNA COⅠ基因鉴别畜禽肉中鸡源性成分
2017-11-16唐修君樊艳凤葛庆联贾晓旭张静刘茵茵张小燕王珏高玉时
唐修君+樊艳凤+葛庆联+贾晓旭+张静+刘茵茵+张小燕+王珏+高玉时
摘 要:为建立畜禽肉中鸡源性成分的快速检测方法,以线粒体DNA细胞色素C氧化酶亚基Ⅰ(COⅠ)基因序列为靶点,比较羊、牛、猪、兔、鸽、鹌鹑、鸡、鸭、鹅9 种动物COⅠ基因的差异位点,设计筛选鸡特异性引物,进行常规聚合酶链式反应(polymerase chain reaction,PCR)和荧光定量PCR检测。结果表明:所设计的引物仅对鸡肉DNA模板有扩增条带和典型扩增曲线,且循环阈(cycle threshold,Ct)值为21.78,对其他动物DNA模板无扩增。方法特异性较强,灵敏度较高,达pg级,可以用于畜禽肉与肉制品中鸡源性成分的快速、有效、準确检测。
关键词:鸡源性成分;线粒体DNA;COⅠ基因;荧光定量PCR
Identification of Chicken Origin Ingredients in Livestock and Poultry Meat Based on Mitochondrial DNA COI Gene
TANG Xiujun, FAN Yanfeng, GE Qinglian, JIA Xiaoxu, ZHANF Jing, LIU Yinyin, ZHANG Xiaoyan, WANG Jue, GAO Yushi*
(Institute of Poultry, Chinese Academy of Agricultural Sciences, Yangzhou 225125, China)
Abstract: In this study, a quick method to identify ingredients of chicken origin in livestock and poultry meat was developed by polymerase chain reaction (PCR) and fluorescence quantitative PCR using mitochondrial DNA cytochrome C coxidase subunit Ⅰ (CO Ⅰ) gene as target gene. The mitochondrial DNA CO Ⅰ genes from chicken, duck, goose, pig, cattle, sheep, rabbit, pigeon and quail revealed distinct loci. Based on this, a set of chicken-specific primers was designed. The results showed that the designed primers could only amplify template DNA from chicken with a cycle threshold (Ct) value of 21.78. The PCR assay had a high specificity and sensitivity (at pg level) and it could be used to detect ingredients of chicken origin in livestock and poultry meat quickly and accurately.
Key words: chicken origin ingredients; mitochondrial DNA; cytochrome C coxidase subunit I (CO I) gene; fluorescence quantitative PCR
DOI:10.7506/rlyj1001-8123-201708009
中图分类号:TS207.3 文献标志码:A 文章编号:1001-8123(2017)08-0044-05
作为人类重要的营养来源,肉类与人们的生活和健康密切相关,然而在利益驱动下肉制品掺杂、掺假事件时有发生,“挂鹅头卖鸭肉”、非法使用添加剂牛肉膏等食品安全事件不断出现,严重侵害了消费者的权益。肉类来源鉴别的传统方法是依靠感官评价和肉类形态学手段,但这些已远不能满足监管部门对肉制品掺杂、掺假现象的监控,因此加强肉类产品中动物源性成分的检测技术研究意义重大。
随着分子生物学技术的不断发展,以DNA为基础的聚合酶链式反应(polymerase chain reaction,PCR)技术以其独特的优势被越来越多地应用于畜禽肉源性成分的鉴别,并已逐步成为肉类产品中动物源性成分鉴定的核心方法[1-4]。近年来,实时荧光定量PCR技术凭借其特异性良好、自动化程度高、检测周期短以及扩增目的片段较小等优势在动物源性成分鉴别中成为研究热点,极大地提高了动物源性成分定性检测的效率和灵敏度[5-6]。林彦星等[7]根据鸭mt DNA Cox基因保守序列设计特异性引物和Taq Man探针,建立了畜禽肉制品中鸭源性成分的荧光定量PCR检测方法。孙晶莹等[8]根据牛线粒体DNA片段设计合成了2 对特异性引物,以生牛肉、熟牛肉和牛肉制品为研究对象,建立了牛肉制品中牛源性成分的多重实时荧光PCR检测方法。荧光定量PCR技术的绝对优势使其能够实现样品的定量检测,并且能够简化实验步骤,可以同时实现对目标片段的定性和定量检测,但由于其灵敏度较高,检测结果易产生假阳性,因此对实验室条件和检验人员的要求较高。
动物线粒体基因组序列具有高度物种特异性、拷贝数多以及在食品加工过程中未完全降解等特点,是进行动物源性成分鉴别的良好靶基因[9-11]。近年来陆续报道了一些基于12S rRNA[12]、Cyt b[13]等序列的线粒体基因片段进行肉品中动物源性成分鉴别的方法,但所用到的动物品种相对较少。为进一步完善畜禽肉中鸡源性成分的检测技术,本研究拟选择线粒体DNA COⅠ基因为靶基因,根据羊、牛、猪、兔、鸽、鹌鹑、鸡、鸭、鹅9 种动物COⅠ基因的差异位点设计、筛选鸡特异性引物,建立基于常规PCR和荧光定量PCR技术的畜禽肉中鸡源性成分的快速鉴别方法,为肉制品的掺杂识别提供依据。endprint
1 材料与方法
1.1 材料与试剂
新鲜的羊肉、牛肉、猪肉、兔肉、鸽肉、鹌鹑肉、鸡肉、鸭肉、鹅肉 扬州市邗江区窦庄农贸市场;火
腿肠 金锣集团有限公司;腊鸡腿 上海万有全集团有限公司。
基因组DNA抽提试剂盒 北京天根生化科技有限公司;
2×PCR Mix 南京博尔迪公司;电泳上样缓冲液
宝生物工程(大连)有限公司;琼脂糖 美国Promega公司;荧光染料预混液:AceQ qPCR SYBR Green Master Mix 南京诺唯赞生物科技有限公司。
1.2 仪器与设备
BioPhotometer Plus核酸蛋白检测仪、5331 PCR仪 德国Eppendorf公司;7500实时荧光PCR扩增仪 美国ABI公司;GBox凝胶成像分析系统 基因有限公司。
1.3 方法
1.3.1 DNA提取
将9 种动物肉样分别搅碎至肉糜状,备用。使用Beyotime基因组DNA小量抽提试剂盒提供的蛋白酶K法提取各样本的DNA。经核酸蛋白检测仪测定,9 种动物肉样的DNA模板质量浓度在110~210 ng/μL之间,其中鸡肉为174.57 ng/μL。
1.3.2 引物设计与合成
以Genbank上公布的羊、牛、猪、兔、鸽、鹌鹑、鸡、鸭、鹅的线粒体DNA COⅠ基因序列为靶基因,通过Arraydesigner 2.0、Oligo 6.0和Primer Premier 5.0软件进行比对分析,设计合成鸡特异性引物,由生工生物工程(上海)股份有限公司负责合成,引物序列、DNA熔解温度(melting temperature,Tm)、PCR扩增片段大小和产物序列如表1所示。
1.3.3 常规PCR扩增与测序
20 μL反应体系:2×PCR Mix 10 μL、10 μmol/L正向引物和反向引物各0.2 μL、模板1 μL、双蒸灭菌水8.6 μL。反应条件:95 ℃预变性5 min,95 ℃变性30 s,60 ℃退火30 s,72 ℃延伸60 s,30 个循环,最后72 ℃延伸10 min。反应结束后用15 g/L琼脂糖凝胶电泳对PCR产物进行检测,电泳结束后割胶回收、纯化,交由上海华大基因科技有限公司进行双向测序,将测序结果与GenBank上的已知序列进行比对。
1.3.4 荧光定量PCR扩增
15 μL反应体系:Mix 7.5 μL、染料(Dye)0.3 μL、1 μmol/L正向引物和反向引物各0.5 μL、模板1 μL、双蒸灭菌水5.2 μL。反应条件:50 ℃酶激活2 min,95 ℃预变性10 min,95 ℃变性15 s,60 ℃延伸1 min,40 个循环。反应结束后,观察各动物模板DNA的扩增曲线及循环阈(cycle threshold,Ct)值,判定引物的特异性。若无典型扩增曲线且Ct值大于35,则检测体系无特异性扩增。
1.3.5 灵敏度实验
将DNA模板分别稀释101~108 倍,测定方法的灵敏度,反应条件同1.3.3和1.3.4节。
1.3.6 实际样品检测
随机抽取市售火腿肠和腊鸡腿作为样品,利用本研究建立的方法进行检测。
1.4 数据处理
应用7500实时荧光PCR扩增仪自带软件对PCR扩增产物进行高分辨率熔解曲线分析,确定扩增产物的Tm值和熔解曲线。
2 结果与分析
2.1 常规PCR扩增结果
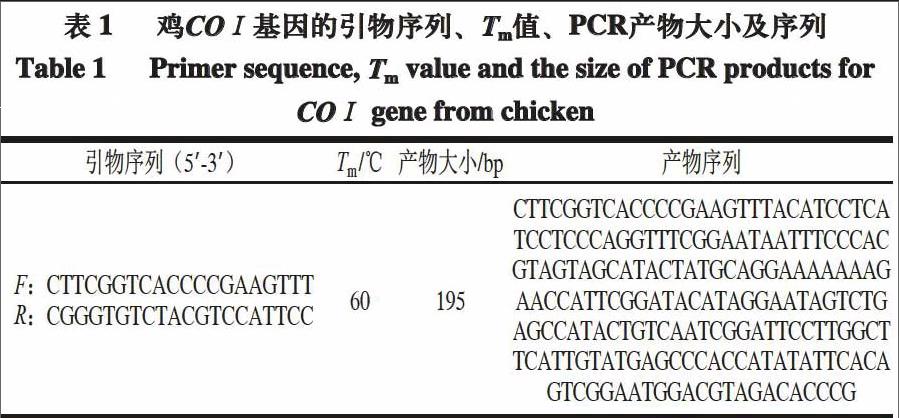
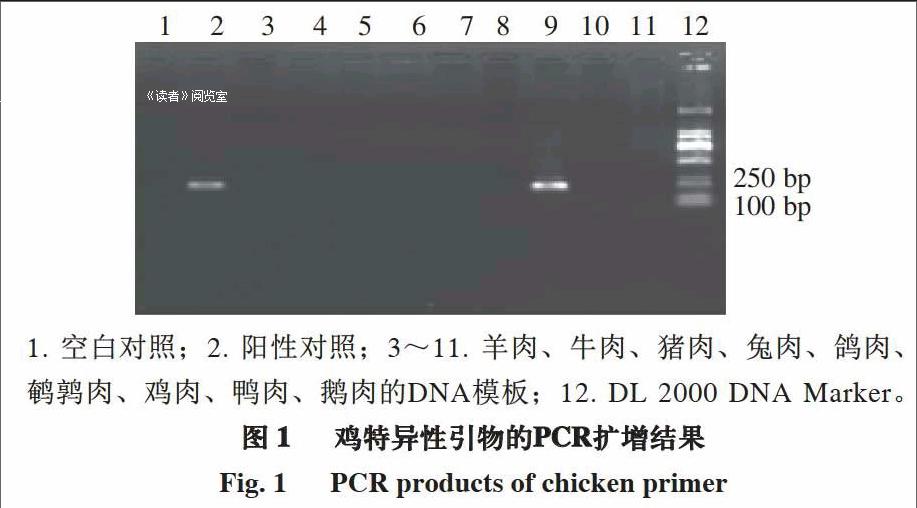
由图1可知,用鸡特异性引物分别与不同动物的DNA模板进行扩增时,仅鸡的DNA模板扩增出195 bp的条带,而其他物种的DNA模板无扩增。由图2可知,将鸡的DNA模板按10倍梯度进行稀释,当稀释倍数达104,即DNA模板质量浓度为17.457 pg/μL时仍有特异性条带出现,表明检测灵敏度达到pg级。
2.2 荧光定量PCR扩增结果
以设计筛选的鸡特异性引物作为引物,以9 种动物的肌肉DNA为模板,进行荧光定量PCR扩增检测。由图3及表2可知,只有鸡的肌肉DNA模板出现了典型扩增曲线,且Ct值为21.78,而其他动物的肌肉DNA模板均未出现典型扩增曲线。
2.3 荧光定量PCR的灵敏度检测
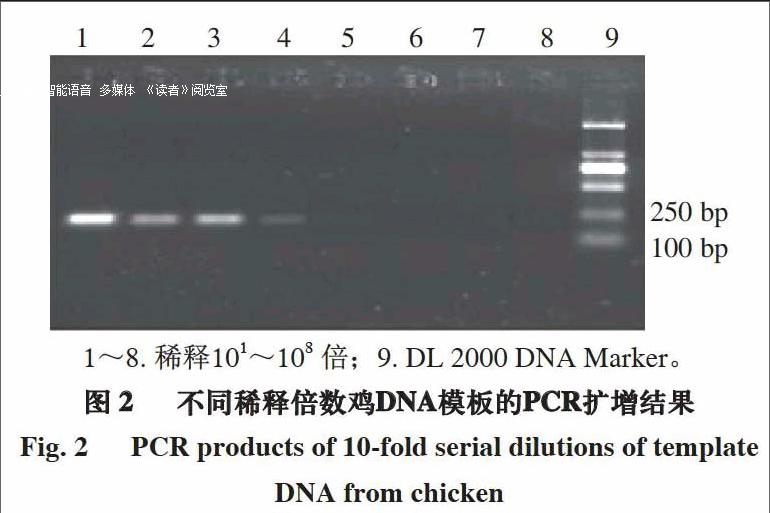
将鸡的DNA模板分别稀释101~108 倍,采用2 种體积的引物(上、下游引物浓度均为10 μmol/L)进行方法的灵敏度检测,确定方法的检测下限。由图4~5及表3可知,当引物体积为0.05 μL时,稀释103 倍的鸡DNA模板有典型扩增曲线,且Ct值小于35,此时鸡DNA模板质量浓度为175 pg/μL;当引物体积为0.20 μL时,稀释104 倍的鸡DNA模板有典型扩增曲线,且Ct值小于35,此时鸡DNA模板质量浓度为17.5 pg/μL。表明所建立的荧光定量PCR方法灵敏度较高,达到pg级。
2.4 实际样品测定
对大、中型超市和农贸市场的相关样品进行抽检,火腿肠及腊鸡腿肉样品均通过优化后的十六烷基三甲基溴化铵(hexadecyltrimethy ammonium bromide,CTAB)法[14]进行DNA提取。由表4可知,标识主要原料肉为鸡肉的火腿肠和腊鸡腿中检测出鸡源性成分,而标识主要原料肉为猪肉和牛肉的火腿肠中未检测出鸡源性成分,表明该方法可以用于畜禽肉与肉制品中鸡源性成分的快速、有效检测。
3 讨 论
近年来,肉类掺假等食品安全事件屡屡发生,建立畜禽肉中动物源性成分的快速鉴别技术显得尤为重要[15-17]。目前我国肉类掺假识别方面的技术相对落后,肉类制品掺假的定量检测方法和相关国家标准仍为空白[18]。随着人们对食品安全的日益重视以及分子生物学等技术的飞速发展,动物源性成分的多种检测技术相继涌现[3,19],其中以核酸检测为基础的食品中肉类成分的鉴别与分析技术已逐渐成熟[20-21]。endprint
荧光定量PCR技术近年来迅速发展,具有简单、快速、灵敏度和准确性高等优点,不仅可以提高肉与肉制品中动物源性成分定性检测的准确性,而且使得定量检测成为可能,应用前景非常广阔[22-24]。齐春萌等[25]根据鸵鸟线粒体细胞色素C氧化酶亚基Ⅰ(COXⅠ)基因序列设计特异性引物和Taq Man探针,建立了肉制品中鸵鸟源性成分的实时荧光PCR鉴定方法。许如苏等[26]基于马的种属保守序列设计特异性引物和Taq Man-LNA探针,建立了可快速检测肉制品中马源性成分的Taq Man-LNA荧光PCR检测方法。冯震等[27]以线粒体细胞色素b(cytochrome b,Cytb)基因的核苷酸序列为检测靶点,设计并优化引物,建立了基于荧光定量PCR技术的生鲜肉中牛、羊源性成分的检测方法,并对方法的特异性和灵敏度进行了验证。
目前,有关畜禽肉中鸡源性成分检测方法的研究报道相对较少,而且已有报道中涉及到的动物种类较少[28-29]。
本研究根据羊、牛、猪、兔、鸽、鹌鹑、鸡、鸭、鹅9 种动物线粒体DNA COⅠ基因序列的位点差异设计鸡特异性引物,进行常规PCR和荧光定量PCR扩增检测。结果表明,所选定的引物对只有在鸡模板DNA存在的情况下才会发生反应,产生特异性扩增条带和扩增曲线,而与羊、牛、猪、兔、鸽、鹌鹑、鸭、鹅8 种动物的DNA模板均无反应,可见所设计筛选的引物特异性较好,可以用于畜禽肉中鸡源性成分的快速、准确检测。该方法的建立不仅可以完善我国肉与肉制品中鸡肉掺假的定量检测方法,也为打击肉类产品的掺杂、掺假等违法违规行为提供了技术保障,对于政府部门的监督管理工作具有极其重要的意义。
4 结 论
本研究以线粒体DNA COⅠ基因为靶基因,设计筛选出了鸡特异性引物,采用常规PCR和实时荧光定量PCR技术建立了畜禽肉中鸡源性成分的快速、准确定量分析方法,方法特异性较好,灵敏度较高,可达pg级。
参考文献:
[1]MURUGAIAH C, NOOR Z M, MASTAKIM M, et al. Meat species identification and Halal authentication analysis using mitochondrial DNA[J]. Meat Science, 2009, 83(1): 57-61. DOI:10.1016/j.meatsci.2009.03.015.
[2]MANE B G, MENDIRATTA S K, TIWARI A K. Polymerase chain reaction assay for identi?cation of chicken in meat and meat products[J]. Food Chemistry, 2009, 116(3): 806-810. DOI:10.1016/j.foodchem.2009.03.030.
[3]GHOVVATI S, NASSIRI M R, MIRHOSEINI S Z, et al. Fraud identi?cation in industrial meat products by multiplex PCR assay[J]. Food Control, 2009, 20(8): 696-699. DOI:10.1016/j.foodcont.2008.09.002.
[4]张驰, 杨军, 王晓丽. 基于线粒体编码基因差异对食品中牛肉与猪肉成分的鉴别[J]. 食品科技, 2011, 36(1): 83-88.
[5]KESMEN Z, GΜLLUCE A, SAHIN F, et al. Identi?cation of meat species by Taq Man-based real-time PCR assay[J]. Meat Science, 2009, 82(4): 444-449. DOI:10.1016/j.meatsci.2009.02.019.
[6]王颖, 史艳宇, 刘金华, 等. 荧光定量PCR方法检测畜肉食品中猪源性成分[J]. 食品安全质量检测学报, 2013, 4(5): 1529-1534.
[7]林彦星, 张彩虹, 阮周曦, 等. 实时荧光定量PCR检测畜禽肉制品中鸭源性成分[J]. 动物医学进展, 2016, 37(11): 48-53. DOI:10.3969/j.issn.1007-5038.2016.11.010.
[8]孙晶莹, 孙丽君, 王晓红, 等. 肉制品中牛源性成分多重实时荧光PCR检测方法的建立及初步应用[J]. 食品安全质量检测学报, 2016, 7(9): 3756-3760.
[9]BALLIN N Z, VOGENSEN F K, KARLSSON A H. Species determination: can we detect and quantify meat adulteration?[J]. Meat Science, 2009, 83(2): 165-174. DOI:10.1016/j.meatsci.2009.06.003.
[10]何玮玲, 张驰, 杨静, 等. 食品中4 种肉類成分多重PCR的快速鉴别方法[J]. 中国农业科学, 2012, 45(9): 1873-1880. DOI:10.3864/j.issn.0578-1752.2012.09.024.
[11]张晶鑫, 樊艳凤, 唐修君, 等. 基于线粒体DNA 16S rRNA基因鉴别畜禽肉中鸭源性成分研究[J]. 中国家禽, 2016, 38(17): 41-44. DOI:10.16372/j.issn.1004-6364.2016.17.009.endprint
[12]王兰萍, 耿荣庆, 王伟, 等. 基于线粒体12S rRNA基因序列鉴别牛肉的种源[J]. 家畜生态学报, 2013, 34(2): 19-21. DOI:10.3969/j.issn.1673-1182.2013.02.005.
[13]钱云开, 王海洋, 崔宗岩, 等. 实时荧光PCR法快速检测肉类中貉源性成分[J]. 中国食品卫生杂志, 2016, 28(5): 602-605. DOI:10.13590/j.cjfh.2016.05.009.
[14]何海宁, 洪霞, 冯玉升, 等. 加工食品中动物源DNA的提取和多重PCR检测方法的建立[J]. 食品与机械, 2015, 31(6): 79-83.
[15]陈冬, 柏凡, 周明亮, 等. 基于线粒体12S rRNA基因鉴别混合牛肉及制品的牛种来源[J]. 遗传, 2008, 30(8): 1008-1014. DOI:10.3321/j.issn:0253-9772.2008.08.010.
[16]曾少灵, 秦智锋, 阮周曦, 等. 多重实时荧光PCR检测牛、山羊和绵羊源性成分[J]. 生物工程学报, 2009, 25(1): 139-146. DOI:10.3321/j.issn:1000-3061.2009.01.021.
[17]唐修君, 樊艳凤, 贾晓旭, 等. 基于线粒体16S rRNA基因鉴别畜禽肉中5 种动物源性成分[J]. 食品科技, 2015, 40(12): 86-89.
[18]徐琼, 张奕南, 顾文佳, 等. Taq Man实时荧光PCR法定量检测生肉中猪源性成分的建立[J]. 食品科技, 2016, 41(2): 309-313.
[19]马灵飞, 周围, 张雅珩, 等. 基于脂肪酸差异的肉制品中猪源性成分鉴别方法的研究[J]. 分析测试学报, 2016, 35(10): 1295-1300. DOI:10.3969/j.issn.1004-4957.2016.10.013.
[20]石盼盼, 李旭, 吴昊, 等. 肉及肉制品中动物源性成分核酸检测方法研究进展[J]. 食品研究与开发, 2016, 37(10): 211-214. DOI:10.3969/j.issn.1005-6521.2016.10.052.
[21]李宗梦, 赵良娟, 赵宏, 等. 肉及肉制品动物源性成分鉴别技术研究进展[J]. 食品研究与开发, 2014, 35(18): 122-127. DOI:10.3969/j.issn.1005-6521.2014.18.032.
[22]MART?N I, GARC?A T, FAJARDO V, et al. SYBR-Green real-time
PCR approach for the detection and quanti?cation of pig DNA in feedstuffs[J]. Meat Science, 2009, 82(2): 252-259. DOI:10.1016/j.meatsci.2009.01.023.
[23]LAUBE I, ZAGON J, BROLL H. Quantitative determination of commercially relevant species in foods by real-time PCR[J]. International Journal of Food Science and Technology, 2007, 42(3): 336-341. DOI:10.1111/j.1365-2621.2006.01249.x.
[24]范丽丽, 李培, 傅春玲, 等. 食品中鸡源性成分实时荧光PCR检测方法的建立[J]. 食品科学, 2014, 35(2): 248-251. DOI:10.7506/spkx1002-6630-201402048.
[25]齐春萌, 杨昕霆, 薛晨玉, 等. 肉制品中鸵鸟源性成分的实时荧光PCR检测[J]. 中国食品学报, 2016, 16(7): 246-251. DOI:10.16429/j.1009-7848.2016.07.033.
[26]许如苏, 周广彪, 段建发, 等. Taq Man-LNA荧光PCR快速检测肉制品中马源性成分的研究[J]. 中国动物检疫, 2015, 32(7): 62-66. DOI:10.3969/j.issn.1005-944X.2015.07.017.
[27]冯震, 杨美成. 生鲜肉中牛源性和羊源性成分定量检测方法的建立[J].
食品安全质量检测学报, 2016, 7(3): 877-886.
[28]汪永信, 安虹, 程坚, 等. 双重实时荧光PCR法检测食品和饲料中的鸡源性成分[J]. 生物技术通报, 2012(1): 134-138.
[29]金萍, 结莉, 陆俊, 等. Taq Man探针荧光聚合酶链式反应实时同步鉴定动物源性食品中猪肉、鸡肉源性成分[J]. 肉类研究, 2016, 30(9): 17-22. DOI:10.15922/j.cnki.rlyj.2016.09.004.endprint
