以藜麦为基质的红茶菌发酵液抗氧化活性研究
2023-02-14肖萍赵可欣蔡倩倩吕晴
肖萍,赵可欣,蔡倩倩,吕晴
(1.天津农学院 食品科学与生物工程学院,天津 300392;2.天津市农副产品深加工技术工程中心,天津 300392;3.黄河三角洲京博化工研究院有限公司,山东 滨州 256500)
红茶菌发酵产品是一种传统的民间发酵饮品,因其含有丰富的营养和生物活性成分,受到国内外学者的广泛关注[1]。红茶是制作红茶菌最常用的基质,在发酵过程中会生成有机酸、酚类物质、维生素、D-葡萄糖二酸-1,4-内酯等多种生物活性成分,因此红茶菌发酵液具有抗氧化、提高免疫力、抗癌防癌、降低血清胆固醇和甘油三酯等多种保健功能[2-3]。为了赋予红茶菌更好的功能特性和特殊风味,近年来将果蔬汁或植物提取物等应用于红茶菌发酵的研究较多[4-6]。Watawana等[7]在红茶菌中添加樱桃花、决明子、紫苑花等10种花草茶,提高了红茶菌发酵液的抗氧化活性和α-淀粉酶及α-葡萄糖苷酶的抑制活性;Vitas等[8]以蓍草的水提取物和亚临界水提取物为发酵基质,可以得到感官风味更好的红茶菌发酵饮品,且其抗氧化活性得到提高。除此之外,通过红茶菌的发酵作用也可以为食品生产中的副产品提供新的利用途径,如豆制品加工过程中的废液——黄浆水,经发酵后总黄酮浓度和抗氧化活性均得到明显提高[9];陈巧红等[10]研究了大豆乳清红茶菌发酵液的抑菌性,发现其对金黄色葡萄球菌抑菌作用最强。
藜麦为苋科藜属一年生双子叶C3植物,起源于南美洲安第斯高原地区,距今已有7 000多年的栽培历史。2013年,联合国粮农组织宣布该年为“国际藜麦年”,并将藜麦视为21世纪应对粮食安全的重要谷物之一[11]。藜麦是全营养完全蛋白碱性食物,其主要的营养成分为蛋白质、碳水化合物、脂类、维生素和矿质元素等。近些年的藜麦产品大多是以藜麦为主要原料来制作的各种功能性食品,其中发酵类产品是较为重要的一部分,如藜麦乳饮料、藜麦酸奶、藜麦酵素、藜麦啤酒、藜麦面包等[12-16]。
目前,藜麦和红茶菌这两种功能性较强的食品已成为研究热点,但是,将两者结合起来,以藜麦为基质的红茶菌发酵产品及其功能特性的研究鲜见。因此,本文将以藜麦为发酵基质制备红茶菌发酵液,选择传统以红茶为基质的红茶菌发酵液为对照,对2种发酵液的营养理化指标和抗氧化活性进行研究分析,以期为藜麦红茶菌发酵食品的开发提供理论支撑。
1 材料与方法
1.1 材料与试剂
白藜麦:金昌西域神话食品有限公司;红茶:福建正山堂茶叶有限公司;白砂糖:广州福正东海食品有限公司;红茶菌菌种:天津农学院食品营养与化学实验室筛选并保存;MRS肉汤、酵母浸出粉胨葡萄糖肉汤培养基(yeast extract peptone and glucose broth medium,YPD):北京索莱宝科技有限公司。
1.2 仪器与设备
SW-CJ-2FD洁净工作台:苏州安泰空气技术有限公司;BXM-30R立式压力蒸汽灭菌器、BSC-250恒温恒湿箱:上海博迅实业有限公司医疗设备厂;STARTER3100实验室pH计:奥豪斯仪器(上海)有限公司;KPBV1358搅拌机:深圳市康佳电器有限公司;LGR20-W高速冷冻离心机:北京京立离心机有限公司。
1.3 试验方法
1.3.1 红茶菌发酵液的制备
以藜麦为基质的红茶菌发酵液(quinoa kombucha fermentation broth,QFB):按照课题组前期优化确定的最佳工艺参数[料液比14:100(g/mL),接种量8%,温度25℃,加糖量6%]发酵红茶菌1 d~5 d后6 480×g离心15 min,上清液即为QFB[17]。
传统红茶菌发酵液(traditional kombucha fermentation broth,TFB):将2g的红茶茶叶用300mL沸水冲泡,过滤后加入30 g白砂糖,充分搅拌至白砂糖完全溶解。冷却后按10%接种量接种红茶菌,于25℃静置培养1 d~5 d后 6 480×g离心15 min,上清液即为TFB。
1.3.2 红茶菌发酵液不同发酵时间营养理化指标的测定
1.3.2.1 pH值的测定
取红茶菌发酵液 10 mL,6 480×g离心 15 min,取上清液利用pH计测定。
1.3.2.2 总酸含量的测定
采用GB 12456—2021《食品安全国家标准食品中总酸的测定》中酸碱滴定法进行测定。
1.3.2.3 红茶菌发酵液中总酚含量的测定
以没食子酸作为总酚含量测定的标准品,采用Folin-Ciocalten法[18]测定发酵液总酚含量。
1.3.2.4 红茶菌发酵液中黄酮含量的测定
以芦丁作为黄酮含量测定的标准品,采用NaNO2-Al(NO3)3-NaOH法[19]测定发酵液黄酮含量。
1.3.2.5 微生物指标的测定
吸取1 mL红茶菌发酵液用9 mL灭菌后的生理盐水梯度稀释后分别涂布于醋酸菌培养基、MRS培养基和YPD培养基上,其中醋酸菌和酵母菌30℃培养24 h,乳酸菌37℃培养48 h,培养后记录菌落数量,连续测定 1 d~5 d。
1.3.3 红茶菌发酵液体外抗氧化活性测定
1.3.3.1 1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-picrylhydrazyl,DPPH)自由基清除率的测定
取1mL红茶菌发酵上清液加入试管中,加入3.9mL 0.1 mmol/LDPPH-乙醇溶液,混匀,避光37℃水浴1h后在517 nm下测定吸光值,以蒸馏水做空白对照。DPPH·清除率计算公式如下。

式中:Ab为空白对照管的吸光值;As为样品测定管的吸光值。
1.3.3.2 超氧阴离子自由基清除率的测定
取pH8.2 0.05 mol/L的三羟甲基氨基甲烷盐酸盐缓冲液3 mL与1 mL红茶菌发酵上清液混合,25℃保温20 min后,加入同样预热的25 mmol/L邻苯三酚0.4 mL,混匀后反应4 min,用0.5 mL浓HCl终止反应,在325 nm处测其吸光值。超氧阴离子自由基清除率计算公式如下。
超氧阴离子自由基清除率/%=(Aj-Ak)/Aj×100
式中:Ak为以蒸馏水代替样品的吸光值;Aj为样品的吸光值。
1.3.3.3 羟基自由基清除率的测定
在具塞试管中加红茶菌发酵上清液1 mL、9 mmol/L FeSO4溶液1mL、9mmol/L水杨酸-乙醇溶液1mL,混匀,再加入8.8 mmol/L H2O2溶液1 mL,37℃反应30 min,510 nm处测其吸光值。羟基自由基清除率计算公式如下。
羟基自由基清除率/%=[A0-(Am-An)]/A0×100
式中:A0为用蒸馏水代替样品时测得的吸光值;Am为用样品测得的吸光值;An为用蒸馏水代替H2O2时测得的吸光值。
1.3.3.4 铁离子还原力的测定
取1mL的红茶菌发酵上清液,加入pH6.6 0.2mol/L的磷酸溶液1 mL和1%K3Fe(CN)6溶液1 mL,混匀后,50℃水浴反应20 min,冷却,加入1 mL 10%三氯乙酸,1 359×g离心10 min,取上层溶液2.5 mL,然后加入2.5 mL蒸馏水和0.1%FeCl30.5 mL,充分混匀,室温静置10 min,在700 nm处测定其吸光值,以蒸馏水取代样品作为空白对照。
1.3.4 红茶菌发酵液对氧化损伤酿酒酵母细胞的保护作用
1.3.4.1 红茶菌发酵液对紫外损伤酿酒酵母细胞的保护作用
将培养至对数期的酵母细胞2 600×g离心15 min后,弃上清液,沉淀中加入5 mL pH7.4 0.1 mol/L的磷酸盐缓冲液中,混匀,制备酵母细胞悬浮液。向Φ90mm的培养皿中加入5mL酵母细胞悬浮液和1mL红茶菌发酵液,30℃避光温浴20min后,置于紫外灯(8W,45cm)下照射150 s,适当稀释后涂布于YPD固体培养基上,30℃静置培养24 h并计算细胞存活率,计算公式如下。
细胞存活率/%=A1/A2×100
式中:A1为紫外照射活菌数或经H2O2处理活菌数;A2为未照射活菌数或未经H2O2处理活菌数。
1.3.4.2 红茶菌发酵液对H2O2损伤酿酒酵母细胞的保护作用
酵母菌悬浮液的制备方法同1.3.4.1,取酵母细胞悬浮液5 mL,加1 mL红茶菌发酵液和终浓度为2.5%的 H2O2溶液2.5 mL,37℃,50 r/min摇床培养1 h,适当稀释后涂布于YPD固体培养基上,30℃静置培养24 h并计算细胞的存活率。
1.4 数据处理
试验数据采用Excel软件处理,结果以平均值±标准差表示。使用SPSS 23.0统计软件包进行ANOVA统计学分析。
2 结果与分析
2.1 不同发酵时间对营养理化指标的影响
2.1.1 不同发酵时间对pH值的影响
不同发酵时间红茶菌发酵液对pH值的影响见图1所示。
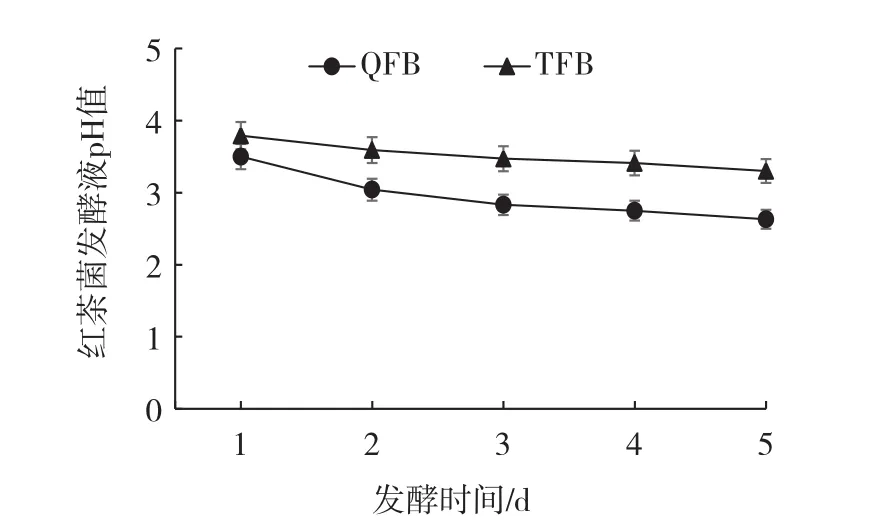
图1 不同发酵时间对发酵液pH值的影响Fig.1 Effect of different fermentation time on pH value
如图1所示,QFB和TFB的pH值随发酵时间的增加,不断下降,培养至第3天后,pH值趋于平稳。红茶菌在发酵过程中分为两个阶段,一个是乙醇发酵阶段,另一个是醋酸发酵阶段,其中醋酸发酵阶段是使发酵液中pH值下降的主要原因。研究证明,红茶菌在发酵过程中产生的CO2溶于水后生成的HCO3-会与有机酸释放的H+反应,即使在醋酸发酵阶段会产生大量的有机酸,pH值仍然保持稳定[20]。
同时,在培养第5天时,QFB和TFB的pH值分别为(2.63±0.08)和(3.30±0.01)。研究表明,以茶叶为发酵原料时,红茶菌发酵液pH值为2.95~3.21[21],Vitas等[8]利用红茶菌发酵蓍草亚临界水提取物时,其pH值更低,为2.39~2.60,说明蓍草亚临界水提取物更适合红茶菌的发酵。本文研究结果与Vitas研究结果相似,说明藜麦中的营养成分更利于微生物生长,发酵效果更好。
2.1.2 不同发酵时间对总酸含量的影响
不同发酵时间红茶菌发酵液对总酸含量的影响见表1所示。

表1 不同发酵时间对总酸含量的影响Table 1 Effect of different fermentation time on total acid content
如表1所示,QFB和TFB的总酸含量随着培养时间的增加都呈现逐渐上升的趋势且QFB的总酸含量高于TFB。在发酵第5天时,总酸含量达到最大,QFB的总酸浓度是TFB的3.04倍。根据显著性差异分析,QFB发酵第2天~第5天时的总酸含量与发酵第1天时的具有显著性差异(p<0.05),发酵第5天时的总酸含量与发酵第2天时的具有显著性差异(p<0.05)。TFB在整个发酵期间总酸含量的变化均无显著性差异(p>0.05)。 QFB和TFB在发酵第1天时的总酸含量无显著性差异(p>0.05),而在发酵第 2、3、4、5 天时的总酸含量均差异显著(p<0.05)。
2.1.3 不同发酵时间对总酚含量的影响
不同发酵时间红茶菌发酵液对总酚含量的影响见表2所示。

表2 不同发酵时间对总酚含量的影响Table2 Effect of different fermentation time on total phenol content
如表2所示,随着发酵时间的增加,QFB和TFB中总酚含量呈现先升高再降低的趋势,在发酵第2天时浓度达到最大值,分别为(0.580±0.009)mg/mL和(0.340±0.009)mg/mL,QFB的总酚含量明显高于 TFB(p<0.05),是TFB的 1.71倍;且 QFB 在发酵期间,1 d~5 d的总酚含量均具有显著性差异(p<0.05)。藜麦本身含有丰富的多酚类物质,通过发酵作用可使结合态多酚转变为游离态的酚类物质,使得发酵液中的总酚含量增加;而随着发酵时间的延长,微生物也会利用部分酚类物质进行生长繁殖[22]。韩林等[23]利用酵母菌发酵藜麦时发现,在发酵前3 d,总酚含量呈线性增加,而发酵3 d后则逐步减少,与本试验研究结果一致。
2.1.4 不同发酵时间对黄酮含量的影响
不同发酵时间红茶菌发酵液对黄酮含量的影响见表3所示。
如表3所示,QFB和TFB中的黄酮含量变化趋势与总酚相似,均是先升高,再降低,在发酵第2天时含量达到最大,分别是(0.240±0.002)mg/mL和(0.120±0.001)mg/mL,QFB是TFB的2.0倍。根据显著性差异分析可知,QFB和TFB在发酵期间,每一天的黄酮含量均具有显著性差异(p<0.05)。

表3 不同发酵时间对黄酮含量的影响Table 3 Effect of different fermentation time on flavone content
2.1.5 不同发酵时间对微生物总数的影响
不同发酵时间红茶菌发酵液对微生物总数的影响见表4~表6所示。

表4 不同发酵时间对乳酸菌菌落数的影响Table 4 Effect of different fermentation time on the number of lactic acid bacteria colonies

表5 不同发酵时间对酵母菌菌落数的影响Table 5 Effect of different fermentation time on the number of yeast colonies
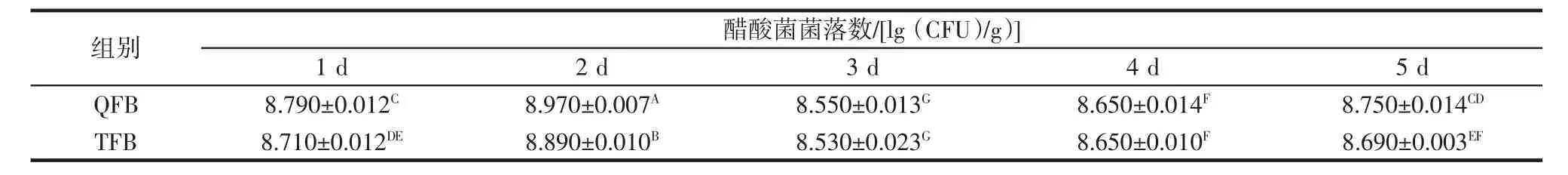
表6 不同发酵时间对醋酸菌菌落数的影响Table 6 Effect of different fermentation time on the number of acetic acid bacteria colonies
如表4~表6所示,红茶菌发酵液在整个培养过程中,醋酸菌数量最多,其次是乳酸菌,最后是酵母菌。培养前期,醋酸菌、酵母菌和乳酸菌的数量均呈上升趋势。发酵第2天时菌落数达到最高,QFB中的醋酸菌、乳酸菌、酵母菌的数量分别为(8.970±0.007)、(8.460±0.009)、(7.460±0.015)lg(CFU)/g;TFB 中的醋酸菌、乳酸菌、酵母菌的数量分别为(8.890±0.010)、(8.110±0.008)、(7.230±0.029)lg(CFU)/g,之后开始下降。发酵第4天时,醋酸菌数量有一个小幅度上升趋势。其原因一方面可能是在取菌液时,破坏了菌膜,导致氧气进入发酵液,造成醋酸菌生长;另一方面可能是酵母菌和乳酸菌的死亡,释放的代谢产物正好是醋酸菌所需要的营养物质。
同时,发现QFB和TFB在相同发酵时间,乳酸菌和酵母菌菌落数均具有显著性差异(p<0.05),QFB和TFB在发酵第1、2、5天的醋酸菌总量具有显著性差异(p<0.05)。本试验研究发现,醋酸菌是红茶菌液中的优势菌群,与廖卢燕等[24]和王春龙[25]所研究的醋酸菌是红茶菌液中的优势菌群结果相吻合。从整体试验来看,以藜麦为基质发酵红茶菌时的菌落总数明显大于以茶叶发酵红茶菌时的菌落总数,表明添加藜麦发酵红茶菌可以提高红茶菌液中的菌落数量,增强红茶菌发酵效果。
2.2 红茶菌发酵液体外抗氧化活性研究
2.2.1 红茶菌发酵液对DPPH·清除能力的影响
不同发酵时间红茶菌发酵液对DPPH·清除能力的影响见表7所示。
如表7所示,随着发酵时间的增加,QFB和TFB对DPPH自由基的清除效果呈现先升高再缓慢降低的趋势,在发酵2 d时达到最大,QFB和TFB清除率分别为(76.520±0.082)%和(53.500±0.160)%,QFB 是 TFB 的1.43倍。根据显著性差异分析,QFB和TFB 1 d~5 d的自由基清除率均与其余4 d的具有显著性差异(p<0.05)。

表7 不同发酵时间对DPPH·清除率的影响Table 7 Effects of different fermentation time on DPPH·scavenging
2.2.2 红茶菌发酵液对·O2-清除能力的影响
不同发酵时间两种红茶菌发酵液对·O2-清除能力的影响见表8所示。

表8 不同发酵时间对·O2-清除率的影响Table 8 Effects of different fermentation time on·O2-scavenging
如表8所示,发酵过程中,2种发酵液清除·O2-的能力均在第2天显著增加,而后随着发酵时间的延长,清除能力呈现降低的趋势;发酵第2天时,TFB的·O2-清除率为(18.310±0.123)%,而 QFB的·O2-清除率达到(33.930±0.284)%,是TFB的1.85倍。根据显著性差异分析,QFB、TFB 1 d~5 d的·O2-清除率均与其余 4 d的具有显著性差异(p<0.05)。
2.2.3 红茶菌发酵液对·OH清除能力的影响
不同发酵时间两种红茶菌发酵液对·OH清除能力的影响见表9所示。

表9 不同发酵时间对·OH清除率的影响Table 9 Effects of different fermentation time on·OH scavenging
从表9可以看出,发酵1 d~5 d,随着培养时间的延长,清除·OH能力先升高后降低,QFB的·OH清除率明显高于TFB,QFB、TFB均在发酵第2天时达到最高值,分别是(52.950±0.221)%、(31.430±0.342)%,QFB是TFB发酵液的1.68倍。根据显著性差异分析,QFB、TFB 1 d~5 d的自由基清除率均与其余4 d的具有显著性差异(p<0.05)。
2.2.4 红茶菌发酵液对铁离子还原力的影响
不同发酵时间两种红茶菌发酵液对铁离子还原力的影响见表10所示。

表10 不同发酵时间对铁离子还原力的影响Table 10 Effect of different fermentation time on iron reduction power
还原力是表示抗氧化物质提供电子能力的重要指标,抗氧化物质通过提供电子可使自由基变成稳定的分子,从而失去活性,许多研究证实抗氧化活性同还原力是密切相关的。从表10发酵过程中的还原力变化可以看出,2种发酵液的还原力均呈先增大后减小的趋势。发酵过程中,QFB的还原力明显大于TFB的还原力,说明QFB的抗氧化活性要强于TFB,均在发酵第2天时达到最大,其还原力OD值分别为0.682±0.002(QFB)和 0.549±0.001(TFB),QFB 对铁离子还原力是TFB的1.24倍。根据显著性差异分析,QFB和TFB在相同发酵时间,对铁离子的还原力均具有显著性差异(p<0.05)。
综上,在发酵前期,酵母菌快速增长,分解原料中的营养物质,产生大量的抗氧化性物质(如小分子的酚类物质和黄酮类物质等),抗氧化性随之增强,随着酵母菌生长进入稳定期和衰亡期及在发酵过程中氧气的进入,抗氧化物质被分解或发生其他化学反应,进而抗氧化性随之下降[4,26]。丁艳如等[27]研究表明传统的红茶菌发酵液清除DPPH·能力可达90%以上,经10d发酵,·O2-的清除率高达100%,对·OH的清除率保持在20%左右;以咖啡液为发酵基质时,红茶菌对于·O2-的清除率在12%左右[28];当以蛇果为发酵基质进行红茶菌发酵14d,其对 DPPH·清除率为(18.03±0.36)%[29]。可见,红茶菌发酵基质不同时,对于不同的自由基的清除能力不同。
2.3 红茶菌发酵液对紫外损伤酿酒酵母细胞的保护作用
不同发酵时间两种红茶菌发酵液对紫外损伤酿酒酵母细胞保护作用的影响见表11所示。

表11 发酵液对紫外损伤酿酒酵母细胞的保护作用Table 11 Protective effect of fermentation broth on UV-damaged S.cerevisiae
紫外线辐射产生的活性氧自由基会引发细胞损伤和凋亡[30-31],抗氧化剂具有清除自由基的作用,可有效减缓紫外辐射对细胞造成的损伤。通过建立酿酒酵母损伤模型评价红茶菌发酵的抗氧化活性,对于开发更有营养价值的红茶菌饮品具有一定的参考价值。如表11所示,添加不同发酵时间的发酵液,随着发酵时间的增加,酿酒酵母细胞的存活率呈现先升高再降低的趋势,当添加第2天的发酵液时酿酒酵母细胞存活率达到最大值,分别为(24.92±0.73)%(QFB)、(20.79±1.22)%(TFB),且添加QFB的存活率大于TFB酿酒酵母细胞的存活率,是TFB的1.23倍,之后逐渐降低。根据显著性差异分析,添加发酵1 d-5 d的QFB与不添加发酵液的空白组之间的酿酒酵母存活率差异显著(p<0.05);添加第2天和第3天的TFB与空白组之间差异显著(p<0.05),添加其他发酵时间的红茶菌发酵液与空白组之间无显著性差异(p>0.05);添加整个发酵期间的QFB对酿酒酵母细胞存活率的影响均无显著性差异(p>0.05)。
2.4 红茶菌发酵液对H2O2损伤酿酒酵母细胞的保护作用
不同发酵时间两种红茶菌发酵液对H2O2损伤酿酒酵母细胞保护作用的影响见表12所示。

表12 发酵液对H2O2损伤酿酒酵母细胞的保护作用Table 12 Protective effect of fermentation broth on H2O2-damaged S.cerevisiae
H2O2在诱导细胞建立氧化应激损伤模型等方面应用非常广泛,是一种常用的细胞氧化应激诱导剂。H2O2能在细胞内产生对机体造成伤害的羟自由基,而抗氧化剂可降低H2O2对细胞的损伤。由表12可知,与空白组比较,添加不同发酵时间的QFB和TFB对酿酒酵母细胞氧化损伤具有保护作用,可明显提高酿酒酵母存活率(p<0.05)。当添加发酵第2天的QFB和TFB酿酒酵母存活率最高,分别为(19.400±0.600)%和(15.460±0.861)%,QFB 酿酒酵母细胞存活率高于TFB,是其存活率的1.42倍,二者之间存在显著差异性(p<0.05)。
3 结论
本研究以红茶菌为菌种、以藜麦为基质进行发酵,与以传统红茶菌发酵液相比,其营养和抗氧化活性均呈显著升高。当发酵第2天时TFB和QFB中的微生物总数总酸、总酚和黄酮含量均达到最高值,QFB发酵液中总酚和黄酮含量分别是TFB中总酚和黄酮含量的1.71倍和2.0倍,且在整个发酵周期内,TFB中的总酚和黄酮含量均显著高于TFB(p<0.05)。在此基础上,采用体外抗氧化试验和建立酿酒酵母细胞损伤模型评价红茶菌发酵的抗氧化活性,发现与TFB比较,发酵1d~5 d的QFB体外抗氧化活性均得到了明显的提高,二者具有显著性差异(p<0.05);同时,当添加发酵2 d的QFB时对H2O2诱导酵母细胞形成的氧化应激损伤具有保护作用,细胞存活率显著高于添加2 d的TFB。由此可知,QFB具有更强的抗氧化活性,总酚和黄酮含量的增加是其抗氧化活性提高的重要因素。
