ICOS与4-1BB共刺激域增强CAR-T细胞在肺癌中的抗肿瘤活性①
2023-01-19张志东魏海龙林振海陈吉柏儋州市人民医院胸心肿瘤外科儋州571700
张志东 魏海龙 林振海 陈吉柏 彭 文(儋州市人民医院胸心肿瘤外科,儋州 571700)
肺癌是全球癌症相关死亡的主要原因,其中非小细胞肺癌(non-small cell lung cancer,NSCLC)约占所有病例的80%[1-3]。过去十年中,驱动癌基因靶向疗法的普及彻底改变了晚期NSCLC的治疗模式,而近年免疫疗法在NSCLC治疗中取得了惊人疗效,使其备受关注[4-7]。多项具有里程碑意义的临床试验表明,抗PD-1/PD-L1疗法可显著延长患者总生存期,但总体而言,仅有约30%的NSCLC患者受益于单一抗PD-1/PD-L1疗法[8-10]。因此,为使更多人群受益,需进一步开发新的免疫疗法。
过继性嵌合抗原受体T细胞免疫疗法在治疗血液系统恶性肿瘤方面已显示出惊人疗效,但多种技术和生物学障碍限制了CAR修饰的T细胞治疗实体瘤[11]。CAR通常包含3个模块:细胞外抗原识别结构域、跨膜结构域和传递激活信号的细胞内信号域。其中一代CAR的胞内信号域通常仅由T细胞受体CD3ζ链组成,二代CAR往往额外包含来自CD28、4-1BB、OX40、CD27或ICOS共刺激蛋白的信号域。目前,含CD28或4-1BB共刺激结构域的CAR使用最为广泛[12]。是否存在新的共刺激蛋白组合可克服CAR-T细胞在实体瘤中的障碍,是研究人员关心的问题。
研究表明,ICOS共刺激信号可增强T细胞效应功能和体内持久性[13]。间皮素MSLN作为为数不多的CAR-T细胞针对实体瘤的靶标,在包括肺癌在内的多种实体瘤中高表达,因此被选为本研究靶标[14]。本研究拟将ICOS共刺激信号域整合至传统二代CAR,探究新型CAR-T细胞是否可对肺癌治疗产生积极响应,为优化CAR-T细胞在实体瘤中的抗肿瘤活性以实现肺癌患者治疗提供新的策略。
1 材料与方法
1.1 材料 人肺癌细胞A549购自中科院上海细胞库;过表达MSLN的A549细胞系(M-A549)为本实验先前保存,采用含有10%FBS的DMEM培养基于37℃、5%CO2培养;4~6周龄雌性NSG小鼠由海南医学院动物实验中心提供;Ficoll试剂购自北京索莱宝生物科技有限公司;CD3/CD28激活磁珠购自美国Invitrogen公司;polybrene购自美国Sigma公司;Anti-CD69-PE、Anti-CD8-PE、Anti-IFN-γ-BV421、Anti-PD-1-APC抗体购自美国Biolegend公司;苏木精-伊红试剂购自生工生物工程(上海)有限公司。
1.2 方法
1.2.1 慢病毒感染外周血单核细胞3例健康志愿者外周血取自儋州市人民医院血液科,所有志愿者知情同意。按照制造商说明,采用Ficoll试剂从外周血中分离PBMC,并与CD3/CD28激活磁珠1∶1混合,48 h后按MOI=10加入慢病毒,同时加入6 µg/ml polybrene,30℃、1 200 g离心60 min,培养24 h后更换正常培养基。本研究所用慢病毒由上海汉恒生物科技有限公司提供(图1A)。
1.2.2 流式细胞术检测MSLN-ICOSBBz CAR-T阳性率和CD69、IFN-γ及PD-1表达 病毒感染T细胞72 h后,取3×105个T细胞,PBS清洗3次,流式细胞仪检测MSLN-ICOSBBz CAR-T或MSLN-BBz CAR-T阳性率,以未感染的T细胞为对照。共孵育实验:将1×104个M-A549细胞与2×104个效应细胞共孵育,24 h后收集上清,离心获得效应细胞,PBS清洗3次,加入5 µl Anti-CD69-PE抗体4℃避光孵育30 min,PBS清洗3次,流式细胞仪检测CD69表达。肿瘤浸润T细胞:取30 mg肿瘤组织,机械解离后采用1 mg/ml胶原酶Ⅰ37℃消化1 h,70µm滤膜过滤,加入Anti-CD8-PE和Anti-PD-1-APC抗体4℃避光孵育30 min,加入固定破膜试剂及Anti-IFN-γ-BV421 4℃避光孵育30 min,perm/wash buffer清洗3遍,流式细胞仪检测。
1.2.3 CELigence实时细胞分析系统检测靶细胞毒性 肿瘤细胞以1×104个/孔的密度接种,按效靶比1∶1加入效应细胞,记录阻抗信号50 h,间隔5 min。
1.2.4 活体成像检测小鼠肿瘤大小 动物实验经儋州市人民医院伦理委员会审核批准。将5×106个M-A549细胞皮下注射于NSG小鼠左侧腋下,10 d后将15只小鼠随机分为3组:PBS组、MSLN-ICOSBBz CAR-T组和MSLN-BBz CAR-T组,静脉注射1×107个T细胞,回输T细胞后第21天采用Xenogen IVIS成像系统采集荧光图像,解剖小鼠肿瘤,称重。
1.2.5 HE染色 将新鲜的肿瘤组织固定于4%多聚甲醛,48 h后梯度乙醇脱水,石蜡包埋,切片(5 µm),脱蜡水合,根据制造商说明进行HE染色,树胶封片,显微镜下观察。
1.3 统计学分析 采用SPSS19.0软件进行统计学处理,计量数据采用±s表示,组间样本比较采用t检验,P<0.05为差异有统计学意义。
2 结果
2.1 MSLN-ICOSBBz CAR-T获得 以4-1BB为共刺激分子的二代CAR-T细胞(MSLN-BBz CAR-T)为基础,加入ICOS共刺激域构建三代CAR-T细胞MSLNICOSBBz CAR-T,流式细胞术结果表明,MSLN-BBz CAR-T和MSLN-ICOSBBz CAR-T均构建成功,阳性率约为40%(图1B、C)。
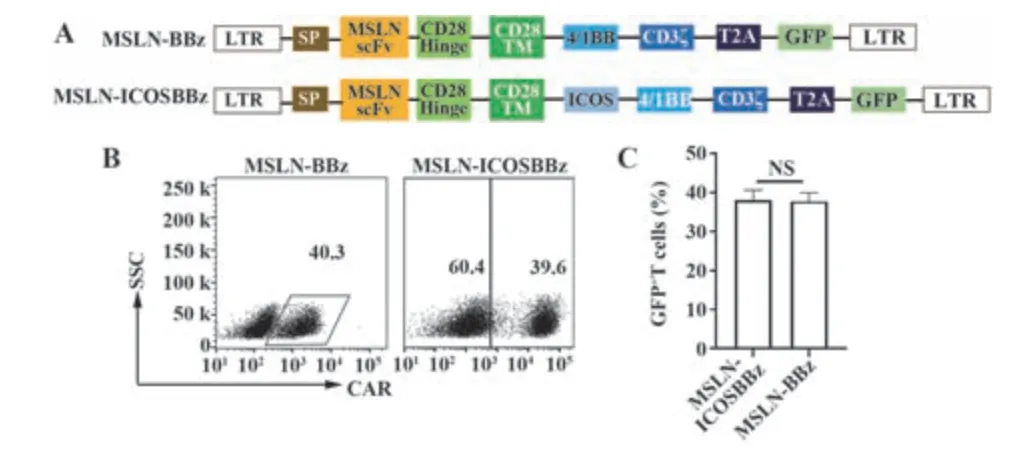
图1 MSLN-ICOSBBz CAR-T结构Fig.1 Construction of MSLN-ICOSBBz CAR-T
2.2 MSLN-ICOSBBz CAR-T较MSLN-BBz CAR-T体外激活能力更强 效应细胞与靶细胞共孵育后,流式细胞术结果显示,MSLN-ICOSBBz CAR-T表面CD69表达较MSLN-BBz CAR-T更高,表明其激活更充分(P<0.001,图2)。

图2 MSLN-ICOSBBz CAR-T体外激活Fig.2 Activation of MSLN-ICOSBBz CAR-T in vitro
2.3 MSLN-ICOSBBz CAR-T较MSLN-BBz CAR-T体外靶细胞裂解能力更强 效靶细胞共孵育后,T细胞增殖结果显示,MSLN-ICOSBBz CAR-T共孵育组的T细胞较MSLN-BBz CAR-T共孵育组靶细胞裂解明显增加,而正常T细胞组靶细胞裂解较少(P<0.001,图3)。
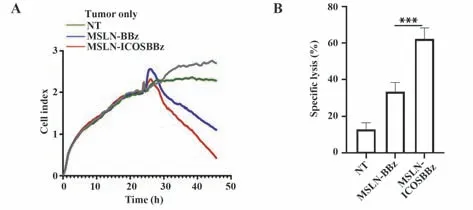
图3 MSLN-ICOSBBz CAR-T体外靶细胞毒性Fig.3 Cytotoxicity of MSLN-ICOSBBz CAR-T in vitro
2.4 MSLN-ICOSBBz CAR-T较MSLN-BBz CAR-T体内抑瘤能力更强 活体成像结果显示,MSLNICOSBBz CAR-T和MSLN-BBz CAR-T均能抑制小鼠体内肺癌细胞生长,而MSLN-ICOSBBz CAR-T较MSLN-BBz CAR-T肿瘤抑制能力更强(图4A)。瘤重比较结果也显示,MSLN-ICOSBBz CAR-T治疗组较MSLN-BBz CAR-T治疗组肿瘤质量更小(P<0.01,图4B)。
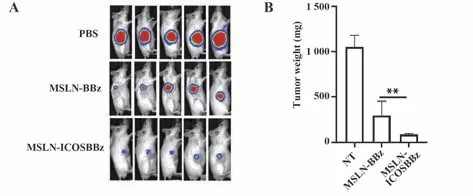
图4 体内MSLN-ICOSBBz CAR-T抑瘤能力Fig.4 Tumor inhibition ability of MSLN-ICOSBBz CAR-T in vivo
2.5 肿瘤浸润的MSLN-ICOSBBz CAR-T较MSLNBBz CAR-T拥有更显著的抗肿瘤表型 回输MSLNICOSBBz CAR-T的小鼠肿瘤组织中T细胞得到了更强的抗肿瘤表型,肿瘤浸润T细胞流式检测结果显示,MSLN-ICOSBBz CAR-T较MSLN-BBz CAR-T IFN-γ表达水平更高(P<0.000 1,图5A),同时免疫检查点PD-1表达更低(P<0.001,图5B),抗肿瘤活性更强。
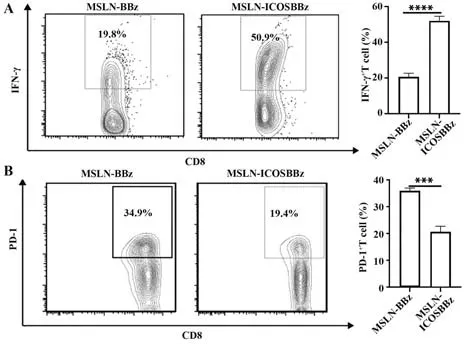
图5 肿瘤浸润性T细胞抗肿瘤表型Fig.5 Anti-tumor phenotype of tumor infiltrating T cells
2.6 MSLN-ICOSBBz CAR-T与MSLN-BBz CAR-T未对小鼠产生明显器官毒性 主要器官HE结果显示,MSLN-ICOSBBz CAR-T与MSLN-BBz CAR-T均未对组织造成明显损伤,表明其在体内未产生严重毒性(图6)。
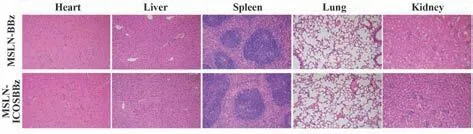
图6 主要器官HE染色结果Fig.6 HE staining results of main organs
3 讨论
尽管CAR-T细胞疗法在血液系统肿瘤中取得了巨大成功,但其在实体瘤中疗效有限[15]。本研究探讨了通过优化共刺激域增强CAR-T细胞对肺癌治疗的有效性。
研究表明,ICOS共刺激信号可增强效应T细胞介导的抗肿瘤活性[16]。本研究发现,与二代CAR-T细胞相比,通过整合ICOS CAR介导的信号增加了MSLN-ICOSBBz CAR-T的激活状态。此外,当效应细胞与靶细胞共孵育时,MSLN-ICOSBBz CAR-T靶细胞裂解能力显著高于MSLN-BBz CAR-T。内源性4-1BB信号可影响记忆CD8+T细胞数量和持久性,4-1BB刺激可将T细胞从无能和疲惫状态中解救出来,且有助于T细胞长期存活[17-18]。此外,也有研究报道,ICOS可诱导Th细胞分化,刺激T细胞产生更多的效应细胞因子,从而强化机体抗肿瘤免疫功能[19]。本研究表明,三代CAR中,通过结合4-1BB和ICOS信号域可进一步提高4-1BB CAR激活信号,增强CAR-T细胞肿瘤细胞清除能力。同时体内研究表明,肿瘤浸润的MSLN-ICOSBBz CAR-T PD-1表达更低,表明ICOS也可减轻CAR-T细胞抑制状态。
BOLE-RICHARD等[20]发现,CD28置于细胞膜远端,而CD3ζ移动至膜近端位置的结构是无功能的。因此多数三代CAR将CD28放置于细胞膜近端[21]。ICOS和CD28均为CD28家族成员,具有独特且重叠的功能,可协同调节T细胞分化。研究表明,ICOS能够比CD28更有效地激活PI3K信号传导,从而导致Akt信号传导增加[22]。因此本研究将ICOS放置于膜近端,与4-1BB联合显示出协同增强的抗肿瘤效应,支持了优化CAR T细胞共刺激的重要性。
尽管本研究构建的MSLN-ICOSBBz CAR-T已展现出良好的肺癌细胞清除功能,但仍存在不足。本研究参考文献[20]选择了将ICOS置于近膜部位,但ICOS在CAR中的其他定位需在后续研究中验证。此外,本研究通过主要脏器HE染色初步评估了MSLN-ICOSBBz CAR-T的体内安全性,但更充分的毒理研究需在后续研究中进行。
总之,本研究证明:选择ICOS协同4-1BB共刺激结构域可显著提高CAR-T细胞对肺癌的抗肿瘤功能,可指导功能增强型和持久性增强型的下一代细胞疗法设计,同时为MSLN-ICOSBBz CAR-T对肺癌治疗的进一步探索提供了依据。