梅毒螺旋体Tp0971经MAPKs、NF-κB和组蛋白乙酰化途径诱导巨噬细胞分泌IL-8及GM-CSF
2023-01-19周艳飞刘佳强肖鹏程张跃军
周艳飞 刘佳强 彭 俊 肖鹏程 张跃军
(中南大学湘雅医学院附属株洲医院检验医学中心,株洲 412007)
梅毒是由苍白密螺旋体(Treponema pallidum,Tp)感染引起的一种性传播疾病。Tp感染生殖系统黏膜后可经血液和淋巴系统扩散至全身,导致多器官慢性损伤[1]。Tp感染早期,机体主要以单核-巨噬细胞、树突状细胞为主的固有免疫应答发挥作用[2]。Tp缺乏明显的毒力因子编码基因,如革兰氏阴性菌常见的内毒素、Ⅲ型分泌系统、热休克蛋白(heat shock protein,HSP)等细胞毒力因子。课题组前期研究表明,外膜蛋白是Tp重要的毒力因子,是Tp感染后免疫病理损伤的重要物质[3-4]。Tp0971是课题组前期证实的一种具有促炎活性的膜蛋白,体外研究表明,Tp0971经TLR2识 别后可 激 活MAPKs和NF-κB诱 导巨噬 细胞分 泌TNF-α和IL-1β[5]。但Tp0971是否有其他促炎机制尚不明确。近年研究发现,细胞内表观遗传学机制在炎症反应过程中发挥重要作用,其中乙酰化修饰是最常见的表观遗传学机制,组蛋白乙酰化后可引起染色体结构松弛,从而有利于各种转录因子和协同转录因子与DNA结合而诱导基因表达。研究发现,组蛋白乙酰化广泛参与调控细胞因子和某些趋化因子表达,且课题组前期研究表明,Tp0971可激活NF-κB[6-7],但在Tp外膜蛋白诱导的细胞因子分泌过程中是否也具有类似作用尚不明确。因此本研究旨在研究膜蛋白Tp0971对诱导巨噬细胞分泌IL-8及GM-CSF的影响,并探讨组蛋白乙酰化机制的作用。
1 材料与方法
1.1 材料Tp0971为课题组前期表达纯化并进行去内毒素处理[7];MAPK抑制剂SP-600125、U0126和SB-203580购 自 德 国Calbiochem;IL-8和GM-CSF ELISA试剂盒购自深圳欣博盛生物科技有限公司;TrichostatinA(TSA)购自英国Biomol;HDAC1(H-51)和HDAC2(H-54)多克隆抗体购自Santa Cruz;抗乙酰化H3和H4购自美国Life;组蛋白活性试剂盒购自Abnova;TRIzol试剂购自Invitrogen;cDNA试剂盒购自Bio-Rad;SensiFAST SYBR No-Rox Mix试剂盒购自Bioline;HDAC Fluorometric Assay Kit购自Abnova;DNA提取试剂盒购自Qiagen公司;其他试剂购自Sigma-Adrich或上海生物工程有限公司,均为分析纯。
1.2 方法
1.2.1 细胞培养与Tp0971处理 人单核细胞系THP-1采用含10%胎牛血清及抗生素的RPMI1640培养基接种至6孔板培养,生长至70%密度时,参考文献[5]加入PMA(160 nmol/L)孵育48 h诱导其分化为巨噬细胞。根据不同实验目的加入不同浓度Tp0971刺激后用于后续实验。
1.2.2 ELISA检 测IL-8和GM-CSF分 泌Tp0971刺激结束后取培养上清,采用双抗体夹心ELISA测定上清IL-8和GM-CSF浓度,按照试剂盒说明操作。所有样品设3个复孔,所用IL-8和GM-CSF试剂盒检测下限分别为7 pg/ml和4 pg/ml。
1.2.3 qRT-PCR检测GM-CSF mRNA表达 预冷PBS漂洗细胞后,加入1 ml TRIzol试剂提取细胞总RNA,逆转录为cDNA,采用SensiFAST SYBR No-Rox Mix试剂盒进行qPCR反应。正向引物:5'-GGCGTCTCCTGAACCTGAGT-3';反 向 引 物:5'-GGGGAT‐GACAAGCAGAAAGT-3',内参β‐actin正向引物:5'-GACAGGATGCAGAAGGA-3';反向引物:5'-TGATC‐CACATCTGCTGGAA-3',2−ΔΔCt计算相对表达[8]。
1.2.4 Western blot检测蛋白表达Tp0971孵育结束后,无菌PBS洗涤2次,加入100 µl RIPA裂解液并用细胞刮将其转移至离心管,快速漩涡振荡30 s,冰上静置30 min,加入等体积上样缓冲液煮沸5 min,取20 µl蛋白用于SDS-PAGE,转至硝酸纤维素膜,5%BSA室温封闭2 h,加入相应蛋白抗体4℃孵育过夜,PBST缓冲液洗涤后孵育二抗,化学发光、显影。
1.2.5 组蛋白分离与检测 处理结束的巨噬细胞用预冷PBS漂洗2次(含100 mmol/L NaF、2 mmol/L Na3VO4和15 mmol/L Na4P2O7),加入800µl裂解缓冲液[含10 mmol/L HEPES(pH=7.9)、1.5 mmol/L MgCl2、10 mmol/L KCl、1.5 mmol/L PMSF和0.5 mmol/L DTT]后将其刮入EP管,加入0.2 mol/L H2SO4,冰上静置60 min。离心取上清,加入终浓度为20%的三氯乙酸4℃孵育45 min,离心取沉淀,1 ml丙酮洗涤2次,采用含100 mmol/L NaF、2 mmol/L Na3VO4以 及15 mmol/L Na4P2O7的PBS重悬,用于Western blot分析。
1.2.6 组蛋白活性分析 采用HDAC Fluorometric Assay Kit测定组蛋白去乙酰化酶活性。试剂盒分别提供了荧光团或显色团标记的底物,经样本内HDAC酶去乙酰化后被激活,随后与赖氨酸显色剂作用产生荧光,荧光酶标仪测定其强度。按试剂盒说明操作,结果以相对光单位(relative light unit,RLU)表示。
1.2.7 染色质共沉淀分析 细胞处理结束后弃培养基,1%甲醛固定1 min,预冷PBS(含0.125 mol/L甘氨酸)漂洗2次。加入RIPA缓冲液裂解细胞[含10 mmol/L Tris(pH=7.5)、150 mmol/L NaCl、1%Non‐idet P-40、1%脱氧胆酸、0.1%SDS、1 mmol/L EDTA和1%Aprotinin]超声处理,离心取上清,加入蛋白A/G琼脂糖珠孵育60 min获取免疫复合物,RIPA缓冲液和高盐缓冲液[2 mol/L NaCl、10 mmol/L Tris(pH=7.5)、1%Nonidet P-40、0.5%脱氧胆酸、1 mmol/L EDTA]洗涤,加入洗脱缓冲液37℃、1 200 r/min振荡洗涤15 min,RNA酶37℃孵育30 min,依次用蛋白酶K于37℃和65℃消化6 h,提取DNA,采用PCR扩增IL-8启动子DNA。正向引物:5'-AAGAAAACTTTCGTCATACTCCG-3';反向引物:5'-TGGCTTTTTATATCATCACCCTAC-3'。PCR反应 条件:95℃预变性15 min,35个循环:94℃20 s,60℃20 s,72℃20 s,72℃延伸7 min。产物经琼脂糖凝胶电泳后拍照、显影。
1.3 统计学分析 采用Graphpad 8.0软件处理数据。组间比较采用方差分析后行Tukey's Post Hoc检验。P<0.05为差异有统计学意义。
2 结果
2.1 Tp0971诱导巨噬细胞分泌GM-CSF THP-1细胞经PMA诱导48 h分化为巨噬细胞(约5×105个),加入Tp0971刺激,ELISA结果显示,10µg/ml Tp0971处理巨噬细胞24 h后可诱导巨噬细胞大量分泌GM-CSF,且GM-CSF分泌呈一定时间依赖性(图1A),10 µg/ml Tp0971处理6 h即可诱导其分泌,并持续至24 h(图1B)。qPCR结果也显示,0.1~10 µg/ml Tp0971也能上调其mRNA表达(图1C)。

图1 Tp0971以剂量和时间依赖方式诱导巨噬细胞表达和分泌GM-CSFFig.1 Tp0971 induced a time-and dose-dependent GMCSF expression and transcription in macrophages
2.2 Tp0971经ERK1/2和p38诱导巨噬细胞分泌IL-8和GM-CSF为研究MAPKs是否参与IL-8和GM-CSF分泌,巨噬细胞先与20µmol/L MAPKs抑制剂预处理30 min,随后用Tp0971孵育24 h,结果显示,ERK1/2抑制剂U0126和p38抑制剂SB-203580均能显著抑制IL-8和GM-CSF分泌,而SP-600125对两者分泌无明显影响(图2)。
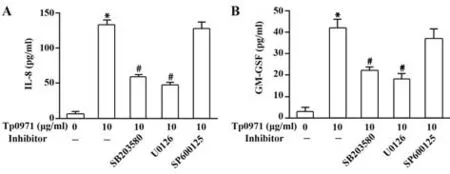
图2 ERK和p38抑制剂抑制Tp0971诱导的巨噬细胞分泌IL-8和GM-CSFFig.2 ERK and p38 inhibitors decrease Tp0971-induced macrophages secretion of IL-8 and GM-CSF
2.3 NF-κB参与Tp0971诱导巨噬细胞分泌IL-8和GM-CSF而IL-8和GM-CSF基因启动子上游存在NF-κB结合位点,为证实NF-κB与IL-8和GM-CSF分泌的关系,采用20 µmol/L NF-κB抑制剂IKKNBD预处理巨噬细胞30 min,结果显示,抑制NF-κB后IL-8和GM-CSF分泌水平显著降低(图3)。
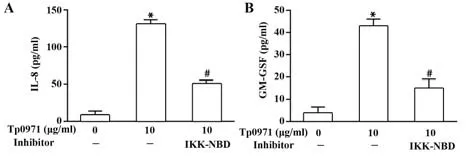
图3 NF-κB抑制剂抑制Tp0971诱导的巨噬细胞IL-8和GM-CSF分泌Fig.3 NF-κB inhibitor decrease Tp0971-induced macro⁃phages secretion of IL-8 and GM-CSF
2.4 Tp0971诱导H3和H4组蛋白乙酰化Western blot结果显示,Tp0971处理巨噬细胞2 h可显著上调乙酰化H3和H4表达(图4A)。采用染色质共沉淀检测H3和H4与IL-8启动子的结合情况,结果显示,Tp0971可显著促进乙酰化H3和H4结合至IL-8启动子(图4B)。采用组蛋白去乙酰化酶抑制剂TSA预处理细胞后,ELISA结果显示,IL-8分泌显著增加(图4C)。
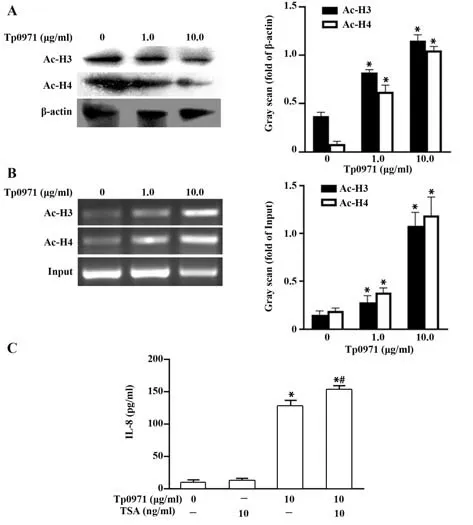
图4 Tp0971增强乙酰化H3和H4表达并结合至IL-8启动子区诱导其表达Fig.4 Tp0971 enhances histone H3 and H4 acetylation at IL-8 promoter to induce its expression
2.5 Tp0971抑制组蛋白去乙酰化酶表达与活性Western blot结果显示,Tp0971处 理后,HDAC1和HDAC2表达明显降低(图5A)。酶学实验也证实Tp0971可明显降低细胞核内HDAC酶活性(图5B)。
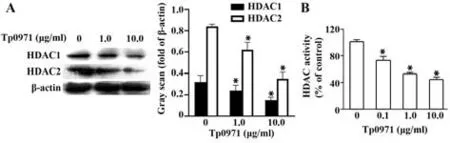
图5 Tp0971下调HDAC1和HDAC2表达及HDAC酶活性Fig.5 Tp0971 reduces HDAC1 and HDAC2 expressions and HDAC activity
3 讨论
Tp感染后的炎症反应是导致组织损伤的重要因素[2]。本研究对Tp诱导的巨噬细胞分泌IL-8和GM-CSF的机制进行了探讨,结果表明Tp诱导的细胞因子分泌依赖于丝裂原活化蛋白激酶p38和ERK1/2激活,可能是巨噬细胞活化的重要机制,在早期固有免疫应答中起重要作用。但本研究也证实JNK可能并不参与IL-8和GM-CSF释放,可能与病原体及细胞不同有关。如KRÜLL等[9]最近报道了肺炎衣原体诱导的巨噬细胞分泌GM-CSF是通过激活ERK1/2和p38介导的,与JNK激酶无关。此外,大环内酯类抗生素诱导人巨噬细胞分泌IL-8和GM-CSF也不依赖于JNK激活[10]。表明Tp诱导的IL-8转录调控可能是不同MAPK通路间复杂的调控网络所致。
NF-κB是参与病原微生物感染后免疫应答的重要核转录因子。Tp0971可激活NF-κB,本研究证实采用NF-κB抑制剂处理后,IL-8和GM-CSF分泌显著减少,表明两者分泌受NF-κB调控。最近研究表明,炎症基因转录在一定程度上受核小体DNA局部解旋程度调控,而核小体DNA受组蛋白修饰(如乙酰化)调控[11]。多数物种组蛋白H3和H4乙酰化水平提高会导致DNA结构更加松散,允许转录因子和RNA聚合酶Ⅱ进入[12]。越来越多的证据表明,IL-8表达受核心组蛋白乙酰化修饰调控[13]。但对这些机制在细菌感染中的作用知之甚少。SCHMECK等[14]首次证明感染单核细胞增生性李斯特菌后,人内皮细胞IL-8启动子区组蛋白发生改变。本研究也证实Tp0971在巨噬细胞的IL-8启动子处诱导了H3和组蛋白H4乙酰化。同时证明Tp0971处理可募集H3和H4结合至IL-8启动子,从而促进巨噬细胞活化。
组蛋白低乙酰化和去乙酰化分别导致DNA缠绕收紧和基因转录降低。组蛋白去乙酰化酶(HDAC)可抑制组蛋白H3或H4乙酰化,而组蛋白H3或H4对IL-8的转录非常重要[15]。HDAC抑制剂TSA也证实IL-8分泌依赖于乙酰化。TSA通过阻止组蛋白去乙酰化明显增加Tp0971诱导的细胞IL-8产生。本研究还发现Tp0971可降低巨噬细胞HDAC1和HDAC2整体表达和活性,表明Tp0971通过影响巨噬细胞组蛋白去乙酰化和乙酰化平衡促进细胞因子分泌。
总之,本研究证实Tp0971是Tp重要的毒力因子。Tp0971与巨噬细胞相互作用可激活p38和ERK激酶及NF-κB通路,导致HDAC表达和活性降低,巨噬细胞核组蛋白乙酰化及去乙酰化平衡改变,最终促发炎症反应。