外泌体通过NF-κB信号通路调节骨关节炎的炎症反应①
2023-01-19吴文哲付长秀黄李晨露郑永钦贺军栋昆明理工大学医学院昆明650000
吴文哲 付长秀 黄李晨露 郑永钦 贺军栋(昆明理工大学医学院,昆明 650000)
骨关节炎(osteoarthritis,OA)是一种慢性退行性关节疾病,其特征是关节软骨逐渐破坏,进而产生继发性滑膜炎症,软骨下骨破坏[1-2]。OA的病理靶点是关节软骨,因此,研究关节软骨对其治疗具有重要意义。
正常关节软骨主要由Ⅱ型胶原蛋白α1(CoL2A1)和蛋白聚糖(Aggrecan)组成,OA的主要特征是软骨细胞产生的软骨降解酶-基质金属蛋白酶(matrix metalloproteinase,MMP)上调,如MMP-1、MMP-3、MMP-13和ADAMTS金属蛋白酶等,它们可降解CoL2A1、Aggrecan[3]。其关键诱导因子IL-1和TNF-α可刺激软骨降解酶合成,IL-6可使炎症反应加重[4-5]。OA中活性氧和活性氮的增加也会通过DNA损伤诱导软骨细胞过早衰老。一氧化氮(NO)通过多种机制促进软骨降解,如抑制软骨基质大分子(如胶原蛋白和蛋白聚糖)合成、增加其他氧化剂(如H2O2)、增强MMP的产生及包括PGE2在内的炎症细胞因子,并诱导细胞凋亡[6-7]。正常情况下,NF-κB二聚体与IκB蛋白的相互作用存在于细胞质,细胞受到刺激后,IκB被IκB激酶(IKKs)磷酸化并被蛋白酶体降解,因此NF-κB二聚体转运至细胞核,与NF-κB反应元件结合,激活数百种免疫调节蛋白、促炎细胞因子、趋化因子、黏附分子和生长因子表达[8-9]。NF-κB的激活包括经典途径和非经典途径,经典途径涉及由p65、c-Rel和p50亚基组成的NF-κB二聚体及IKK复合物(IKKα/β/γ)通路,该通路具有快速、可逆特点;而非典型通路主要通过IKKα激活p52和RelB,非经典途径NF-κB激活速度慢,且持续时间更长。NF-κB由促炎信号或参与发育的因子激活,基因敲除研究发现,典型的p65/p50复合物对胚胎发育和免疫系统功能至关重要,p65蛋白磷酸化后从细胞质转移到细胞核,说明NF-κB信号通路被激活[10]。
外泌体是多囊体与质膜融合时,通过胞吐作用释放到细胞外环境的一种囊泡。外泌体可促进细胞增殖、抑制细胞凋亡、调节免疫反应、抑制纤维化、促进血管生成等[11]。近期研究显示,间充质外泌体可通过调节生长因子及相关基因表达促进胶原蛋白表达及软骨细胞的增殖、分化。尽管已经有很多关于干细胞外泌体的研究,但外泌体在OA中的作用机制尚不明确。本研究分离脐带间充质干细胞外泌体,通过与软骨细胞共培养,研究外泌体是否通过NF-κB信号通路对骨关节炎软骨细胞发挥免疫调节作用。
1 材料与方法
1.1 材料 脐带来源于云南省第一人民医院妇产科2019年7月至2020年12月收治的剖宫产患者,试验经云南省第一人民医伦理委员会批准,患者或法定代表人签署知情同意书;原代大鼠软骨细胞购于上海通派细胞库;外泌体提取试剂盒购于SBI公司;CCK-8试剂盒、超敏ECL化学发光试剂A、B液购于MCE公司;Annexin V-FITC/PI凋亡检测试剂盒、LPS、大鼠TNF-α、IL-6、PEG2 ELISA检测试剂盒购于索莱宝公司;大鼠NO ELISA检测试剂盒、TSG101一抗、CD63购于Abcam公司;总RNA提取试剂盒、逆转录试剂盒购于天根公司;兔二抗、兔荧光二抗、Aggrecan-1一抗、CoL2A一抗、p65一抗、p-p65一抗、CD9一抗购于CST公司;PKH26红色荧光染料试剂盒购于Sigma公司;GAPDH购于Elabscience公司;鼠二抗MMP-13购于Proteintech公司;SYBR®Premix Ex TaqTMⅡ购于TaKaRa公司。
1.2 方法
1.2.1 细胞的提取、培养与鉴定 脐带间充质干细胞提取:将脐带剔除血管,生理盐水清洗,剪成0.5~1 cm2的组织块铺于T72瓶中,加入含10%胎牛血清、1%链霉素-青霉素、89%DMEM的完全培养基中。每隔3 d观察细胞爬出情况。
脐带间充质干细胞分化诱导鉴定:通过干细胞成骨诱导分化完全培养基、干细胞成脂诱导分化完全培养基AB液、干细胞成软骨诱导分化完全培养基诱导干细胞成骨细胞、成脂细胞、成软骨细胞分化,分别用茜素红、油红O、阿利新蓝染色,显微镜下观察。
脐带间充质干细胞流式细胞术鉴定:当干细胞融合度达到85%左右时,胰酶消化,1 000 r/min离心10 min,PBS清洗2遍,重悬,2 000 r/min离心6 min,将细胞以至少1×105个/管转移至流式管,加入1 µl抗体,4℃避光孵育30 min后上机检测。
大鼠软骨细胞培养:大鼠软骨细胞采用含10%胎牛血清、1%链霉素-青霉素、89%DMEM的完全培养基培养。
1.2.2 外泌体的提取与鉴定 脐带间充质干细胞密度为80%左右时,收取上清,3 000 g离心15 min以去除死细胞及细胞碎片,吸取上清于新离心管中,通过外泌体提取试剂盒提取外泌体,每5 ml培养上清加入1 ml exoQuick-TC Exosome沉淀液,翻转混合均匀,4℃过夜后,3 000 g、4℃离心10 min,离心管底部可见乳白色外泌体沉淀,弃上清,用30~1 00µl的buffer B重悬外泌体。透射电镜观察外泌体形态,纳米流式仪进行外泌体NTA粒径分析,BCA比色法对蛋白进行定量,取10 µg蛋白煮沸变性后进行SDS-PAGE凝胶电泳,转至PVDF膜,5%奶粉封闭非特异性蛋白,加入目的一抗4℃孵育过夜后,加入对应二抗室温孵育1 h。使用ECL化学发光显影试剂盒进行发光成像。
1.2.3 软骨细胞损伤模型的建立 以LPS构建大鼠软骨细胞关节炎模型,软骨细胞长至80%密度时铺于96孔板,每孔约4 000个细胞、100 µl细胞悬液,24 h后以含0、20、40、80 ng/ml LPS的完全培养基处理软骨细胞24 h,CCK-8检测软骨细胞活力,酶标仪测定450 nm波长处的吸光度值,发现当LPS浓度为40 ng/ml时,细胞增殖最慢。因此选取40 ng/ml LPS构建细胞模型。
实验分为软骨细胞组(Control组)、软骨细胞+40 ng/ml LPS组(LPS组)、软骨细胞+40 ng/ml LPS+10µg/ml外泌体组(LPS+Exo组)。LPS组处理方法:加入LPS处理24 h后更换完全培养基培养48 h;LPS+Exo组 处 理 方 法:LPS处 理24 h后 更 换 含 有10µg/ml外泌体的完全培养基培养48 h。倒置显微镜下观察三组形态变化。
1.2.4 激光共聚焦显微镜实验 为确定外泌体是否进入细胞发挥作用,取5µl外泌体与500µl稀释液C混匀,同时取2µl PKH26荧光染液与500µl稀释液C混匀,混匀两管液体,室温孵育5 min,加1 ml胎牛血清终止反应,室温孵育1 min后,3 000 g离心10 min,弃上清,以5 ml完全培养基重悬沉淀,重复离心2次后(除去未结合的染料),5 ml完全培养基重悬,取1 ml加入LPS处理的OA细胞,2 h后加入DAPI,激光共聚焦显微镜下采用油镜观察外泌体是否被细胞摄取。
1.2.5 细胞凋亡水平检测Annexin V-FITC/PI凋亡检测试剂盒检测各组细胞凋亡水平。细胞长至80%以上后,胰酶消化,收集约1×107个细胞,PBS洗涤,1×Binding buffer悬浮细胞,300 g离心10 min,弃上清;1×Binding buffer再次悬浮细胞,使细胞密度达到1×106个/ml;每管加入100 µl细胞悬液,进行FITC、PI染色后,1 h内用流式细胞仪检测,比较三组细胞凋亡程度。
1.2.6 炎症相关因子表达检测 收集各组细胞上清液,按照TNF-α、IL-6、PEG2、NO检测试剂盒说明书操作,检测吸光度值。根据标准曲线换算为TNF-α、IL-6、PEG2、NO 4种炎症因子表达水平。
1.2.7 实时荧光定量PCR使用RNA提取试剂盒提取收集三组细胞总RNA,逆转录试剂盒逆转录合成cDNA,采用SYBR®Premix Ex TaqTMⅡ试剂进行实时荧光定量PCR,反应程序:95℃5 s;60℃30 s。共40个循环。采用2−ΔΔCt法计算MMP-13、CoL2A1、GAPDH mRNA表达。引物设计见表1。
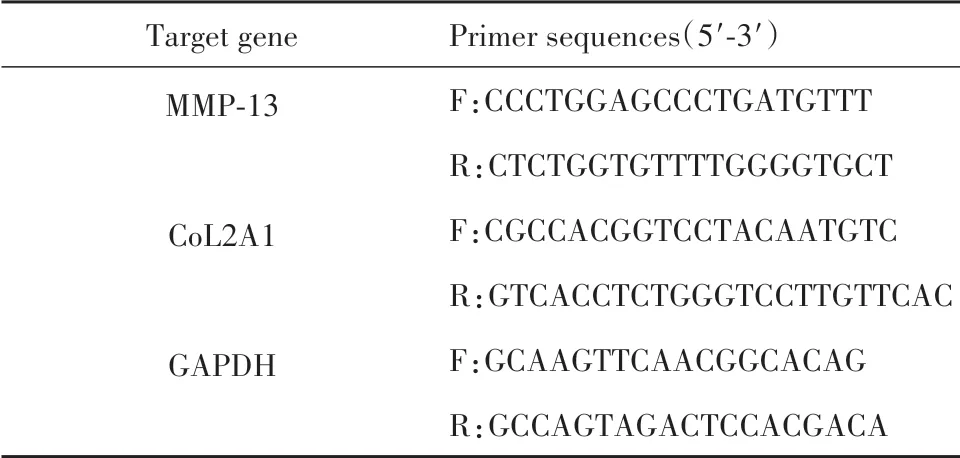
表1 基因引物序列Tab.1 Gene primer sequences
1.2.8 Western blot收集三组细胞,以含1%蛋白酶抑制剂的RIPA裂解液裂解细胞,离心获得含有蛋白的上清,BCA比色法对蛋白进行定量,取10µg蛋白煮沸变性后,行SDS-PAGE凝胶电泳,转至PVDF膜,5%奶粉封闭非特异性蛋白,加入目的一抗4℃孵育过夜后,TBST洗涤3次,每次5 min,加入对应二抗室温孵育1 h,使用ECL化学发光显影试剂盒进行发光成像。
1.2.9 细胞免疫荧光 在共聚焦小室中培养三组细胞,预冷PBS洗涤,取1 ml 4%的多聚甲醛固定细胞30 min,预冷PBS洗涤后,采用Triton-100室温通透30 min,预冷PBS洗涤,然后以2%的BSA于37℃封闭1 h,预冷PBS洗涤。加入p65一抗(1∶400)4℃过夜,预冷PBS洗涤,加入荧光兔二抗(1∶500)室温孵育1 h,PBS洗涤后加入DAPI,1 min后于共聚焦显微镜下观察蛋白入核情况。
1.3 统计学分析 本实验均重复3次,实验结果表示为±s,两组间数据比较采用独立样本t检验。使用Image、SPSS和GraphPad Prism 8.0软件进行图像分析、数据采集,作图分析组间差异性,P<0.05为差异具有统计学意义。
2 结果
2.1 脐带间充质干细胞的提取与鉴定 倒置显微镜下观察到原代细胞以梭形、纺锤形为主,周围有多角形、圆形等,P3代为长梭形,且细胞形态稳定(图1A)。成脂、成骨、成软骨诱导3周左右,油红O染色显示大量脂滴沉淀;经茜素红染色后,出现大量钙沉积;阿利新蓝染色后,软骨组织中有内酸性黏多糖出现(图1B)。流式细胞术检测CD90、CD73和CD105抗体的阳性表达率分别为99.86%、99.61%和99.71%,HLA-DR、CD45、CD34抗体的阳性表达率分别为0.31%、0.32%、0.34%(图1C),与脐带间充质干细胞标志物表达一致。以上结果表明成功分离提取出脐带间充质干细胞。
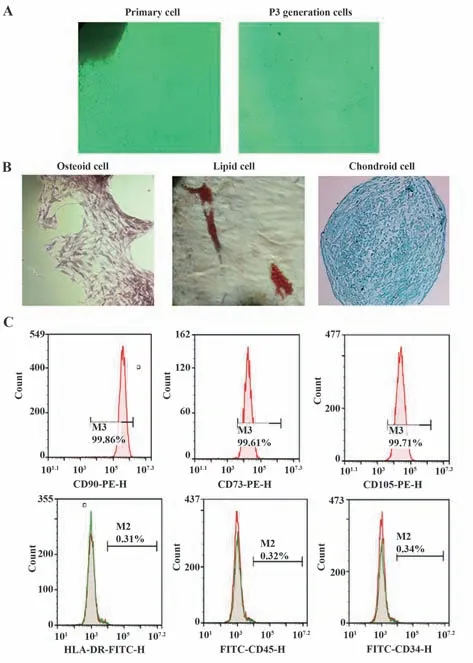
图1 脐带间充质干细胞的培养与鉴定Fig.1 Culture and identification of umbilical cord mesen⁃chymal stem cells
2.2 外泌体的提取与鉴定 透射电镜下观察提取物外泌体呈周围凸起中心凹陷的杯托状(图2A),直径30~200 nm,与外泌体粒径一致(图2B),含有CD9、TSG101、CD63三种标志蛋白(图2C)。以上结果表明提取物为脐带间充质干细胞外泌体,外泌体蛋白含量为1.7~2.0 mg/ml。
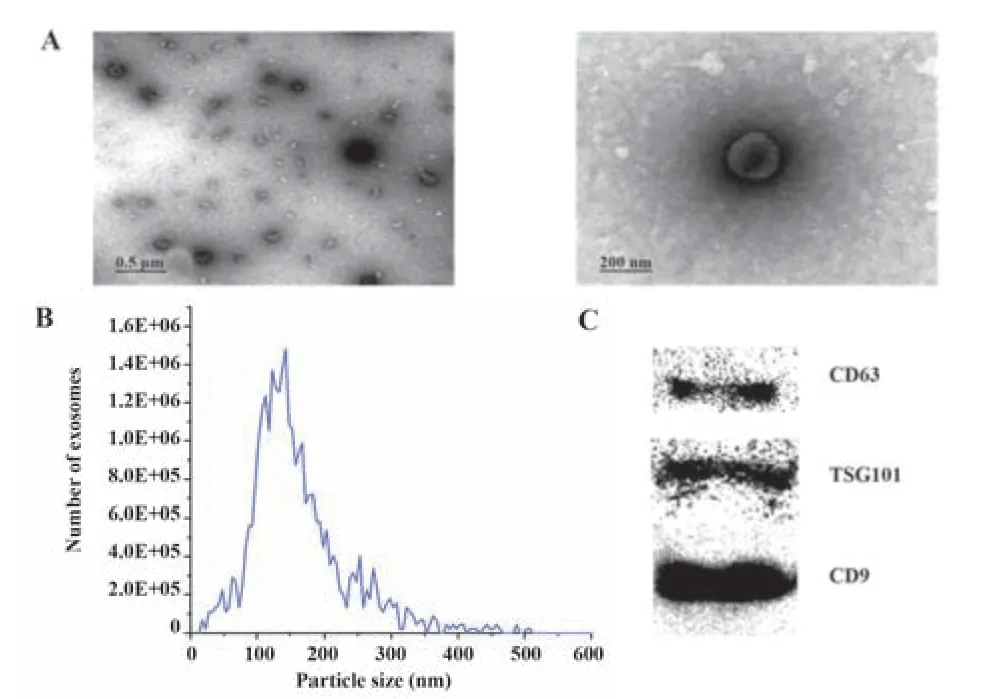
图2 脐带间充质干细胞外泌体的提取与鉴定Fig.2 Extraction and identification of umbilical cord mes⁃enchymal stem cells exosomes
2.3 OA模型建立,外泌体被OA细胞内化 如图3所示,与Control组相比,LPS组加入40 ng/ml LPS处理24 h后,部分细胞发生凋亡,活细胞数量减少,细胞形态变圆,细胞核变大;LPS+Exo组加入外泌体处理后细胞数增加,细胞形态向正常细胞转变。外泌体与OA软骨细胞共培养后,共聚焦显微镜下观察到外泌体已经被细胞内化,外泌体富集在胞核附近。
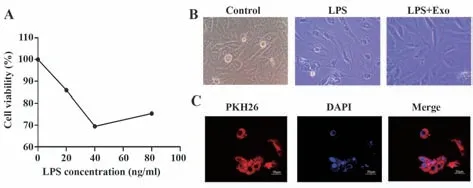
图3 OA模型建立、外泌体与细胞共培养Fig.3 Model establishment of OA and co-culture of exosomes and cells
2.4 外泌体对OA软骨细胞凋亡水平的影响 与Control组相比,LPS组细胞凋亡率显著提高(P<0.001);与LPS组相比,LPS+Exo组软骨细胞凋亡率显著降低(P<0.001,表2、图4)。
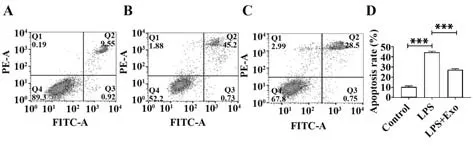
图4 流式细胞术检测软骨细胞凋亡Fig.4 Flow cytometry to detect chondrocyte apoptosis
表2 各组细胞凋亡率(±s,%)Tab.2 Apoptosis rate of each group(±s,%)

表2 各组细胞凋亡率(±s,%)Tab.2 Apoptosis rate of each group(±s,%)
Note:Compared with control group,1)P<0.001;compared with LPS group,2)P<0.001.
Groups Control LPS LPS+Exo Apoptosis rate 10.99±0.89 45.68±0.341)29.97±1.012)
2.5 外泌体对OA细胞中相关炎症因子表达的影响ELISA检测结果显示,与Control组相比,LPS组细胞中IL-6、TNF-α、NO表达量均显著升高(P<0.001或P<0.01);与LPS组相比,LPS+Exo组细胞中IL-6、TNF-α、NO表达量显著降低(P<0.001或P<0.05);各组细胞中PEG2表达量变化差异无统计学意义(P>0.05,表3、图5)。
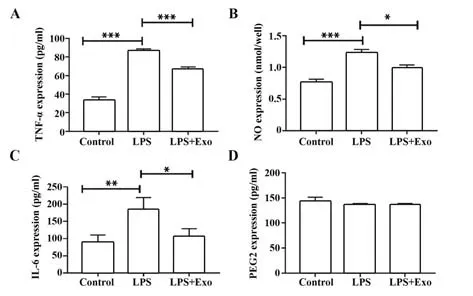
图5 外泌体和骨关节炎细胞共培养后相关炎症因子表达Fig.5 Expressions of related inflammatory factors after co-culture of exosomes and OA cells
表3 各组细胞相关炎症因子的表达(±s)Tab.3 Expressions of cell-related inflammatory factors in each group(±s)
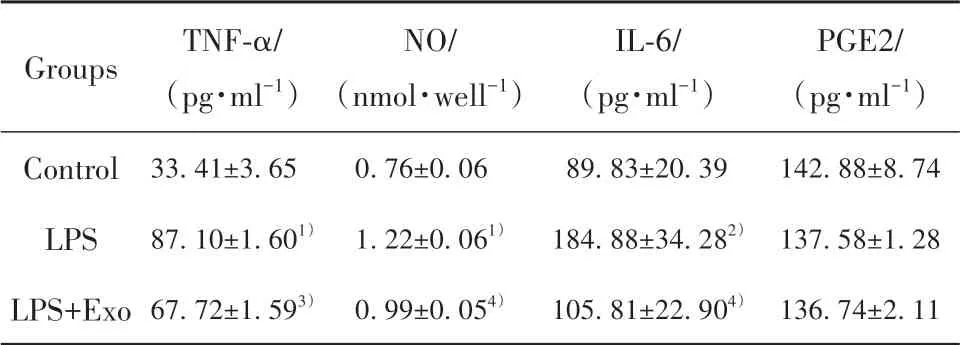
表3 各组细胞相关炎症因子的表达(±s)Tab.3 Expressions of cell-related inflammatory factors in each group(±s)
Note:Compared with control group,1)P<0.001,2)P<0.01;compared with LPS group,3)P<0.001,4)P<0.05.
Groups Control LPS LPS+Exo TNF-α/(pg·ml−1)33.41±3.65 87.10±1.601)67.72±1.593)NO/(nmol·well−1)0.76±0.06 1.22±0.061)0.99±0.054)IL-6/(pg·ml−1)89.83±20.39 184.88±34.282)105.81±22.904)PGE2/(pg·ml−1)142.88±8.74 137.58±1.28 136.74±2.11
2.6 外泌体对OA软骨细胞软骨相关基因表达的影响qRT-PCR结果显示,与Control组相比,LPS组细胞CoL2A表达量显著降低(P<0.01),MMP-13表达量显著升高(P<0.01);与LPS组相比,LPS+Exo组细胞中CoL2A表达量显著升高(P<0.01),MMP-13表达量差异无统计学意义,但仍可见MMP-13表达有下降趋势(P>0.05,表4、图6A、B)。Western blot检测结果显示,与LPS组相比,LPS+Exo组关节炎细胞中CoL2A、AGC-1蛋白表达量显著升高,MMP-13蛋白表达量显著降低(图6C~F)。

图6 外泌体和骨关节炎细胞共培养后软骨生成及降解基因的表达量Fig.6 Expressions of chondrogenic and degradable genes after co-culture of exosomes and OA cells
表4 各组细胞软骨生成及降解基因表达量(±s)Tab.4 Expressions of chondrogenesis and degradation genes in each group(±s)
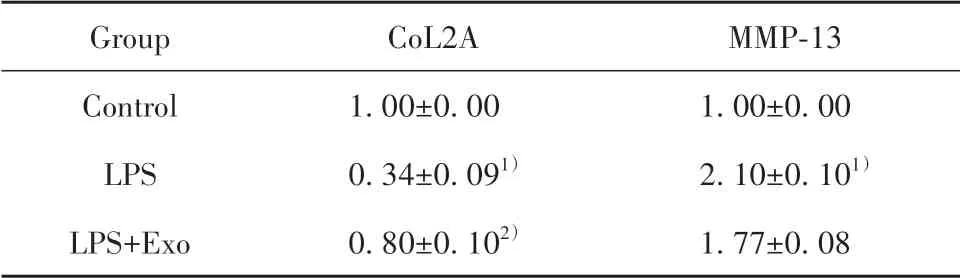
表4 各组细胞软骨生成及降解基因表达量(±s)Tab.4 Expressions of chondrogenesis and degradation genes in each group(±s)
Note:Compared with control group,1)P<0.01;compared with LPS group,2)P<0.01.
Group Control LPS LPS+Exo CoL2A 1.00±0.00 0.34±0.091)0.80±0.102)MMP-13 1.00±0.00 2.10±0.101)1.77±0.08
2.7 外泌体对NF-κB信号通路的影响 免疫荧光显示LPS+Exo组细胞核中p65表达明显低于LPS组(图7A~C);Western blot结果显示,与Control组相比,LPS组中p-p65蛋白表达量显著升高(P<0.001),p65蛋白表达量显著降低(P<0.001);与LPS组相比,LPS+Exo组中p-p65蛋白表达量显著降低(P<0.01),p65蛋白表达量显著升高(P<0.01,表5、图7D~F)。

图7 NF-κB信号通路中p65蛋白的定位与表达水平Fig.7 Localization and expression level of p65 protein in NF-κB signaling pathway
表5 各组细胞p-p65、p65蛋白表达量(±s)Tab.5 Expressions of p-p65 and p65 protein in cells of each group(±s)

表5 各组细胞p-p65、p65蛋白表达量(±s)Tab.5 Expressions of p-p65 and p65 protein in cells of each group(±s)
Note:Compared with control group,1)P<0.001;compared with LPS group,2)P<0.01.
Groups Control LPS LPS+Exo p-p65 0.75±0.06 1.69±0.061)1.46±0.032)p65 2.03±0.03 1.56±0.051)1.85±0.062)
3 讨论
脐带间充质干细胞来源外泌体可缓解多种疾病,如移植物抗宿主病、心肌缺血-再灌注损伤和急性肾损伤等。外泌体在体外可促进多种细胞增殖,并抑制其凋亡,在体内可促进血管生成,抑制多种器官的纤维化进展,且具有一定的免疫调节作用,有研究发现外泌体可缓解葡聚糖硫酸钠诱导的小鼠结肠炎模型[12]。本研究首先成功提取脐带间充质干细胞,发现其高表达CD73、CD90、CD105,低表达CD45、CD34、HLR-DR,并成功将其诱导为骨样细胞、脂肪样细胞和软骨样细胞,以上结果均符合国际细胞疗法学会制定标准;将成功提取外的泌体进行电镜观察、NTA粒径分析、外泌体表达标志物鉴定;本研究发现外泌体通过进入骨关节炎软骨细胞,富集在细胞核附近,对细胞的形态和数量发挥调控作用。
外泌体可通过调节生长因子及相关基因表达促进胶原蛋白生成,促进软骨细胞增殖及分化[13];此外,在OA模型小鼠中,滑膜衍生的外泌体可上调软骨生成基因CoL2A1和聚集蛋白聚糖,下调MMP-13和Runx2(相关转录因子2)[14]。本研究以LPS处理正常软骨细胞后,软骨细胞凋亡率提高,IL-6、TNF-α、NO表达量增加,且软骨生成基因MMP-13表达增加,降解基因CoL2A表达量降低,而将外泌体加入OA细胞模型时,以上结果发生了一定程度的逆转,炎症因子及氧化应激因子表达被显著抑制,MMP-13蛋白表达降低,CoL2A、AGC-1蛋白表达量升高,且促进软骨细胞增殖,这些结果表明外泌体对OA软骨细胞具有正向调控作用。有研究表明骨髓间充质细胞来源的外泌体可能通过抑制PEG2表达抑制巨噬细胞活化,诱导巨噬细胞向抗炎表型分化,从而减少滑膜的炎症激活,减轻OA鼠骨关节炎症[15],但本研究中PEG2的表达在三组实验中无明显差异,可能由于本实验使用的诱导剂(LPS)与文献中使用的诱导剂(IL-1β)不同,也可能是由于外泌体来源不同,导致PEG2表达不同。
NF-κB是一种可诱导的转录调节因子,在免疫反应、炎症反应、细胞分化及正常和恶性细胞存活中发挥核心作用,NF-κB反式激活域包括RelA(P65)、RelB和c-Rel,p65蛋白磷酸化后从细胞质转移到细胞核说明NF-κB信号通路被激活[10,16-17]。NF-κB信号通路参与许多生物学过程,且在多种疾病中失调。丁酸钠可通过GPR43/β-阻滞素-2/NF-κB信号通路减少炎症反应,从而显著减轻LPS诱导的肝损伤[18]。本研究发现LPS处理正常软骨细胞后,p65蛋白由细胞质转运至细胞核,且p-p65蛋白表达升高,p65蛋白表达降低,提示NF-κB信号通路被激活;加入外泌体后,p65蛋白磷酸化水平受到抑制,并抑制p65蛋白从细胞质向细胞核转运,提示外泌体可能通过降低NF-κB信号通路的活化水平调控OA细胞。
总之,本研究发现脐带间充质干细胞外泌体可调节骨关节炎细胞免疫反应,并可抑制NF-κB信号通路激活,为缓解OA提供了新思路。但本文只研究了NF-κB通路,对其他通路的研究尚未开展。后期课题组将根据现有的实验结果进行深入研究。