hsa_circ_0044235对类风湿关节炎滑膜成纤维细胞增殖和迁移的影响及机制
2023-01-19田晓静薛宏峰姚雨叶南京中医药大学附属常州市中医医院检验科常州213003
田晓静 薛宏峰 蒋 辉 姚雨叶(南京中医药大学附属常州市中医医院检验科,常州 213003)
类风湿关节炎(rheumatoid arthritis,RA)是一种慢性自身免疫性疾病,其病理特征主要为炎症反应、滑膜增生和关节软骨损伤等,严重影响患者身心健康[1]。滑膜成纤维细胞主要位于滑膜组织,不仅可分泌大量炎症细胞因子参与滑膜炎症反应,还具有肿瘤细胞样特点,其增殖和迁移能力明显强于正常人滑膜细胞,是RA治疗的主要靶细胞[2-3]。因此,抑制或减弱滑膜成纤维细胞增殖能力对RA治疗具有重要意义。环状RNA(circRNA)是一类呈闭合环状的非编码RNA,结构稳定,具有高度保守性,参与细胞增殖、凋亡和迁移等生命活动调控,在人类多种疾病发生发展中起重要作用[4-5]。有报道称,hsa_circ_0044235在RA患者外周血中表达降低,外周血hsa_circ_0044235水平可能是诊断RA的生物标志物[6]。但hsa_circ_0044235对RA滑膜成纤维细胞增殖和迁移等恶性表型的影响及分子机制尚未阐明。
多数circRNA含有与微小RNA(miRNA)互补的核苷酸序列,可作为竞争性内源性RNA与miRNA靶向结合调控miRNA靶基因表达,进而发挥生物学功能[7]。Circular RNA Interactome生物在线软件预测显示,hsa_circ_0044235可靶向结合miR-338-5p。研究显示,上调miR-338-5p表达可靶向抑制活化T细胞核因子5(NFAT5)表达促进RA滑膜成纤维细胞增殖、迁移和侵袭,miR-338-5p是RA治疗的潜在分子靶点[8]。本研究以滑膜成纤维细胞MH7A为研究对象,采用脂多糖(lipopolysaccharide,LPS)诱导MH7A细胞建立滑膜成纤维细胞损伤模型,观察hsa_circ_0044235对LPS诱导的MH7A细胞增殖和迁移的影响及其能否靶向调控miR-338-5p发挥作用,以期为RA治疗提供新的分子靶点。
1 材料与方法
1.1 材料 滑膜成纤维细胞系MH7A(上海通派生物科技有限公司);DMEM培养基、细胞周期检测试剂盒、二喹啉甲酸(BCA)蛋白检测试剂盒(北京索莱宝公司);胎牛血清(FBS,浙江天杭生物科技公司);LipofectamineTM2000试剂盒和Trizol试剂(美国Invit‐rogen公司);PCR引物、hsa_circ_0044235过表达载体(pcDNA-hsa_circ_0044235)、空载体(pcDNA)、miR-338-5p模拟物(mimics)、模拟对照序列(miRNC,上海生工生物工程有限公司);逆转录试剂盒和PCR试剂盒(大连宝生物工程公司);上皮型钙黏蛋白(E-cadherin)、神经型钙黏蛋白(N-cadherin)和GAPDH多克隆抗体(美国Santa Cruz公司);双荧光素酶活性检测试剂盒(美国Promega公司)。
1.2 方法
1.2.1 细胞培养、转染与分组 复苏MH7A细胞,采用含10%FBS的DMEM培养基(常规培养基)培养,将对数生长期MH7A细胞以5.0×105个/孔接种于6孔板,LipofectamineTM2000脂质体法分别转染pcDNA、pcDNA-hsa_circ_0044235、共 转 染pcDNAhsa_circ_0044235与miR-NC、pcDNA-hsa_circ_004-4235与miR-338-5p mimics,转染6 h后更换培养基再培养24 h,0.25%胰蛋白酶消化,收集细胞备用。未转染的MH7A细胞分为对照组(Con组)和LPS组,Con组细胞采用常规培养基培养,LPS组细胞采用含1.0 mg/L LPS的培养基培养[9]。转染pcDNA、pcDNA-hsa_circ_0044235、共转染pcDNA-hsa_circ_0044235与miR-NC、pcDNA-hsa_circ_0044235与miR-338-5p mimics的MH7A细胞均采用含1.0 mg/L LPS的培养基培养,记为LPS+pcDNA组、LPS+pcDNAhsa_circ_0044235组、LPS+pcDNA-hsa_circ_0044235+miR-NC组、LPS+pcDNA-hsa_circ_0044235+miR-338-5p组。
1.2.2 RT-qPCR检测hsa_circ_0044235和miR-338-5p表达 将未转染、转染后的MH7A细胞均以5.0×104个/孔接种于24孔板,按1.2.1进行分组处理,培养24 h后收集细胞。Trizol试剂提取各组细胞总RNA,逆转录为cDNA,行PCR扩增。扩增条件:95℃5 min,95℃10 s,58℃30 s,72℃30 s,共35个循环。hsa_circ_0044235正向引物:5'-GCGATAG‐GCTAGGCGTAGAG-3',反向引物:5'-CGACTACTACGACATACAGGCGG-3';GAPDH正向引物:5'-TGACTTCAACAGCGACACCCA-3',反向引物:5'-CACCCTGTTGCTGTAGCCAAA-3';miR-338-5p正 向 引物:5'-GAGCTCCGAGCAATTCTCCTGTGTC-3',反向引物:5'-CTCGAGTACAGCATCCCTCCCAAC-3';U6正向引物:5'-CTCGCTTCGGCAGCACA-3',反向引物:5'-AACGCTTCACGAATTTGCGT-3'。2−ΔΔCt计 算相对表达。
1.2.3 克隆形成实验 将未转染、转染后的MH7A细胞均以5.0×103个/孔接种于6孔板,按1.2.1分组处理,2 d/次换液,培养14 d后弃培养基,4%多聚甲醛固定30 min,0.1%结晶紫染色15 min,显微镜观察,统计超过50个细胞的克隆数。
1.2.4 流式细胞术检测细胞周期 将未转染、转染后的MH7A细胞均以5.0×104个/孔接种于24孔板,按1.2.1进行处理,培养24 h后,0.25%胰蛋白酶消化,收集细胞,PBS清洗2次。加1 ml 70%乙醇混悬细胞,4℃固定12 h,1 000 r/min离心5 min,弃上清,加1 ml PBS重悬细胞,1 000 r/min离心5 min,弃上清,加0.5 µl PI 37℃孵育30 min,流式细胞仪检测。
1.2.5 划痕实验检测细胞迁移 将未转染、转染后的MH7A细胞均以5.0×103个/孔接种于6孔板,细胞贴壁后,采用200µl移液器枪头在培养板底部沿中轴划两条平行线,PBS清洗,除去划痕间细胞,测量划痕间距,记为d0h。按1.2.1分组处理,培养24 h后再次测量细胞间距,记为d24h,计算划痕愈合率。划痕愈合率(%)=(d0h−d24h)/d0h×100%。
1.2.6 Western blot检 测E-cadherin和N-cadherin蛋白表达 将未转染、转染后的MH7A细胞均以5.0×104个/孔接种于24孔板,按1.2.1处理,培养24 h后收集细胞,RIPA试剂提取各组细胞总蛋白,BCA法进行蛋白定量,行10%SDS-PAGE电泳,转至PVDF膜,5%脱脂奶粉封闭1 h,分别置于E-cadherin(1∶500)、N-cadherin(1∶500)和GAPDH(1∶1 000)一抗孵育液中4℃孵育过夜,置于山羊抗兔二抗(1∶1 000)孵育液37℃孵育1 h,显影液避光显影,凝胶成像系统曝光拍照,Image J软件分析蛋白条带灰度值。
1.2.7 双荧光素酶报告基因实验 根据Circular RNA Interactome生物在线软件预测显示的miR-338-5p与hsa_circ_0044235结合 位点 进行PCR扩增,插入pmirGLO质粒,构建hsa_circ_0044235野生型荧光素报告载体(WT-hsa_circ_0044235),同时采用基因突变技术将结合位点突变后插入pmirGLO质粒,构建hsa_circ_0044235野生型荧光素报告载体(MUT-hsa_circ_0044235),该过程由上海生工生物工程有限公司完成。将对数生长期MH7A细胞以5.0×105个/孔接种于6孔板,LipofectamineTM2000脂质体法分别共转染WT-hsa_circ_0044235与miR-NC或miR-338-5p mimics、MUT-hsa_circ_0044235与miR-NC或miR-338-5p mimics,转染6 h后更换培养基再培养24 h,收集细胞并裂解,离心(3 500 r/min、5 min),取上清,参照双荧光素酶活性检测试剂盒说明书检测荧光素酶活性。
1.3 统计学分析 采用SPSS22.0软件进行统计学分析。计量资料以±s表示。两组间比较采用独立样本t检验,多组间比较采用单因素方差分析,进一步两两比较采用SNK-q检验。P<0.05表示差异有统计学意义。
2 结果
2.1 MH7A细 胞hsa_circ_0044235和miR-338-5p表达 与Con组比较,LPS组MH7A细胞hsa_circ_0044235表达降低(P<0.05),而miR-338-5p表达升高(P<0.05)。与LPS+pcDNA组比较,LPS+pcDNAhsa_circ_0044235组MH7A细 胞hsa_circ_0044235表达升高(P<0.05),而miR-338-5p表达降低(P<0.05)。LPS组 和LPS+pcDNA组MH7A细 胞hsa_circ_0044235和miR-338-5p表达差异无统计学意义(P>0.05,表1)。
表1 MH7A细胞hsa_circ_0044235和miR-338-5p表达(±s,n=3)Tab.1 Expressions of hsa_circ_0044235 and miR-338-5p in MH7A cells(±s,n=3)
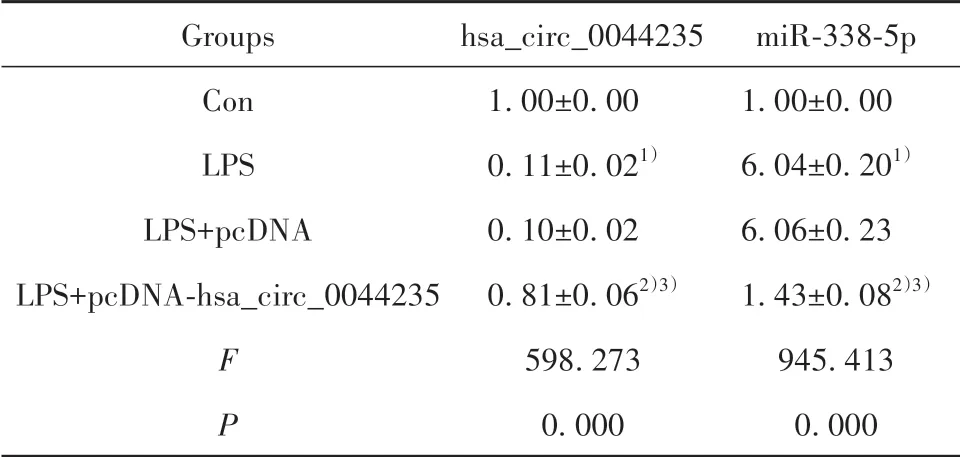
表1 MH7A细胞hsa_circ_0044235和miR-338-5p表达(±s,n=3)Tab.1 Expressions of hsa_circ_0044235 and miR-338-5p in MH7A cells(±s,n=3)
Note:Compared with Con group,1)P<0.05;compared with LPS group,2)P<0.05;compared with LPS+pcDNA group,3)P<0.05.
Groups Con LPS LPS+pcDNA LPS+pcDNA-hsa_circ_0044235 F P hsa_circ_0044235 1.00±0.00 0.11±0.021)0.10±0.02 0.81±0.062)3)598.273 0.000 miR-338-5p 1.00±0.00 6.04±0.201)6.06±0.23 1.43±0.082)3)945.413 0.000
2.2 过表达hsa_circ_0044235对LPS诱导的MH7A细胞克隆形成和细胞周期的影响 与Con组比较,LPS组MH7A细胞克隆形成数增加(P<0.05),细胞周期G0~G1期缩短(P<0.05),S期延长(P<0.05),而G2~M期无明显变化(P>0.05)。与LPS+pcDNA组比较,LPS+pcDNA-hsa_circ_0044235组MH7A细胞克隆形成数减少(P<0.05),细胞周期G0~G1期延长(P<0.05),S期缩短(P<0.05),而G2~M期无明显变化(P>0.05)。LPS组和LPS+pcDNA组MH7A细胞克隆形成数和细胞周期差异无统计学意义(P>0.05,图1、图2、表2)。
表2 hsa_circ_0044235对LPS诱导的MH7A细胞克隆形成和细胞周期的影响(±s,n=3)Tab.2 Effect of hsa_circ_0044235 on LPS-induced MH7A cells clone formation and cell cycle(±s,n=3)
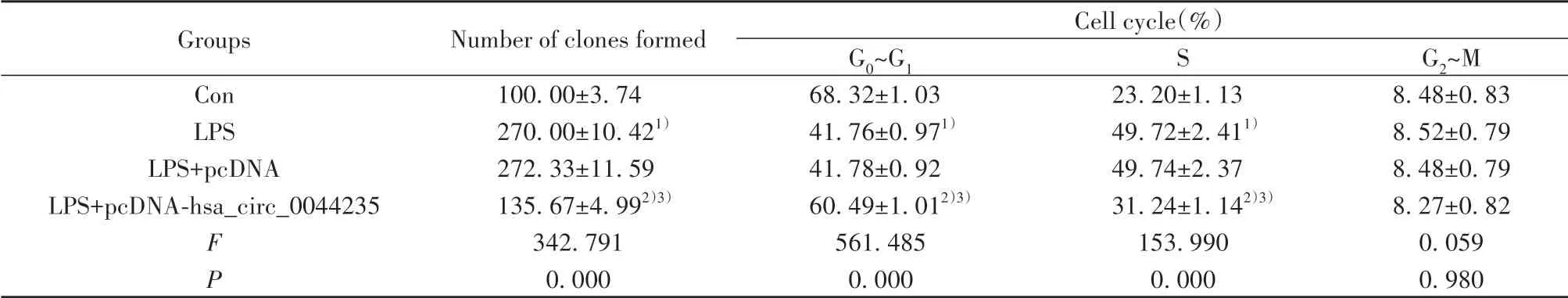
表2 hsa_circ_0044235对LPS诱导的MH7A细胞克隆形成和细胞周期的影响(±s,n=3)Tab.2 Effect of hsa_circ_0044235 on LPS-induced MH7A cells clone formation and cell cycle(±s,n=3)
Note:Compared with Con group,1)P<0.05;compared with LPS group,2)P<0.05;compared with LPS+pcDNA group,3)P<0.05.
Groups Con LPS LPS+pcDNA LPS+pcDNA-hsa_circ_0044235 FP Number of clones formed 100.00±3.74 270.00±10.421)272.33±11.59 135.67±4.992)3)342.791 0.000 Cell cycle(%)G0~G1 68.32±1.03 41.76±0.971)41.78±0.92 60.49±1.012)3)561.485 0.000 S 23.20±1.13 49.72±2.411)49.74±2.37 31.24±1.142)3)153.990 0.000 G2~M 8.48±0.83 8.52±0.79 8.48±0.79 8.27±0.82 0.059 0.980

图1 LPS诱导的过表达hsa_circ_0044235的MH7A细胞克隆形成情况Fig.1 Clone formation of LPS-induced MH7A cells overexpressed hsa_circ_0044235
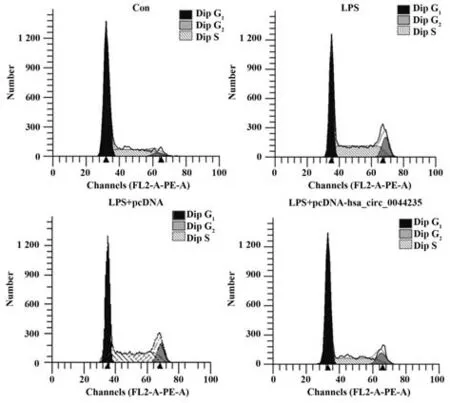
图2 LPS诱导的过表达hsa_circ_0044235的MH7A细胞周期情况Fig.2 Cell cycle of LPS-induced MH7A cells over-ex⁃pressed hsa_circ_0044235
2.3 过表达hsa_circ_0044235对LPS诱导的MH7A细胞迁移的影响 与Con组比较,LPS组MH7A细胞划痕愈合率升高(P<0.05),E-cadherin蛋白表达降低(P<0.05),N-cadherin蛋白表达升高(P<0.05)。与LPS+pcDNA组比较,LPS+pcDNA-hsa_circ_0044235组MH7A细胞划痕愈合率降低(P<0.05),E-cad‐herin蛋白表达升高(P<0.05),N-cadherin蛋白表达降低(P<0.05)。LPS组和LPS+pcDNA组各检测指标差异无统计学意义(P>0.05,图3、表3)。
表3 过表达hsa_circ_0044235对LPS诱导的MH7A细胞迁移的影响(±s,n=3)Tab.3 Effect of over-expression of hsa_circ_0044235 on migration of MH7A cells induced by LPS(±s,n=3)
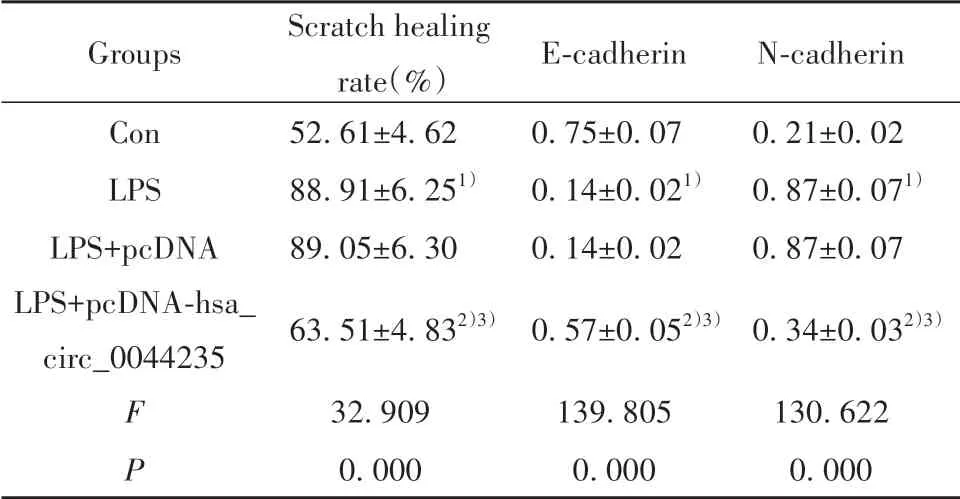
表3 过表达hsa_circ_0044235对LPS诱导的MH7A细胞迁移的影响(±s,n=3)Tab.3 Effect of over-expression of hsa_circ_0044235 on migration of MH7A cells induced by LPS(±s,n=3)
Note:Compared with Con group,1)P<0.05;compared with LPS group,2)P<0.05;compared with LPS+pcDNA group,3)P<0.05.
Groups Con LPS LPS+pcDNA LPS+pcDNA-hsa_circ_0044235 FP Scratch healing rate(%)52.61±4.62 88.91±6.251)89.05±6.30 63.51±4.832)3)32.909 0.000 E-cadherin 0.75±0.07 0.14±0.021)0.14±0.02 0.57±0.052)3)139.805 0.000 N-cadherin 0.21±0.02 0.87±0.071)0.87±0.07 0.34±0.032)3)130.622 0.000
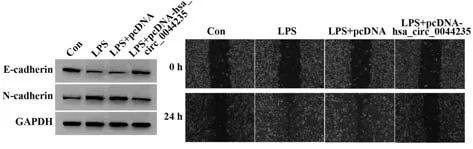
图3 LPS诱导的过表达hsa_circ_0044235的MH7A细胞E-cadherin、N-cadherin蛋白表达、迁移情况Fig.3 Protein expressions of E-cadherin and N-cadherin and migration in LPS-induced MH7A cells overexpressed hsa_circ_0044235
2.4 hsa_circ_0044235靶向调控miR-338-5p表达生物信息学软件预测显示,hsa_circ_0044235与miR-338-5p核苷酸序列存在连续结合位点(图4)。共转染WT-hsa_circ_0044235与miR-338-5p的细胞荧光素酶活性低于共转染WT-hsa_circ_0044235与miR-NC的细胞(0.23±0.02vs1.03±0.07,t=19.033,P<0.05),而共转染MUT-hsa_circ_0044235与miR-338-5p的细胞与共转染MUT-hsa_circ_0044235与miR-NC的细胞荧光素酶活性差异无统计学意义(0.96±0.05vs1.00±0.06,t=0.887,P=0.425),说明hsa_circ_0044235可与miR-338-5p靶向结合。

图4 hsa_circ_0044235和miR-338-5p的互补序列Fig.4 Complementary sequences of hsa_circ_0044235 and miR-338-5p
2.5 过表达miR-338-5p逆转过表达hsa_circ_0044235对LPS诱导的MH7A细胞克隆形成和细胞周期的影响 与LPS+pcDNA-hsa_circ_0044235+miR-NC组比较,LPS+pcDNA-hsa_circ_0044235+miR-338-5p组MH7A细胞miR-338-5p表达升高(P<0.05),克隆形成数增加(P<0.05),细胞周期G0~G1期缩短(P<0.05),S期延长(P<0.05),而G2~M期无明显变化(P>0.05,图5、表4)。
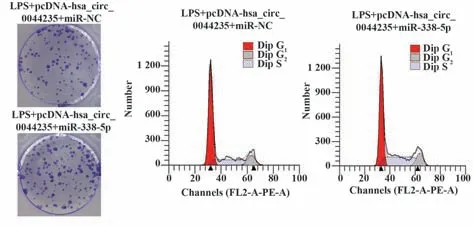
图5 LPS诱导的过表达miR-338-5p和hsa_circ_0044235的MH7A细胞克隆形成、细胞周期Fig.5 Clone formation and cell cycle of LPS-induced MH7A cells over-expressed miR-338-5p and hsa_circ_0044235
表4 过表达miR-338-5p可逆转过表达hsa_circ_0044235对LPS诱导的MH7A细胞克隆形成和细胞周期的影响(±s,n=3)Tab.4 Over-expression of miR-338-5p reversed effect of over-expression of hsa_circ_0044235 on clone formation and cell cycle of MH7A cells induced by LPS(±s,n=3)

表4 过表达miR-338-5p可逆转过表达hsa_circ_0044235对LPS诱导的MH7A细胞克隆形成和细胞周期的影响(±s,n=3)Tab.4 Over-expression of miR-338-5p reversed effect of over-expression of hsa_circ_0044235 on clone formation and cell cycle of MH7A cells induced by LPS(±s,n=3)
Note:Compared with LPS+pcDNA-hsa_circ_0044235+miR-NC group,1)P<0.05.
Groups LPS+pcDNA-hsa_circ_0044235+miR-NC LPS+pcDNA-hsa_circ_0044235+miR-338-5p tP hsa_circ_0044235 0.82±0.07 0.80±0.081)0.326 0.761 miR-338-5p 1.43±0.09 5.40±0.201)31.353 0.000 Number of clones formed 135.00±5.10 244.00±9.091)18.113 0.000 Cell cycle(%)G0~G1 60.47±0.99 51.45±0.891)11.736 0.000 S 31.24±1.08 40.21±1.111)10.032 0.001 G2~M 8.29±0.83 8.34±1.15 0.061 0.954
2.6 过表达miR-338-5p可逆转过表达hsa_circ_0044235对LPS诱导的MH7A细胞迁移的影响 如表5、图6所示,与LPS+pcDNA-hsa_circ_0044235+miR-NC组比较,LPS+pcDNA-hsa_circ_0044235+miR-338-5p组MH7A细胞划痕愈合率升高(P<0.05),Ecadherin蛋白表达降低(P<0.05),N-cadherin蛋白表达升高(P<0.05)。

图6 LPS诱导的过表达miR-338-5p和hsa_circ_0044235的MH7A细胞E-cadherin、N-cadherin蛋白表达及迁移Fig.6 Protein expressions of E-cadherin and N-cadherin and migration in LPS-induced MH7A cells overexpressed miR-338-5p and hsa_circ_0044235
表5 过表达miR-338-5p可逆转过表达hsa_circ_0044235对LPS诱导的MH7A细胞迁移的影响(±s,n=3)Tab.5 Over-expression of miR-338-5p reversed effect of over-expression of hsa_circ_0044235 on migration of MH7A cells induced by LPS(±s,n=3)
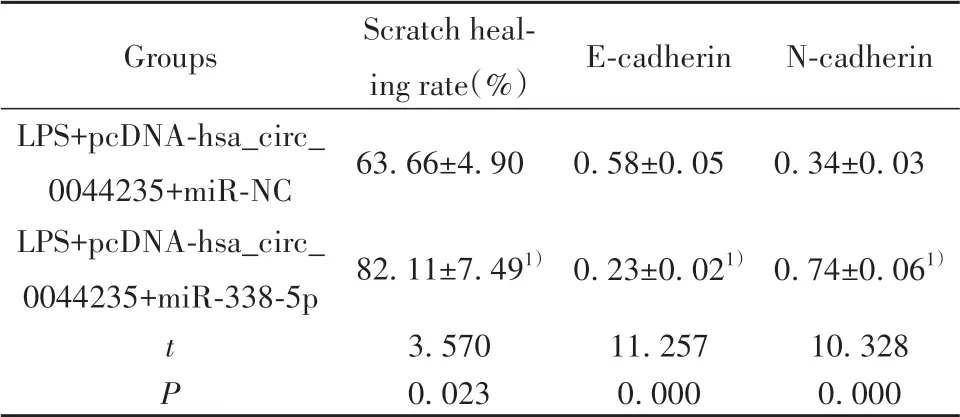
表5 过表达miR-338-5p可逆转过表达hsa_circ_0044235对LPS诱导的MH7A细胞迁移的影响(±s,n=3)Tab.5 Over-expression of miR-338-5p reversed effect of over-expression of hsa_circ_0044235 on migration of MH7A cells induced by LPS(±s,n=3)
Note:Compared with LPS+pcDNA-hsa_circ_0044235+miR-NC group,1)P<0.05.
Groups LPS+pcDNA-hsa_circ_0044235+miR-NC LPS+pcDNA-hsa_circ_0044235+miR-338-5p tP Scratch heal‐ing rate(%)63.66±4.90 82.11±7.491)3.570 0.023 E-cadherin 0.58±0.05 0.23±0.021)11.257 0.000 N-cadherin 0.34±0.03 0.74±0.061)10.328 0.000
3 讨论
circRNA在真核生物中广泛存在,参与骨关节炎炎症反应、滑膜细胞增殖和迁移等过程,是骨关节炎靶向治疗的潜在分子靶点[10-11]。hsa_circ_0044235是与炎症性疾病发生发展密切相关的一种circRNA,在系统性红斑狼疮等多种炎症性疾病中起重要调控作用[12]。已有研究显示,hsa_circ_0044235在骨关节炎患者外周血中表达降低[6],但hsa_circ_0044235影响骨关节炎滑膜成纤维细胞增殖和迁移等恶性表型的相关报道较少。
LPS是革兰氏阴性菌细胞壁的主要成分,可诱导滑膜成纤维细胞炎症反应,引起细胞增生。本研究显示,LPS可促进滑膜成纤维细胞增殖和迁移,与既往报道结果一致[13];LPS抑制了滑膜成纤维细胞hsa_circ_0044235表达,而过表达hsa_circ_0044235减弱了LPS诱导的滑膜成纤维细胞增殖和迁移能力,阻滞了细胞周期,提示hsa_circ_0044235可能是骨关节炎治疗的分子靶点,通过靶向上调其表达可有效抑制骨关节炎发展进程。上皮-间质转化是细胞失去上皮极性而获得间质细胞特性的过程,此过程中上皮标志物如E-cadherin表达降低,而间质标志物如N-cadherin表达升高,骨架改变,迁移能力增强[14-15]。本研究显示,过表达hsa_circ_0044235后,LPS诱导的滑膜成纤维细胞E-cadherin蛋白表达升高,而N-cadherin蛋白表达降低,提示过表达hsa_circ_0044235可能通过抑制细胞上皮-间质转化过程抑制LPS诱导的滑膜成纤维细胞迁移。
为进一步探究过表达hsa_circ_0044235抑制LPS诱导的滑膜成纤维细胞增殖和迁移的分子机制,本研究采用双荧光素酶报告基因实验证实hsa_circ_0044235可靶向结合miR-338-5p;同时,过表达hsa_circ_0044235抑制了LPS诱导的滑膜成纤维细胞miR-338-5p表达,进一步说明hsa_circ_0044235靶向结合并负调控miR-338-5p表达。miR-338-5p在RA组织和细胞中高表达,通过直接下调软脂酰化磷蛋白促进成纤维细胞增殖、侵袭和促炎细胞因子表达[16];下调miR-338-5p可直接靶向上调蛋白聚糖降解酶-9抑制RA滑膜成纤维细胞增殖和迁移[17]。表明miR-338-5p是RA发生发展的不利的因素,可作为RA治疗分子靶点,通过靶向抑制其表达延缓RA发展。本研究还显示,LPS可促进滑膜成纤维细胞miR-338-5p表达,而过表达miR-338-5p逆转了过表达hsa_circ_0044235对LPS诱导的滑膜成纤维细胞增殖、细胞周期进程及迁移的抑制作用,提示hsa_circ_0044235可能通过靶向负调控miR-338-5p影响LPS诱导的滑膜成纤维细胞增殖、细胞周期进程和迁移。
综上,LPS可促进膜成纤维细胞增殖和迁移,而过表达hsa_circ_0044235可有效抑制LPS诱导的膜成纤维细胞增殖和迁移,其作用机制可能与靶向抑制miR-338-5p表达有关,hsa_circ_0044235/miR-338-5p轴可能为RA治疗提供新的靶点。