lncRNA CASC9靶向miR-513a-5p调控高糖诱导的肾小管上皮细胞损伤的机制研究①
2023-01-19董海芸郑君波张钰君青海大学附属医院营养科西宁810000
董海芸 郑君波 张钰君 梅 峰③(青海大学附属医院营养科,西宁 810000)
糖尿病肾病是糖尿病的常见并发症,严重威胁人类生命健康。糖尿病患者长期处于高血糖状态,高糖可引起肾小管上皮细胞损伤,这也是导致糖尿病肾病发生发展的主要原因[1]。肾小管上皮细胞损伤包括炎症损伤、氧化应激损伤及细胞凋亡等[2]。探究影响高糖诱导的肾小管生皮细胞损伤的分子机制,可为糖尿病肾病的治疗提供分子靶点。长链非编码RNA(lncRNA)和微小RNA(miRNA)是两类非编码RNA,且lncRNA可发挥miRNA分子海绵作用调控miRNA靶基因的表达,进而发挥生物学作用[3]。CASC9是一种lncRNA,参与多种疾病发展进程。研究显示,CASC9在脊髓损伤大鼠和脂多糖(LPS)诱导的神经细胞PC12中表达下调,上调其表达可减轻脊髓损伤大鼠氧化应激和炎症反应,并减少细胞凋亡,其作用机制与靶向结合miR-383-5p并促进LDHA表达有关[4];LPS抑制人小气道上皮细胞(HSAECs)中CASC9表达,上调CASC9可通过调节miR-195-5p/PDK4改 善 脓 毒 症 肺 损 伤[5]。然 而,CASC9能否影响高糖诱导的肾小管上皮细胞损伤还未知。
LncBase Predicted v.2靶基因在线软件预测显示,CASC9可能靶向结合miR-513a-5p。研究显示,miR-513a-5p在敌敌畏诱导的人肾小管上皮细胞HK-2中表达上调,过表达miR-513a-5p可通过靶向抑制Bcl-2促进敌敌畏诱导的HK-2细胞凋亡[6]。但miR-513a-5p能否影响高糖诱导的肾小管上皮细胞损伤也还未知。本研究建立高糖诱导的肾小管上皮细胞HK-2损伤模型,观察CASC9和miR-513a-5p对高糖诱导的HK-2细胞炎症因子表达和细胞凋亡的影响及CASC9能否靶向miR-513a-5p发挥作用,以期为糖尿病肾病的治疗提供分子靶标。
1 材料与方法
1.1 材料 人肾小管上皮细胞HK-2(武汉普诺赛生命科技有限公司);胎牛血清(杭州四季青);低糖DMEM培养基、Annexin V-FITC/PI细胞凋亡试剂盒、二喹啉甲酸蛋白检测试剂盒和双荧光素酶活性检测试剂盒(北京索莱宝);LipofectamineTM2000试剂盒和Trizol试剂(美国Invitrogen公司);CASC9过表达载体(pcDNA-CASC9)、空载体(pcDNA)、miR-513a-5p抑制剂(anti-miR-513a-5p)、抑制剂阴性序列(anti-miR-NC)、miR-513a-5p模拟物(mimics)、模拟对照序列(miR-NC)及PCR引物(上海生工);RNA抽提试剂盒、逆转录试剂盒和PCR试剂盒(大连宝生物);IL-6和TNF-α试剂盒(南京建成);兔抗活化的半胱天冬酶(cleaved-caspase)3、cleaved-caspase9和甘油醛-3-磷酸脱氢酶(GAPDH)多克隆抗体(中国Abcam公司)。
1.2 方法
1.2.1 细胞培养 复苏HK-2细胞,用含10%胎牛血清的低糖DMEM培养液培养。培养箱条件:温度37℃、CO2体积分数5%、湿度97%。当细胞生长密度达到90%时,0.25%胰蛋白酶消化,传代培养。
1.2.2 RT-qPCR检 测CASC9和miR-513a-5p表达 取6孔板接种HK-2细胞(5.0×105个/孔),培养12 h后,分为对照(Con)组和高糖(HG)组。其中Con组细胞用含5.5 mmol/L葡萄糖的培养液干预24 h,HG组细胞用含25.0 mmol/L葡萄糖的培养液干预24 h[7]。培养后,弃培养液,收集细胞,用RNA抽提试剂盒提取细胞中总RNA,逆转录为cDNA后,行PCR扩增。引物序列:CASC9正向5'-AGAT‐GAAGCCGGTACCTCAGAT-3',反向5'-TCACTTTA‐AAGAGGGAGAGGAG-3';miR-513a-5p正向5'-GCGCGTTCACAGGGAGG-3',反向5'-AGTGCAGGGTCCGAGGTATT-3';GAPDH正向5'-TATGATGATATCAAGAGGGTAGT-3',反向5'-TGTATCCAAACTCATTGTCATAC-3';U6正向5'-CTCGCTTCGGCAGCACA-3',反向5'-AACGCTTCACGAATTTGCGT-3'。2−ΔΔCt法计算CASC9相对GAPDH、miR-513a-5p相对U6的表达量。
1.2.3 细胞转染和分组处理 取6孔板接种HK-2细胞(5.0×105个/孔),培养24 h。弃培养液,用Lipo‐fectamineTM2000脂质体法分别转染pcDNA-CASC9、pcDNA、anti-miR-513a-5p、anti-miR-NC、共转染pc-DNA-CASC9与miR-NC、pcDNA-CASC9与miR-513a-5p mimics。转染12 h后,RT-qPCR法检测CASC9或miR-513a-5p表达验证转染效果。将转染后的各细胞重新接种至6孔板中(5.0×105个/孔),培养12 h后,均用含25 mmol/L葡萄糖的培养液干预24 h,分别记为HG+pcDNA-CASC9组、HG+pcDNA组、HG+anti-miR-513a-5p组、HG+anti-miR-NC组、HG+pcDNACASC9+miR-NC组、HG+pcDNA-CASC9+miR-513a-5p组。培养后,收集各组细胞培养上清和细胞用于后续指标检测。
1.2.4 ELISA法检测细胞培养上清中IL-6和TNF-α水平 将收集的各组细胞培养上清3 500 r/min离心5 min,保留上清。按照IL-6和TNF-α试剂盒说明书检测上清中IL-6和TNF-α水平。
1.2.5 流式细胞仪检测细胞凋亡 将收集的各组细胞密度调整为1.0×106个/ml,取1.0 ml细胞悬液,1 000 r/min离心5 min,弃上清。加500µl结合缓冲液,混悬细胞。依次加10µl Annexin V-FITC和5µl PI,室温避光孵育15 min后,上流式细胞仪检测细胞凋亡。
1.2.6 Western blot检测cleaved-caspase3和cleavedcaspase9蛋白表达 用RIPA试剂提取各组细胞中总蛋白,二喹啉甲酸蛋白检测试剂盒测定蛋白含量,行10%SDS-PAGE电泳。将分离蛋白转至PVDF膜,并用5%脱脂奶粉封闭2 h。于4℃冰箱中分别用cleaved-caspase3(1∶500)、cleaved-caspase9(1∶500)和GAPDH(1∶1 000)一抗孵育过夜,洗膜后,再于37℃摇床中用山羊抗兔二抗(1∶2 000)孵育1 h。加化学发光试剂,避光显影,曝光拍照,Image J软件分析cleaved-caspase3、cleaved-caspase9相对GAPDH的表达量。
1.2.7 双荧光素酶报告基因实验 由上海生工根据LncBase Predicted v.2靶基因预测的CASC9与miR-513a-5p的结合位点进行扩增,同时将结合位点突变,均插入载体,分别构建CASC9野生型(WTCASC9)和突变型(MUT-CASC9)荧光素酶报告基因载体。取6孔板接种HK-2细胞(5.0×105个/孔),培养24 h。弃培养液,用LipofectamineTM2000脂质体法,分别共转染WT-CASC9与miR-NC或miR-513a-5p mimic、MUT-CASC9与miR-NC或miR-513a-5p mimic。转染12 h后,弃培养液。加细胞裂解液裂解细胞,将裂解液3 500 r/min离心10 min,取上清,检测荧光素酶活性,具体操作参照双荧光素酶活性检测试剂盒说明书。
1.3 统计学分析SPSS22.0软件分析实验数据。符合正态分布的计量资料以±s表示。两组间比较采用独立样本t检验;多组间比较采用单因素方差分析,进一步两两比较采用LSD-t检验。以P<0.05表示差异有统计学意义。
2 结果
2.1 CASC9和miR-513a-5p在高糖诱导的肾小管上皮细胞中的表达 与对照组比较,高糖组HK-2细胞中CASC9的表达量减少(P<0.05),而miR-513a-5p的表达量增加(P<0.05),见表1。
表1 高糖对HK-2细胞中CASC9和miR-513a-5p表达的影响(±s,n=3)Tab.1 Effect of high glucose on expressions of CASC9 and miR-513a-5p in HK-2 cells(±s,n=3)

表1 高糖对HK-2细胞中CASC9和miR-513a-5p表达的影响(±s,n=3)Tab.1 Effect of high glucose on expressions of CASC9 and miR-513a-5p in HK-2 cells(±s,n=3)
Note:Compared with Con group,1)P<0.05.
Groups Con HG t P CASC9 1.00±0.00 0.44±0.031)32.332 0.000 miR-513a-5p 1.00±0.00 2.79±0.241)12.918 0.000
2.2 上调CASC9对高糖诱导的肾小管上皮细胞损伤的影响 转染pcDNA-CASC9的HK-2细胞中CASC9表达量明显高于转染pcDNA的HK-2细胞(2.98±0.13vs1.00±0.00,t=26.380,P<0.05),说明上调CASC9的HK-2细胞构建成功。与对照组比较,高糖组HK-2细胞培养上清中IL-6和TNF-α表达量增加(P<0.05),细胞凋亡率升高(P<0.05),细胞中凋亡相关蛋白cleaved-caspase3和cleaved-cas‐pase9的表达量增加(P<0.05)。与HG+pcDNA组比较,HG+pcDNA-CASC9组HK-2细胞培养上清中IL-6和TNF-α表达量减少(P<0.05),细胞凋亡率降低(P<0.05),细胞中cleaved-caspase3和cleaved-cas‐pase9蛋白表达量减少(P<0.05)。见图1、表2。
表2 上调CASC9对高糖诱导的肾小管上皮细胞炎症因子表达的影响(±s,n=3,pg/ml)Tab.2 Effect of up-regulating CASC9 on expressions of inflammatory factors in renal tubular epithelial cells induced by high glucose(±s,n=3,pg/ml)
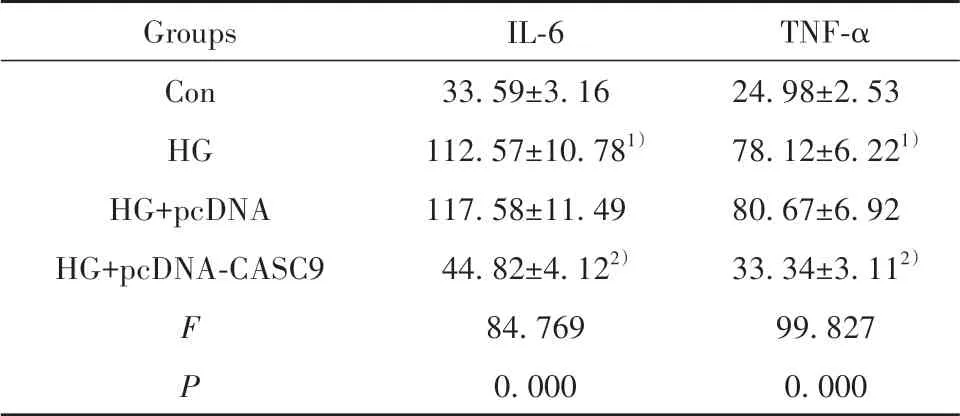
表2 上调CASC9对高糖诱导的肾小管上皮细胞炎症因子表达的影响(±s,n=3,pg/ml)Tab.2 Effect of up-regulating CASC9 on expressions of inflammatory factors in renal tubular epithelial cells induced by high glucose(±s,n=3,pg/ml)
Note:Compared with Con group,1)P<0.05;compared with HG+pcDNA group,2)P<0.05.
Groups Con HG HG+pcDNA HG+pcDNA-CASC9 FP IL-6 33.59±3.16 112.57±10.781)117.58±11.49 44.82±4.122)84.769 0.000 TNF-α 24.98±2.53 78.12±6.221)80.67±6.92 33.34±3.112)99.827 0.000
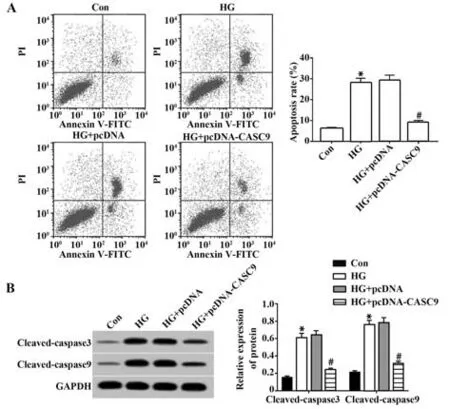
图1 上调CASC9对高糖诱导的肾小管上皮细胞凋亡的影响Fig.1 Effect of up-regulating CASC9 on renal tubular epithelial cell apoptosis induced by high glucose
2.3 CASC9靶向调控miR-513a-5p的表达Lnc‐Base Predicted v.2靶基因预测的CASC9与miR-513a-5p的结合位点见图2。共转染WT-CASC9与miR-513a-5p的HK-2细胞荧光素酶活性显著低于共转染WT-CASC9与miR-NC的细胞(P<0.05),而共转染MUT-CASC9与miR-513a-5p的HK-2细胞荧光素酶活性与共转染MUT-CASC9与miR-NC的细胞比较差异无统计学意义(P>0.05),见表3。转染pcDNA-CASC9的HK-2细胞中miR-513a-5p表达量明显低于转染pcDNA的HK-2细胞(0.52±0.05vs1.00±0.00,t=16.628,P<0.05),说明上调CASC9抑制HK-2细胞中miR-513a-5p的表达。
表3 双荧光素酶报告实验结果(±s,n=3)Tab.3 Double luciferase report experiment results(±s,n=3)
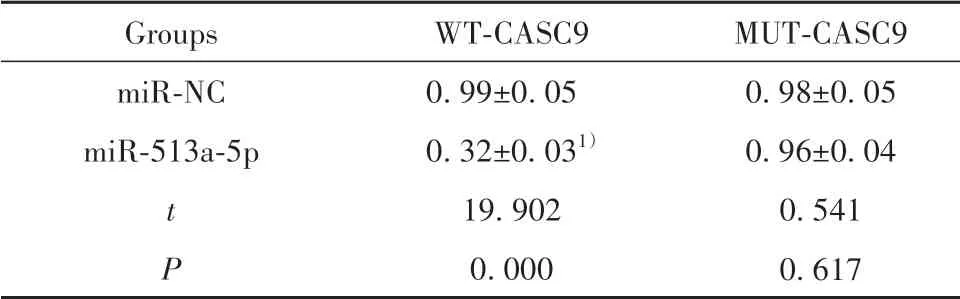
表3 双荧光素酶报告实验结果(±s,n=3)Tab.3 Double luciferase report experiment results(±s,n=3)
Note:Compared with miR-NC group,1)P<0.05.
Groups miR-NC miR-513a-5p t P WT-CASC9 0.99±0.05 0.32±0.031)19.902 0.000 MUT-CASC9 0.98±0.05 0.96±0.04 0.541 0.617

图2 CASC9与miR-513a-5p互补的核苷酸序列Fig.2 Complementary nucleotide sequence of CASC9 and miR-513a-5p
2.4 下调miR-513a-5p对高糖诱导的肾小管上皮细胞损伤的影响 转染anti-miR-513a-5p的HK-2细胞中miR-513a-5p表达量明显低于转染anti-miR-NC的HK-2细胞(0.21±0.03vs1.00±0.00,t=45.611,P<0.05),说明下调miR-513a-5p的HK-2细胞构建成功。与anti-miR-NC组比较,HG+anti-miR-513a-5p组HK-2细胞培养上清中IL-6和TNF-α表达量减少(P<0.05),细胞凋亡率降低(P<0.05),细胞中凋亡相关蛋白cleaved-caspase3和cleaved-caspase9的表达量减少(P<0.05)。见图3、表4。
表4 下调miR-513a-5p对高糖诱导的肾小管上皮细胞炎症因子表达的影响(±s,n=3,pg/ml)Tab.4 Effect of down-regulating miR-513a-5p on expres⁃sion of inflammatory factors in renal tubular epithe⁃lial cells induced by high glucose(±s,n=3,pg/ml)
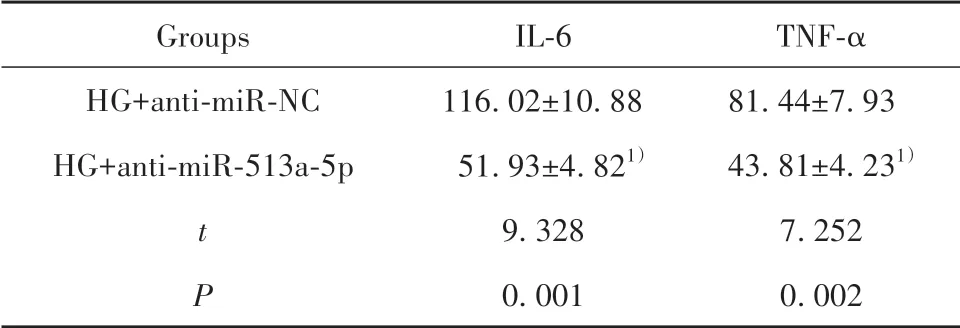
表4 下调miR-513a-5p对高糖诱导的肾小管上皮细胞炎症因子表达的影响(±s,n=3,pg/ml)Tab.4 Effect of down-regulating miR-513a-5p on expres⁃sion of inflammatory factors in renal tubular epithe⁃lial cells induced by high glucose(±s,n=3,pg/ml)
Note:Compared with HG+anti-miR-NC group,1)P<0.05.
Groups HG+anti-miR-NC HG+anti-miR-513a-5p t P IL-6 116.02±10.88 51.93±4.821)9.328 0.001 TNF-α 81.44±7.93 43.81±4.231)7.252 0.002

图3 下调miR-513a-5p对高糖诱导的肾小管上皮细胞凋亡的影响Fig.3 Effect of down-regulating miR-513a-5p on renal tubular epithelial cell apoptosis induced by high glucose
2.5 上调miR-513a-5p表达逆转lncRNA CASC9过表达对高糖诱导的肾小管上皮细胞损伤的作用共转染pcDNA-CASC9与miR-513a-5p mimics的HK-2细胞中miR-513a-5p表达量明显高于共转染pcDNACASC9与miR-NC的HK-2细胞(2.34±0.21vs1.00±0.00,t=11.052,P<0.05),说明HK-2细胞中miR-513a-5p表达上调。与HG+pcDNA-CASC9+miR-NC组 比 较,HG+pcDNA-CASC9+miR-513a-5p组HK-2细胞培养上清中IL-6和TNF-α表达量增加(P<0.05),细胞凋亡率升高(P<0.05),细胞中凋亡相关蛋白cleaved-caspase3和cleaved-caspase9的表达量增加(P<0.05)。见图4、表5。
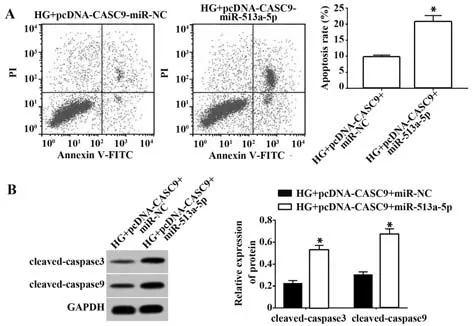
图4 上调miR-513a-5p逆转上调CASC9对高糖诱导的肾小管上皮细胞凋亡的作用Fig.4 Up-regulating miR-513a-5p reversed effect of upregulating CASC9 on apoptosis of renal tubular epithelial cells induced by high glucose
表5 上调miR-513a-5p逆转上调CASC9对高糖诱导的肾小管上皮细胞炎症因子表达的作用(±s,n=3,pg/ml)Tab.5 Up-regulating miR-513a-5p reversed effect of upregulating CASC9 on expression of inflammatory factors in renal tubular epithelial cells induced by high glucose(±s,n=3,pg/ml)
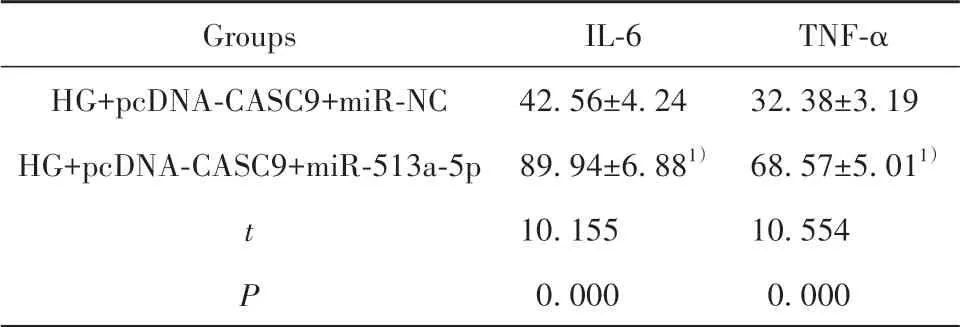
表5 上调miR-513a-5p逆转上调CASC9对高糖诱导的肾小管上皮细胞炎症因子表达的作用(±s,n=3,pg/ml)Tab.5 Up-regulating miR-513a-5p reversed effect of upregulating CASC9 on expression of inflammatory factors in renal tubular epithelial cells induced by high glucose(±s,n=3,pg/ml)
Note:Compared with HG+pcDNA-CASC9+miR-NC group,1)P<0.05.
Groups HG+pcDNA-CASC9+miR-NC HG+pcDNA-CASC9+miR-513a-5p t P IL-6 42.56±4.24 89.94±6.881)10.155 0.000 TNF-α 32.38±3.19 68.57±5.011)10.554 0.000
3 讨论
近年来,随着居民生活水平的提高及生活方式的改变,糖尿病的发病率逐年升高[8]。糖尿病肾病作为糖尿病的常见并发症,其发病率也随着糖尿病患者增加而升高。长期高血糖是糖尿病肾病的主要诱因,其可造成肾小管上皮细胞过度炎症反应和氧化应激,诱导细胞凋亡或坏死,导致糖尿病肾病的发生发展[9]。本研究结果显示,人肾小管上皮细胞HK-2经高糖刺激后,炎症因子IL-6和TNF-α的分泌量增加,且细胞凋亡率升高,与文献[10]报道结果一致,说明高糖诱导的HK-2细胞损伤模型建立成功。
lncRNA在真核生物中广泛存在,其可靶向miRNA调控miRNA靶基因的表达,进而参与调控细胞增殖、分化、凋亡、氧化应激和炎症反应等生理或病理过程[11]。研究显示,GAS5、MALAT1和SNHG7等多种lncRNA参与高糖诱导的HK-2细胞损伤,可作为糖尿病肾病治疗的分子靶点[12-14]。本研究结果显示,经高糖处理的HK-2细胞中CASC9的表达量明显减少,提示CASC9可能参与高糖诱导的HK-2细胞损伤;通过上调HK-2细胞中CASC9的表达发现,上调CASC9可阻碍高糖诱导的HK-2细胞分泌IL-6和TNF-α炎症因子,并减少细胞凋亡,说明CASC9可保护高糖诱导的HK-2细胞损伤,其有可能成为糖尿病肾病治疗的分子靶标。Caspase级联反应参与调控细胞凋亡,其中caspase9是caspase级联反应的起始分子,其被活化后生成cleaved-cas‐pase9;cleaved-caspase9进一步激活caspase3,生成cleaved-caspase3,剪切细胞内各种底物,诱导细胞凋亡[15]。本研究结果显示,上调CASC9抑制了高糖诱导 的HK-2细 胞中cleaved-caspase9和cleaved-cas‐pase3的蛋白表达水平,提示CASC9可能通过抑制caspase级联反应来减少高糖诱导的HK-2细胞凋亡。
为了进一步探究CASC9影响高糖诱导的HK-2细胞炎症因子分泌和细胞凋亡的分子机制,本研究证实了CASC9可靶向结合miR-513a-5p,且上调CASC9抑制HK-2细胞中miR-513a-5p的表达,这与本文HK-2细胞经高糖处理后CASC9表达降低而miR-513a-5p表达升高的结果一致。研究显示,miR-513a-5p可 以通过下调XIAP,从而 抑 制TNF-α和LPS诱导人脐静脉内皮细胞凋亡[16]。本研究结果显示,下调miR-513a-5p可抑制高糖诱导的HK-2细胞分泌IL-6和TNF-α,并减少细胞凋亡,提示下调miR-513a-5p有可能起到治疗肾小管上皮细胞损伤的作用。此外,上调miR-513a-5p逆转了上调CASC9对高糖诱导的HK-2细胞IL-6和TNF-α分泌及细胞凋亡的抑制作用,进一步提示CASC9可能通过靶向miR-513a-5p抑制高糖诱导的HK-2细胞炎症损伤和凋亡,但其具体调控的miR-513a-5p的靶基因还有待进一步探究。
综上,高糖可抑制肾小管上皮细胞中CASC9的表达,而促进miR-513a-5p表达;上调CASC9可能通过靶向下调miR-513a-5p阻碍高糖诱导的人肾小管上皮细胞HK-2分泌炎症因子及细胞凋亡,CASC9/miR-513a-5p轴可能为糖尿病肾病的治疗提供了潜在分子靶点。