人源化小鼠模型的研究进展①
2023-01-19安凌波张茂森西安医学院基础与转化医学研究所院士工作站西安710021
安凌波 张茂森 栾 晶(西安医学院基础与转化医学研究所,院士工作站,西安 710021)
由于人类和动物基因的相似性较高,通过在动物身上复制人类疾病,构建相关的动物疾病模型,是研究人类疾病发病机制、探索治疗方法、评估药物药效和安全性的重要手段。相比于体外培养的细胞模型,在动物模型上得到的实验结果更为可靠。为了缩小动物和人之间因种属差异性带来的误差,研发和构建无限接近于人的动物模型,即人源化动物模型,成为模式动物研究领域发展的风向标。人源化动物模型的快速发展基于免疫缺陷动物受体的出现,为移植人类细胞、组织、脏器等提供了可能性,免疫系统缺陷程度越高,对移植物的排斥反应越小,移植效果越好。同时,移植物的成分越复杂,小鼠的人源化程度越高。
1 免疫缺陷小鼠的起源与发展过程
1.1 裸鼠 裸鼠因浑身无毛而得名,是最早出现的免疫缺陷小鼠,由于该小鼠体内发生等位基因(即第11号染色体上的Foxnl基因)突变导致其先天性胸腺缺失,进而影响胸腺参与的一系列特异性免疫功能,缺乏成熟的T细胞和T细胞参与的适应性免疫应答,包括T细胞介导的免疫排斥反应[1]。研究发现,将裸鼠与不同品系的小鼠杂交可获得多种突变品种,已在我国得到广泛使用的有NIH-nu、BALB/c-nu、NC-nu、Swiss-nu等[2]。但由于裸鼠体内仍存在鼠源的自然杀伤细胞(natural killer cell,NK)和B细胞,完整的先天免疫在一定程度上仍会对移植的人源组织或细胞进行防御进而产生不可逆转的损伤。此外,随着年龄的增长,裸鼠还会出现T细胞渗漏现象,限制其使用范围[3]。
1.2 重症联合免疫缺陷(severe combined immuno‐deficiency,SCID)小 鼠BOSMA等[4]在1983年 发现,CB17小鼠体内蛋白激酶催化亚基的基因(Prkdc基因)发生突变,导致T细胞受体和B细胞受体的修复和重组受阻,进而影响T细胞和B细胞分化成熟的进程,表现为胸腺和外周淋巴组织严重萎缩,缺乏成熟的功能性T、B淋巴细胞并患有低免疫球蛋白血症[5]。这些特点使该小鼠可耐受人造血干细胞(hematopoietic stem cell,HSC)以及恶性血液瘤等的低水平移植,此外,人源组织也可以在该小鼠体内生长[6]。虽然SCID小鼠的移植效率优于裸鼠,但仍存在一定问题:首先,随着年龄的增长,部分SCID小鼠体内会自发修复因基因突变造成的免疫缺陷,从而生成一系列正常的免疫细胞并发育成熟,出现免疫细胞渗漏现象[7];其次,SCID小鼠残存NK细胞、补体及髓系细胞的正常免疫功能,可持续抵抗人源组织和细胞的植入并抑制其生长。此外,SCID小鼠会发生自发性T细胞淋巴瘤(主要在胸腺),发病率在15%左右[8]。以上缺陷限制了SCID小鼠的应用。
1.3 非肥胖型糖尿病(non-obese diabetic,NOD)/SCID小鼠 为降低免疫缺陷小鼠体内NK细胞的活性,提高异种细胞、组织移植成功率,1995年,SHULTZ等[9]通过将突变的Prkdc基因导入至NOD小鼠体内,成功构建了NOD/SCID小鼠模型。由于NOD小鼠的固有免疫系统存在缺陷导致其巨噬细胞和NK细胞均为低活性,且补体循环存在缺陷,抑制了补体活化[6]。在NOD小鼠基因背景上引入Prkdc突变基因的NOD/SCID小鼠同时缺乏完整的适应性免疫系统和固有免疫系统,很大程度上降低了天然免疫细胞和NK细胞的功能,对在小鼠体内重建人源实体瘤、血液瘤以及免疫细胞起到更好的支持作用[9]。不足之处在于:①该小鼠难以接受大幅度的放射线辐照;②大龄的小鼠发生渗漏现象的概率更高;③由于NOD基因易发生突变,使得自发性胸腺淋巴瘤的发生概率大幅提高,导致这种小鼠的寿命很短,平均寿命仅为8个月[4]。
1.4 重组酶激活基因(recombination activating genes,RAG)缺陷小鼠RAG缺陷小鼠的出现对NOD/SCID小鼠模型的不足进行了弥补,RAG1基因和RAG2基因在抗体生成和TCR重排中发挥着重要作用,两者缺陷将导致小鼠体内缺乏成熟的T细胞和B细胞,使其成为较理想的移植受体[10]。该小鼠的优势在于对放射线不敏感,也不会出现免疫渗漏现象。不足之处是其NK细胞活性仍然较高,限制了人造血干细胞重构[5]。为了减少高活性NK细胞带来的阻碍,研究人员对影响NK细胞发育的因子进行研究,发现β2m是主要组织相容性复合体(major histocompatibility complex,MHC)Ⅰ类分子的重要组成部分,而该类分子对NK细胞的发育至关重要。研 究 发 现,剔 除β2m后 获 得 的NOD/SCID β2m−/−(NSB)小鼠缺乏功能性NK细胞,因此即便减少脐血造血干细胞的植入,也可以获得比NOD/SCID小鼠的人源细胞重建水平更高的小鼠。不足之处是该小鼠仍残存少量NK细胞,严重抑制了人源化T细胞和B细胞的分化成熟[1]。
1.5 NOG、NPG、NCG、NSG、NRG、BRG小鼠 为了提高人源化免疫系统的重建水平,研究人员在NOD/SCID背景的小鼠基础上又进一步将IL-2受体的普通伽马链(IL-2Rγc)进行了敲除,该链是高亲和力受体的重要组成部分,编码重要信号通路组成因子(如IL-2、IL-4、IL-7、IL-9、IL-15和IL-21)的功能[11]。具体操作是用NOD/SCID小鼠与C57BL/6JIL-2Rγcnull小鼠进行8次回交得到NOG(NOD/SCID/IL-2Rγcnull)小鼠,其T、B细胞的免疫功能缺失,NK细胞发育受阻[12-13]。给每只小鼠接种约500万个人源细胞,通过对组织切片进行免疫组化分析发现,所有NOG小鼠的脾、肺和外周血中超过50%的细胞为人源,远大于接种的细胞数量,接种的人源细胞可以在NOG小鼠体内增殖,并在各器官生长和分化,因此,NOG小鼠在人血液系统移植方面是较为理想的模型[14]。随后问世的NSG(NOD/SCID/IL-2RYcnull)小鼠、NPG(NOD-PrkdcscidIL-2Rγnull)小鼠以及NCG(NOD-Prk‐dcem26Cd52IL-2Rγem26Cd22)小鼠与NOG小鼠构建原理基本相同[15-19]。NOG与NSG小鼠的区别在于,NOG小鼠缺失IL-2Rγ胞内结构域,而NSG小鼠则完全缺失IL-2Rγ,NSG小鼠的一个优势是不发生渗漏现象和胸腺瘤,可能与其缺乏有活性的IL-2R有关[5]。NOG/NSG/NPG/NCG小鼠的不足之处在于,因SCID突变而对辐射高度敏感。
为了增强小鼠的抗辐射能力,采用基因编辑技术由RAG1或RAG2基因缺失代替SCID突变,得到NOD背景RAG1−/−(或RAG2−/−)、IL-2Rγ−/−表型的 小鼠,因此得名NRG小鼠[20]。NRG(NOD/RAG1/2−/−IL-2Rγnull)小鼠同样具有T细胞、B细胞、NK细胞、巨噬细胞缺陷,因而可以作为高度免疫缺陷小鼠用于建立异种组织和肿瘤移植模型。因NRG小鼠无SCID基因突变,更耐辐射和耐受放疗药物组合的药效试验。
与NRG小 鼠 类 似,BRG(BALB/cRAG2−/−IL-2Rγcnull)小鼠是在BALB/c背景的小鼠中引入RAG1−/−或RAG2−/−突变以及IL-2Rγ缺失,表现为T、B细胞缺失和NK细胞无活性[21]。NRG小鼠的人HSC细胞植入率比BRG高,主要原因是NOD背景小鼠的SIRPα带有突变,可以结合人源CD47,抑制巨噬细胞对人源细胞的吞噬作用[22]。
1.6 免疫缺陷小鼠的优缺点对比 在以上诸多免疫缺陷模型中(图1),NOG(NSG、NPG、NCG)和NRG小鼠是目前最主要的几种用于构建人源化小鼠模型的重度免疫缺陷模型,是迄今为止免疫系统缺陷最为彻底的小鼠模型,适合CDX、PDX、PBMC和CD34+HSC移植重建,小鼠生存周期长,利于长期移植及药效评价[23]。在使用过程中,各免疫缺陷小鼠有各自的优点和缺点(表1),如NOG(NSG、NPG、NCG)小鼠对辐射和潜在药物诱导的DNA损伤敏感性增强,而NRG和BRG小鼠则具有抗性。虽然这些差异不影响肿瘤的发病率,但可能对化疗和放射治疗产生极大的影响,因此研究者需仔细考虑治疗问题选择合适的模型[20]。

表1 主要免疫缺陷小鼠的优点和缺点Tab.1 Advantages and disadvantages of immunodeficient mice
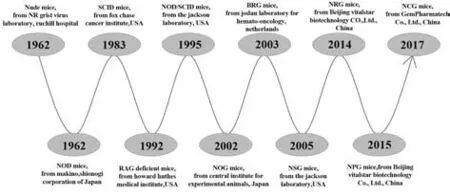
图1 主要免疫缺陷小鼠的发展历史Fig.1 Development history of immunodeficient mice
2 免疫系统人源化小鼠模型的构建
2.1 人外周血单个核细胞/人外周血淋巴细胞(pe‐ripheral blood mononuclear cell,PBMC/perihperal blood lymphocyte,PBL)小鼠模型 该模型构建方法是将人PBMC或PBL移植到成年SCID小鼠循环系统,称为hu-PBMC-SCID或hu-PBL-SCID小鼠模型,首次由MOSIER等[26]建立。该模型具有以下特点:操作简便,人外周血白细胞(human peripheral blood leuko‐cytes,PBLs)易于获得;人体免疫细胞可在受体内存活数周并发挥正常的免疫功能;移植的免疫细胞可以被嗜血细胞病毒如HIV-1、EB等感染。不足的是,人类淋巴细胞的重建水平较低且不稳定;人细胞重建后小鼠缺乏正常淋巴组织,脾脏中亦无法观察到囊泡状生发结构;人源细胞的大量注入会激活小鼠免疫系统,导致体内淋巴细胞增生;另外,T细胞的注入可引发移植物抗宿主病(graft versus host disease,GVHD)。为有效减少GVHD的发生,延长小鼠生存期,可在移植前除去人PBMC中的CD4+T细胞;此外,敲除小鼠MHCⅠ类分子也可以降低hu-PBMC模型GVHD发生率[27]。进一步研究发现,用CB17-SCID小鼠构建hu-PBL-SCID小鼠模型出现GVHD反应程度较弱,并可分泌特异性抗体[1]。TAKAJO等[14]还发现,有效植入人PBMC的NOG小鼠均可正常生长发育,1个月内无立毛或体质量减轻现象,未发现肿瘤或淋巴结肿大。目前该小鼠模型多采用NOG(NOD/SCID/IL-2Rγcnull)、NSG(NOD/SCID IL-2Rγc−/−)或RG(BALB/c RAG2−/−IL-2Rγc−/−)小鼠进行构建,移植效果更为突出[28]。该类模型多用于病毒免疫和对效应T细胞活性的研究[1]。
2.2 人造血干细胞(human-stem cell-severe com‐bined immunodeficiency,hu-HSC-SCID)小鼠模型该模型是将hu-HSC-SCID注射到新生的或成年免疫缺陷小鼠体内,使多系hu-HSC发育为包括T细胞、B细胞、髓系细胞及NK细胞在内的免疫细胞[27]。HSC的获得途径包括脐带血、骨髓和粒细胞集落刺激因子(granulocyte colony stimulating factor,G-CSF)动员后的外周血或胚胎肝脏,其中最常用的途径来自于脐带血和胚胎肝脏,因为此来源的HSCs较成年人HSCs在SCID小鼠体内更易定植。KUCHMA等[29]在免疫表型的研究中发现,相比于脐带血,胎肝含有更丰富的造血干细胞。早期该模型的构建是通过静脉或股动脉注射的方式在合适的成熟NOD/SCID小鼠体内植入CD34+HSCs,经10~12周可重建淋巴细胞增殖过程,但该方法会影响小鼠骨髓生成,且通常不会进行T细胞发育[14,30-31]。目前,多采用NSG、RG或NOG(NOD/Shi-SCID IL-2Rγc−/−)小鼠,由于这类小鼠人体细胞定植效果更好,能够产生全系T细胞、B细胞、巨噬细胞、NK细胞和树突状细胞等[31-32]。hu-HSC-SCID模型的优势在于其造血系统及免疫细胞是HSCs在小鼠体内重新发育而来的,因此小鼠的免疫系统不会对人源细胞产生排斥反应,GVHD发生率极低,模型构建的稳定期可达到近3个月[33]。缺陷在于小鼠胸腺上皮细胞仅表达来自小鼠自身的MHC分子,人T细胞在宿主体内无法经历正常的阴性选择和阳性选择[34]。因此,NSG等免疫缺陷小鼠体内产生的T细胞难以被人抗原呈递细胞(antigen-presenting cell,APC)以及人类白细胞抗原(human leukocyte antigen,HLA)限制的方法激活。进一步研究发现,转入人HLA基因的免疫缺陷小鼠可以使同型人HSCs经历正常的分化筛选并产生功能性的人T细胞和B细胞[8]。另有研究发现,该模型中影响免疫系统构建的因素较多:首先是小鼠周龄,周龄小的小鼠体内HSC的定植效果更优;其次是小鼠性别,在雌性NSG小鼠体内人HSC的植入更稳定。目前该模型在病毒感染和肿瘤移植方面具有广阔的研究前景[35]。
2.3 人源肿瘤组织异种移植(patient-derived tumor xenograft,hu-PDX)模型PDX小鼠模型的构建方法是通过将人的新鲜肿瘤组织或细胞移植到免疫缺陷小鼠体内。最早为1951年TOOLAN[36]通过X射线照射使得小鼠发生基因突变从而形成免疫缺陷小鼠,并向小鼠体内植入人表皮癌组织所得。移植部位通常为皮下、肾包膜下或原位。皮下移植操作较为简单,且易观察肿瘤生长情况,为目前多数PDX小鼠建模所采用的方法,但成功率低[37]。肾包膜下移植成功率较高,但操作难度较大[38]。原位移植能够模拟肿瘤的生长状态,但操作难度大,实验数据也不易采集整理[8]。从BALB/c、裸鼠、SCID小鼠、NOD/SCID小鼠、NOG小鼠到NSG/NRG小鼠,随着免疫系统缺失程度的加重,PDX模型成功率也依次提高。另外,PDX模型构建的成功率还与肿瘤类型和疾病特征有关,如胰腺癌组织比乳腺癌组织移植成功率更高[39]。该模型的优势在于其保留了较为完整的肿瘤发生微环境,取自患者肿瘤部位的组织或细胞可以在小鼠体内维持正常的形态和生理功能[40-41]。同时,受体内免疫系统对肿瘤组织的防御吞噬也可在该模型中被完整观察到,是基础医学研究中最接近患者临床表现的模型。不足之处在于,受体小鼠缺乏完整的人体免疫系统,因此无法针对特定患者肿瘤组织发挥防御作用,且肿瘤生长速度较慢,移植物的成活率不稳定[42]。为了对上述缺陷进行优化,研究者将人HSC和患者来源的肿瘤组织或细胞同时移植入免疫缺陷小鼠体内,进而构建出人源肿瘤组织异种移植(hu-HSC-PDX)小鼠模型。该模型构建成功的标志是能够在肿瘤组织中检测到人成纤维细胞、巨噬细胞和淋巴细胞等。其优势在于能够更完整地模拟肿瘤发生的微环境,为肿瘤组织或细胞提供更舒适的生长环境,使得人类肿瘤的病理结构和组织成分得以更好地保存[43]。PDX小鼠模型已广泛用于肺癌、胃癌、肝癌、食管癌、结肠癌、胰腺癌等肿瘤的临床研究,在模拟肿瘤组织生长、临床预后等方面独具优势[44]。
2.4 人骨髓、肝脏、胸腺(human-bone、liver、thy‐mus,hu-BLT)小鼠模型BLT小鼠是通过将人的胚胎肝脏和胸腺共同移植到免疫缺陷鼠的肾被膜下,同时将同一胚胎来源的肝脏造血干细胞注射到小鼠体内而建立的目前人源化程度最高的小鼠模型[14]。早期BLT小鼠用NOD-SCID小鼠构建,目前多采用NSG或NOG小鼠[45]。由于表达人HLA分子同源胸腺的植入为人HSC提供了较为完整的人体微环境,使其能够经历正常分化筛选并发育成熟。因此,BLT小鼠的所有组织均能检测出包括T细胞、B细胞、单核细胞、树突状细胞、巨噬细胞、红细胞和血小板、NK细胞等多种免疫细胞系在内的人免疫系统的高水平移植,更重要的是可产生有效的适应性免疫应答。该模型具有如下特点:免疫系统的构建非常完整,重组的人T细胞在小鼠胸腺上皮中受到教化,限制了抗原抗体的特异性结合,因此人胸腺细胞的生长和发育可在小鼠胸腺内被观察到;同时该人源化小鼠的脾脏和淋巴结会明显大于普通小鼠[27,30]。但其局限性在于胚胎组织及成年供体样本难以取得,且比其他小鼠更易发生GVHD[46]。LAVENDER等[47]通过研究发现,为有效避免GVHD发生,可在BLT小鼠体内对CD47基因进行敲除。另外,为降低BLT小鼠的局限性,AGARWAL等[30]将人脾脏组织移植入BLT小鼠体内,构建了BLTS小鼠模型,由于脾脏可吞噬衰老红细胞,产生并集合淋巴细胞,因此该模型可促进生发中心形成,进而推动次级淋巴细胞生长。
2.5 基因工程小鼠(genetically engineered mouse models,GEMMs)模型GEMMs模型是将人源目的基因导入小鼠基因组内,通过基因鉴定筛选出可表达目的基因并稳定遗传的小鼠模型。20世纪80年代早期,利用基因工程构建的基因修饰小鼠模型彻底改变了人类对癌症的研究进程。1974年,JAE‐NISCH等[48]将来自西米安病毒的病毒肿瘤基因(SV40)显微注射到小鼠胚胎中,虽然由此构建的小鼠模型未长出肿瘤,但在其体内可以检测到整合在不同组织细胞基因组的病毒DNA,因此被认为是第一只转基因小鼠。20世纪80年代后期,研究人员构建出第一只转基因癌症小鼠模型,该小鼠可表达特定的人癌症基因。构建基因工程小鼠主要通过以下三种方法:①逆转录病毒法,该方法不常用于造模,因为插入基因过小以及基因间的随机整合,有可能影响相邻基因的表达,导致表型与所转基因无关;另外,在插入逆转录病毒载体后,病毒起源的目的基因在DNA去甲基化后不发挥作用;②标准转基因方法,通过显微注射目的基因或将以核酸内切酶为基础的试剂(如Cas9+sgRNA+ssDNA混合物)直接注入受精小鼠卵母细胞的原核中。其优势在于产生转基因后代的速度较快;向小鼠直接注入DNA结构,目的基因被随机混入一部分卵母细胞中,其后代绝大多数均含有目的基因,缺陷在于DNA可能插入关键位点导致有害的基因突变,或者插入沉默位点,不表达所需表型;③靶向转基因方法,通过靶向操作使小鼠胚胎干细胞(embryonic stem cell,ES)在选定的位点丧失目的基因的功能,将该ES显微注射到小鼠囊胚后植入假孕小鼠;该方法至少需要经过两代小鼠进行筛选,耗费时间较长[49]。基因工程在造模中发挥独特优势,但基因工程并不适用于临床研究,因为癌细胞最早来源于小鼠细胞,小鼠乳腺肿瘤病毒感染的历史模型在组织学上未表现出人类肿瘤特征。此外,建立模型耗费时间较长,通常在1年及以上[50]。
2.6 人源化小鼠模型总结 随着重度免疫缺陷小鼠的发展和成熟,其可耐受人源细胞和组织的程度越来越高,小鼠人源化的水平也越来越高。从最易构建的PBL小鼠模型到目前为止人源化水平最高的BLT小鼠模型,再到基因工程小鼠,人源化小鼠模型的快速发展为人类疾病的在体研究和精准治疗的发展提供了前所未有的平台。本文详细介绍5种模型,现将各模型优缺点总结如下(表2)。

表2 免疫系统人源化小鼠模型的构建Tab.2 Construction of humanized mouse model of immune system
3 人源化小鼠模型的应用
3.1 在感染性疾病中的研究 人源化小鼠模型通过移植人免疫细胞至免疫缺陷小鼠,可以使许多人特异性致病源发挥感染作用。在病毒研究领域中,随着人源化小鼠模型构建技术的逐步发展,人源化小鼠模型在人免疫缺陷病毒(HIV-1)、乙型肝炎病毒(hepatitis B virus,HBV)、EB病毒、登革热病毒、流感病毒等病毒感染性疾病中有较广泛的应用,其中HIV-1的研究发展最为迅速[52-56]。作为一种逆转录病毒,HIV-1能够特异性感染人的免疫系统。研究发现,HIV病毒可通过抗逆转录病毒疗法(ART)抑制其复制并阻止病程发展,但由于HIV病毒可以在CD4+T细胞内长期潜伏,ART目前并不能完全治愈HIV-1感染患者[57]。
早期主要通过hu-PBL-SCID模型和hu-SCID模型研究HIV感染的作用机制,这两种模型在小鼠体内很好地演示了HIV感染、复制和致病性,即HIV介导的CD4+T细胞清除的过程[58]。但由于在hu-PBLSCID小鼠模型中缺乏明显的适应性免疫应答,输入的PBLs不能地活化且数量持续下降,使该模型应用受到限制。研究发现,BRG、NOG和NSG小鼠可以观察到持续的病毒血症和CD4+T细胞清除,但针对病毒的特异性适应性免疫应答反应非常微弱,且并非存在于所有小鼠。随后,BLT小鼠模型被投入到对HIV发病机制的探索研究中,研究发现其可在多数感染的小鼠中检测到明显的适应性免疫应答[1]。除HIV致病机制的研究,该模型还支持人类细胞在小鼠黏膜组织的重构,在对人类HIV黏膜感染预防及治疗方面也有较好的应用前景。
通过将人HSCs和/或PBMCs悬液注入SCID小鼠可获得免疫系统人源化(human immune system,HIS)小鼠模型,小鼠存活时间更长且具有更多与人体组织的相似性,有利于临床评价治疗方案的安全性和有效性[59]。
3.2 在肿瘤中的研究 人源化小鼠模型现已成为验证与评估人类癌症疾病治疗效果方面非常有价值的工具,当前主要依赖在HIS基础上构建的人类肿瘤小鼠模型(human tumor model,HTM),即在NSG等免疫缺陷小鼠体内同时移植人免疫细胞和人肿瘤细胞系获得的小鼠模型,可在重塑功能性人免疫系统的同时支持人肿瘤细胞生长。研究者可以通过HTM小鼠探索肿瘤如何与免疫系统相互作用、肿瘤免疫逃逸的机制、免疫调节潜在疗法的机制等[60];通过选择移植特定的免疫细胞,研究其在肿瘤免疫中特定免疫细胞所发挥的主要功能;此外,该模型还可作为免疫检查点抑制剂的评价工具,免疫检查点主要包括程序性细胞死亡蛋白1(PD-1),细胞毒性T淋巴细胞相关蛋白4(CTLA-4),T细胞免疫球蛋白3(TIM-3)和淋巴细胞激活基因3(LAG-3),这些调节分子可抑制过度活化的T细胞攻击自身组织,防止自身免疫疾病的发生[61]。利用HTM小鼠以探究免疫检查点抑制剂的治疗效果和作用机制[35,44],如 有 研 究 用LIN等[62]构 建 的hu-PBL-NSI(NOD/SCID IL2rg−/−)和hu-HSC-NSI两种模型来评估靶向PD-L1/PD-1免疫检查点的治疗策略,发现Hu-PBL-NSI人源化小鼠模型在免疫靶向治疗中显示出更高的抗肿瘤效果,推测其差异可能与供体T细胞发育过程有关[35]。此外,值得一提的是,目前生物抗体药物的表现远优于药物平均水平,而非人源性抗体进入人体内会引起严重的排异反应,进而影响抗体在临床应用时的安全性和治疗效果,因此人源化抗体已经成为抗体药物的发展趋势,而人源化抗体药物的一系列评价更苛刻地依赖于人源化小鼠模型的构建。
3.3 实现精准医疗 精准医疗是一种将个人遗传物质与生活习惯差异考虑在内的新兴预防和治疗方法,其本质是通过基因组、蛋白组等组学技术和医疗手段,寻找疾病发生机制,从而达到对特定患者制定出符合个体情况的治疗方案,进而开展精准治疗的目的。目前,开展最多的肿瘤精准医疗,即通过基因检测获得患者基因变异的信息,如通过高通量测序方法获得肿瘤DNA的突变位点、变异基因拷贝数、基因移位和融合基因等,结合大数据分析设计治疗方案,再利用人源化小鼠模型进行筛选和验证,以实现治疗效果最优化和毒副作用最小化[63]。
肿瘤精准治疗策略要求肿瘤模型务必具有原肿瘤各种特征的良好保真性,人源化小鼠模型可以较好地复制人类免疫微环境,以模拟肿瘤的发生发展和转移过程[64]。目前,PDX小鼠模型已广泛用于对患者进行肿瘤移植治疗的临床试验,将患有难治性实体肿瘤或早期、预后性不佳的癌症患者的部分肿瘤组织植入免疫缺陷小鼠体内,构建PDX小鼠模型,再对这些PDX小鼠进行治疗从而筛选出最有效的治疗药物。AIDALGO等[41]从6例原发性再切肿瘤患者和8例再切转移患者中共获得14个肿瘤移植物,并在232个单剂或组合治疗中用63种不同的抗癌剂进行治疗,共跨越了33种独特的机制。治疗结果显示,14例受试者中有12例确定了异种移植的有效治疗方案,另有2例患者无有效治疗方法。得到有效治疗方案的12例患者,其中1例在接受治疗前死亡,另11例接受了17次前瞻性指导治疗,其中15种得到持久的部分缓解[41]。这项数据证实了人源化小鼠模型在实现精准医疗方面具有巨大的潜力。人源化小鼠还可以结合单细胞基因组学,促进功能性精准医疗,如风险分层和个体优化治疗方法,广泛用于对人类造血系统的体内动力学和功能研究[42]。
4 结语
人源化小鼠模型在探索各类发病机制和评估治疗性药物尤其是人源化抗体类药物的研发中发挥重要作用。目前,人源化小鼠模型已在感染性疾病、血液系统病及肿瘤等方面研究中得到了广泛应用并逐渐成为人类个性化治疗的载体。但人源化小鼠模型的发展仍面临诸多挑战,如是否能彻底消除小鼠天然NK细胞活性、简化供者组织提取、降低免疫排斥反应等。人源化小鼠模型的构建成本相对较高,一方面是其依赖于重度免疫缺陷小鼠作为受体,另一方面,供体由于是人体组织和细胞,来源较为受限,同时存在一些伦理问题;此外,由于重度免疫缺陷小鼠遗传背景的单一性,其应用也受到一定限制。如何有效克服这些问题并推广到临床研究中,需要更多的探索和验证。
人源化小鼠模型为精准医疗提供了理想的工具,随着重度免疫缺陷小鼠的发展和成熟,其可耐受人源细胞和组织的程度越来越高,小鼠人源化的水平也越来越高。通过用人源化小鼠模型尽可能复制人类免疫微环境,以模拟患者肿瘤发生发展和转移的过程,在研究肿瘤耐药、患者抗癌方案的筛选方面得到的数据更为可靠,特别是引入PDX小鼠模型中的免疫细胞提高了个体潜在临床前治疗的可预测性[65-66]。另外,目前较火爆的靶向免疫疗法应用评价也得益于人源化小鼠模型[67-68]。然而,人源化小鼠模型在精准医疗方面的应用仍面临诸多瓶颈,包括免疫细胞和肿瘤之间的MHC不相容性,鼠类固有免疫细胞的残留以及缺乏人类特异性的细胞因子等。由于免疫缺陷小鼠自身存在个体差异,加之在移植人源组织或细胞的过程中由于组织或细胞的不均一性以及手术操作的不稳定性,人源化小鼠模型的可复制性和建模成功率较不稳定。例如,建模成功后部分小鼠体内会出现移植物抗宿主排斥反应,而部分小鼠体内并未出现;移植物存活时间和存活状态因个体不同而存在较大差异;人源化小鼠的成模时间相对较长,造模成功后模型稳定期相较于治疗方案的一一验证又相对较短,对急需有效治疗方案的肿瘤患者来说是一个漫长的等待过程,甚至有部分患者在治疗方案没有优化前就出现病情恶化。人源化小鼠模型为精准治疗的发展提供了前所未有的平台,优化人源化小鼠模型对于精准医疗来说是一项长期的革命,建模前对重度免疫缺陷小鼠均一性的优选、建立系统化的样本处理流程指南、临床医生和科研人员的密切配合和无延时衔接等,都是未来要解决的问题。
