基于STAT1信号通路探讨疏风通络方对支气管哮喘小鼠Th1/Th2失衡的影响①
2023-01-19钟新春朱振刚刘超武乔亚珍
钟新春 朱振刚 刘超武 乔亚珍 熊 桅
(天津中医药大学第一附属医院,国家中医针灸临床医学研究中心,天津 300381)
支气管哮喘是人体内多种细胞(如嗜酸性粒细胞、肥大细胞、T淋巴细胞、中性粒细胞、平滑肌细胞、气道上皮细胞等)及细胞组分参与的气道慢性炎症性疾病,通常伴有气道高反应性,出现广泛多变的可逆性气流受限,并可引起反复发作的喘息、气急、胸闷或咳嗽等症状,常在夜间和清晨发作、加剧,多数患者可自行缓解或经治疗后缓解[1-4]。目前,哮喘是世界上较为常见的慢性病之一,且其患病率逐年升高,给患者的生活质量和身体健康带来很大影响[5-7]。相关研究指出,哮喘是一种免疫性疾病,辅助性T淋巴细胞亚群中Th1/Th2失衡是哮喘免疫学发病的基础[7]。部分研究认为,哮喘发病过程中Th1型免疫反应减弱而Th2型免疫反应异常增强,Th1型细胞因子IL-12、IFN-γ等分泌减少,而Th2细胞分泌的IL-4、IL-5、IL-10和IL-13等细胞因子增多[8-9]。本研究旨在通过实验分析疏风通络方对支气管哮喘小鼠模型的干预作用,研究疏风通络方在STAT1、IL-27通路中的作用,初步分析疏风通络方调控STAT1信号通路缓解Th1/Th2免疫平衡的作用机制。
1 材料与方法
1.1 材料
1.1.1 实验动物 实验小鼠30只,体质量(150±20)g,购自河南省实验动物中心,许可证号:SCXK(豫)2017-0001,于普通环境的动物房饲养,鼠笼安静整洁,室内温度保持在15~25℃,空气流通干燥。
1.1.2 药物 疏风通络方方剂由炙麻黄、荆芥、厚朴、甘草各6 g、僵蚕、地龙、杏仁、黄芩、半夏各10 g、丹参30 g熬制而成。选择小鼠与人等效剂量的倍数为5.98。处方总剂量200 g,如给体质量60 kg的成人每日服用1剂,则成人剂量为3.33 g/(kg·d),小鼠等效剂量为19.93 g/(kg·d),约为20 g/(kg·d)。
1.1.3 试剂及仪器 卵蛋白(OVA)购自Sigma公司;氢氧化铝佐剂购自美国赛默飞世尔科技公司;重组人IL-27购自美国eBioscience公司;特异性STAT1抑制剂购自美国Selleck公司;β-actin抗体、IFN-γ ELISA试剂盒、IL-4 ELISA试剂盒购自Abcam公司;IFN-γ抗体、pSTAT1抗体、STAT1抗体、IL-4抗体购自美国BioLegend公司;化学发光检测试剂盒购自中国北京索莱宝公司;PVDF膜购自瑞士罗氏公司;雾化器购自北京九州晟欣科技有限公司(中国);烟熏箱购自Teague Enterprises公司;切片机购自德国徕卡有限公司。
1.2 方法
1.2.1 动物造模30只实验级小鼠按照随机分配原则分为对照组、模型组、IL-27组、疏风通络方组和疏风通络方+STAT1抑制剂组,每组6只。模型组小鼠在实验第1天和第7天腹腔注射OVA(100 mg)、氢氧化铝(100 mg)混合液1 ml致敏,第15天开始每天1%OVA滴鼻激发,持续7 d,末次激发后次日处死小鼠。IL-27组小鼠在实验前7 d及开始实验后7 d于麻醉状态下鼻腔滴入IL-27溶液,早晚各1次,200 ng/次,剩余步骤同模型组。疏风通络方组小鼠在实验第15天开始,于激发前1 h给药[20 g/(kg·d)],1次/d,连续7 d,剩余步骤同模型组。疏风通络方+STAT1抑制剂组小鼠在实验第15天开始于激发前1 h给药,同时腹腔注射80 mg/kg Fludarabine(抑制剂),1次/d,连续7 d,剩余步骤同模型组。正常组小鼠用等剂量生理盐水致敏和激发,剩余步骤同模型组。
1.2.2 造模过程小鼠的一般情况 观察造模全过程各组小鼠行为学变化,包括呼吸情况、精神状态、运动情况等。
1.2.3 咳嗽敏感性测定 最后一次给药后静置30 min,将各组小鼠转移至密闭烧杯,采用辣椒素溶液进行雾化,浓度为1×10−4mol/L,持续4 min,雾化停止后静置4 min,记录8 min内小鼠的咳嗽次数。
1.2.4 血清及支气管肺泡灌洗液中IL-4及IFN-γ表达5组小鼠剖腹后,分离腹主动脉取血,37℃水浴15 min至凝,1 500 r/min离心10 min,离心半径8 cm,分离血清,−80℃冰箱保存。分离取出完整的气管、支气管和肺组织,结扎左侧主支气管,于右肺进行气管插管肺泡灌洗,每次注入2 ml生理盐水,抽吸3次后收集液体,重复3次,1 500 r/min离心10 min,离心半径13.5 cm,上清液于−80℃冰箱保存。根据试剂盒说明书检测IL-4和IFN-γ表达水平。
1.2.5 流式细胞术检测 无菌取出脾脏,置于含RPMI1640培养基的EP管中制备单细胞悬浮液,接种于96孔板,每孔200 µl,与乙酸肉豆蔻佛波醇(PMA,50 ng/ml)和离子霉素(1 g/L)在5%CO2培养箱中孵育5 h。以抗小鼠CD3和CD4抗体4℃下标记细胞30 min。将细胞固定于Perm/Wash缓冲液中,在黑暗中透化20 min,加入IFN-γ和IL-4抗体,4℃孵育30 min,采用流式细胞仪检测细胞。
1.2.6 HE染色观察小鼠肺组织炎症情况 分别取右侧支气管肺组织,常规石蜡包埋、制片、按照HE染色试剂盒说明操作,显微镜下观察肺内气道炎症变化。
1.2.7 Western blot检测pSTAT1和STAT1蛋白水平 蛋白上清液测总蛋白含量,加入缓冲液煮沸5 min,取50 mg蛋白上样,10%凝胶电泳分离总蛋白并电转至PVDF膜;脱脂奶粉封闭,1∶1 000稀释的pSTAT1、STAT1和GAPDH抗体杂交,TBST反复清洗3次后,1∶5 000稀释的羊抗IgG杂交,清洗3次,超敏ECL化学发光显像,凝胶图像分析系统扫描各蛋白条带灰度值,以GAPDH为内参蛋白。
1.3 统计学分析 收集的所有实验数据均采用例数(n)或±s形式记录,数据分析用F检验。所有统计学分析均采用SPSS23.0软件完成,P<0.05表示差异有统计学意义。
2 结果
2.1 造模过程中五组小鼠一般情况 对照组小鼠呼吸平稳、无喘息,精神状况正常,运动良好,毛发颜色正常。模型组小鼠出现呼吸困难、喘息、咳嗽、腹肌痉挛等情况,精神不振,运动大幅减少,毛发暗淡,出现点头运动并伴随前肢缩抬,身体消瘦等。IL-27组小鼠造模后表现同模型组,使用IL-27鼻腔滴注后小鼠喘息、咳嗽得到一定程度缓解,精神恢复,小鼠毛发颜色逐渐恢复正常。疏风通络方组造模后表现同模型组,用药后呼吸平稳,精神恢复,运动自如,体质量逐渐增加。疏风通络方+STAT1抑制剂组小鼠造模后同模型组,用药后未见明显改变。
2.2 各组小鼠咳嗽情况 与对照组相比,模型组小鼠咳嗽次数增加(P<0.05);与模型组相比,IL-27组和疏风通络方组小鼠咳嗽次数减少(P<0.05);与IL-27组和疏风通络方组相比,疏风通络方+STAT1抑制剂组小鼠咳嗽次数增加(P<0.05),见表1、图1。
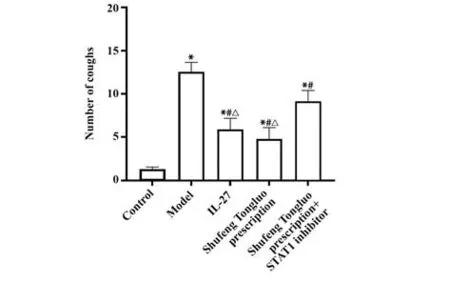
图1 各组小鼠咳嗽情况Fig.1 Cough situation of mice in each group
表1 各组小鼠咳嗽次数(±s,n=6)Tab.1 Cough times of mice in each group(±s,n=6)

表1 各组小鼠咳嗽次数(±s,n=6)Tab.1 Cough times of mice in each group(±s,n=6)
Note:Compared with control group,1)P<0.05;compared with model group,2)P<0.05;compared with Shufeng Tongluo prescription+STAT1 inhibitor group,3)P<0.05.
Groups Control Model IL-27 Shufeng Tongluo prescription Shufeng Tongluo prescription+STAT1 inhibitor FP Cough 1.31±0.26 12.55±3.211)5.89±1.271)2)3)4.76±1.331)2)3)9.13±1.251)2)36.024 0.000
2.3 血清及支气管肺泡灌洗液中IL-4及IFN-γ的表达 与对照组相比,模型组小鼠血清及支气管肺泡灌洗液中IL-4水平提高,IFN-γ水平降低(P<0.05);与模型组相比,IL-27组和疏风通络方组小鼠IL-4水平降低,IFN-γ水平升高(P<0.05);与IL-27组和疏风通络方组相比,疏风通络方+STAT1抑制剂组小鼠IL-4水平升高(P<0.05);与疏风通络方组相比,疏风通络方+STAT1抑制剂组小鼠IFN-γ水平降低(P<0.05),见表2、图2。
表2 血清及支气管肺泡灌洗液中IL-4及IFN-γ的表达(±s,n=6)Tab.2 Expressions of IL-4 and IFN-γ in serum and bronchoalveolar lavage fluid(±s,n=6)
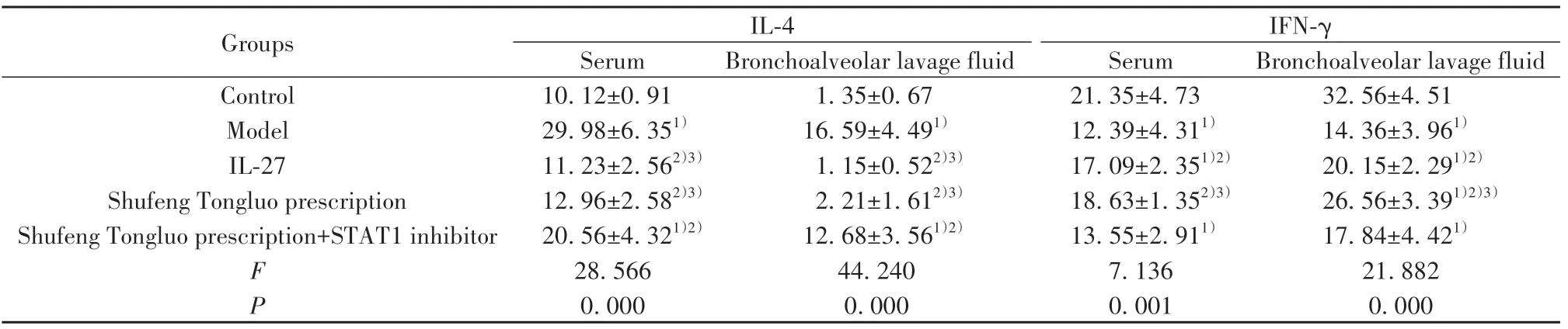
表2 血清及支气管肺泡灌洗液中IL-4及IFN-γ的表达(±s,n=6)Tab.2 Expressions of IL-4 and IFN-γ in serum and bronchoalveolar lavage fluid(±s,n=6)
Note:Compared with control group,1)P<0.05;compared with model group,2)P<0.05;compared with Shufeng Tongluo prescription+STAT1 inhibitor group,3)P<0.05.
Groups Control Model IL-27 Shufeng Tongluo prescription Shufeng Tongluo prescription+STAT1 inhibitor F P IL-4 Serum 10.12±0.91 29.98±6.351)11.23±2.562)3)12.96±2.582)3)20.56±4.321)2)28.566 0.000 Bronchoalveolar lavage fluid 1.35±0.67 16.59±4.491)1.15±0.522)3)2.21±1.612)3)12.68±3.561)2)44.240 0.000 IFN-γ Serum 21.35±4.73 12.39±4.311)17.09±2.351)2)18.63±1.352)3)13.55±2.911)7.136 0.001 Bronchoalveolar lavage fluid 32.56±4.51 14.36±3.961)20.15±2.291)2)26.56±3.391)2)3)17.84±4.421)21.882 0.000

图2 血清及支气管肺泡灌洗液中IL-4及IFN-γ表达Fig.2 Expressions of IL-4 and IFN-γ in serum and bron⁃choalveolar lavage fluid
2.4 Th1和Th2细胞比例比较 与对照组相比,模型组小鼠Th1/Th2降低(P<0.05);与模型组相比,IL-27组和疏风通络方组小鼠Th1/Th2升高(P<0.05);与IL-27组和疏风通络方组相比,疏风通络方+STAT1抑制剂组小鼠Th1/Th2降低(P<0.05),见表3。
表3 各组小鼠脾脏CD4+IFN-γ+、CD4+IL-4+及Th1/Th2比较(±s,n=6,%)Tab.3 Comparison of CD4+IFN-γ+,CD4+IL-4+and Th1/Th2 in spleen of mice in each group(±s,n=6,%)

表3 各组小鼠脾脏CD4+IFN-γ+、CD4+IL-4+及Th1/Th2比较(±s,n=6,%)Tab.3 Comparison of CD4+IFN-γ+,CD4+IL-4+and Th1/Th2 in spleen of mice in each group(±s,n=6,%)
Note:Compared with control group,1)P<0.05;compared with model group,2)P<0.05;compared with Shufeng Tongluo prescription+STAT1 inhibitor group,3)P<0.05.
Groups Control Model IL-27 Shufeng Tongluo prescription Shufeng Tongluo prescription+STAT1 inhibitor F P CD4+IFN-γ+28.79±4.31 14.56±3.211)19.25±3.691)2)3)24.36±4.021)2)3)15.29±3.431)15.720 0.000 CD4+IL-4+10.65±1.23 30.25±4.291)13.21±2.022)3)18.06±2.961)2)3)24.43±3.681)2)42.036 0.000 Th1/Th2 1.15±0.18 0.20±0.031)0.62±0.041)2)3)0.67±0.021)2)3)0.32±0.011)2)114.135 0.000
2.5 小鼠肺组织炎症情况HE染色可见对照组小鼠肺泡及支气管结构正常,无明显炎症现象。模型组小鼠肺泡间隙变大,部分断开,炎症反应明显,出现炎症细胞浸润,各级支气管出现上皮细胞脱落及炎症性渗出物。与模型组相比,IL-27组和疏风通络方组小鼠肺泡间隙减小,炎症反应减弱,支气管上皮细胞肿胀、脱落减少。与疏风通络方组相比,疏风通络方+STAT1抑制剂组小鼠肺泡间隙增大,炎症反应增加,支气管上皮细胞肿胀脱落增加(图3)。
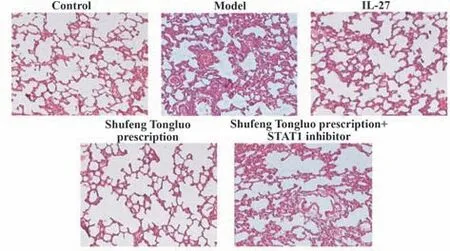
图3 小鼠肺组织炎症情况Fig.3 Inflammation of lung tissue in mice
2.6 pSTAT1和STAT1蛋白水平 五组小鼠肺组织内STAT1蛋白水平比较差异无统计学意义(P>0.05);与对照组相比,模型组小鼠pSTAT1蛋白水平降低(P<0.05);与模型组相比,IL-27组和疏风通络方组小鼠pSTAT1蛋白水平表达升高(P<0.05);与IL-27组和疏风通络方组相比,疏风通络方+STAT1抑制剂组小鼠pSTAT1蛋白水平表达降低(P<0.05,表4、图4)。
表4 pSTAT1和STAT1蛋白水平(±s,n=6)Tab.4 pSTAT1 and STAT1 protein levels(±s,n=6)
表4 pSTAT1和STAT1蛋白水平(±s,n=6)Tab.4 pSTAT1 and STAT1 protein levels(±s,n=6)
Note:Compared with control group,1)P<0.05;compared with model group,2)P<0.05;compared with Shufeng Tongluo prescription+STAT1 inhibitor group,3)P<0.05.
Groups Control Model IL-27 Shufeng Tongluo prescription Shufeng Tongluo prescription+STAT1 inhibitor FP pSTAT1 1.25±0.47 0.19±0.041)0.47±0.081)2)3)0.63±0.111)2)3)0.17±0.031)2)24.377 0.000 STAT1 0.39±0.01 0.40±0.03 0.38±0.01 0.38±0.02 0.39±0.02 0.833 0.489
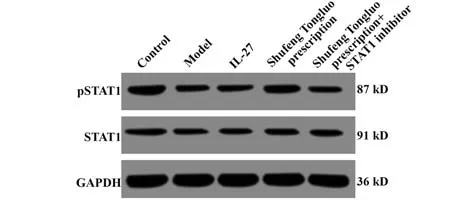
图4 pSTAT1和STAT1蛋白水平Fig.4 pSTAT1 and STAT1 protein levels
3 讨论
支气管哮喘是由多种细胞及细胞组分参与的气道慢性炎症性疾病,伴有气道高反应性及可逆性气流受限,引起反复性喘息、气急、胸闷或咳嗽,以夜间清晨发作为主。支气管哮喘的发病原因复杂,目前尚未明确。受学术界广泛认同的一种说法是“卫生假说”,以该学说的免疫学机制为根本,认为Th1/Th2失衡及Th2免疫优势是哮喘发病的重要基础[10]。现有文献记载,诱导Th1相关细胞发生反应可刺激IL-12、IFN-γ生成,从而抑制Th2相关细胞产生,缓解Th1/Th2失衡,最终达到抑制哮喘发生的目的[9]。疏风通络方对哮喘的预防和治疗具有良好效果,已有研究证实,该方剂还具有改善气道炎症、调节肺功能、纠正患者缺氧状态作用[11]。本研究采用辣椒素诱咳实验测定小鼠咳嗽敏感性,发现疏风通络方可降低小鼠咳嗽次数,证实了其临床疗效。因此,本文旨在通过实验分析疏风通络方对支气管哮喘小鼠模型的干预作用,研究其在STAT1通路中的作用,并初步分析其调控STAT1信号通路缓解Th1/Th2免疫平衡的作用机制。
Th1及Th2相关细胞分泌的多种抑炎和促炎细胞因子在人体内发挥重要作用,这些细胞因子的存在使得Th1、Th2相互制衡,达到一个稳定状态。IFN-γ由Th1分泌,在人体内发挥促炎功效,同时也能促使免疫负向调节[12]。Th1/Th2相互制衡状态下,IFN-γ结合并活化其受体,从而激活JAK-STAT信号通路,达到上调T-bet、促进Th1细胞分化目的。IL-4由Th2分泌而来,是T细胞炎症反应的初始开启因素,经相关类别蛋白水平的提高,达到聚集、活化呼吸道炎症细胞、增加支气管哮喘发作次数的效果[13]。IFN-γ及IL-4与支气管哮喘的发生发展及病情严重程度紧密相关[14]。本实验发现,疏风通络方能够上调血清及灌洗液中IFN-γ水平、下调IL-4水平,提示疏风通络方可改善支气管哮喘患者Th1/Th2失衡。IL-27是新发现的IL-12家族细胞因子,对Th1型细胞免疫应答具有促进作用,对Th2细胞应答具有抑制作用[15]。实验发现,IL-27组血清及灌洗液中IL-4水平降低,提示哮喘小鼠体内Th2水平受到抑制。SU等[16]的研究也指出,提前使用IL-27治疗支气管哮喘模型小鼠可降低其体内IL-5及IL-13表达,可能与其对Th2的抑制有关。本文中疏风通络方组哮喘小鼠体内IL-4与IFN-γ水平同IL-27组。为观察两组改善Th1/Th2失衡的效果,文章还检测了IL-27对Th2水平代表因子IL-4及Th1水平特征性因子IFN-γ的影响,发现疏风通络方及IL-27组均可提高哮喘小鼠体内IFN-γ和Th1水平。由此猜测疏风通络方抑制哮喘的机制可能与IL-27抑制哮喘的机制相类似。有研究表明,IL-27诱导Th细胞向Th1方向分化并分泌IFN-γ,Th细胞表面分布的IL-27受体与IL-27结合后可激活STAT1通路,由受体上的pg130亚基招募JAK1或JAK2,JAK发生自身磷酸化后再进一步磷酸化和二聚化STATs分子,而二聚化的pSTATs转位进入细胞核,结合于特定的靶基因序列,发挥转录因子作用[17]。相关研究记载,IL-27能够上调小鼠Th细胞转录因子T-bet表达水平,进而促进Th1分化和IFN-γ分泌;IL-27和JAK/STATs通路除了可促进Th1胞分化外,也可通过上调IL-12Rβ2表达间接抑制Th2特异性转录因子GATA-3表达,但阻断STAT1磷酸化水平可减弱IL-27对Th2的抑制作用,证明IL-27通过STAT1磷酸化抑制Th2分化[18]。STAT1磷酸化对IL-27生物学功能的正常发挥极为重要,文献表明,高水平IL-4的哮喘患者存在IL-27治疗耐受现象,IL-27无法抑制Th2细胞分化,随后发现这一现象可能与IL-4诱导Th细胞抑制STAT1磷酸化相关[19]。研究表明,支气管哮喘气道中STAT1磷酸化障碍可引起IL-27抑制Th2细胞功能受损,导致Th1/Th2平衡失调,诱发、加重哮喘[20]。因此,提高STAT1磷酸化水平,增强IL-27通路对Th2的抑制作用,恢复哮喘患者气道内Th1/Th2免疫平衡,为哮喘治疗提供了新的通路及靶点。
本研究表明,疏风通络方可明显改善Th1/Th2失衡,但添加STAT1抑制剂后,其对哮喘的抑制和治疗作用大幅降低,提示STAT1磷酸化对疏风通络方缓解Th1/Th2失衡具有重要意义。Western blot实验证实疏风通络方及IL-27可提高pSTAT1水平,促进STAT1通路磷酸化,但加入STAT1抑制剂后,疏风通络方逆转pSTAT1表达下降的作用被阻碍,证实疏风通络方的治疗作用与STAT1通路的磷酸化相关。
综上所述,疏风通络方能够缓解支气管哮喘小鼠喘息、气急、咳嗽等症状,可能与疏风通络方调节STAT1信号通路,改善Th1/Th2失衡密切相关。但该信号通路的其他分子机制尚不明确,仍需深入研究发掘。