祛痰、化瘀和祛痰化瘀方对氧化低密度脂蛋白诱导血管内皮细胞增殖及凋亡功能的影响❋
2018-01-02林雅军马雅銮李玉梅胡镜清
陈 冰,林雅军,马雅銮,李玉梅,薛 欣,胡镜清△
(1. 中国中医科学院中医基础理论研究所,北京 100700; 2. 北京医院国家老年医学中心,北京 100730)
【实验研究】
祛痰、化瘀和祛痰化瘀方对氧化低密度脂蛋白诱导血管内皮细胞增殖及凋亡功能的影响❋
陈 冰1,林雅军2,马雅銮1,李玉梅1,薛 欣1,胡镜清1△
(1. 中国中医科学院中医基础理论研究所,北京 100700; 2. 北京医院国家老年医学中心,北京 100730)
目的:观察祛痰、化瘀和祛痰化瘀方对ox-LDL损伤HUVEC增殖及凋亡功能的影响。方法:建立HUVEC ox-LDL损伤模型,采用MTT检测法、AnnexinV-FITC/PI双染结合流式细胞术和Western blot 检测法,观察方药对HUVEC增殖率、凋亡率及与增殖、凋亡相关蛋白VEGFR、P66、P53、Bcl-2、BAX表达的影响。结果:在细胞增殖方面,祛痰化瘀方能增加HUVEC吸光度,祛痰方、祛痰化瘀方可上调HUVEC VEGFR的表达水平,ox-LDL作用下4种方剂均可增加HUVEC吸光度并上调VEGFR表达水平。在细胞凋亡方面,祛痰方、化瘀方和祛痰化瘀方均能降低P66的表达水平;ox-LDL作用下,HUVEC Bcl-2表达降低,BAX、P66表达升高;祛痰化瘀方等4种方剂对早期、晚期及总凋亡率都有极大改善,且均可降低BAX的表达水平;祛痰方组、化瘀方组和祛痰化瘀方可降低P66的表达水平,祛痰化瘀方可提高Bcl-2的表达水平,Ox-LDL及4种方剂均对P53的表达水平无明显影响。结论:祛痰、化瘀和祛痰化瘀方及基础方均可在不同程度上通过促进增殖、抗凋亡达到对抗HUVEC氧化损伤的作用,其中祛痰化瘀方的效果最显著。
祛痰方、化瘀方和祛痰化瘀方;人脐静脉内皮细胞;氧化低密度脂蛋白;增殖;凋亡
动脉粥样硬化[1](atherosclerosis,As)表现为动脉内膜的脂质、血液成分的沉积,平滑肌细胞及胶原纤维增生,并伴有坏死及钙化等不同程度病变,是严重危害人类健康的常见病。中医认为,As的基本病机是痰浊、血瘀,“水谷津液若化得其正则成津血,化失其正则为痰浊”。痰浊即成则随气升降,无处不到,痰性稠浊注于血脉,则血行凝涩,久则成瘀。认为As多为痰瘀互阻型,因此临床治疗此类患者多使用痰瘀同治法。
本文使用的痰瘀同治方药为我所胡镜清研究员多年来用于治疗高脂血症/As 与心脑疾病等痰瘀互结证的经验方,经过拆分后分为祛痰方、化瘀方、祛痰化瘀方、基础方4组。本研究以ox-LDL作用于人脐静脉内皮细胞(human umbilical vein endothelial cells,HUVEC)后,观察这4种方药对ox-LDL诱导的HUVEC增殖、凋亡功能的影响。
1 材料
1.1 药品与试剂
实验所用药材均购自北京同仁堂药店共4种组方:基础方(党参、干姜、麻黄等)、祛痰方(法半夏、陈皮、茯苓等加基础方)、化瘀方(桃仁、红花、生地等加基础方)和祛痰化瘀方(祛痰方加化瘀方加基础方)。Ⅱ型胶原酶、低糖DMEM、胎牛血清购自美国Hyclone公司,内皮细胞培养基购自美国Sciencell公司,MTT试剂盒购自美国Sigma公司,Annexin V-FITC/PI凋亡试剂盒购自美国BD公司,ox-LDL购自北京协生生物科技有限公司。血管内皮生长因子受体(vascular endothelial growth factor receptor,VEGFR)-2、P66、P53、Bcl-2、BAX、β-actin一抗购自美国Cell Signaling Technology公司,免疫印记法(Western Blot) 发光液和免疫印迹PVDF 膜购自美国Millipore公司。
1.2 动物分组及含药血清的制备
清洁级雄性SD大鼠,体质量(220±20)g,由中国人民解放军军事医学科学院实验动物中心提供(许可证号SCX-(军)2012-0004)。大鼠按随机数字表法分为正常组、基础方组、祛痰方组、化瘀方组、祛痰化瘀方组5组各10只。大鼠给药前禁食不禁水4 h,各组药物加8倍量水浸泡1 h,煎煮30 min滤去药液,药渣加6倍量水再煎煮30 min过滤,合并2次滤液,以蒸馏水调至适当浓度备用。各组按成人临床日用量等效剂量的2倍灌胃,正常组以去离子水代替,每天2次共5次;末次灌胃1.5 h后,腹主动脉取血,3000 rpm/min离心分离血清,56 ℃灭活30 min,0.22 μm无菌滤膜过滤分装,-80 ℃保存备用。水煎2次合并药液过滤浓缩,浓缩成含生药量2 g/ml,给药时以蒸馏水稀释至所需浓度。
1.3 仪器
1300 series A2超净工作台购自美国Thermo公司,Fluor Chen FC2电泳仪购自美国Cell Biosciences公司,IX-70倒置显微镜购自日本Olympus公司,FACS Callibur流式细胞仪购自美国BD公司,3K15高速低温离心机购自美国Sigma公司,-80 ℃低温冰箱购自美国Thermo公司。
2 方法
2.1 HUVEC的原代培养
取长度约20 cm的新鲜脐带,用37 ℃生理盐水冲洗脐静脉后,以0.1%的Ⅱ型胶原酶灌注脐静脉20 min,收集灌注液,800 r/min离心10 min,收集内皮细胞至25 cm2培养瓶中,加入5 ml含10%胎牛血清的内皮细胞培养基在37 ℃含5%的CO2培养箱中培养,将3~5代细胞用于实验。
2.2 实验分组及用药方法
本研究分为正常组、模型组、基础方组、祛痰方组、化瘀方组和祛痰化瘀方组6组。正常组用含20%正常组大鼠血清+2%胎牛血清的内皮细胞培养基,模型组用含ox-LDL(100 mg/L)+20%正常组大鼠血清+2%胎牛血清内皮细胞培养基,基础方组用含ox-LDL(100 mg/L)+20%基础方组大鼠血清+2%胎牛血清的内皮细胞培养基,祛痰方组用含ox-LDL(100 mg/L)+20%祛痰方组大鼠血清+2%胎牛血清的内皮细胞培养基,化瘀方组用含ox-LDL(100 mg/L)+20%化瘀方组大鼠血清+2%胎牛血清的内皮细胞培养基,祛痰化瘀方组用含ox-LDL(100 mg/L)+20%祛痰化瘀方组大鼠血清+2%胎牛血清的内皮细胞培养基。
2.3 MTT法检测不同药物对HUVEC增殖的影响
取对数生长期HUVEC,将细胞以4000 /孔的密度接种于96孔板中,待细胞融合生长至80%后,以PBS冲洗,加入不同浓度的4组(基础方组、祛痰方组、化瘀方组和祛痰化瘀方组)含药血清培养基。用药方案如下:正常组即0%含药血清组(0%含药方组大鼠血清+20%正常组大鼠血清),5%含药血清组(5%含药方组大鼠血清+15%正常组大鼠血清),10%含药血清组(10%含药方组大鼠血清+10%正常组大鼠血清),15%含药血清组(15%含药方组大鼠血清+5%正常组大鼠血清),20%含药血清组(20%含药方组大鼠血清+0%正常组大鼠血清)。作用24 h后,每孔加MTT(5 mg/mL)20 μL,继续在培养箱中培养4 h后终止培养。小心吸弃孔内培养液,每孔加入150 mL DMSO振荡10 min。用酶标仪于570 nm处测定每个孔A570值。按下面公式计算细胞的存活率:细胞存活率=(加药组A570值-空白组A570值)/(对照组A570值-空白组A570值)×100%,实验重复3次。
2.4 MTT法检测不同药物对ox-LDL诱导HUVEC损伤的影响
实验方法同2.3,除2.3中各组均加入ox-LDL外,另增设1个正常组,即0%含药血清组(0%含药方组大鼠血清+20%正常组大鼠血清)。
2.5 流式细胞术检测不同药物对ox-LDL诱导HUVEC凋亡率的影响
以2×104/孔的细胞密度将HUVEC接种于6孔板中,以PBS冲洗后,按照2.2中的实验分组和用药方法处理细胞。作用24 h后, 用0.25%的胰酶进行消化,于室温2000 rpm离心10 min收集细胞;用预冷1×PBS(4 ℃)重悬细胞,2000 rpm离心10 min,洗涤细胞2次,加入300 μL的1×Binding Buffer 悬浮细胞;加入5 μL的Annexin V-FITC混匀后避光,室温孵育15 min;上机前5 min再加入5 μL的PI染色,并补加200 μL的1×Binding Buffer,最后通过流式细胞仪检测细胞早期和晚期凋亡率。
2.6 Western blot 法检测不同药物对HUVEC增殖和凋亡相关蛋白表达的影响
将HUVEC接种于25 cm2细胞培养瓶,24 h 后以PBS冲洗后,按照2.2中的实验分组和用药方法处理细胞,继续培养24 h后,收集各组细胞用BCA 试剂盒进行蛋白定量。蛋白变性后进行SDS-聚丙烯酰胺凝胶电泳,采用湿转法将凝胶上的蛋白转印到PVDF 膜上。2 h 后将转印好的PVDF 膜置于含8% 脱脂牛奶的1×TBST 缓冲液中,室温封闭2 h 后加入含抗VEGFR2、P66、P53、Bcl-2、BAX、β-actin的一抗孵育液(1∶1000),4 ℃ 震荡孵育过夜,1×TBST 洗3次,每次15 min,加入TBST 缓冲液稀释的辣根过氧化物酶标记的羊抗兔二抗(1∶5000)室温震荡1 h,1×TBST 洗3次,每次15 min。Millipore 发光试剂盒进行显色,将PVDF 膜在alpha 凝胶成像仪上照相并分析各条带吸光度变化。
2.7 统计学方法

3 结果
3.1 不同药物对HUVEC增殖的影响
表1显示,与正常组(0%含药血清)比较,基础方组、祛痰方组和化瘀方组吸光度值差异无统计学意义,表明上述3种方剂对HUVEC增殖无明显影响。而祛痰化瘀方组(10%、15%、20%)吸光度显著高于正常组(P<0.05),其中20%浓度组效果最显著(P<0.01),表明祛痰化瘀方剂能够促进HUVEC增殖。
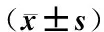
表1 不同药物对HUVEC增殖的影响
注:与正常组(0%含药血清)比较:*P<0.05,**P<0.01
3.2 不同药物对ox-LDL诱导HUVEC损伤的保护作用
表2显示,与正常组(0%含药血清)比较,模型组(ox-LDL+0%含药方组大鼠血清+20%正常组大鼠血清)吸光度值显著降低(P<0.01),表明ox-LDL可抑制HUVEC增殖;与模型组比较,不同浓度的祛痰方、化瘀方、祛痰化瘀方、基础方组吸光度值均有不同程度增加,其中,祛痰方(10%、15%、20%)、化瘀方(15%、20%)、祛痰化瘀方(5%、10%、15%、20%)、基础方组(15%、20%)吸光度值显著增加(P<0.01),表明上述4种方剂含药血清可明显抑制ox-LDL对HUVEC增殖的影响。
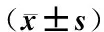
表2 不同药物对ox-LDL诱导HUVEC增殖的影响
注:与正常组(0%含药血清)比较:*P<0.05,**P<0.01;与模型组(0%+ ox-LDL)比较:▲P<0.05,▲▲P<0.01
3.3 不同药物对ox-LDL诱导HUVEC凋亡的保护作用
图1表3显示,与正常组(0%含药血清)比较,模型组早期及晚期凋亡率均显著增加(P<0.01),表明ox-LDL可诱导HUVEC凋亡;祛痰方、化瘀方、祛痰化瘀方、基础方均可显著降低ox-LDL损伤导致的HUVEC早、晚期凋亡率(P<0.01),表明上述4种方剂均可抑制ox-LDL损伤导致的HUVEC凋亡。其中,基础方组对早期凋亡率作用最为显著,祛痰化瘀方对晚期凋亡率的作用最显著。
3.4 不同药物对增殖和凋亡相关蛋白表达的影响

表3 不同药物对ox-LDL诱导HUVEC凋亡的保护作用
注:与正常组比较:*P<0.05,**P<0.01;与模型组比较:▲▲P<0.01
图2表4显示,与正常组比较,基础方组、祛痰方组、化瘀方组、祛痰化瘀方组P53、Bcl-2、BAX表达差异无统计学意义,表明上述4种方剂对这4种与细胞增殖和凋亡相关基因的蛋白表达水平无明显影响。而与正常组比较,祛痰方和祛痰化瘀方能增加VEGFR的表达水平,祛痰方、化瘀方和祛痰化瘀方能降低P66表达水平。

图1 不同药物对ox-LDL诱导HUVEC凋亡的保护作用注:B.正常组;M.模型组;C.基础方组;T.祛痰方组;Y.化瘀方组;T+Y.祛痰化瘀方组;Ⅰ.坏死细胞 Ⅱ:晚期凋亡细胞; Ⅲ:正常活细胞; Ⅳ:早期凋亡细胞

组 别例数VEGFR2P66P53Bcl-2BAX正常组61.11±0.062.35±0.300.46±0.031.27±0.100.38±0.02基础方组61.05±0.062.42±0.200.38±0.031.23±0.090.31±0.01祛痰方组61.30±0.07*2.01±0.21*0.54±0.051.08±0.070.27±0.02化瘀方组61.17±0.072.13±0.15*0.48±0.041.15±0.080.29±0.01祛痰化瘀方组61.37±0.07*2.18±0.15*0.46±0.031.30±0.110.25±0.02
注:与正常组比较:*P<0.05

图2 不同药物对增殖和凋亡相关蛋白表达的影响注:B.正常组;C.基础方组;T.祛痰方组;Y.化瘀方组;T+Y.祛痰化瘀方组
3.5 不同药物对ox-LDL诱导HUVEC增殖和凋亡相关蛋白表达的影响
图3表5显示,与正常组比较模型组VEGFR和Bcl-2表达水平降低,P66和BAX表达水平升高。与模型组比较,基础方能升高VEGFR的表达水平,降低BAX的表达水平;祛痰方和化瘀方能升高VEGFR的表达水平,降低P66和BAX的表达水平;祛痰化瘀方能够升高VEGFR和Bcl-2的表达水平,降低P66和BAX的表达水平。

图3 不同药物对ox-LDL诱导的HUVEC增殖和凋亡相关蛋白表达的影响注:B.正常组;M.模型组;C.基础方组;T.祛痰方组;Y.化瘀方组;T+Y.祛痰化瘀方组
4 讨论
Ox-LDL携带氧自由基,是造成内皮细胞损伤的最主要因素之一,ox-LDL通过影响内皮细胞通透性、分泌功能及炎症反应等方式,以及通过某些信号通路抑制内皮细胞增殖,促进内皮细胞凋亡,从而导致内皮功能障碍。
中医辨证分型发现,痰瘀互结证是心血管疾病的主要证型之一,“痰浊”与“血瘀”为高脂血症及动脉粥样硬化共同的病理变化[2]。《灵枢·百病始生》指出:“温气不行,凝血蕴里而不散,津液涩渗,著而不去,而积皆成矣。”《丹溪心法》谈到:“痰夹瘀血,遂成窠囊。”《血证论》中的“须知痰水之壅,由瘀血使然,但去瘀血,则痰水自消”“血积既久,亦能化为痰水”,以上观点都说明痰瘀互结、交阻胸中是心血管疾病的重要病因病机。
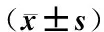
表5 不同药物对ox-LDL诱导的增殖和凋亡相关蛋白表达的影响
注:与正常组比较:*P<0.05,**P<0.01;与模型组比较:▲P<0.05,▲▲P<0.01
目前已有学者对痰瘀同治方药含药血清进行实验研究,发现痰瘀同治方对人脐静脉内皮细胞有促进增殖和迁移作用[3]。中国中医科学院中医基础理论研究所胡镜清研究员在多年临床经验基础上,针对动脉粥样硬化等常见心血管疾病,总结具有祛痰化瘀、补益脾肾、解表开郁、清热解毒功效的方剂,经我们拆解成祛痰方、化瘀方、祛痰化瘀方、基础方。在前期的工作中我们发现[4],这4 种方剂对于高血脂引发的apoE-/-高脂血症/As 模型小鼠血管局部炎症反应均起到保护作用。本研究观察了这4种方剂对内皮细胞的增殖、凋亡方面的影响。
在细胞增殖方面,与内皮细胞增殖相关的血管内皮生长因子(vascular endothelial growth factor,VEGF)在正常人血液中浓度非常低,其生物学效应通过其特异性受体VEGFR的介导来实现的。VEGF与VEGFR结合后,将细胞外的信号传递至胞内,激活VEGF介导的下游信号传导通路,从而起到促进细胞增殖、迁移、抗凋亡和形成新生血管等作用,并提高内皮细胞的存活率[5]。实验发现,祛痰方、化瘀方、祛痰化瘀方、基础方4种方剂中,祛痰化瘀方能增加HUVEC吸光度;祛痰方、祛痰化瘀方可上调HUVEC VEGFR的表达水平;氧化应激情况下,4种方剂均可增加HUVEC吸光度并上调VEGFR的表达水平。
在细胞凋亡方面,主要有内源性途径、外源性途径及内质网途径。其中, Bcl-2、BAX主要参与内源性凋亡途径,Bcl-2[6]抑制凋亡发生的主要机制为:通过抑制线粒体通透性的改变,抑制细胞色素C从线粒体透过线粒体膜向胞质的释放,阻止caspase的活化;稳定内质网膜,阻断Ca2 +从内质网释放,使依赖Ca2 +的核酸内切酶活性降低,从而阻断细胞凋亡。BAX与Bcl-2作用相反,通过提高线粒体的外膜通透性,增加线粒体中细胞色素C的释放,激活效应caspase,最终导致细胞凋亡[7]。P53主要参与外源性凋亡途径,可通过激活Fas基因增加细胞表面Fas,修复Fas-L/Fas死亡信号通路,促进Fas缺损的细胞凋亡[8]。P66可受P53及JNK调节,介导细胞的凋亡作用[9]。实验发现,祛痰方、化瘀方和祛痰化瘀方均能降低P66的表达水平;氧化应激情况下,HUVEC抗凋亡蛋白Bcl-2的表达水平降低,促凋亡蛋白BAX、P66表达水平升高;祛痰化瘀方等4种方剂对早期、晚期及总凋亡率都有极大改善,且均可降低BAX的表达水平;祛痰方组、化瘀方组和祛痰化瘀方可降低p66的表达水平,只有祛痰化瘀方可提高Bcl-2的表达水平。实验发现,应用100 mg/L ox-LDL刺激24 h后,p53表达水平无明显改变,祛痰化瘀方等4种方剂对p53表达水平也无明显影响,可能由于作用时间或浓度不够所致,或药物抗凋亡作用主要是通过内源性途径进行所致。
综上所述,祛痰方、化瘀方、祛痰化瘀方、基础方4种方剂可以从提高细胞增殖率、上调VEGFR表达水平从而发挥促增殖作用;并通过调节Bcl-2、BAX、P66介导的凋亡途径达到抗凋亡作用,从而达到对抗氧化应激导致的内皮细胞损伤的作用,其中以祛痰化瘀方效果最为显著。这可能是其抗As的重要作用机制,可为痰瘀同治法治疗As等常见心血管疾病提供依据。
[1] LUSIS AJ. Atherosclerosis[J]. Nature, 2000, 407 (6801): 233-241.
[2] 王东生, 袁肇凯, 余亚明.痰瘀与动脉粥样硬化相关性探讨[J].山东中医药大学学报, 2003, 27(3): 162-164.
[3] 朱盛, 刘建勋. 痰瘀同治方对人脐静脉内皮细胞有促进增殖和迁移的作用.痰瘀同治方药物血清对人脐静脉内皮细胞增殖和迁移的影响[J]. 中国中医药信息杂志, 2015, 22(1): 50-52.
[4] 乔艳雪, 马雅銮, 韩俊燕, 等. 祛痰、化瘀和祛痰化瘀方对apoE-/-小鼠全身和主动脉血管局部免疫反应影响的对比研究[J]. 中国中医基础医学杂志, 2015, 21(12): 1507-1510.
[5] 黎鹏程, 卢丽丽, 尹勇, 等. 舒心稳斑颗粒对动脉粥样硬化兔血管内皮生长因子和基质金属蛋白酶蛋白酶-9表达的影响[J].中国中医药信息杂志, 2014, 21(4): 55-58.
[6] XU YH, XIONG J, WANG SS, TANG D, et al. Calycosin entered HUVECs and ameliorated AGEs-promoted cell apoptosis via the Bcl-2 pathway[J]. Journal of Natural Medicines, 2014, 68 (1):163-72.
[7] PIETSCH EC, SYKES SM, MCMAHON SB, et al. The p53 family and programmed cell death[J]. Oncogene, 2008, 27(50): 6507-6521.
[8] WESTPHAL D, KLUCK RM, DEWSON G. Building blocks of the apoptotic pore: how Bax and Bak are activated and oligomerize during apoptosis, 2014, 21(2):196-205.
[9] GALIMOV ER. The role of p66shc in oxidative stress and apoptosis[J]. Acta Naturae, 2010, 2(4): 44-51.
EffectsofEliminatingPhlegm,RemovingBloodStasisandEliminatingPhlegmandRemovingStasisPrescriptiononProliferationAndApoptosisofVascularEndothelialCellsInducedbyOxidizedLowDensityLipoprotein
CHEN Bing1, LIN Ya-jun2, MA Ya-luan1, LI Yu-mei1, XUE Xin1, HU Jing-qing1△
(1.InstituteofBasicTheoryforChinesemedicine,ChinaAcademyofChineseMedicalScience,Beijing100700,China; 2.NationalCenterofGerontology,BeijingHospital,Beijing100730,China)
Objective: To observe the effect of Qutan-Fang, Huayu-Fang, and Qutan-Huayu- Fang on proliferation and apoptosis of Human umbilical vascular endothelial cells induced by ox-LDL.(HUVECs) in oxidative injury. Methods: HUVEC were divided into normal group, model group, Basic-Fang group, Qutan-Fang group,Huayu-Fang group and Qutan-Huayu-Fang group, which treated with ox-LDL(100mg/ml). Proliferation of HUVECs were detected by MTT. Apoptosis of HUVECs were analysed by AnnexinV-FITC/PI staining with flow cytometry. And the expression of VEGFR, P66, P53, Bcl-2, BAX were detected by Western blot. Results: Compared with normal group, Qutan-Huayu-Fang can promote the light absorption value of HUVEC, and Qutan-Fang, Qutan-Huayu-Fang can increase the expression of VEGFR. All four prescriptions can increase the light absorption value on HUVEC and raising the expression of VEGFR stimulated with ox-LDL.Compared with normal group, Qutan-Fang,Huayu-Fang,Qutan- Huayu-Fang can reduce the expression of P66 of HUVEC. Stimulated with ox-LDL, the expression of Bcl-2 was reduced, and the expression of BAX、P66 were increased. All four prescriptions can improve the early apoptotic rate, the late apoptotic rate,and the total apoptotic rate. These four prescriptions can reduced the expression of BAX. Qutan-Fang,Huayu-Fang,Qutan-Huayu-Fang can reduce the expression of P66 stimulated with ox-LDL. Qutan- Huayu- Fang can increase the expression of Bcl-2 of HUVEC. Conclusion: Qutan-Fang, Huayu-Fang, Qutan-Huayu-Fang can effectively reduce the oxidative injury on HUVECs by improve their proliferation and inhibiting their apoptosis. The effect of Qutan-Huayu-Fang was the most significant in all four prescriptions.
Qutan-Fang; Huayu-Fang and Qutan-Huayu-Fang; Human umbilical vein endothelial cells; Oxide low density lipoprotein; Proliferation; Apoptosis
国家重点基础研究计划(2014CB542903)-中医证候临床辨证的基础研究;中国中医科学院自主选题研究项目(YZ-1408)-祛痰、化瘀及祛痰化瘀法对人血管内皮细胞VEGF信号通路的影响;中国中医科学院自主选题研究项目(YZ-1407)-祛痰、化瘀及祛痰化瘀对ApoE-/-动脉粥样硬化小鼠的作用机制的对比研究
陈 冰(1975-),女,辽宁盘锦人,副研究员,医学博士,从事证候物质基础及方证相应研究。
△通讯作者:胡镜清(1965-),男,研究员,医学博士,博士研究生导师,从事适应中医药理论构筑与诊疗模式的临床方法研究,Tel:13911546633,E-mail: gcp306@126.com。
R285.5
B
1006-3250(2017)11-1554-05
2017-03-24
